Расплавы, 2020, № 5, стр. 443-451
Электровосстановление смесей хлорида кобальта(II) и фторида кобальта(II) в термоактивируемом химическом источнике тока
О. В. Волкова a, *, В. В. Захаров a, С. В. Плаксин a, Е. А. Ильина a, А. А. Панкратов a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: olga@ihte.uran.ru
Поступила в редакцию 29.05.2019
После доработки 13.06.2019
Принята к публикации 27.06.2019
Аннотация
Исследованы разрядные характеристики элементов термоактивируемого химического источника тока (ТХИТ), содержащих в качестве положительного электрода смеси CoCl2–CoF2. Определены состав и морфология продуктов восстановления исследуемых катодных материалов. Установлено, что использование смесей вместо индивидуальных галогенидов кобальта позволяет стабилизировать разрядные характеристики и понизить температуру разряда элемента ТХИТ. Показано, что процесс восстановления Co2+ до металла Co0 протекает в условиях контроля диффузии.
ВВЕДЕНИЕ
Основным преимуществом термоактивируемых химических источников тока (ТХИТ) перед другими видами генераторов электрической энергии является возможность обеспечения высокой удельной мощности в широком диапазоне температур окружающей среды [1–10]. Поэтому разработчики новых ТХИТ стремятся снизить массогабаритные параметры своих изделий, сохранив или улучшив при этом их электрические характеристики. Возможным способом решения этой задачи является снижение температуры разряда ТХИТ, что позволяет уменьшить количество нагревательных реагентов. В разрабатываемых нами ТХИТ с Li–B анодом, интервал рабочих температур, как привило, лежит в диапазоне 550–650°С [11, 12]. Данный температурный режим определяется свойствами положительного электрода и мощностью, снимаемой с элемента ТХИТ. В связи с этим, возникла потребность в поиске новых катодных материалах с более низким диапазоном рабочих температур, не уступающих по разрядным характеристикам своим предшественникам. Наше внимание привлекли галогениды кобальта: CoCl2 и CoF2. Их электрическая емкость сопоставима с исследованными нами ранее галогенидами никеля и хрома (емкость токообразующей реакции CoX2 + + 2e– → Co + 2X–, 0.41 и 0.55 А ⋅ ч/г для CoCl2 и CoF2 соответственно). В то же время, значения температур точек нонвариантного равновесия в системах содержащих соли кобальта, как правило, значительно ниже, чем в системах с используемыми нами ранее солями никеля и хрома. Так, например, в двойных системах эвтектического типа NiF2–LiF, CoF2–LiF и перитектического типа NiCl2–LiCl, CoCl2–LiCl температуры нонвариантных точек составляют 868, 700 и 630, 522°С соответственно [13–16]. Помимо этого, при восстановлении смесей CoCl2–CoF2 в составе литиевого ТХИТ, возможно образование эвтектики галогенидов лития (LiCl–30LiF, мол. %) с температурой плавления 488°С. Наличие жидкой фазы в зоне катодной реакции должно снизить диффузионные затруднения по доставке активных компонентов.
Цель настоящей работы – изучить разрядные характеристики и процесс восстановления катодных смесей CoCl2–CoF2, в температурном интервале 450–550°С.
МЕТОДИКА ЭКСПЕРИМЕНТА
При изготовлении элементов ТХИТ были использованы реактивы марки “ч. д. а.”. Исходные навески галогенидов кобальта(II) гомогенизировали в агатовой ступке и спрессовывали в таблетки. При формировании элемента ТХИТ использовали токоотводы чашечной конструкции, в которые помешались активные электродные компоненты. В качестве отрицательного электрода использовали литий – борный композит с содержанием бора 24 мас. % [17]. Анодный материал брали в избыточном количестве, что гарантировало лимитирующую роль катода в разрядных характеристиках элемента ТХИТ. В качестве сепаратора применяли низкоплавкую смесь галогенидов лития 22LiF–31LiCl–47LiBr (мол. %) с температурой плавления 430°С, загущенную γ-LiAlO2. Все операции по изготовлению элемента ТХИТ проводили в сухом аргоновом боксе.
Рентгенофазовый анализ (РФА) образцов проводили при комнатной температуре на дифрактометре Rigaku D/MAX-2200VL/PC (Rigaku, Япония) с использованием CuKα излучения в диапазоне брегговских углов 2θ от 10° до 85° с шагом 0.02°.
Для синхронного термического анализа (СТА) использовали термический анализатор STA 449 F1 Jupiter (NETZSCH). Измерения проводили в графитовых тиглях в интервале температур 35–650°С, скорость нагрева/охлаждения 10°С/мин. Измерительную ячейку с образцом продували аргоном со скоростью 50 мл/мин. Полученные данные были обработаны с помощью программного обеспечения NETZSCH Proteus.
Разряд электрохимических ячеек проводили в гальваностатическом режиме с помощью электрохимической рабочей станции Zahner IM6.
Морфологию продуктов восстановления катода исследовали с помощью растрового электронного микроскопа (РЭМ) с безазотным энергодисперсионным детектором X-Act ADD + JSM-5900LV (Jeol, Япония), пространственное разрешение 3 нм (2.5 нм с катодом LaB6).
Потенциодинамические кривые снимали на двухэлектродной ячейке при помощи потенциостата/гальваностата Model 263A. Площадь рабочего электрода составлял 0.07 см2. В качестве противоэлектрода использовали таблетку Li–B композита площадью 2.3 см2. Поляризация противоэлектрода не превышала 10 мВ. Малая величина поляризации противоэлектрода позволяет использовать его в качестве электрода сравнения.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Нами было проведено исследование разрядных характеристик элементов ТХИТ с катодными материалами на основе смесей CoCl2–CoF2 в температурном интервале 450–550°С. Из полученных данных следует, что в диапазоне плотностей тока от 0.25 до 1.5 А/см2 (в расчете на поверхность исходного катода), рассматриваемые катодные материалы позволяют снизить температуру разряда элементов ТХИТ до 480°С. Оптимальный состав катодной смеси зависит от температуры и плотности тока разряда, и варьируется в диапазоне 20–30 мас. % CoF2. Так, для 480°С, оптимальным является состав CoCl2–CoF2 (30 мас. %) (рис. 1). Следует отметить, что в этих условиях, разрядные кривые, полученные при плотностях тока ниже 0.5 А/см2, теряют свою стабильность (кривая 1, рис. 2), что может быть связанно с изменением состава и морфологии катода в процессе его восстановления. Для катодных смесей с содержанием CoF2 менее 70 мас. %, начальный участок разрядных кривых также является нестабильным (участок I, рис. 1). Мы предположили, что вид разрядных кривых определяется соотношением галогенидов лития в продуктах восстановления катода. При разряде используемой нами конструкции элементов ТХИТ, граница катодной реакции смещается от сепаратора вглубь катода (рис. 3). На участке I (рис. 1) происходит формирование зоны катодной реакции. Подвод носителей заряда в зону реакции осуществляется через формирующийся слой восстановленного катода. Поэтому, продукты восстановления при рабочих температурах должны обладать достаточно высокой проводимостью. Электронную проводимость способен обеспечить металлический кобальт, образующийся в процессе восстановления катодной смеси. А высокую проводимость по ионам лития, в интересующем нас температурном интервале, может реализовать расплав галогенидов лития эвтектического состава. При нехватке в продуктах восстановления LiF, эвтектический состав не образуется, и доставка ионов Li+ в отсутствии расплавленной фазы затруднена. Для проверки этого предположения мы провели разряд элемента ТХИТ с катодной смесью CoCl2–LiF (11.5 мас. %) (кривая 6, рис. 1), что соответствует расчетному соотношению галогенидов лития при восстановлении смеси CoCl2–CoF2 (20 мас. %). Полученная разрядная кривая характеризуется гладким начальным участком, это позволяет утверждать, что в начале формирования зоны катодной реакции преимущественно протекает реакция CoCl2 + 2Li+ + 2e– → Co + 2LiCl. В процессе смещения верхней границы зоны реакции вглубь катода, доставка к ней ионов Li+ становится энергетически более затратной, чем восстановление фторида кобальта в более близких к сепаратору слоях катода (CoF2 + 2Li+ + 2e– → Co + 2LiF). Появление в зоне реакции, наряду с LiCl, фторида лития ведет к образованию расплава галогенидов лития, что в свою очередь облегчает доставку ионных носителей заряда к верхней границе зоны катодной реакции, и ее дальнейшему продвижению вглубь катода. Наряду с этим, так же возможно частичное растворение в образовавшемся расплаве галогенидов кобальта и снижение температуры плавления расплава.
Рис. 1.
Разрядные кривые элементов ТХИТ: 1 – Li–B/CoCl2; 2 – Li–B/CoCl2–CoF2 (20 мас. %); 3 – Li–B/CoCl2–CoF2 (30 мас. %); 4 – Li–B/CoCl2–CoF2 (90 мас. %); 5 – Li–B/CoF2; 6 – Li–B/CoCl2–LiF (11.5 мас. %). Плотность тока разряда 0.5 A ⋅ см–2; Тразряда = 480°С. Удельная емкость рассчитана на массу активных компонентов катода (CoCl2, CoF2).
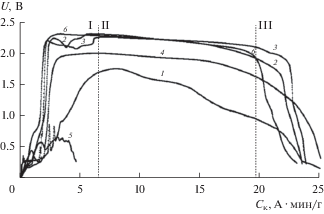
Рис. 2.
Разрядные кривые элементов ТХИТ Li–B/CoCl2–CoF2 (30 мас. %). Плотность тока разряда: 1 – 0.25; 2 – 1; 3 – 1.5 A ⋅ см–2. Тразряда = 480°С.
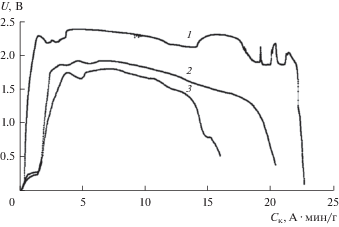
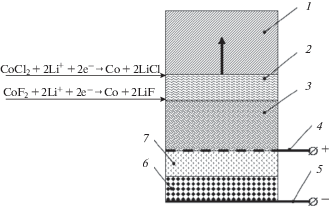
Рис. 3.
Схема разряжаемого элемента ТХИТ: 1 – исходный катодный материал; 2 – зона катодной реакции; 3 – продукты восстановления катода; 4 – катодный токоотвод; 5 – анодный токоотвод; 6 – анодный материал; 7 – сепаратор.
На участке II (рис. 1) устанавливается баланс между протекающими катодными реакциями, и процесс восстановления принимает квазистационарный характер с фиксированной шириной зоны реакции, формируя разрядное плато.
Следует отметить, что замена CoF2 на LiF ведет к уменьшению продолжительности разрядного плато и снижает удельную емкость катода, за счет присутствия в нем компонента не участвующего в электрохимической реакции.
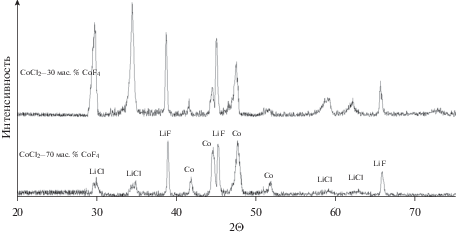
Исследование состава продуктов восстановления катода с помощью рентгенофазового анализа показало, что образцы содержали две модификации металлического кобальта (α-Со – низкотемпературная модификация кобальта с гексагональной структурой, β-Со – высокотемпературная модификация кобальта с кубической структурой) и галогениды лития LiCl, LiF (рис. 4). Энергодисперсионный анализ позволил установить, наличие в образцах от 2.5 до 3.5 ат. % LiBr. Присутствие этой фазы свидетельствует о том, что в процессе разряда элемента ТХИТ происходит диффузия галогенидов лития из сепаратора в катод. Топология LiBr аналогична расположению LiCl в образце. Поэтому мы предполагаем образование твердых растворов LiCl–LiBr. В пользу этого предположения так же говорит и уширение линий LiCl на дифрактограммах продуктов восстановления катодных смесей. Диффузионные процессы на границе катод | сепаратор, не оказывают существенного влияния на состав и свойства электролита.
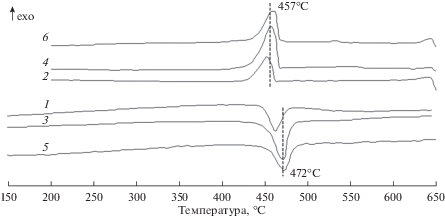
ДСК кривые исследуемых образцов содержат один пик (рис. 5). Мы относим его к процессу плавления смеси галогенидов лития и кобальта. С ростом концентрации фторидной составляющей, наблюдается незначительное смещение экстремума в область более низких температур. Так, например, для состава CoCl2–CoF2 (30 мас. %) величина экстремума составляет 472 и 457°С, для кривой нагрева и охлаждения, соответственно.
Рис. 5.
ДСК кривые продуктов восстановления катодных смесей: 1, 2 – CoCl2–CoF2 (80 мас. %); 3, 4 – CoCl2–CoF2 (30 мас. %); 5, 6 – CoCl2–LiF (11.5 мас. %) (плотность тока разряда 0.5 A ⋅ см–2).
РЭМ исследования продуктов катодной реакции показали, что солевая фракция покрывает формирующуюся в процессе разряда матрицу из металлического кобальта. Морфология матрицы зависит от величины тока разряда элемента ТХИТ (рис. 6). При токах более 0.25 A ⋅ см–2 наблюдается уплотнение дендритной структуры и образование конгломератов. Очевидно, конгломератная структура, обладающая большей дисперсностью, менее подвержена пассивации, что позволяет обеспечить более стабильные разрядные характеристики.
Рис. 6.
РЭМ отмытых в дистиллированной воде продуктов катодной реакции элементов ТХИТ полученные при разряде разной плотностью тока: 1 – 1; 2 – 0.25 A ⋅ см–2; Тразряда = 500°С.

Для уточнения лимитирующей стадии процесса восстановления катода был использован хроновольтамперометрический метод. Съемка потенциодинамических кривых проводилась при температуре 480°С, скорость развертки (v) варьировалась от 5 до 200 мВ/с, смещение потенциала от НРЦ ±1 В. В качестве рабочего электрода были использованы смеси CoCl2–CoF2. Пять первых циклов использовались для формирования поверхности рабочего электрода и исключались из дальнейшего анализа. Полученные данные свидетельствуют о том, что характер потенциодинамических кривых не зависит от состава смесей. Типичные циклические вольтамперные кривые представлены на рис. 7. Уширение катодного пика, обусловлено увеличением дисперсности поверхности рабочего электрода в процессе роста дендритов металлического кобальта. Линейная зависимость тока пиков от корня квадратного из скорости развертки потенциала говорит о том, что электрохимическая реакция протекает в режиме диффузионной кинетики.
Рис. 7.
Циклические вольтамперные кривые, снятые на электроде – CoCl2–CoF2 (30 мас. %); скорость развертки: 1 – 5; 2 – 50; 3 – 100; 4 – 200 мВ/с; врезка: зависимости плотности тока анодного и катодного пика от скорости развертки потенциала.
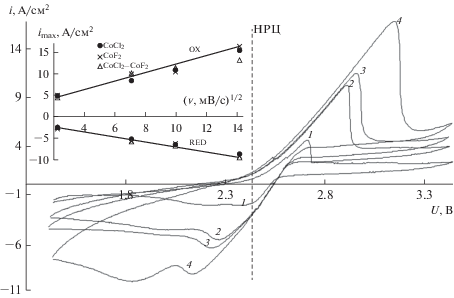
Мы считаем, что окисление металлического кобальта сопровождается пассивацией его поверхности солевой пленкой образовавшегося хлорида кобальта, препятствующей доставке аниона к зоне анодной реакции. Соотношение исходных компонентов смесей рабочего электрода не влияет на концентрацию катионов кобальта в зоне катодной реакции. Лимитирующей стадией процесса восстановления Co2+ является доставка катионов лития.
ЗАКЛЮЧЕНИЕ
Исследованы разрядные характеристики элементов ТХИТ, содержащих в качестве положительного электрода смеси CoCl2–CoF2. Установлено, что рассматриваемые катодные материалы позволяют снизить температуру разряда элементов ТХИТ до 480°С. Восстановление смесей CoCl2–CoF2 сопровождается образованием расплава галогенидов лития и кобальта, способствующих облегчению доставки катиона лития в зону электродной реакции. В процессе разряда элементов ТХИТ наблюдается диффузия электролита в катодную область. Однако это не приводит к существенной деградации сепаратора. Продукты восстановления исследуемых катодных материалов содержат металлический кобальт, образующий дендритную структуру. Дисперсность и морфология дендритов определяется плотностью тока разряда и не чувствительна к соотношению компонентов исходной катодной смеси. Электродная реакция протекает в режиме диффузионной кинетики.
Исследования выполнены с использованием оборудования ЦКП “Состав вещества” ИВТЭ УрО РАН.
Список литературы
Guidotti R.A., Masset P. // J. Power Sources. 2006. 161. P. 1443–1449. https://doi.org/10.1016/j.jpowsour.2006.05.037
Коровин Н.В., Скундин А.М. Химические источники тока: Справочник. Изд.: МЭИ, 2003.
Кукоз Ф.И., Труш Ф.Ф., Кондратенков В.И. Тепловые химические источники тока. Изд. Ростовского университета. 1989.
Guidotti R., Reinhardt F.W., Dai J., Reisner D.E. Performance of thermal cells and batteries made with plasma-sprayed cathodes and anodes // J. Power Sources. 2006. 160. P.1456–1464.
Nelson P.A. Advanced High-Temperature Batteries // J. Power Sources. 1990. 29. P. 565–577.
Masset P.J., Guidotti R.A. Thermal activated (“thermal”) battery technology: Part IIIa: FeS2 cathode material // J. Power Sources. 2008. 177. P. 595–609.
Masset P.J., Guidotti R.A. Thermal activated (“thermal”) battery technology: Part IIIb. Sulfur and oxide-based cathode materials // J. Power Sources. 2008. 178. P. 456–466.
Butler P., Wagner C., Guidotti R., Francis I. Long-life, multi-tap thermal battery development // J. Power Sources. 2004. 136. P. 240–245.
Au M. Nanostructured thermal batteries with high power density // J. Power Sources. 2003. 115. P. 360–366.
Masset P.J. // Z. Naturforsch. 2008. 63a. P. 596–602.
Volkova O.V., Zakharov V.V., Reznitskikh O.G. Electroreduction of chromium(III) chloride in a thermal battery // Russian Metallurgy. 2017. № 8. P. 655–659.
Volkova O.V., Zakharov V.V. Electroreduction of Chromium(III) Chloride and Molybdenum(VI) Oxide Mixtures in a Thermally Activated Battery // Russian Metallurgy. 2018. № 2. P. 201–204.
Seifert H.-J. // Z. Anorg. Allg. Chemie. 1961. Bd.307. P. 137–144.
Ольховская Л.А., Икрами М.Б., Николаева Т.А., Грачева И.Ю. // Журн. неорган. химии. 1989. 34. № 4. С. 1009.
Петров С.В., Ольховая Л.А., Икрами Д.Д., Федоров П.П., Соболев П.П. Исследование систем LiF–NiF2, NaF–NiF2, CoF2–NiF2 // Журн. неорган. химии. 1989. 34. № 3. С. 762–765.
Голубева М.С., Медведев Б.С. Тройная взаимная система из хлоридов и сульфатов лития и никеля // Журн. неорган. химии. 1962. 7. № 2. С. 2600–2603.
Захаров В.В. и др. Способ изготовления литий-борного композита и реактор. Патент РФ № 2 395 603. 2010.
Дополнительные материалы отсутствуют.