Расплавы, 2020, № 5, стр. 508-520
Расчет поверхности ликвидус в бинарных солевых смесях NaF–NaCl, CsF–CsCl, NaF–CsF и NaCl–CsCl эвтектического типа на основе термодинамической теории возмущений
А. Г. Давыдов a, *, Н. К. Ткачев a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: A.Davydov@ihte.uran.ru
Поступила в редакцию 24.03.2020
После доработки 25.05.2020
Принята к публикации 01.06.2020
Аннотация
Представлен метод учета поляризационных взаимодействий между ионами в бинарных жидкосолевых расплавах с общими катионами и анионами посредством термодинамической теории возмущений на базе модели многосортной смеси заряженных твердых сфер различающихся диаметров. На этой основе проведены расчеты температур плавления простых галогенидных солей натрия и цезия, а также поверхности ликвидус на фазовых диаграммах бинарных солевых смесей NaF–NaCl, CsF–CsCl, NaF–CsF и NaCl–CsCl эвтектического типа. Показано, что учет ион-дипольных взаимодействий в жидкой фазе приводит к снижению температур плавления щелочно-галоидных солей по сравнению с моделью заряженных твердых сфер. Погрешность в определении температур плавления простых солей натрия и цезия без подгонки параметров парного потенциала не превышает 10%. При описании линий ликвидус в рассмотренных бинарных системах наблюдается смещение положения эвтектического равновесия в сторону менее тугоплавкого компонента на величину до 5% и небольшое завышение температуры эвтектической точки по сравнению с температурами плавления чистых компонентов смеси.
ВВЕДЕНИЕ
Интерес к расплавленным солевым системам обусловлен их широким применением в различных сферах производства и химических наук [1]. Например, в последнее время все большее внимание сосредоточено на использовании солевых расплавов в целях эффективного развития ресурсосберегающей и безопасной энергетики, ядерных разработок, а также металлургии и электрохимии [1–5]. При этом в вопросах, связанных с материаловедением, одними из первоочередных являются сведения о границах стабильного существования фаз [6], и особый интерес с точки зрения практических приложений представляют многокомпонентные системы, свойства которых можно регулировать в зависимости от состава смеси [7–9]. Вследствие этого большое внимание уделяется развитию теоретических подходов к описанию и предсказанию фазовых диаграмм расплавленных солей [6, 9–11].
Наиболее распространенным в этой области теоретических исследований является метод термодинамического моделирования (ThermoCalc, CALPHAD и др.), который основан на использовании феноменологической модели субрегулярных растворов и поиском параметров с помощью баз данных по термодинамическим свойствам и фазовым равновесиям простых систем (таких как SGTE, CCT, ThermoTech, NPL, NIST, MIT и т.д.) для расчета фазовых равновесий в системах более сложного типа [12]. Данная группа методов хорошо зарекомендовала себя при описании фазовых равновесий в солевых системах [12–15], однако, к сожалению, применение данного подхода в описании жидких фаз не имеет микроскопического обоснования. Например, остается открытым вопрос об ограничении радиуса взаимодействия второй координационной сферой, как это осуществлялось в работах Пельтона и соавторов [16, 17]. При этом возрастание числа подгоночных параметров является наиболее уязвимым местом методов данного типа. В результате, потенциал достоверного прогнозирования фазовых равновесий все более сложных систем резко снижается.
В последнее время с ростом вычислительных возможностей получили развитие и другие подходы к описанию фазовых диаграмм расплавленных солей, основанные на методах ab initio и молекулярной динамики [18–21], где возможно учесть различные типы реалистичных межионных взаимодействий, в том числе поляризационный вклад (Polarizable ion model – PIM) [22, 23]. Кроме того, комбинация методов ab initio и молекулярной динамики дает более приемлемые результаты, поскольку позволяет уточнить данные моделирований за счет квантово-химической оптимизации параметров парных потенциалов взаимодействия ионов в расплаве [23–26].
В рамках статистической теории задачу, связанную с рассмотрением таких эффектов, наиболее удобно решать с помощью термодинамической теории возмущений (TPT) [27], учитывая более сложные взаимодействия на базе простых моделей, имеющих аналитические решения. Термодинамическая теория возмущений успешно применяется при рассмотрении различных взаимодействий и для расчетов на этой основе физико-химических свойств в самых разнообразных системах (органических и неорганических, молекулярных и ионных, полярных и неполярных жидкостях) [28–32]. Также TPT-подход нашел применение при моделировании термодинамических свойств и фазовых равновесий в чистых металлических системах и их сплавах [33–38].
При построении таких моделей важной особенностью является удачный выбор системы сравнения и параметров парного потенциала, а также учет наиболее значительных дополнительных вкладов в свободную энергию. К примеру, для вычисления свойств жидких металлов в качестве систем сравнения наиболее часто используют такие модели статистической теории как модель твердых сфер, потенциал с прямоугольной ямой, заряженные твердые сферы в однородном нейтрализующем фоне и др. [35, 36, 38].
Однако для солевых расплавов термодинамическая теория возмущений на основе модели заряженных твердых сфер вообще не была разработана. Кроме того, в отличие от металлических расплавов, например, в случае описания энергии жидкосолевых электролитов необходимо также учитывать эффекты взаимной поляризации ионов. Такой вид межчастичного взаимодействия имеет более сложную многочастичную природу, поскольку заряд каждого иона индуцирует дипольные моменты на соседних ионах, которые будут не только взаимодействовать друг с другом, но и в свою очередь индуцировать дипольные моменты на других ионах [39].
В рамках данной работы рассматривается только наиболее существенный тип поляризационных эффектов, который необходимо учитывать в галогенидных расплавах щелочных металлов, связанный с ион-дипольными взаимодействиями. При этом пренебрегается еще более слабыми диполь-дипольными и диполь-квадрупольными межионными взаимодействиями, которые могут оказаться существенны в расплавах щелочноземельных и редкоземельных солей, содержащих более сложные по своему электронному строению ионы. Отметим, что в работе [40] была представлена модель учета ион-дипольного вклада в свободную энергию простых солей на примере галогенидов цезия, однако рассмотрение поляризационных взаимодействий и описание равновесий жидкость–кристалл в многокомпонентных галогенидных расплавах на основе термодинамической теории возмущений ранее не проводилось. Поэтому целями настоящей работы было: 1) обобщить термодинамическую теорию возмущений, позволяющую учесть вклад поляризационных взаимодействий между ионами на базе модели многосортной смеси заряженных твердых сфер, для бинарных жидких расплавов с общими катионами и анионами; 2) провести расчеты и сопоставление результатов с экспериментальными кривыми ликвидус в бинарных галогенидных системах NaF–NaCl, CsF–CsCl, NaF–CsF и NaCl–CsCl.
МОДЕЛЬ
Рассмотрим систему из N = N1+ N2+ N3 свободных частиц, которая содержит N1 катионов ${\text{M}}_{1}^{ + }$ с зарядом z1 = +1 и N2 анионов ${\text{X}}_{1}^{ - }$ с зарядом z2 = –1, а также N3 ионов ${\text{M}}_{2}^{ + }$ или ${\text{X}}_{2}^{ - }$ с зарядом z3 = ±1 (где M+ = Na+ или Cs+ , а X– = F– или Cl–). Определим также мольные доли компонентов в такой смеси как xi = Ni/N, и диаметры ионов как d1, d2 и d3, соответственно. Поскольку кулоновское взаимодействие практически полностью определяет структуру солевых расплавов [41], основной вклад в свободную энергию рассматриваемой системы описывается в рамках модели многосортной смеси заряженных твердых сфер (“charged hard spheres” – CHS). Среднесферическое приближение (“mean spherical approximation” – MSA) для этого случая можно записать в виде [42, 43]:
(1)
${{C}_{{ij}}}\left( R \right) = \left\{ \begin{gathered} C_{{ij}}^{{{\text{hs}}}}\left( R \right),\,\,\,\,R \leqslant {{d}_{{ij}}} \hfill \\ - \frac{{{{z}_{i}}{{z}_{j}}{{e}^{2}}}}{{\varepsilon R{{k}_{{\text{B}}}}T}},\,\,\,\,{{d}_{{ij}}} < R \hfill \\ \end{gathered} \right.,$(2)
${{F}_{{{\text{liq}}}}} = {{F}_{{{\text{CHS}}}}} + 2\pi \rho \sum\limits_{i,j} {{{x}_{i}}{{x}_{j}}} \int\limits_0^\infty {\phi _{{ij}}^{{{\text{Pol}}}}} \left( R \right) \cdot g_{{ij}}^{{{\text{CHS}}}}\left( R \right) \cdot {{R}^{2}}dR~{\kern 1pt} ,~$(3)
${{F}_{{{\text{CHS}}}}} = {{F}_{{{\text{id}}}}} + {{F}_{{{\text{hs}}}}} + {{F}_{{{\text{msa}}}}},$Дополнительный ион-дипольный вклад в свободную энергию системы описывается вторым слагаемым в выражении (2). Однако, с точки зрения уменьшения потребности в вычислительных ресурсах удобнее оперировать структурными факторами в пространстве Фурье-образов. Тогда свободную энергию жидкосолевой смеси можно записать в виде:
(4)
${{F}_{{{\text{liq}}}}} = {{F}_{{{\text{CHS}}}}} + \frac{1}{{4{{\pi }^{2}}}} \cdot \sum\limits_{i,j} {\sqrt {{{x}_{i}}{{x}_{j}}} } \int\limits_0^\infty {\phi _{{ij}}^{{{\text{Pol}}}}} \left( k \right) \cdot \left( {S_{{ij}}^{{{\text{CHS}}}}\left( k \right) - {{\delta }_{{ij}}}} \right) \cdot {{k}^{2}}dk + \frac{\rho }{2} \cdot \sum\limits_{i,j} {{{x}_{i}}{{x}_{j}}\phi _{{ij}}^{{{\text{Pol}}}}} \left( 0 \right),$При этом Фурье-образы парциальных структурных факторов для всех пар ионов в трехсортной смеси рассчитываются аналогично следующим выражениям:
(5)
$\begin{gathered} {{S}_{{11}}}\left( k \right) = \frac{{\left( {1 - \rho \cdot {{x}_{2}} \cdot {{c}_{{22}}}\left( k \right)} \right)\left( {1 - \rho \cdot {{x}_{3}} \cdot {{c}_{{33}}}\left( k \right)} \right) - {{x}_{2}} \cdot {{x}_{3}} \cdot {{\rho }^{2}} \cdot c_{{23}}^{2}\left( k \right)}}{{D\left( k \right)}}, \\ {{S}_{{12}}}\left( k \right) = \frac{{\left( {1 - \rho \cdot {{x}_{3}} \cdot {{c}_{{33}}}\left( k \right)} \right) \cdot \rho \cdot \sqrt {{{x}_{1}}{{x}_{2}}} \cdot {{c}_{{12}}}\left( k \right) + {{\rho }^{2}} \cdot {{x}_{3}} \cdot \sqrt {{{x}_{1}}{{x}_{2}}} \cdot {{c}_{{13}}}\left( k \right) \cdot {{c}_{{23}}}\left( k \right)}}{{D\left( k \right)}}, \\ \end{gathered} $Выражение для вклада ион-дипольных взаимодействий в парный потенциал можно записать в следующем виде:
(6)
$\phi _{{ij}}^{{{\text{Pol}}}}\left( k \right) = \pi k{{E}_{{ij}}} \cdot \left( {\frac{{\sin k{{d}_{{ij}}}}}{{{{k}^{2}}d_{{ij}}^{2}}} + \frac{{\cos k{{d}_{{ij}}}}}{{k{{d}_{{ij}}}}} - {\text{Si}}\left( {k{{d}_{{ij}}}} \right)} \right),$(7)
${{E}_{{ij}}} = \frac{{\left( {\varepsilon - 1} \right)b_{i}^{3} - \left( {\varepsilon + 2} \right){{\alpha }_{i}}}}{{\left( {2\varepsilon + 1} \right)b_{i}^{3} - 2\left( {\varepsilon - 1} \right){{\alpha }_{i}}}} \cdot \frac{{{{{\left( {{{z}_{j}}e} \right)}}^{2}}b_{i}^{3}}}{\varepsilon } + \frac{{\left( {\varepsilon - 1} \right)b_{j}^{3} - \left( {\varepsilon + 2} \right){{\alpha }_{j}}}}{{\left( {2\varepsilon + 1} \right)b_{j}^{3} - 2\left( {\varepsilon - 1} \right){{\alpha }_{j}}}} \cdot \frac{{{{{\left( {{{z}_{i}}e} \right)}}^{2}}b_{j}^{3}}}{\varepsilon }.$Свободная энергия кристаллов рассчитывалась в соответствие с уравнением Борна–Майера [49], которое включает в себя энергию Маделунга и энергию отталкивания электронных оболочек с добавлением колебательного вклада по модели Дебая:
(8)
${{F}_{{{\text{sol}}}}} = \frac{{NA{{z}_{i}}{{z}_{j}}{{e}^{2}}}}{{2{{R}_{0}}}} \cdot \left( {1 - \frac{{{{\rho }_{e}}}}{{{{R}_{0}}}}} \right) + N{{k}_{{\text{B}}}}T \cdot \left[ {3\ln \left( {1 - {{e}^{{ - \frac{{{{\theta }_{{\text{d}}}}}}{T}}}}} \right) + \frac{9}{8} \cdot \frac{{{{\theta }_{{\text{d}}}}}}{T} - D\left( {\frac{{{{\theta }_{{\text{d}}}}}}{T}} \right)} \right].$Вычисление точки равновесия жидкости и кристалла при заданном составе и давлении осуществлялось стандартно посредством приравнивания химических потенциалов компонентов в обеих фазах [50].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Представленная модель учета ион-дипольных взаимодействий в бинарных жидкосолевых смесях с общими катионами и анионами опробована при расчете поверхностей ликвидус на диаграммах плавкости бинарных пограничных смесей эвтектического типа в системе Na, Cs || F, Cl. В литературе собрано достаточно большое количество данных по экспериментально измеренным фазовым диаграммам указанных бинарных смесей [51, 52], а также и самой тройной взаимной системы Na, Cs || F, Cl [53]. В данном разделе приводятся результаты расчетов линий ликвидус в указанных системах при сопоставлении с имеющимися в литературе экспериментальными данными и зависимостями, взятыми из базы данных FactSage [54].
На рис. 1 представлены данные о поверхности ликвидус на фазовой диаграмме эвтектического типа бинарной смеси NaF–NaCl. Сплошными линиями обозначены результаты расчетов на основе предложенной в данной работе модели, пунктирными линиями – литературные значения, взятые из базы данных FactSage. Кроме того, на диаграмме плавкости отмечены рассчитанные по модели значения температур плавления чистых компонентов смеси, а также температура плавления и содержание NaF в точке эвтектического равновесия.
Рис. 1.
Поверхность ликвидус на фазовой диаграмме эвтектической смеси NaF–NaCl (сплошные линии – рассчитанные данные, пунктирные линии – данные FactSage database).
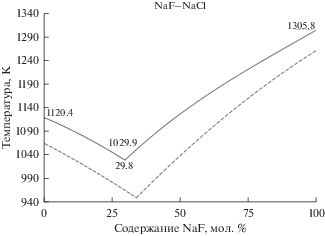
По данным различных авторов [52] положение точки эвтектического равновесия в смеси NaF–NaCl находится в диапазоне температур 946–955 K и 33.5–34.5 мол. % содержания NaF. Рассчитанное значение эвтектической точки составляет 1029.9 К и 29.8% NaF. Нетрудно увидеть из сопоставления расчетных и литературных данных, что вычисленное в рамках TPT-модели положение эвтектического равновесия дополнительно смещено в сторону менее тугоплавкого компонента не более чем на 5 мол. %, а температура плавления смеси завышена примерно на 80 К. Рисунок 1 также наглядно демонстрирует указанные расхождения. При этом из рисунка видно, что температура эвтектики завышена сильнее по сравнению с температурами плавления чистых компонентов смеси. В целом же рассчитанные кривые ликвидус достаточно хорошо повторяют топологию зависимостей, представленных в литературе.
На рис. 2 представлены расчетные и литературные зависимости линий ликвидус от состава бинарной смеси CsF–CsCl эвтектического типа, где сплошными линиями обозначены рассчитанные в данной работе значения, пунктирными линиями – данные FactSage. Также на рисунке нанесены расчетные значения температур плавления чистых солей CsF и CsCl, температура и содержание CsF в эвтектической точке.
Рис. 2.
Поверхность ликвидус на фазовой диаграмме эвтектической смеси CsF–CsCl (сплошные линии – рассчитанные данные, пунктирные линии – данные FactSage database).
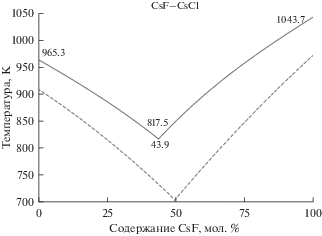
Для смеси солей CsF–CsCl положение экспериментально измеренной точки эвтектического равновесия соответствует температуре 713 К и содержанию CsF – 49 мол. % [52]. Вычисленное по модели положение эвтектической точки – 817.5 К и 43.9% CsF. Видно, что рассчитанное положение эвтектики также смещено в сторону менее тугоплавкого компонента примерно на 5 мол. %, а температура плавления смеси завышена на 105 К. Сопоставление, проведенное на рис. 2, также показывает, что температура плавления смеси в эвтектической точке демонстрирует большее отклонение от литературных данных по сравнению с чистыми солями.
Рисунок 3 иллюстрирует поверхность ликвидус на диаграмме плавкости бинарной смеси NaF–CsF с общим анионом. Сплошными кривыми обозначены расчетные зависимости, пунктирными кривыми – значения базы данных FactSage. Аналогично, на рисунке представлены вычисленные температуры плавления чистых солей, а также температура и содержание NaF в точке эвтектического равновесия.
Рис. 3.
Поверхность ликвидус на фазовой диаграмме эвтектической смеси NaF–CsF (сплошные линии – рассчитанные данные, пунктирные линии – данные FactSage database).
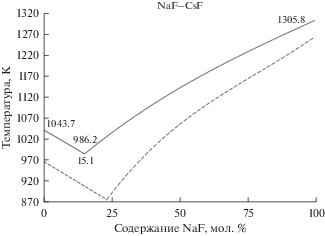
Литературные данные по фазовой диаграмме системы NaF–CsF [51] свидетельствуют о положении точки эвтектического равновесия в диапазоне температур 878–888 К при содержании NaF 20–24 мол. %. Вычисленное в данное работе положение эвтектического равновесия соответствует 986.2 К и 15.1% содержания NaF. Аналогично предыдущим случаям, рассчитанное значение состава в эвтектической точке смещено в сторону менее тугоплавкого компонента, а температура плавления смеси завышена менее чем на 100 К, в то время как для чистых компонентов смеси температура плавления завышена не более чем на 70 К. При этом рассчитанная кривая ликвидус имеет те же топологические закономерности, что и кривая по данным FactSage database.
Наконец, на рис. 4 представлены рассчитанные линии ликвидус на фазовой диаграмме бинарной смеси NaCl–CsCl в зависимости от содержания NaCl в сопоставлении с данными FactSage и с использованием тех же обозначений. На рисунке также отмечены температуры плавления и состав в эвтектической точке.
Рис. 4.
Поверхность ликвидус на фазовой диаграмме эвтектической смеси NaCl–CsCl (сплошные линии – рассчитанные данные, пунктирные линии – данные FactSage database).
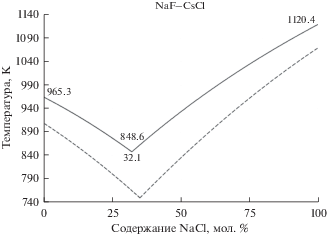
По различным экспериментальным данным [51] смесь NaCl–CsCl в точке эвтектического состава 34–36 мол. % NaCl имеет температуру плавления 763–768 К. Вычисленное в работе положение эвтектической точки составляет 32.1% при температуре 848.6 К. Закономерно рассчитанная точка эвтектики смещена в сторону менее тугоплавкого компонента примерно на 2–4% по оси состава смеси и вверх по температуре на 80–85 К. При сопоставлении расчетных и литературных данных на рис. 4 наблюдаются те же закономерности, что и для других рассмотренных выше смесей.
В табл. 1 представлены результаты моделирования температур плавления простых галогенидов натрия и цезия в рамках предложенной модели, учитывающей поляризационный вклад в свободную энергию расплавленных солей, в сопоставлении с экспериментальными данными. Также в таблице приведены значения относительной погрешности (Δ) между расчетными и литературными данными.
Таблица 1.
Результаты расчетов температур плавления Tm для простых солей NaX и CsX (где X– = F–, Cl–, Br– и I–) в сопоставлении с литературными данными
Приведенные в табл. 1 данные показывают, что разработанная модель учета поляризационных эффектов способна неплохо описывать температуры плавления щелочно-галоидных солей. Погрешность в описании температур плавления солей натрия и цезия не превышает 10%. Завышение температуры плавления наиболее сильно проявляется с увеличением размеров аниона, то есть при переходе от фторидов щелочных металлов к иодидам. Такая закономерность связана с тем, что свободная энергия расплавов, содержащих более крупные анионы с наибольшими значениями поляризуемостей, недооценена значительно сильнее по сравнению с фтор- и хлорсодержащими расплавами. Данный факт является следствием повышения диэлектрической постоянной в системах с наибольшими поляризуемостями анионов и, вероятно, может быть исправлен при учете дополнительных вкладов в свободную энергию, например, за счет дисперсионных взаимодействий. Аналогичная ситуация наблюдается и для расплава CsF, однако в данном случае ключевую роль в завышении температуры плавления играет поляризуемость катиона Cs+, которая значительно больше поляризуемости фторид-аниона. При этом стоит отметить, что в отсутствие вклада ион-дипольных взаимодействий свободные энергии всех расплавов недооцениваются еще более существенно, что приводит к резкому завышению температур плавления по сравнению с экспериментальными данными [40].
В целом сопоставление расчетных и экспериментальных данных для рассмотренных галогенидных расплавов натрия и цезия, а также их бинарных смесей показывает неплохое согласие модели с литературными данными без использования каких-либо подгоночных параметров. Во всех рассмотренных системах наблюдается некоторое завышение расчетных температур плавления вследствие недооцененной свободной энергии жидкой фазы. Также можно отметить общую тенденцию смещения положения эвтектического равновесия в бинарных смесях в сторону менее тугоплавкого компонента и завышение температуры эвтектики по сравнению с температурами плавления чистых компонентов. Данная закономерность, вероятно, связана с излишним упорядочением (понижением энтропии) в рамках среднесферической модели, которое становится еще более существенным с появлением третьего сорта частиц в смеси со своими значениями твердосферных диаметров.
ВЫВОДЫ
1. Проведено обобщение термодинамической теории возмущений для учета ион-дипольного вклада в свободную энергию бинарных щелочно-галоидных расплавов на базе модели многосортной смеси заряженных твердых сфер различающихся диаметров.
2. На этой основе проведены расчеты температур плавления галогенидных солей натрия и цезия, а также линий ликвидус на диаграммах плавкости бинарных пограничных смесей в системе Na, Cs || F, Cl.
3. Учет ион-дипольных взаимодействий в жидкой фазе приводит к снижению температур плавления галогенидных солей по сравнению с моделью заряженных твердых сфер. Несмотря на отсутствие подгоночных параметров погрешность в описании температур плавления простых солей натрия и цезия не превышает 10%.
4. При описании линий ликвидус на фазовых диаграммах бинарных солевых смесей NaF–NaCl, CsF–CsCl, NaF–CsF и NaCl–CsCl показано смещение положения эвтектического равновесия в сторону менее тугоплавкого компонента на величину до 5% и завышение температуры эвтектики не более чем на 100 К.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-33-01234 и частично № 18-03-00606.
Список литературы
Greenwood N.N., Earnshaw A. Chemistry of the Elements. Butterworth-Heinemann, 1997.
Петрянов-Соколов И.В. Популярная библиотека химических элементов. М.: Наука, 1977.
Janz G.J. Molten Salts Handbook. Academic Press Inc., 1967.
Braunstein J., Mamantov G., Smith G. Advances in Molten Salt Chemistry, V. 1. Plenum Press, 1971.
Gale J., Lovering D. Molten Salt Techniques, V. 2. Springer Science & Business Media, 1984.
Lantelme F., Groult H. Molten Salts Chemistry: From Lab to Applications. Elsevier Inc., 2013.
Capelli E., Beneš O., Konings R.J.M. // Journal of Nuclear Materials. 2018. 501. P. 238–252. https://doi.org/10.1016/j.jnucmat.2018.01.024
Mamantov G., Marassi R. Molten Salt Chemistry: An Introduction and Selected Applications. D. Reidel Publishing Company, 1987.
Gaune-Escard M., Haarberg G.M. Molten Salts Chemistry and Technology. John Wiley & Sons, 2014.
Gaune-Escard M. Molten Salts: From Fundamentals to Applications. Springer Science & Business Media, 2002.
Braunstein J., Mamantov G., Smith G. Advances in Molten Salt Chemistry, V. 3. Plenum Press, 1975.
Chang Y.A., Chen S., Zhang F., Yan X., Xie F., Schmid-Fetzer R., Oates W.A. Phase diagram calculation: past, present and future // Progress in Materials Science. 2004. 49. P. 313–345.
Gong W. // Thermochimica Acta. 2013. 562. P. 105–108. https://doi.org/10.1016/j.tca.2013.03.038
Gong W., Wu Y., Zhang R., Gaune-Escard M. // Calphad. 2012. 36. P. 44–51. https://doi.org/10.1016/j.calphad.2011.11.001
Kapała J., Bochyńska M., Broczkowska K., Rutkowska I. // J. Alloys and Compounds, 2008. 451. P. 679–681. https://doi.org/10.1016/j.jallcom.2007.04.085
Zhu Z., Pelton A.D. // J. Alloys and Compounds. 2015. 641. P. 261–271. https://doi.org/10.1016/j.jallcom.2015.02.227
Kang Y.-B., Pelton A.D. The shape of liquid miscibility gaps and short-range-order // J. of Chemical Thermodynamics. 2013. 60. P. 19–24.
Anwar J., Frenkel D., Noro M. // J. Chem. Phys. 2003. 118. P. 728–735. https://doi.org/10.1063/1.1522375
Rodrigues P.C.R., Fernandes F.M.S. Phase diagrams of alkali halides using two interaction models: A molecular dynamics and free energy study // J. Chem. Phys. 2007. 126. P. 02450301–02450310.
Jayaraman S., Thompson A., Anatole von Lilienfeld O. Molten salt eutectics from atomistic simulations // Physical Review E. 2011. 84. P. 0302011–0302014.
Aragones J.L., Sanz E., Valeriani C., Vega C. Calculation of the melting point of alkali halides by means of computer simulations // J. Chem. Phys. 2012. 137. P. 10450701–10450710.
Sarou-Kanian V., Rollet Anne-Laure, Salanne M., Simon C., Bessada C., Madden P.A. // Physical Chemistry Chemical Physics. 2009. 11. P. 11501–11506. https://doi.org/10.1039/b912532a
Beneš O., Zeller Ph., Salanne M., Konings R.J.M. // J. Chem. Phys. 2009. 130. P. 13 471 601–13 471 613. https://doi.org/10.1063/1.3097550
Belonoshko A.B., Ahuja R., Johansson B. Molecular dynamics of LiF melting // Physical Review B. 2000. 61. P. 11928–11935.
Tabacchi G., Mundy C.J., Hutter J., Parrinello M. Classical polarizable force fields parametrized from ab initio calculations // J. Chem. Phys. 2002. 117. P. 1416–1433.
Pentin I.V., Schön J.C., Jansen M. // J. Chem. Phys. 2007. 126. P. 12 450 801–12 450 815. https://doi.org/10.1063/1.2711431
Zwanzig R.W. // J. Chem. Phys. 1954. 22. P. 1420–1426. https://doi.org/10.1063/1.1740409
Xue X.-Y., Sun J.-X., Wen-Juan M. // J. Molecular Liquids. 2008. 139. P. 80–88. https://doi.org/10.1016/j.molliq.2007.11.003
Mahboub M.S., Farrokhpour H., Parsafar G.A. // J. Molecular Liquids. 2016. 220. P. 623–630. https://doi.org/10.1016/j.molliq.2016.01.094
Urbic T. // J. of Molecular Liquids. 2017. 238. P. 129–135. https://doi.org/10.1016/j.molliq.2017.04.095
Jover J., Galindo A., Jackson G., Müller E.A., Haslam A.J. // Molecular Physics. 2015. 113. P. 2608–2628. https://doi.org/10.1080/00268976.2015.1047425
Chanda S., Ahmed A.Z., Bhuiyan G.M., Barman S.K., Sarker S. A test of distribution function method in the case of liquid transition metals alloys // J. Non-Crystalline Solids. 2011. 357. P. 3774–3780.
Thakor P.B., Sonvane Y.A., Gajjar P.N., Jani A.R. Thermodynamics of Na-based liquid binary alloys // Physics and Chemistry of Liquids. 2011. 49. P. 237–246.
Kasem R., Bhuiyan G.M., Maruf H.U. // J. Chem. Phys. 2015. 143. P. 0345031–0345038. https://doi.org/10.1063/1.4926573
Akinlade O. // Physica Status Solidi B. 1990. 161. P. 75–83. https://doi.org/10.1002/pssb.2221610106
Dubinin N., Yuryev A., Vatolin N. Gibbs–Bogoliubov variational procedure with the square-well reference system // J. Non-Equilibrium Thermodynamics. 2010. 35. P. 289–300.
Hausleitner C., Hafner J. // J. Physics F: Metal Physics. 1988. 18. P. 1013–1023. https://doi.org/10.1088/0305-4608/18/6/007
Umar I.H., Meyer A., Watabe M., Young W.H. Thermodynamic calculations for liquid alloys with an application to sodium-potassium // J. Physics F: Metal Physics. 1974. 4. P. 1691–1706.
Stillinger F.H. Equilibrium theory of pure fused salts. Molten salt chemistry, 1964.
Давыдов А.Г., Смолярчук Е.В., Ткачев Н.К. // Расплавы. 2019. № 6. С. 513–530. https://doi.org/10.1134/S0235010619060021
Ziman J.M. Models of Disorder: The Theoretical Physics of Homogeneously Disordered Systems. Cambridge University Press, 1979.
Lebowitz J.L., Percus J.K. // Physical Review. 1966. 144. P. 251–258. https://doi.org/10.1103/PhysRev.144.251
Blum L. // Theoretical Chemistry: Advances and Perspectives. 1980. 5. P. 1–66. https://doi.org/10.1016/b978-0-12-681905-2.50007-4
Blum L., Rosenfeld Y. // J. of Statistical Physics. 1991. 63. P. 1177–1190. https://doi.org/10.1007/BF01030005
Solana J.R. Perturbation Theories for the Thermodynamic Properties of Fluids and Solids. CRC Press: Taylor & Francis Group, 2013.
Mansoori G.A., Carnahan N.F., Starling K.E., Leland T.W. Equilibrium thermodynamic properties of the mixture of hard spheres // J. Chem. Phys. 1971. 54. P. 1523–1525.
Hiroike K. // Molecular Physics. 1977. 33. P. 1195–1198. https://doi.org/10.1080/0026897770010101136
Ashcroft N.W., Langreth D.C. // Physical Review. 1967. 159. P. 500–510. https://doi.org/10.1103/PhysRev.159.500
Sirdeshmukh D.B., Sirdeshmukh L., Subhadra K.G. Alkali halides: A handbook of physical properties. Springer-Verlag Berlin Heidelberg, 2001.
Prigogine I., Defay R. Chemical thermodynamics. Longmans Green and Co, 1954.
Посыпайко В.И. и др. Диаграммы плавкости солевых систем. Ч. 1. Двойные системы с общим анионом. М.: Металлургия, 1977.
Посыпайко В.И. и др. Диаграммы плавкости солевых систем. Ч. 3. Двойные системы с общим катионом. М.: Металлургия, 1979.
Шегурова Г.А., Бухалова Г.А., Ягубьян Е.С. Система Na, Cs || F, Cl // Журн. неорганической химии. 1971. 16. С. 2600–2602.
FTsalt – FACT Salt Phase Diagrams. Available at: http://www.crct.polymtl.ca/fact/documentation/FTsalt/FTsalt_Figs.htm
Haynes W.M. CRC Handbook of Chemistry and Physics: 97th Edition. CRC Press: Taylor & Francis Group, 2017.
Дополнительные материалы отсутствуют.


