Расплавы, 2020, № 5, стр. 452-460
Изучение механизма катодного восстановления ионов Dy(III) в расплавленной эвтектике 3LiCl–2KCl
А. В. Новоселова a, b, *, В. В. Смоленский a, b, А. Л. Бове a, b
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
b Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: alena_novoselova@list.ru
Поступила в редакцию 29.04.2020
После доработки 11.05.2020
Принята к публикации 23.05.2020
Аннотация
Электрохимическими методами исследована реакция катодного восстановления ионов Dy(III) на инертном молибденовом электроде в расплавленной эвтектике 3LiCl–2KCl в интервале температур 723–843 K в инертной атмосфере. На циклической вольтамперограмме в исследуемом “электрохимическом окне” фиксируется один катодный пик тока при потенциале –3.19 ± 0.11 В и соответствующий ему анодный пик тока при потенциале –2.95 ± 0.11 В относительно хлорного электрода сравнения. Следовательно, процесс восстановления протекает по реакции Dy3+ + 3ē → → Dy. Анализ циклических вольтамперограмм показал, что потенциал пика тока смещается в отрицательную область с увеличением скорости сканирования, а ток катодного пика прямо пропорционален корню квадратному от скорости поляризации. Установлено, что увеличение скорости сканирования приводило к закономерному возрастанию необратимости катодного процесса. Число электронов (n) реакции восстановления ионов Dy(III) определяли методом квадратно-волновой вольтамперометрии. Рассчитанное значение равно: n = 2.93 ± 0.05. Согласно теории циклической вольтамперометрии катодный процесс восстановления протекает необратимо, в одну стадию и контролируется скоростью переноса заряда. Методом хронопотенциометрии при нулевом токе определена зависимость условного стандартного потенциала пары Dy(III)/Dy от температуры. Экспериментальные значения описываются линейным уравнением: $E_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{{\text{*}}}$ = $ - \left( {{\text{3}}{\text{.401}} \pm {\text{0}}{\text{.009}}} \right)$ + + $\left( {{\text{6}}{\text{.2}} \pm {\text{0}}{\text{.1}}} \right) \cdot {\text{1}}{{{\text{0}}}^{{ - 4}}} \cdot T \pm {\text{0}}{\text{.007}}\,\,{\text{В}}$. Рассчитаны изменение условной стандартной энергии Гиббса, энтальпии, энтропии реакции образования трихлорида диспрозия из элементов в расплавленной эвтектике 3LiCl–2KCl и коэффициент активности DyCl3.
ВВЕДЕНИЕ
Расплавленные соли являются перспективной средой в технологии получения высокочистых металлов [1], в частности редкоземельных, обладающих рядом уникальных физических и химических свойств. Основными методами получения индивидуальных редких металлов являются электролиз и металлотермия. Производство и потребление редких элементов зачастую опережает темпы появления надежных справочных данных по термодинамическим и другим физико-химическим характеристикам редких металлов и их соединений. Термодинамические характеристики, с одной стороны, являются необходимой предпосылкой создания теоретических основ электрохимических процессов разделения, рафинирования и получения редкоземельных металлов, их оптимизации и совершенствования. С другой стороны, служат фундаментом и критерием правильности представлений о механизмах взаимодействия металлов и их соединений с солевой средой.
За последние годы открыта новая область использования расплавленных солей, их возможное применение для процессов пирохимической очистки основных компонентов ядерного топлива (U, Pu) от продуктов деления. Концепция разделения и трансмутации рассматривается в настоящее время как эффективный способ снижения активности радиоактивных отходов. Пирохимические методы разделения имеют ряд преимуществ по сравнению с гидрометаллургическими процессами, главными из которых являются высокая радиационная стойкость солевых расплавов и возможность регенерации отработавшего ядерного топлива (ОЯТ) с малым временем охлаждения [2–4].
Электрохимические методы, такие как электролиз, электрорафинирование или восстановительная экстракция используются в пирохимических процессах для разделения компонентов. Наиболее известным из них является переработка металлического топлива реактора EBR-II [5]. В этом процессе отделение актинидов от продуктов деления осуществляется электрохимическим методом. Уран осаждают на твердый металлический катод, а плутоний и минорные актиниды (МА) – на жидкий кадмиевый электрод [6].
Регенерация ОЯТ также может быть осуществлена методом восстановительной экстракции на жидких катодах [7] или электрохимически с использованием твердых активных электродов [8].
В литературе имеются немногочисленные сведения об электрохимическом поведении соединений диспрозия в расплавленных солях. В [9] изучены электронные спектры поглощения трехвалентного самария, диспрозия, гольмия и эрбия в ряду от LiCl до CsCl. Показано, что в расплавах происходит образование комплексных группировок $[{\text{LnCl}}]_{6}^{{3 - }}$. Исследовано электрохимическое поведение ионов Dy(III) в хлоридных и фторидных расплавах на активных твердых электродах [10–12]. Установлено, что электродные процессы протекают с деполяризацией с образованием интерметаллических соединений разного состава. В работе [13] изучено электровосстановление ионов Dy(III) в расплаве 3LiCl–2KCl на инертном W и активном Al электродах. Установлено, что на инертном электроде процесс протекает в две последовательные стадии, а на активном электроде – в одну стадию с деполяризацией.
Целью данной работы является изучение механизма электрохимического восстановления ионов диспрозия(III) в расплавленной эвтектике 3LiCl–2KCl и расчет термодинамических характеристик исследуемого процесса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали LiCl (Aldrich > 99.99%), KCl (99.9% квалификация “х. ч.”). Безводный трихлорид диспрозия синтезировали непосредственно конверсией его оксида парами тетрахлорида углерода [14] по реакции:
(1)
$2{\text{D}}{{{\text{y}}}_{2}}{{{\text{O}}}_{3}} + 3{\text{CC}}{{{\text{l}}}_{4}} \to 4{\text{DyC}}{{{\text{l}}}_{3}} + 3{\text{C}}{{{\text{O}}}_{2}}{\kern 1pt} \uparrow {\kern 1pt} .$Электрохимические исследования проводили в стандартной трехэлектродной кварцевой ячейке в тигле из стеклоуглерода под атмосферой сухого аргона в области температур 723–843 K. В качестве рабочего электрода применяли молибденовую проволоку диаметром 1 мм, которую погружали в расплав на глубину 3–10 мм. Площадь поверхности катода определяли экспериментально после каждого опыта. Противоэлектродом служил стержень из стеклоуглерода диаметром 3 мм. Измерения осуществляли относительно стандартного хлорного электрода сравнения [15]. Для анализа электрохимических процессов были использованы следующие методы: циклическая, квадратно-волновая вольтамперометрия и потенциометрия при нулевом токе. Измерения выполняли на потенциостате-гальваностате AUTOLAB PGSTAT302N с программным обеспечением (NOVA 1.11).
Образцы растворов проб, содержащие диспрозий, анализировали методом ICP-MS на оптическом эмиссионном спектрометре с индуктивно-связанной плазмой Perkin Elmer OPTIMA 4300 DV.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
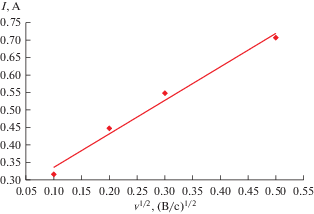
Циклические вольтамперограммы расплава LiCl–KCl–DyCl3, полученные на молибденовом инертном электроде при 723 K, представлены на рис. 1. В исследуемом “электрохимическом окне” фиксируется только один катодный пик тока при потенциале –3.19 ± 0.11 В и соответствующий ему анодный пик тока при потенциале –2.95 ± ± 0.11 В относительно хлорного электрода сравнения. Анализ циклических вольтамперограмм показал, что потенциал пика восстановления ионов $[{\text{DyCl}}]_{6}^{{3 - }}$ до металлического Dy смещается в отрицательную сторону с увеличением скорости сканирования, рис. 2. В тоже время ток катодного пика прямо пропорционален корню квадратному от скорости поляризации во всем исследуемом диапазоне потенциалов, рис. 3.
Рис. 1.
Циклические вольтамперограммы расплава LiCl–KCl–DyCl3, полученные на Мо электроде (S = = 0.14 см2) при разных скоростях сканирования, В/с: 1 – 0.075; 2 – 0.2; 3 – 0.5. m(DyCl3) = 4.1 ⋅ 10–2 моль/кг. T = 723 K.
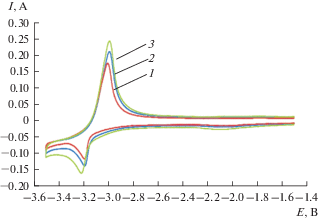
Рис. 2.
Зависимость катодного потенциала пика от логарифма скорости развертки потенциала в расплаве LiCl–KCl–DyCl3. S(Mo) = 0.14 см2. m(DyCl3) = 4.1 ⋅ 10–2 моль/кг. T = 723 K.
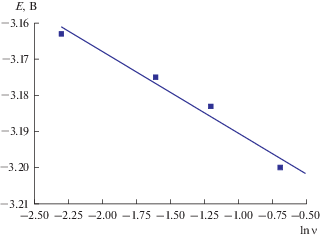
Рис. 3.
Зависимость катодного тока пика от корня квадратного скорости развертки потенциала в расплаве LiCl–KCl–DyCl3. S(Mo) = 0.14 см2. m(DyCl3) = 4.1 ⋅ 10–2 моль/кг. T = 723 K.
Для определения числа электронов, принимающих участие в электродной реакции восстановления ионов $[{\text{DyCl}}]_{6}^{{3 - }}$ в расплаве LiCl–KCl–DyCl3, был использован метод квадратно-волновой вольтамперометрии. На рис. 4 представлена вольтамперограмма исследуемого расплава при 825 K. Число электронов электродной реакции рассчитывали по уравнению (2), измеряя ширину полуволны пика восстановления в области изменения частоты 6–22 Гц.
где R – универсальная газовая постоянная, 8.314 Дж/моль ∙ K; T – абсолютная температура, K; n – число электронов электродной реакции; F – постоянная Фарадея, 96 485 Кл/моль · K.Рис. 4.
Квадратно-волновая вольтамперограмма, зарегистрированная в расплаве LiCl–KCl–DyCl3 при частоте 12 Гц. S(Mo) = 0.11 см2. m(DyCl3) = 3.9 ⋅ 10–2 моль/кг. T = 723 K.
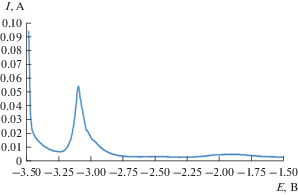
В области частот 8–20 Гц наблюдается линейная зависимость между пиком тока и корнем квадратным от частоты. Рассчитанное число электронов для реакции восстановления ионов $[{\text{DyCl}}]_{6}^{{3 - }}$ до металла было близко к трем (n = 2.93 ± 0.05).
Согласно теории циклической вольтамперометрии процесс катодного восстановления ионов $[{\text{DyCl}}]_{6}^{{3 - }}$ до металла протекает необратимо, в одну стадию и контролируется скоростью переноса заряда [16, 17].
(3)
${\text{DyCl}}_{{\text{6}}}^{{{\text{3}} - }} + {\text{3}}{\kern 1pt} {\bar {e}} = {\text{Dy}} + {\text{6C}}{{{\text{l}}}^{ - }}.$Степень необратимости электродной реакции рассчитывали по уравнению (4):
(4)
${{E}_{{\text{p}}}} - {{E}_{{{{\text{p}} \mathord{\left/ {\vphantom {{\text{p}} 2}} \right. \kern-0em} 2}}}} = - 1.857\frac{{RT}}{{\alpha nF}},$Кинетические параметры реакции катодного восстановления ионов $[{\text{DyCl}}]_{6}^{{3 - }}$ приведены в табл. 1. Анализ представленных данных указывает на закономерное уменьшение величины “α” с увеличением скорости сканирования.
Таблица 1.
Кинетические характеристики реакции электровосстановления ионов $[{\text{DyCl}}]_{6}^{{3 - }}$ до металла при температуре 723 K в расплаве 3LiCl–2KCl на Мо инертном электроде
| ν, B/c | Ep, B | Ep/2, B | α · n | α |
|---|---|---|---|---|
| 0.075 | –3.181 | –3.140 | 2.85 | 0.95 |
| 0.1 | –3.186 | –3.143 | 2.72 | 0.91 |
| 0.2 | –3.192 | –3.147 | 2.60 | 0.87 |
| 0.3 | –3.209 | –3.161 | 2.44 | 0.81 |
| 0.5 | –3.218 | –3.168 | 2.34 | 0.78 |
Определение условного стандартного потенциала пары Dy(III)/Dy при разных температурах проводили методом хронопотенциометрии при нулевом токе, рис. 5. Для этого инертный молибденовый катод поляризовали током 200–250 мА в течение 20–30 с, а затем снимали зависимость потенциал–время. На полученных хронопотенциограммах четко наблюдается два плато, которые соответствуют квазиравновесным потенциалам Li(I)/Li, рис. 5 участок 1, и Dy(III)/Dy, рис. 5 участок 2. Для расчета условного стандартного потенциала применяли уравнение Нернста:
(5)
${{E}_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}{\text{\;}}}}} = E_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{*} + \frac{{RT}}{{nF}}\ln {{X}_{{{\text{DyC}}{{{\text{l}}}_{{\text{3}}}}}}},$(6)
$E_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{{\text{*}}} = E_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{^\circ } + \frac{{RT}}{{nF}}\ln {{\gamma }_{{{\text{DyC}}{{{\text{l}}}_{3}}}}}.$Рис. 5.
Зависимости потенциал–время, снятые после катодной поляризации Мо рабочего электрода в расплаве LiCl–KCl–DyCl3. I = 200 мА; τ = 25 с. A – 823 K; B – 773 K; С – 723 K. S(Mo) = 0.23 см2. m(DyCl3) = = 5.3 ⋅ 10–2 моль/кг. 1 – квазиравновесный потенциал пары Li(I)/Li; 2 – квазиравновесный потенциал пары Dy(III)/Dy.
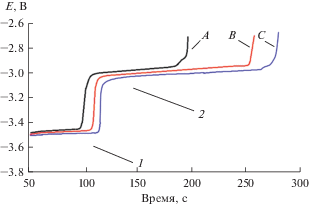
Полученные экспериментальные значения удовлетворительно описываются линейным уравнением (7), полученным с использованием метода наименьших квадратов с доверительным интервалом 0.95:
(7)
$E_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{{\text{*}}} = - \left( {{\text{3}}{\text{.401}} \pm {\text{0}}{\text{.009}}} \right) + \left( {{\text{6}}{\text{.2}} \pm {\text{0}}{\text{.1}}} \right) \cdot {\text{1}}{{{\text{0}}}^{{ - 4}}} \cdot T \pm {\text{0}}{\text{.007}}\,\,{\text{В}}{\text{.}}$Изменение условной стандартной энергии Гиббса $(\Delta G_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{{\text{*}}}){\text{\;}}$ определяли по следующему выражению (8):
(8)
$\Delta G_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{{\text{*}}} = nFE_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{{\text{*}}}.$Поскольку известна зависимость условного стандартного потенциала $(E_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{{\text{*}}})$ от температуры, представляется возможным определить энтальпию $(\Delta H_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{{\text{*}}})$ и энтропию $(\Delta S_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{{\text{*}}}$) исследуемой реакции (9), которая описывается выражением (11):
(9)
${\text{D}}{{{\text{y}}}_{{\left( {{\text{тв}}} \right)}}} + {3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}{\text{C}}{{{\text{l}}}_{{2\left( {\text{г}} \right)}}} = {\text{DyC}}{{{\text{l}}}_{{3\left( {{\text{тв}}} \right)}}},$(10)
$\Delta G_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{{\text{*}}} = \Delta H_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{{\text{*}}} - T\Delta S_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{{\text{*}}},$(11)
$\Delta G_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{{\text{*}}} = - 984.5 + 0.179 \cdot T \pm 1.3\,\,{\text{\;}}~{\text{кДж}} \cdot {\text{мол}}{{{\text{ь}}}^{{ - 1}}}.$(12)
${\text{lg\;}}{\kern 1pt} {{\gamma }_{{{\text{DyC}}{{{\text{l}}}_{3}}}}} = \frac{{\Delta G_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{{\text{*}}} - \Delta G_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{^\circ }}}{{2.303RT}},$ВЫВОДЫ
Нестационарными и стационарными электрохимическими методами исследована реакция катодного восстановления ионов Dy(III) до металла в расплавленной эвтектике 3LiCl–2KCl в интервале температур 723–843 K на инертном молибденовом электроде. Установлен механизм осаждения металлического диспрозия. Показано, что электродная реакция необратима, протекает в одну стадию по реакции Dy3+ + 3ē → Dy и контролируется скоростью переноса заряда. Рассчитаны коэффициенты активности ${\text{DyC}}{{{\text{l}}}_{3}}{\text{\;}}$ в расплаве и определены основные термодинамические характеристики трихлорида диспрозия.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-03-00743.
Список литературы
Барабошкин А.Н. Электрокристаллизация металлов из расплавленных солей. М.: Наука, 1976.
OCDE/NEA Report: Accelerator-driven systems (ADS) and Fast Reactors (FR) in Advanced Nuclear Fuel Cycles. A Comparative Study. 2002.
Kormilitsyn M.V., Bychkov A.V., Ishunin V.S. Pyroelectrochemical reprocessing of irradiated fuel of fast reactors. VI. Generalization of experience on BOR-60 spent nuclear fuel reprocessing using approaches “UO2 to UO2” “MOX to PuO2” and “MOX to MOX”, Global 2003, USA, New Orleans. 2003. P. 782–783.
Комаров В.Е., Смоленский В.В., Афоничкин В.К. Перспективы использования расплавленных солей в радиохимических технологиях // Расплавы. 2000. 2. С. 59–65.
Laidler J.J., Battles J.E., Miller W.E., Ackerman J.P., Carls E.L. Development of pyroprocessing technology // Prog. Nucl. Energ. 1997. 31. P. 131–140.
Sakamura Y., Hijikata T., Kinoshita K., Inoue T., Storvick T.S., Krueger C.L., Roy J.J., Grimmett D.L., Fusselman S.P., Gay R.L. Measurement of standard potentials of actinides (U, Np, Pu, Am) in LiCl–KCl eutectic salt and separation of actinides from rare earths by electrorefining // J. Alloys Compd. 1998. 271–273. P. 592–596.
Kinoshita K., Kurata M., Inoue T. Estimation of material balance in pyrometallurgical partitioning process of transuranic elements from high-level liquid waste // J. Sci. Technol. 2000. 37. P. 75–83.
Serp J., Allibert M., Le Terrier A., Malmbeck R., Ougier M., Rebizant J., Glatz J.-P. Electroseparation of actinides from lanthanides on solid aluminum electrode in LiCl–KCl eutectic melts // J. Electrochem. Soc. 2005. 152. № 3. P. C167–C172.
Fujii T., Nagai T., Uehara A., Yamana H. Electronic absorption spectra of lanthanides in a molten chloride. III. Absorption characteristics of trivalent samarium, dysprosium, holmium, and erbium in various molten chlorides // J. Alloys Compd. 2007. 441. P. L10–L13.
Saïla A., Gibilaro M., Massot L., Chamelot P., Taxil P., Affoune A.M. Electrochemical behavior of dysprosium(III) in LiF–CaF2 on Mo, Ni and Cu electrodes // J. Electroanal. Chem. 2010. 642. P. 150–156.
Kouji Ya., Kobayashi S., Nohira T., Hagiwara R. Electrochemical formation of Dy–Ni alloys in molten NaCl–KCl–DyCl3 // Electrochim. Acta. 2013. 106. P. 293–300.
Su L.-L., Liu K., Liu Y.-L., Wang L., Yuan L.-Y., Wang L., Li Z.-J., Zhao X.-L., Chai Z.-F., Shi W.-Q. Electrochemical behaviors of Dy(III) and its co-reduction with Al(III) in molten LiCl-KCl salts // Electrochim. Acta. 2014. 147. P. 87–95.
Castrillejo Y., Bermejo M.R., Barrado A.I., Pardo R., Barrado E., Martínez A.M. Electrochemical behavior of dysprosium in the eutectic LiCl–KCl at W and Al electrodes // Electrochim. Acta. 2005. 50. P. 2047–2057.
Ревзин Г.Е. Безводные хлориды редкоземельных элементов и скандия. В сборнике: “Методы получения химических реактивов и препаратов”. М.: ИРЕА, 1967. 16. С. 124–129.
Смирнов М.В. Электродные потенциалы в расплавленных хлоридах. М.: Наука, 1973.
Галюс З. Теоретические основы электрохимического анализа. М.: Мир, 1974.
Bard A.J., Faulkner L.R. Electrochemical Methods: Fundamentals and Applications. N.-Y.: John Wiley & Sons, 1980.
Дополнительные материалы отсутствуют.


