Расплавы, 2020, № 6, стр. 589-598
Изучение растворения Al2O3 в расплаве KF–AlF3
П. С. Першин a, *, А. В. Суздальцев a, Ю. П. Зайков a, b
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
b Уральский федеральный университет
Екатеринбург, Россия
* E-mail: pspershin@ihte.uran.ru
Поступила в редакцию 28.06.2020
После доработки 18.07.2020
Принята к публикации 24.07.2020
Аннотация
Расплавы на основе системы KF–AlF3–Al2O3 являются перспективными средами для электролитического получения алюминия в энергоэффективных электролизерах нового поколения. В настоящей работе методами циклической вольтамперометрии и карботермического восстановления проб расплава на анализаторе LECO изучен процесс растворения Al2O3 в расплаве KF–AlF3 с мольным отношением [KF]/[AlF3] = 1.5 моль/моль при температуре 785°С. Для измерений использована конструкция измерительной ячейки в составе стеклоуглеродного рабочего электрода, газового CO/CO2 электрода сравнения и графитового противоэлектрода. В ходе измерений фиксировали пиковое значение отклика тока на вольтамперограммах в зависимости от скорости развертки потенциала, времени растворения очередной навески глинозема и содержания глинозема в расплаве. Показано, что пиковое значение отклика тока линейно зависит от содержания Al2O3 в исследуемом расплаве, при этом скорость растворения оксида составила от 2.4 · 10–3 до 5.45 · 10–5 моль/с в зависимости от его содержания в расплаве. На основании анализа полученных результатов показана принципиальная возможность оперативного неразрушающего контроля содержания глинозема (Al2O3) при электролизе расплавов на основе системы KF–AlF3–Al2O3, включающая фиксацию пикового значения отклика тока на вольтамперной зависимости и определение по эмпирической зависимости текущего содержания глинозема в расплаве.
ВВЕДЕНИЕ
Основным способом промышленного производства алюминия уже более ста лет является электролиз криолит-глиноземного расплава. При этом концентрация глинозема в электролите является одним из ключевых технологических параметров электролиза, поскольку именно оно оказывает существенное влияние на основные физико-химические свойства криолит-глиноземного расплава [1].
В настоящее время в ходе электролиза для введения глинозема в электролизную ванну используется система автоматизированного питания глиноземом (АПГ), основным регулирующим параметром которой является напряжение на ванне, в т.ч. определяемое содержанием глинозема (растворенного и нерастворенного) в криолит-глиноземном расплаве [1–3]. Недостаток такой регулировки заключается в том, что увеличение напряжения на ванне может быть вызвано как снижением содержания глинозема в расплаве, так и увеличением выше 3–4 мас. %. В результате, регулировка питания ванны глиноземом по напряжению становится неэффективна, и некорректный режим работы АПГ приводит к ухудшению технологических показателей процесса (снижение катодного выхода по току, повышение напряжения, повышение удельного расхода электроэнергии и др.) и снижению срока службы электролизера. В связи с этим разработка методов оперативного контроля содержания глинозема в электролизерах является важной и актуальной задачей, в т.ч. для разработки комплексных математических моделей растворения и распределения глинозема в них.
Поскольку в настоящее время ведется активная разработка новых эффективных технологий и электролизеров производства для алюминия [4–6], задача изучения растворения глинозема (Al2O3) в криолит-глиноземном расплаве и новых легкоплавких электролитах с целью оперативного контроля его содержания при электролизе становится еще более актуальной. Из анализа литературных источников следует, что содержание глинозема может быть наиболее точно и быстро определено посредством сочетания двух методик:
– измерение непосредственно в электролизере свойства или параметра исследуемой системы, надежно и обоснованно коррелирующего с содержанием растворенного в расплаве глинозема;
– анализ физико-химическими методами отобранных из электролизера образцов расплава.
Для исследования растворимости и кинетики растворения оксидов во фторидных расплавах известны следующие методы:
– потенциометрия (по ЭДС концентрационного элемента) [2, 6–8];
– метод вращающегося дискового электрода [9];
– вольтамперометрия (по пику анодного тока) [10–12];
– хронопотенциометрия (по переходному времени) [13, 14];
– термоанализ (по температуре ликвидуса) [3, 15];
– импедансометрия (по электропроводности расплава) [16, 17];
– стационарная поляризация (по анодному перенапряжению) [18, 19];
– оптический метод (по изменению структуры расплава) [20];
– визуальный метод (по наличию в расплаве взвеси глинозема) [8, 21, 22].
Целью настоящей работы является изучение некоторых закономерностей растворения Al2O3 в расплаве KF–AlF3 с использованием метода циклической вольтамперометрии и изучение возможности оперативного контроля содержания глинозема в исследуемых расплавах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Изучение процесса растворения Al2O3 провели в расплаве KF–AlF3 с мольным отношением [KF]/[AlF3] = 1.5 моль/моль и разным содержанием оксида на воздухе при температуре 785°С. Расплав был приготовлен по ранее описанной методике [23] из индивидуальных солей: фторид калия (KF) и фторид алюминия (AlF3) – марки х. ч. (Вектон, Россия). В качестве кислородсодержащей добавки использовали оксид алюминия марки х. ч. (Реахим, Россия).
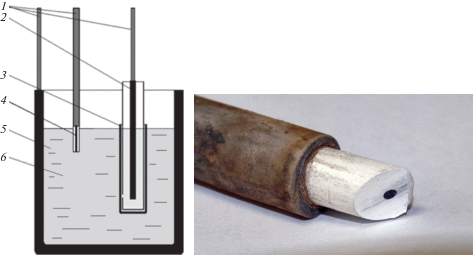
Измерения были проведены в трехэлектродной электрохимической ячейке, схема которой представлена на рис. 1. В качестве рабочего электрода был использован погруженный в расплав стеклоуглеродный (СУ) стержень (4), экранированный спеченным нитридом бора (Унихим, Россия). Роль вспомогательного электрода выполнял графитовый тигель с исследуемым расплавом. В качестве электрода сравнения (2) был использован газовый электрод CO/CO2 [24], размещенный в тигле из пористого графита. Рабочий электрод периодически извлекали из расплава для шлифовки и обновления поверхности.
Рис. 1.
Схема экспериментальной ячейки и фотография рабочего электрода: 1 – стальные токоподводы; 2 – газовый электрод CO/CO2; 3 – пористый графитовый тигель; 4 – рабочий торцевой электрод (СУ-стержень, экранированный нитридом бора); 5 – исследуемый расплав; 6 – графитовый тигель (противоэлектрод).
Электрохимические измерения проводили с использованием “PGSTAT AutoLab 320N” и ПО “NOVA 1.11” (Metrohm, Нидарланды). Вольтамперограммы были получены при скоростях развертки потенциала от 1 до 20 В/с. Для компенсации омического падения напряжения IR использовали процедуру I-Interrupt.
Температуру печи и расплава задавали и контролировали при помощи термопар Pt/Pt–Rh, терморегулятора “Варта ТП-703” и термопарного модуля USB-ТС01 (National Instruments, USA).
Для анализа состава расплава в ходе измерений отбирали пробы расплава массой 0.2–0.3 г при помощи никелевой ложки. До анализа пробы хранили в герметичном сухом боксе с инертной атмосферой. Содержание глинозема в образцах определяли путем карботермического сжигания образцов с последующей фиксацией поглощения инфракрасного излучения в потоке отходящего инертного газа на анализаторе ОН 836 (LECO, США). Элементный состав расплавов определяли спектрально-эмиссионным методом с индуктивно-связанной плазмой с использованием спектрометра “iCAP 6300 Duo” (Thermo scientific, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
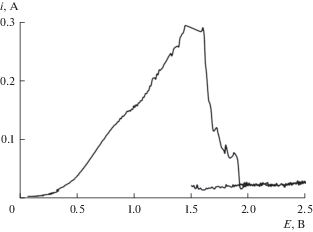
Вольтамперные измерения. На рис. 2 представлены вольтамперограммы, полученные в расплаве KF–AlF3 с 2.36 мас. % Al2O3. При развертке потенциала в анодную сторону при потенциале 1.5–1.6 В наблюдается пик, связанный с окислением ионов кислорода, входящих в состав электроактивных оксидно-фторидных анионных группировок. Резкий спад тока до значений 0.03–0.04 А при дальнейшей поляризации рабочего электрода связан с истощением прианодного слоя по кислородсодержащим ионам и наступлением “анодного эффекта” [10, 11]. Подобные вольтамперограммы были получены авторами работы [11] при исследовании кинетики анодного процесса на графите в легкоплавких расплавах NaF–AlF3–Al2O3 ([NaF]/[AlF3] = 1.2 моль/моль).
Рис. 2.
Вольтамперограмма, полученная в расплаве KF–AlF3 (КО = 1.5) с 2.36 мас. % Al2O3 при температуре 785°С и скорости развертки 1 В/с.
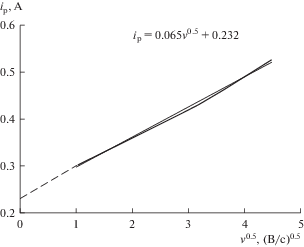
На рис. 3 представлены вольтамперограммы, полученные в расплаве KF–AlF3 с 3.15 мас. % Al2O3 в зависимости от скорости развертки потенциала. Видно, что пик на вольтамперограммах формируются уже при скорости развертки потенциала 1 В/с, а повышение скорости развертки потенциала приводит к росту пикового значения отклика тока. Зависимость тока пика от квадратного корня величины скорости развертки (рис. 4) линейна, при этом ее экстраполяция не пересекает начало координат, что указывает на смешанный характер затруднений исследуемого процесса.
Рис. 3.
Вольтамперограммы, полученные в расплаве KF–AlF3 с 3.15 мас. % Al2O3 при температуре 785°С и скорости развертки 1–20 В/с.
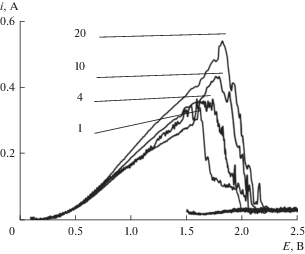
Рис. 4.
Зависимость тока пика от квадратного корня скорости развертки потенциала в расплаве KF–AlF3 с 3.15 мас. % Al2O3 при температуре 785°С.
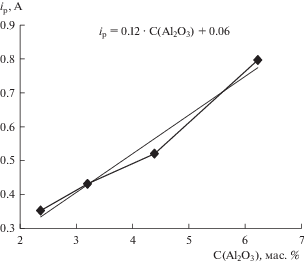
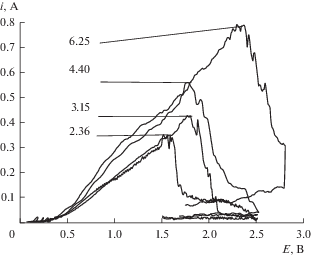
Оценка содержания Al2O3. На рис. 5 представлены вольтамперограммы, полученные в расплаве KF–AlF3 с разным содержанием Al2O3, а на рис. 6 – эмпирическая зависимость пиковых значений отклика тока от содержания Al2O3 в расплаве. Видно, что с ростом содержания Al2O3 в расплаве пиковые значения отклика линейно повышаются. Следовательно, полученная эмпирическая зависимость может быть использована для оперативного неразрушающего контроля содержания Al2O3 при электролизе расплавов на основе системы KF–AlF3–Al2O3, включающая фиксацию пикового значения отклика тока на вольтамперной зависимости и определение по предварительно полученной эмпирической зависимости текущего содержания Al2O3 в расплаве.
Рис. 5.
Вольтамперограммы полученные в расплаве KF–AlF3 при температуре 785°С и скорости развертки 1 В/с в зависимости от концентрации Al2O3.
Практически в ходе подобного контроля может быть определена динамика изменения содержания Al2O3, а соответственно и корректность работы автоматической подачи Al2O3 в электролизер.
Оценка скорости растворения Al2O3. Помимо определения текущего содержания Al2O3 была проверена применимость метода для оценки скорости растворения Al2O3 в расплаве KF–AlF3 ([KF]/[AlF3] = 1.5 моль/моль) с разным содержанием Al2O3 при температуре 785°С. Для этого после загрузки очередной порции оксида в расплав производили фиксацию вольтамперных зависимостей во времени.
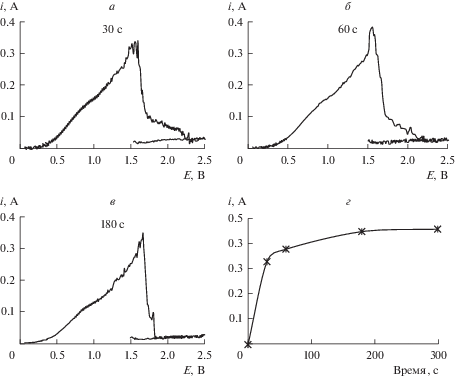
Для дальнейших измерений была выбрана скорость развертки потенциала 1 В/с. Первый набор вольтамперограмм фиксировали сразу после загрузки Al2O3 в расплав, затем по одному измерению через каждые 30 с до окончания роста тока анодного пика. Пример набора таких измерений приведен на рис. 7. Видно, что пиковое значение отклика тока растет со временем после загрузки оксида, причем прирост тока максимален в первые 0–5 с, а затем замедляется. В условиях приведенного примера нарастание тока практически прекратилось после 180–300 с, что указывает на полное растворение навески.
Рис. 7.
Вольтамперограммы, полученные в расплаве KF–AlF3 при изменении содержания Al2O3 в расплаве с 2.36 до 3.15 мас. % после 30 (а), 60 (б) и 180 с (в). Изменение пикового значения отклика тока на вольтамперограммах, полученных на СУ-аноде в расплаве KF–AlF3 при изменении содержания Al2O3 в расплаве с 2.36 до 3.15 мас. % во времени (г).
Стоит отметить, что при визуальном наблюдении растворение Al2O3 в расплаве KF–AlF3–Al2O3 при температуре 785°С протекает значительно быстрее: после введения навеска Al2O3 находится на поверхности расплава 1–5 с, после чего растворяется в объеме расплава в течение 5–10 с.
Таблица 1.
Скорости растворения глинозема Al2O3 в расплаве [KF]/[AlF3] = 1.5 моль/моль при температуре 785°С
| Изменение Al2O3 в расплаве | Скорость растворения, моль/с | ||
|---|---|---|---|
| мас. % | мол. % | за первые 30 с | интегральная |
| 2.36–3.15 | 1.61–2.16 | 2.4 · 10–3 | 5.45 · 10–5 |
| 3.15–4.40 | 2.16–3.02 | 5.9 · 10–4 | |
| 4.40–6.25 | 3.02–4.32 | 3.1 · 10–4 | |
Однако распределение растворенного Al2O3 по объему электролита и диффузия электроактивых ионов к поверхности электрода занимает более продолжительное время, что и было получено в ходе регистрации вольтамперограмм. Исходя из полученных данных, были оценены скорости растворения Al2O3 в расплаве KF–AlF3 с разным исходным содержанием Al2O3 при температуре 785°С. Для этого изменение молей Al2O3 в расплаве (по данным анализатора LECO) делили на время растворения навесок.
В целом можно отметить, что по аналогичным схемам может быть систематически изучен процесс растворения Al2O3 в исследуемых легкоплавких расплавах в зависимости от изменения прочих условий эксперимента.
ЗАКЛЮЧЕНИЕ
Методами циклической вольтамперометрии и карботермического восстановления проб на анализаторе LECO изучен процесс растворения глинозема в расплаве KF–AlF3 с мольным отношением [KF]/[AlF3] = 1.5 моль/моль при температуре 785°С.
Показано, что значение тока пика на полученных вольтамперограммах линейно зависит от содержания Al2O3 в исследуемом расплаве, при этом была оценена скорость растворения глинозема, которая составила от 2.4 · 10–3 до 5.45 · 10–5 моль/с.
Согласно зависимости тока пика на полученных вольтамперограммах в зависимости от концентрации растворенного Al2O3 в расплаве построена градуировочная зависимость. Однако данная зависимость может применяться для конкретного состава расплава, температуры процесса и скорости развертки потенциала.
На основании анализа полученных результатов показана принципиальная возможность оперативного неразрушающего контроля содержания Al2O3 при электролизе расплавов на основе системы KF–AlF3–Al2O3, включающая фиксацию пикового значения отклика тока на вольтамперной зависимости и определение по эмпирической зависимости текущего содержания глинозема в расплаве.
Авторы выражают благодарность О.Б. Павленко за проведение анализов образцов на LECO.
Список литературы
Борисоглебский Ю.В., Галевский Г.В., Кулагин Н.М., Минцис М.Я. Металлургия алюминия. Новосибирск: Наука, 1999.
Bracamonte L., Nilsen K., Rosenkilde Ch., Sandes E. Alumina concentration measurements in cryolite melts // TMS: Light Metals. 2020. P. 600–607.
Skybakmoen E., Solheim A., Sterten A. // Met. & Mat. Trans. B. 1997. 27. P. 81–86.
Yang J., Hryn J.N., Davis B.R., Roy A., Krumdick G.K., Pomykala Jr. J.A. New opportunities for aluminium electrolysis with metal anodes in a low temperature electrolyte system // TMS: Light Metals. 2004. P. 321–326.
Николаев А.Ю., Ясинский А.С., Суздальцев А.В., Поляков П.В., Зайков Ю.П. Электролиз алюминия в расплавах и суспензиях KF–AlF3–Al2O3 // Расплавы. 2017. № 3. С. 205–213.
Yasinskiy A.S., Suzdaltsev A.V., Padamata S.K., Polyakov P.V., Zaikov Yu.P. Electrolysis of low–temperature suspensions: an update // TMS: Light Metals. 2020. P. 626–636.
Васюнина Н.В., Васюнина И.П., Михалев Ю.Г., Виноградов A.M. Растворимость и скорость растворения глинозема в кислых криолитоглиноземных расплавах // Изв. ВУЗов. Цвет. Мет. 2009. 4. С. 24–28.
Frolov A.V., Gusev A.O., Zaikov Yu.P., Khramov A.P., Shurov N.I., Tkacheva O.Yu., Apisarov A.P., Kovrov V.A. Modified alumina-cryolite bath with high electrical conductivity and dissolution rate of alumina // TMS: Light Metals. 2007. P. 571–576.
Frazer E.J., Thonstad J. // Met. & Mat. Trans. B. 2010. 41. P. 543–548.
Richards N.E., Rolseth S., Thonstad J., Haverkamp R.G. Electrochemical analysis of alumina dissolved in cryolite melts // TMS: Light metals.1995. P. 391–404.
Haverkamp R.G., Rolseth S., Thonstad J., Gudbrandsen H. Voltammetry and electrode reactions in AlF3-rich electrolyte // TMS: Light Metals. 2001. P. 481–486.
Nikolaev A.Yu., Pavlenko O.B., Suzdaltsev A.V., Zaikov Yu.P. // J. El. Chem. Soc. 2020 (в пeчaти).
Jain R.K., Gaur H.C., Frazer E.J., Welch B.J. // J. El. Analyt. Chem. 1977. 78. P. 1–30.
Некрасов В.Н., Лимановская О.В., Суздальцев А.В., Зайков Ю.П., Храмов А.П. Хронопотенциометрия на углеродном аноде в расплавах KF–AlF3–Al2O3 // Расплавы. 2011. № 2. С. 18–29.
Дедюхин А.Е., Аписаров А.П., Ткачева О.Ю., Редькин A.A., Зайков Ю.П., Фролов А.В., Гусев А.О. Электропроводность расплавленной системы [(KF–AlF3)–NaF]–Al2О3 // Расплавы. 2009. № 2. С. 23–28.
Kataev A.A., Tkacheva O.Yu., Zakiryanova I.D., Apisarov A.A., Dedyukhin A.E., Zaikov Yu.P. // J. Mol. Liq. 2017. 231. P. 149–153. https://doi.org/10.1016/j.molliq.2017.02.021
Yasinskiy A.S., Suzdaltsev A.V., Polyakov P.V., Padamata S.K., Yushkova O.V. // Cer. Inter. 2020. 46B. № 8. P. 11539–11548. https://doi.org/10.1016/j.ceramint.2020.01.180
Kovrov V.A., Khramov A.P., Zaikov Yu.P., Shurov N.I. Effect of the cationic composition of cryolite-alumina melts on the anodic overvoltage // Rus. J. El. Chem. 2007. 43. P. 909–919.
Суздальцев А.В., Некрасов В.Н., Зайков Ю.П., Храмов А.П., Лимановская О.В. Анодная поляризация на стеклоуглероде в низкоплавких калиевых криолит-глиноземных расплавах // Расплавы. 2009. № 4. С. 41–51.
Kan H.-M., Zhang N., Wang X. // J. Cent. South Univ. 2012. 19. P. 897–902.
Исаева Л.А., Браславский А.Б., Поляков П.В. // Изв. ВУЗов. Цвет. Мет. 2009. 6. С. 35–41.
Welch B.J., Kuschel G.I. // JOM. 2007. 5. P. 50–54.
Николаев А.Ю., Суздальцев А.В., Зайков Ю.П. Новый способ синтеза лигатур Al–Sc в оксидно-фторидных и фторидных расплавах // Расплавы. 2020. № 2. С. 155–165.
Суздальцев А.В., Храмов А.П., Зайков Ю.П. Углеродный электрод для электрохимических исследований в криолит-глиноземных расплавах при 700–960°С // Электрохимия. 2012. 48. № 12. С. 1251–1263.
Дополнительные материалы отсутствуют.