Расплавы, 2020, № 6, стр. 553-564
Температура ликвидуса и электропроводность расплавленной эвтектики CsCl–NaCl–KCl, содержащей IrCl3
А. В. Руденко a, А. П. Аписаров a, А. В. Исаков a, *, О. В. Гришенкова a, Ю. П. Зайков a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: isakov@ihte.uran.ru
Поступила в редакцию 30.06.2020
После доработки 18.07.2020
Принята к публикации 28.07.2020
Аннотация
Температура ликвидуса и удельная электропроводность расплавов (CsCl–NaCl–KCl)эвт–IrCl3, перспективных для производства иридиевых покрытий и композитных материалов, были определены методами термического анализа и импедансной спектроскопии. Установлены диапазоны температур ликвидуса (753–983) ± 5 К и солидуса (751–755) ± 4 К, построена соответствующая часть фазовой диаграммы для квазибинарной системы (CsCl–NaCl–KCl)эвт–(0–2.12 мол. %) IrCl3. Показано, что наименьшее значение температуры ликвидуса наблюдается для расплава, содержащего 1.4 мол. % IrCl3. Увеличение температуры ликвидуса в расплавленных смесях с концентрацией более 1.5 мол. % IrCl3 объяснено образованием соединения Cs3IrCl6, обнаруженного посредством рентгенофазового анализа. Установлено, что удельная электропроводность исследуемых расплавов, измеренная в области гомогенности, линейно снижается с уменьшением температуры и увеличением концентрации IrCl3. Определены коэффициенты, описывающие температурные зависимости электропроводности расплавов (CsCl–NaCl–KCl)эвт–(0–2.12 мол. %) IrCl3. Среднее значение температурного коэффициента составило (2.35 ± 0.02) · 10–3 Ом–1 · см−1 · K−1 для всех исследованных иридийсодержащих составов. Добавка 1 мол. % IrCl3 приводит к уменьшению удельной электропроводности примерно на 7%. Установлено, что при концентрации трихлорида иридия 1.4–1.5 мол. % рабочая температура может быть снижена до ∼800 К, при более низких и высоких концентрациях IrCl3 температура процесса может варьироваться от 850 до 1030 К в зависимости от условий электроосаждения.
ВВЕДЕНИЕ
Электроосаждение из расплавленных солей является одним из наиболее эффективных, недорогих и надежных методов получения металлов платиновой группы, в т.ч. иридия [1–3]. Иридий имеет высокую температуру плавления (2719 К), отличные высокотемпературные механические свойства, низкую кислородную проницаемость (<10−14 г · см–1 · с–1 при 2473 К), превосходную стойкость к окислению и абляции [1–8]. Эти характеристики определяют спрос на изделия из иридия [2, 9, 10], а также иридиевые покрытия [10–13], сплавы [3, 14–17] и композитные материалы [10, 18–21], пригодные для использования в экстремальных условиях. В частности, значительное внимание уделяется разработкам, связанным с барьерными слоями иридия на конструкционных углеродных материалах и Re–Ir композитах, применяемых в аэрокосмических аппаратах (камеры сгорания жидкостных ракетных двигателей, передние кромки и носы гиперзвуковых самолетов и т.п.) [12, 13, 18–20].
Ранние работы по электрокристаллизации иридия проводились в токсичных и нестабильных цианидах [22]. Впоследствии неоднократно было показано, что более подходящими электролитами для электроосаждения иридия являются нетоксичные расплавы на основе хлоридов щелочных металлов [7–13, 23–32], которые имеют хорошую термическую стабильность и позволяют получать компактные, когерентные, беспористые иридиевые слои толщиной до нескольких миллиметров на различных подложках при высокой скорости осаждения. Чаще всего используют легкоплавкую негигроскопичную тройную эвтектическую смесь CsCl–KCl–NaCl (температура плавления 753 K) с добавками IrCl3 в качестве иридийсодержащего компонента. Электроосаждение сплошных покрытий обычно проводят при концентрации иридия в расплаве ≤5 мас. % [7–9, 13, 21, 29–32]. В работе [21] было показано, что для получения сплошных слоев высококачественного иридия из расплава (CsCl–NaCl–KCl)эвт– IrCl3 достаточно 3 мас. % Ir.
Добавление трихлорида иридия в расплав (CsCl–NaCl–KCl)эвт приведет к изменению температуры ликвидуса и электропроводности электролита. В первую очередь это повлечет за собой необходимость изменения диапазона рабочих температур, что может существенно повлиять на закономерности электрокристаллизации и характеристики покрытия. Салтыкова с соавт. [26] обнаружили, что температура оказывает влияние на электрохимическое поведение ионов иридия. Аналогичный вывод о переходе от полностью необратимого механизма электровосстановления Ir3+ в интервале температур от 823 до 883 К к квазиобратимому при 913 К сделал Huang [31]. В той же статье было отмечено существенное влияние температуры на начальные стадии электрокристаллизации иридия, а также структуру, текстуру и пористость осадков. Согласно Кузнецову [24], механизм катодного восстановления ионов Ir3+ в расплаве (NaCl–KCl–CsCl)эвт изменяется от необратимого к обратимому с повышением температуры до 873 К, что, в свою очередь, приводит к образованию дендритного осадка вместо сплошного. Zhu с соавт. [29] обнаружили, что повышение температуры с 793 до 913 К повлияло на морфологию, шероховатость, размер зерна и компактность иридиевых покрытий. Электропроводность также является важным фактором, влияющим на возможность получения сплошных плотных осадков [33]. Кроме того, эффективность и стабильность процесса электроосаждения иридия в значительной степени зависят от вышеупомянутых характеристик электролита.
Однако данные о температуре ликвидуса и электропроводности иридийсодержащих хлоридных расплавов в литературе отсутствуют. Имеются лишь сведения, касающиеся электропроводности тройной системы (CsCl–KCl–NaCl)эвт в интервале температур от 804 до 1146 К [34], а также уравнения, описывающие температурные зависимости электропроводности в расплавах CsCl–KCl (1030–1150 К) и CsCl–NaCl (1050–1150 К) [35]. Целью данной работы является определение температуры ликвидуса и удельной электропроводности расплавов на основе (CsCl–KCl–NaCl)эвт, содержащих до 3.5 мас. % (2.12 мол. %) IrCl3.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Электролиты. Хлориды цезия (Вектон, 99.99%), калия (Вектон, 99.9%) и натрия (Уралкалий, 99.9%) были использованы для приготовления исходного электролита. Для получения эвтектической композиции (табл. 1, состав 1) эти соли смешивали в определенном соотношении и плавили в стеклоуглеродном тигле в атмосфере высокочистого сухого аргона.
Таблица 1.
Составы электролитов
| № | CsCl | KCl | NaCl | IrCl3 | ||||
|---|---|---|---|---|---|---|---|---|
| мол. % | мас. % | мол. % | мас. % | мол. % | мас. % | мол. % | мас. % | |
| 1 | 45.50 | 68.15 | 24.50 | 16.25 | 30.00 | 15.60 | – | – |
| 2 | 45.10 | 66.56 | 24.28 | 15.87 | 29.73 | 15.23 | 0.89 | 2.33 |
| 3 | 44.82 | 65.50 | 24.13 | 15.62 | 29.55 | 14.99 | 1.50 | 3.88 |
| 4 | 44.54 | 64.45 | 23.98 | 15.37 | 29.36 | 14.75 | 2.12 | 5.44 |
Подготовленную эвтектическую смесь (∼350 г) вместе с кусочками иридиевой проволоки (∼35 г) помещали в стеклоуглеродный контейнер и нагревали до 1000 К. Через стеклоуглеродную трубку в крышке контейнера, расплав в течение 18 ч продували газообразным хлором со скоростью 1200 см3 · ч–1; хлор был получен электролизом расплавленного хлорида свинца(II). В условиях избытка хлора протекала реакция
(1)
$2{\text{MeCl}} + {\text{Ir}} + 2{\text{C}}{{{\text{l}}}_{2}} = {\text{M}}{{{\text{e}}}_{{\text{2}}}}{\text{IrC}}{{{\text{l}}}_{6}},$(2)
$3{\text{M}}{{{\text{e}}}_{{\text{2}}}}{\text{IrC}}{{{\text{l}}}_{6}} + 3{\text{MeCl}} = 3{\text{M}}{{{\text{e}}}_{{\text{3}}}}{\text{IrC}}{{{\text{l}}}_{6}} + 1.5{\text{C}}{{{\text{l}}}_{2}}.$Полученная композиция (CsCl–KCl–NaCl)эвт–IrCl3 содержала 3.5 мас. % Ir, что было показано с помощью ICP-OES анализа с использованием оптического эмиссионного спектрометра с индуктивно связанной плазмой (Thermo Scientific iCAP6300 Duo, США). Исходный иридийсодержащий состав 4 разбавляли эвтектической смесью CsCl–KCl–NaCl для получения расплавов с более низкими (2.5 и 1.5 мас. %) концентрациями иридия. Составы исследованных электролитов, после пересчета на концентрацию трихлорида иридия, приведены в табл. 1. Для рентгеноструктурного анализа (XRD) застывших образцов использовали рентгеновский дифрактометр Rigaku D/MAX-2200VL/PC (Rigaku Corp., Япония).
Экспериментальная ячейка. Для определения температуры ликвидуса и удельной электропроводности исследуемых электролитов использовалась та же конструкция ячейки, что и в предыдущей работе [34]. Стеклоуглеродный тигель с исследуемым расплавом (140–150 г) был установлен на графитовом кольце внутри кварцевого контейнера с плотно закрывающейся фторопластовой крышкой, защищенной графитовыми экранами. Блок из двух коаксиально расположенных стеклоуглеродных электродов (наружный электрод с внешним и внутренним диаметрами 18 и 14 мм, соответственно; центральный электрод диаметром 4 мм; BN разделитель в нижней части) и Pt/Pt–Rh термопара в алундовом чехле были зафиксированы в крышке так, чтобы их перемещение по вертикали не нарушало инертную атмосферу в ячейке. Герметичность ячейки и блока электродов обеспечивалась уплотнениями из вакуумной резины. Схема ячейки приведена в работе [34].
Процедуры измерений. Температуру кристаллизации определяли методом термического анализа на основе регистрации тепловых эффектов. Временные зависимости термо-ЭДС регистрировались с использованием мультиметра APPA 109N (APPA Technology Corp., Тайвань) как при нагреве, так и при охлаждении расплавов. Измерение температуры осуществлялось автоматически каждую секунду. Средние значения скорости охлаждения и нагрева составляли соответственно, 4.8 и 7.1 К в минуту. Разница в значениях температуры в точках фазовых переходов, полученных в обоих температурных циклах, не превышала погрешности измерения (~5 К).
Для определения удельной электропроводности (κ, Ом–1 · см−1) методом спектроскопии импеданса использовали блок измерения импеданса ZAHNER-Elektrik IM6E (Zahner Sci. Instr., Германия). Диапазон частот переменного тока – от 100 до 105 Гц, амплитуда – 5 мВ. Сопротивление расплава (R, Ом) определяли, как активную часть импеданса по пересечению кривой с осью абсцисс. Удельную электропроводность рассчитывали по формуле
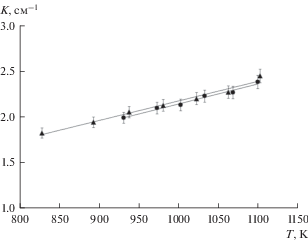
где K – константа электрохимической ячейки (см–1). Для определения K, проводили калибровку с расплавленным хлоридом цезия при нагревании и охлаждении в диапазоне температур от 931 до 1100 K. Данные по удельной электропроводности расплавленного CsCl были взяты из работы [35]. Кроме того, константу ячейки находили с использованием расплава 1, не содержащего иридия (см. табл. 1). Из рис. 1 видно, что температурные зависимости константы ячейки, полученные с этими электролитами, практически идентичны. K(T) можно рассчитать по уравнению где T – температура (K), r 2 – коэффициент детерминации. Небольшое увеличение K с ростом температуры связано с некоторым увеличением объема расплавленного электролита и, соответственно, уровня расплава в тигле (электроды всегда погружались в расплав на глубину 15 мм от точки контакта с расплавом). Температурная зависимость K была учтена при расчете значений удельной электропроводности.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
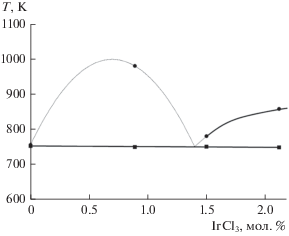
Температура ликвидуса. Кривые нагрева, полученные в расплавах на основе (CsCl–KCl–NaCl)эвт с различными концентрациями IrCl3, представлены на рис. 2. Значения температур ликвидуса и солидуса для исследованных составов расплавов приведены в табл. 2. По этим результатам была построена часть фазовой диаграммы квазибинарной системы (CsCl–NaCl–KCl)эвт–IrCl3 в диапазоне концентрации IrCl3 до 2.12 мол. % (рис. 3). Было установлено, что температура плавления тройной эвтектической смеси CsCl–KCl–NaCl (45.5 : 24.5 : 30 мол. %) составляет 753 K, что совпадает с имеющимися литературными данными [35, 36]. При концентрации IrCl3 около 1.4 мол. %, по-видимому, будет наблюдаться точка псевдоэвтектики, что отражено пунктирной линией на рис. 3. Для построения более точной квазибинарной диаграммы при концентрации IrCl3 < 1.4 мол. % необходимы дополнительные исследования. Экспериментальный факт повышения температуры ликвидуса после 1.5 мол. % IrCl3 может быть связан с образованием (увеличением доли) соединения Cs3IrCl6, найденного методом XRD (рис. 4). Обнаружение этого соединения косвенно подтверждает возможность существования в исследуемом расплаве комплексных ионов [IrCl6]3–. Следует отметить, что в расплаве (CsCl–NaCl–KCl)эвт–ReCl4 была установлена подобная взаимосвязь между повышением температуры ликвидуса и формированием гексахлоррената цезия [34].
Рис. 2.
Кривые нагрева в расплаве (CsCl–NaCl–KCl)эвт–IrCl3 с концентрацией IrCl3 (мол. %): 1 – 0, 2 – 0.89, 3 – 1.50, 4 – 2.12. Ось X (время) не имеет числовых значений для возможности представления кривых, соответствующих разным составам, на одном графике.
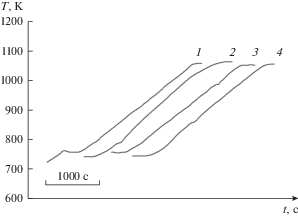
Таблица 2.
Температуры ликвидуса (Tliq) и солидуса (Tsol) в расплаве (CsCl–NaCl–KCl)эвт–IrCl3*
| № | Содержание IrCl3, мол. % | Tliq, K | Tsol, K |
|---|---|---|---|
| 1 | 0 | 753 ± 5.00 | 751 ± 4.00 |
| 2 | 0.89 | 983 ± 5.08 | 753 ± 4.08 |
| 3 | 1.50 | 783 ± 5.02 | 752 ± 4.03 |
| 4 | 2.12 | 861 ± 5.04 | 755 ± 4.05 |
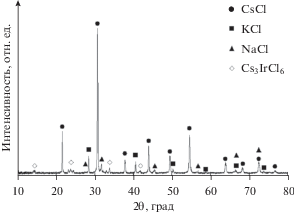
Рис. 4.
Данные XRD для образца застывшего плава (CsCl–KCl–NaCl)эвт–1.5 мол. % IrCl3 (табл. 1, состав 3). Содержание соединения Cs3IrCl6 в образце 1.5 мол. %.
Электропроводность. Экспериментальные данные по удельной электропроводности расплавов (CsCl–NaCl–KCl)эвт–IrCl3, содержащих до 2.12 мол. % IrCl3, представлены на рис. 5 и в табл. 3. Температурные диапазоны, выбранные для измерения электропроводности этих расплавов, отличаются (табл. 4) и соответствуют областям гомогенности, в которых фазовые переходы первого рода не происходят. В табл. 4 приведены также значения коэффициентов a и b, входящих в уравнение, описывающее линейные температурные зависимости удельной электропроводности в виде
Можно видеть, что температурные зависимости имеют практически одинаковый наклон (см. рис. 5), среднее значение температурного коэффициента a составляет (2.35 ± 0.02) · 10–3 Ом–1 · см–1 · K–1 для всех исследованных иридийсодержащих составов. Это значение близко к найденному для расплавов (CsCl–NaCl–KCl)эвт–(1.55–7.61) ReCl4 ((2.12 ± 0.03) · 10–3 Ом–1 · см–1 · K–1) [34], поскольку основной вклад в электропроводность этих электролитов вносят ионы натрия и калия.Рис. 5.
Температурные зависимости удельной электропроводности расплавов (CsCl–NaCl–KCl)эвт–IrCl3 с концентрацией IrCl3 (мол. %): ▲ – 0, ◆ – 0.89, ◼ – 1.5, ⚫ – 2.12 и ReCl4 (мол. %): △ – 1.55, ◇ – 3.21 [34].
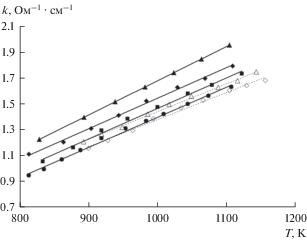
Таблица 3.
Экспериментальные значения удельной электропроводности
| Состав, мол. % | T, K | κ, Ом–1 · см−1 | Состав, мол. % | T, K | κ, Ом–1 · см−1 |
|---|---|---|---|---|---|
| CsCl | 1100 | 1.64 ± 0.08 | 3 | 1121 | 1.74 ± 0.06 |
| 1069 | 1.55 ± 0.03 | 1078 | 1.65 ± 0.05 | ||
| 1033 | 1.44 ± 0.07 | 1043 | 1.58 ± 0.08 | ||
| 1003 | 1.36 ± 0.02 | 999 | 1.48 ± 0.06 | ||
| 973 | 1.27 ± 0.08 | 956 | 1.39 ± 0.06 | ||
| 931 | 1.15 ± 0.08 | 918 | 1.30 ± 0.09 | ||
| 877 | 1.17 ± 0.08 | ||||
| 833 | 1.06 ± 0.07 | ||||
| 1* | 1103 | 1.96 ± 0.08 | 4 | 1106 | 1.63 ± 0.05 |
| 1063 | 1.85 ± 0.08 | 1073 | 1.56 ± 0.04 | ||
| 1023 | 1.75 ± 0.08 | 1043 | 1.50 ± 0.05 | ||
| 981 | 1.63 ± 0.08 | 1008 | 1.42 ± 0.04 | ||
| 938 | 1.52 ± 0.08 | 983 | 1.37 ± 0.04 | ||
| 893 | 1.40 ± 0.12 | 953 | 1.31 ± 0.05 | ||
| 828 | 1.23 ± 0.12 | 918 | 1.24 ± 0.07 | ||
| 888 | 1.15 ± 0.05 | ||||
| 861 | 1.07 ± 0.05 | ||||
| 835 | 1.00 ± 0.03 | ||||
| 813 | 0.95 ± 0.03 | ||||
| 2 | 1108 | 1.80 ± 0.07 | |||
| 1068 | 1.70 ± 0.05 | ||||
| 1028 | 1.63 ± 0.07 | ||||
| 983 | 1.53 ± 0.08 | ||||
| 943 | 1.42 ± 0.07 | ||||
| 903 | 1.31 ± 0.07 | ||||
| 863 | 1.21 ± 0.07 | ||||
| 813 | 1.11 ± 0.07 |
* Составы 1–4 приведены в табл. 1.
Таблица 4.
Значения коэффициентов уравнения (5) и температурные интервалы гомогенности расплавов (CsCl–KCl–NaCl)эвт–IrCl3
| № | Содержание IrCl3, мол. % | a, Ом–1 · см−1 · K−1 | b, Ом–1 · см−1 | r 2 | ΔT, K |
|---|---|---|---|---|---|
| 1 | 0 | 2.65 · 10–3 | 968.67 · 10–3 | 0.99 | 828–1103 |
| 2 | 0.89 | 2.37 · 10–3 | 818.35 · 10–3 | 0.99 | 813–1108 |
| 3 | 1.50 | 2.36 · 10–3 | 890.62 · 10–3 | 0.99 | 833–1121 |
| 4 | 2.12 | 2.34 · 10–3 | 936.72 · 10–3 | 0.99 | 813–1106 |
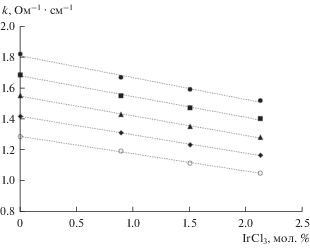
Зависимости удельной электропроводности расплавов (CsCl–KCl–NaCl)эвт–IrCl3 от концентрации IrCl3 при температурах 850, 900, 950, 1000 и 1050 K приведены на рис. 6. Для всех составов добавка 1 мол. % IrCl3 приводит к уменьшению значений κ примерно на 7%. Причиной снижения электропроводности расплавленной смеси при увеличении концентрации трихлорида иридия является, по-видимому, образование соединения Cs3IrCl6. Подобные закономерности были обнаружены в ренийсодержащем расплаве [34].
Рис. 6.
Зависимости удельной электропроводности расплавов (CsCl–NaCl–KCl)эвт–IrCl3 от концентрации IrCl3 при T (K): ⚫ – 850, ◼ – 900, ▲ – 950, ◆ – 1000, ⚪ – 1050.
Полученные данные об областях гомогенности и электропроводности важны для выбора оптимального диапазона рабочих температур и составов, режимов электролиза, энергетических характеристик установок. В частности, на основании полученных результатов можно заключить, что для диапазона концентраций от 1.3 до 2 мол. % IrCl3 рабочие температуры могут составлять ∼850 К. При содержании IrCl3 1.4–1.5 мол. % температура может быть снижена до ∼800 К. При работе до полной выработки электролита по IrCl3 температуру процесса необходимо повышать до 1020–1030 К для обеспечения гомогенности расплава.
ВЫВОДЫ
Измерены температуры ликвидуса и солидуса расплавов (CsCl–NaCl–KCl)эвт–(0‒2.12 мол. %) IrCl3. Построена соответствующая часть фазовой диаграммы квазибинарной системы. Обнаружено, что минимальное значение температуры ликвидуса в исследованном диапазоне концентраций трихлорида иридия будет наблюдаться в расплаве, содержащем 1.4 мол. % IrCl3. Увеличение температуры ликвидуса после 1.5 мол. % IrCl3 может быть связано с образованием соединения Cs3IrCl6, наличие которого подтверждено рентгенофазовым анализом.
Установлено, что удельная электропроводность расплавленной смеси (CsCl–NaCl–KCl)эвт – (0–2.12 мол. %) IrCl3, измеренная в области гомогенности, линейно снижается с увеличением концентрации IrCl3 и уменьшением температуры. Температурные зависимости удельной электропроводности для всех исследованных иридийсодержащих составов имеют практически одинаковый наклон, среднее значение температурного коэффициента составляет (2.35 ± 0.02) · 10–3 Ом–1 · см–1 · K–1. Во всех случаях добавка 1 мол. % IrCl3 приводит к уменьшению электропроводности на ∼7%.
Совокупность полученных данных позволяет заключить, что при концентрации трихлорида иридия от 1.3 до 2 мол. % рабочие температуры могут составлять ∼850 К, а при 1.4–1.5 мол. % ∼800 К. При работе до полной выработки электролита по IrCl3, температура должна быть увеличена до 1020–1030 К для обеспечения гомогенности расплава.
Исследование выполнено (частично) с использованием оборудования ЦКП “Состав вещества” (ИВТЭ УрО РАН).
Список литературы
Wu W., Chen Z. Iridium Coating: Processes, Properties and Application. Part I // Johnson Matthey Technol. Rev. 2017. 61. P. 16–28.
Ohriner E.K. Processing of Iridium and Iridium Alloys // Plat. Met. Rev. 2008. 52. P. 186–197.
Bai S., Zhu L., Zhang H., Ye Y. Review on Preparation of Iridium and Iridium Alloy Coatings by Electrodeposition in Molten Salt // Rare Met. Mater. Eng. 2015. 44. P. 1815–1820.
Weiland R., Lupton D.F., Heraeus W.C., Fischer B., Merker J., Scheckenbach C., Witte J. High-Temperature Mechanical Properties of the Platinum Group Metals. Properties of pure iridium at high temperature // Plat. Met. Rev. 2006. 50. P. 158–170.
Wu W., Chen Z., Wang L. Oxidation behavior of multilayer iridium coating on niobium substrate // Prot. Met. Phys. Chem. Surf. 2015. 51. P. 607–612.
Mumtaz K., Echigoya J., Enoki H., Hirai T., Shindo Y. Thermal cycling of iridium coatings on isotropic graphite // J. Mater. Sci. 1995. 30. P. 465–472.
Zhu L., Bai S., Zhang H., Ye Y., Gao W. Long-term high-temperature oxidation of iridium coated rhenium by electrical resistance heating method // Int. J. Refract. Met. Hard Mater. 2014. 44. P. 42–48.
Huang Y., Bai S., Zhang H., Ye Y. Oxidation of iridium coating on rhenium coated graphite at elevated temperature in stagnant air // Appl. Surf. Sci. 2015. 328. P. 436–443.
Timofeev N.I., Baraboshkin V.E., Saltykova N.A. Production of Iridium Crucibles by Electrolysis of Molten Salts. In: Iridium: Proc. Int. Symp. TMS 2000 (Eds. Ohriner, E.K., Lanam, R.D., Panfilov, P., Harada, H.). 2000. P. 175–179.
Toenshoff D., Lanam R., Ragaini J., Shchetkovskiy A., Smirnov A. Iridium coated rhenium rocket chambers produced by electroforming // Proc. 36th AIAA/ASME/SAE/ASEE Joint Propulsion Conf. 2000. https://doi.org/10.2514/6.2000-3166
Huang Y., Bai S., Zhang H., Ye Y. Growth mechanism and mechanical property of laminar iridium coating by electrodeposition // Int. J. Refract. Met. Hard Mater. 2015. 50. P. 204–209.
Huang Y., Bai S., Zhang H., Ye Y., Zhu L. Oxidation of iridium coatings on rhenium substrates at ultrahigh temperature in stagnant air: Its failure mechanism and life model // Surf. Coat. Technol. 2016. 288. P. 52–61.
Etenko A., McKechnie T., Shchetkovskiy A., Smirnov A. Oxidation-Protective Iridium and Iridium-Rhodium Coatings Produced by Electrodeposition from Molten Salts // ECS Trans. 2007. 3. P. 151–157.
Saltykova N.A., Portnyagin O.V. Electrodeposition of Iridium–Ruthenium Alloys from Chloride Melts: the Structure of the Deposits // Russ. J. Electrochem. 2001. 37. P. 924–930.
Bao Z., Murakami H., Yamabe-Mitarai Y. Microstructure and oxidation behaviour of Ir-rich Ir–Al binary alloys // Corros. Sci. 2014. 87. P. 306–311.
Bao Z., Murakami H., Yamabe-Mitarai Y. Effects of thermal exposure on Ir-based alloys with and without Pt coating // Corros. Sci. 2011. 53. P. 1224–1229.
Ai Y., Bai S., Zhu L., Ye Y., Zhang H., Li S., Tang Y., Zhang K., Wang R. Ablation behaviors of Ir–Al intermetallic coatings in a plasma wind tunnel // Surf. Coat. Technol. 2019. 367. P. 302–310.
Liu C., Chen J., Han H., Wang Y., Zhang Z. A long duration and high reliability liquid apogee engine for satellites // Acta Astronautica. 2004. 55. P. 401–408.
McKechnie T., Shchetkovskiy A. Development of Metallic Foams Monolithic Catalysts for Green Monopropellants Propulsion // Proc. Space Propulsion Conf. 2016. P. 232.
Zhu L., Bai S., Zhang H., Ye Y., Gao W. Rhenium used as an interlayer between carbon – carbon composites and iridium coating: Adhesion and wettability // Surf. Coat. Technol. 2013. 235. P. 68–74.
Isakov A.V., Apisarov A.P., Nikitina A.O. Electrowinning and annealing of Ir–Re–Ir material // Tsvet. Met. 2017. 11. P. 55–60.
Schlain D., McCawley F.X., Smith G.R. Electrodeposition of Platinum Metals from Molten Cyanides: A Technique Applicable To Electroforming // Plat. Met. Rev. 1977. 21. P. 38–42.
Qian J., Zhao T. Electrodeposition of Ir on platinum in NaCl–KCl molten salt // Trans. Nonferrous Met. Soc. China. 2012. 22. P. 2855–2862.
Kuznetsov S.A. Electrochemistry of refractory metals in molten salts: application for the creation of new and functional materials // Pure Appl. Chem. 2009. 81. P. 1423–1439.
Saltykova N.A. Electrodeposition of platinum metals and alloys from chloride melts // J. Min. Met. B. 2003. 39. № 1–2. P. 201–208.
Saltykova N.A., Smirnov A.B. Cathodic processes during electrodeposition of iridium from the molten eutectic KCl–NaCl–CsCl // Melts. 1992. 4. № 6. P. 474–479.
Zhu L., Bai S., Zhang H. Iridium coating prepared on rhenium substrate by electrodeposition in molten salt in the air atmosphere // Surf. Coat. Technol. 2011. 206. P. 1351–1354.
Zhu L., Bai S., Zhang H., Ye Y. Laminar iridium coating produced by pulse current electrodeposition from chloride molten salt //Appl. Surf. Sci. 2013. 282. P. 820–825.
Zhu L., Bai S., Zhang H., Ye Y. Effects of cathodic current density and temperature on morphology and microstructure of iridium coating prepared by electrodeposition in molten salt under the air atmosphere // Appl. Surf. Sci. 2013. 265. P. 537–545.
Huang Y., Zhu L., Ye Y., Zhang H., Bai S. Iridium coatings with various grain structures prepared by electrodeposition from molten salts: Growth mechanism and high temperature oxidation resistance // Surf. Coat. Technol. 2017. 325. P. 190–199.
Huang Y., Bai S., Zhang H., Ye Y., Zhu L. Electrochemical studies of Ir coating deposition from NaCl–KCl–CsCl molten salts // Surf. Coat. Technol. 2017. 322. P. 76–85.
Huang Y., Bai S., Zhang H., Ye Y., Zhu L. Electrocrystallization of iridium on the graphite, rhenium and iridium electrode from the NaCl–KCl–CsCl–IrCl3 molten salts // J. Electroanal. Chem. 2017. 791. P. 138–151.
Барабошкин А.Н. Электрокристаллизация металлов из расплавленных солей. М.: Наука, 1976.
Rudenko A., Isakov A., Apisarov A., Chernyshev A., Tkacheva O., Zaikov Yu. Liquidus temperature and electrical conductivity of molten eutectic CsCl–NaCl–KCl containing ReCl4 // J. Chem. Eng. Data. 2019. 64. P. 567–573.
Jans G. Thermodynamic and Transport Properties for Molten Salts: Correlation Equations for Critically Evaluated Density, Surface Tension, Electrical Conductance, and Viscosity Data // J. Phys. Chem. Ref. Data. 1988. 17(Suppl. 2). P. 1−309.
Посыпайко В.И., Алексеева Е.А. Диаграммы плавкости солевых систем. 4. Тройные системы. М.: Химия, 1977.
Дополнительные материалы отсутствуют.