Расплавы, 2020, № 6, стр. 599-607
Анализ механизма переноса электрона квантовохимическими методами в титансодержащих модельных системах
Ю. В. Стулов a, *, В. Г. Кременецкий a, С. А. Кузнецов a
a Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева – обособленное подразделение Федерального государственного бюджетного учреждения науки
Федерального исследовательского центра “Кольский научный центр Российской академии наук”
Апатиты, Россия
* E-mail: iu.stulov@ksc.ru
Поступила в редакцию 29.06.2020
После доработки 11.07.2020
Принята к публикации 23.07.2020
Аннотация
С помощью квантовохимических методов исследован механизм переноса электрона в титансодержащих модельных системах. Расчеты выполнены с помощью квантовохимического пакета Firefly методами теории функционала плотности (DFT). Метод анализа граничных орбиталей (ГО) показал хорошую применимость для исследования переноса электрона в модельной системе CaTiF6 + 12CaCl2. Найдены структуры, через которые высока вероятность переноса электрона с катода на комплекс титана. В процессе анализа были рассмотрены системы как с более упорядоченным, так и с менее упорядоченным граничным слоем. Такой подход позволил выявить величины сдвига граничных ионов и сжатия связей Ti–F, которые описывают переходное состояние. Показано, что структура переходного состояния в значительной степени разупорядочена, по сравнению с исходными структурами. Это соответствует реальному состоянию граничного слоя вблизи поверхности электрода. Применение метода ГО позволило с небольшими затратами машинного времени определить строение переходного состояния комплексной частицы ${\text{TiF}}_{{\text{6}}}^{{{\text{2}} - }}$ вблизи поверхности электрода, причем расчетная энергия активации переноса электрона хорошо согласуется с экспериментально определенной величиной.
ВВЕДЕНИЕ
В настоящее время квантовохимические исследования механизма переноса электрона в солевых расплавах на основе прямого расчета переходного состояния сталкиваются с практически непреодолимыми вычислительными сложностями. Как показывает наш опыт, минимально необходимый состав модельной системы должен содержать помимо электроактивного комплекса не менее 18 молекул электролита типа MX (M – щелочной металл; X – F, Cl) либо 12 молекул типа MX2 (M – щелочноземельный металл).
Но даже для таких систем прямой поиск переходного состояния требует нереально больших вычислительных затрат. Между тем, имеется подход, позволяющий на качественном уровне дать более детальную оценку возможности электрохимического переноса электрона в том или ином переходном состоянии. Речь идет об использовании метода граничных орбиталей (ГО) [1–3]. Традиционно этот метод применяется для оценки реакционной способности молекул, но ничто не мешает использовать его и для указанной выше цели. Ранее некоторые возможности метода ГО были проиллюстрированы на основе анализа модельной системы MgTiF6 + 12MgCl2 [2]. В этой работе учитывалась возможность смешивания близко лежащих приграничных молекулярных орбиталей (МО). При рассмотрении переноса электрона в системе MgTiF6 + 12MgCl2 было установлено, что для этой системы наиболее перспективными для переноса заряда оказались структуры, у которых длины связей Ti–F были подвергнуты сжатию в результате полносимметричного колебания комплекса титана. Помимо этого параметра в расчетах также варьировалась величина сдвига граничных ионов кальция и хлора относительно референтного состояния. А затем проверялось, допускает ли тип верхней занятой молекулярной орбитали (ВЗМО) системы после переноса электрона локализацию дополнительного электрона на комплексе в процессе релаксации комплекса при его диффузии в глубину системы [2]. В связи с этим несомненный интерес представляет применение метода граничных орбиталей для поиска переходного состояния в других модельных системах.
Целью данной работы являлось применение метода граничных орбиталей для поиска переходного состояния при переносе заряда в модельной системе CaTiF6 + 12CaCl2.
МЕТОДИКА ЭКСПЕРИМЕНТА
Расчеты проведены с помощью пакета квантовохимических программ Firefly [4], частично основанного на кодах программы GAMESS(US) [5], методами теории функционала плотности DFT/B3LYP с использованием квазирелятивистского ECP базиса Stuttgart 1997 [6–8].
Поскольку нас интересует состояние системы вблизи поверхности электрода, то с этой целью с одной стороны системы формировалась плоская граница, состоящая из 12–16 ионов кальция и хлора. В общем случае граничные ионы хлора и кальция не находятся в одной плоскости. Величина взаимного смещения этих ионов определена из расчета в модельной системе C96H24 + 7CaCl2, где C96H24 – плоский углеродный кластер, имитирующий поверхность катода; атомы водорода замыкают оборванные связи атомов углерода для предотвращения артефактов. После оптимизации этой системы анионы хлора оказались смещены на величину 0.5 Å относительно катионов кальция в сторону, противоположную поверхности углеродного кластера. Направление этого смещения соответствует воздействию электрического поля на граничные ионы. Модельную систему CaTiF6 + 12CaCl2 с такой величиной сдвига катионов кальция и анионов хлора считали исходной. Заметим, что добавление углеродного кластера C96H24 к нашей модельной системе CaTiF6 + 12CaCl2 потребовало бы существенного увеличения времени расчетов. Однако для качественных выводов вполне достаточно провести анализ системы CaTiF6 + 12CaCl2. В дальнейших расчетах варьировались следующие параметры: сдвиг ионов от референтного значения (Δd) и величина сжатия связей Ti–F (Δr) и для каждых значений Δd и Δr система оптимизировалась. Положительные значения Δd соответствуют сдвигу граничных анионов хлора относительно катионов кальция в сторону оставшейся части системы, а отрицательные величины указывают на противоположное направление смещения граничных анионов хлора (в сторону катода). На все системы такого рода накладывалось электрическое поле напряженностью 109 В/м, имитирующее поле катода [9].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Вероятность переноса электрона с поверхности электрода в исследуемую модельную систему определяется в первую очередь характером нижней свободной молекулярной орбитали (НСМО) и близко лежащих к ней соседних СМО. Экспериментальные данные по стандартным константам скорости переноса заряда (ks) [10] указывают на мостиковый характер переноса заряда, это означает, что волновая функция НСМО (и близко лежащих к ней СМО) должна быть делокализована между граничными катионами и комплексом. Только в этом случае возможен перенос заряда (ПЗ) на комплекс по мостиковому механизму. Кроме того, в работе [10] установлена линейная зависимость ks от ионного потенциала катионов щелочноземельных металлов, т. е. влияние природы катиона электролита на величину ks не имеет активационного характера [10].
Анализ рассматриваемой в данной работе системы CaTiF6 + 12CaCl2 имеет целый ряд отличий от анализа переноса электрона в модельной системе MgTiF6 + 12MgCl2 [2].
Во-первых, для квантовохимического описания катионов кальция в настоящем исследовании используется квазирелятивистский базисный набор Stuttgart 1997 ECP, а в [2] использовался базис Crenbl ECP. Базис Crenbl ECP для Mg имеет остовную часть из 2 электронов и валентную часть из 10 электронов, в то время как остовная часть у базиса Stuttgart 1997 ECP включает в себя 10 электронов, а валентная – 2. Поэтому использование базисного набора Stuttgart 1997 ECP для описания катионов Mg2+ приводило к существенному завышению энергий. Тем не менее, наш опыт показывает, что использование базисов семейства Stuttgart предпочтительнее в сравнении с базисом Crenbl, поскольку базисы Stuttgart с достаточной достоверностью описывают волновые функции при рассмотрении процессов переноса электрона.
Другое не менее важное отличие модельной системы CaTiF6 + 12CaCl2 от системы MgTiF6 + 12MgCl2 состоит в том, что катионы кальция в отличие от катионов магния имеют свободные 3d-орбитали. Причем 3d-орбитали отделены энергетической щелью в 3–4 кДж/моль от 3s-орбиталей. Следовательно, эти орбитали могут смешиваться, что в свою очередь будет оказывать сильное влияние на перенос электрона в рассматриваемой модельной системе. К тому же ионный радиус кальция значительно больше, чем ионный радиус магния, следовательно, структура граничного слоя ионов и переходного состояния будет иметь существенные отличия от таковой в модельной системе MgTiF6 + 12MgCl2.
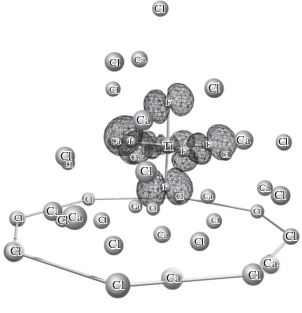
В исходном состоянии системы CaTiF6 + 12CaCl2 характер НСМО и близко расположенных СМО не допускает возможности переноса электрона. Группа указанных СМО локализована на связях комплекса Ti–F и является результатом взаимодействия d и p атомных орбиталей (АО) титана и фтора. Тем не менее, комплекс титана отделен от поверхности электрода внешнесферными катионами кальция, которые блокируют доступ лигандов к поверхности катода. В результате перенос электрона в таких структурах невозможен. Варьирование взаимного положения граничных катионов кальция и анионов хлора не оказывает существенного влияния на структуру граничных молекулярных орбиталей. Во всех случаях блок верхних ЗМО принадлежит анионам хлора, а в области СМО – до 5 нижних орбиталей остаются локализованными на связях Ti–F. На рис. 1 приведен вид НСМО подобной структуры.
Свободные молекулярные орбитали с заметным вкладом АО ионов кальция и хлора отделены от указанных орбиталей энергетической щелью около 150–200 кДж/моль, что делает невозможным их смешивание с нижележащими СМО. Таким образом, в этом состоянии перенос электрона на титан может протекать только через фтор-лиганды, которые экранированы катионами кальция.
Очевидным является предположение, что характер НСМО может измениться для некоторой структуры, которая является промежуточной между начальным и конечным состояниями системы. Однако проведенные расчеты опровергли это предположение. В этом состоянии характер НСМО существенно не меняется по сравнению с исходным состоянием (рис. 1). В частности, у структуры, имеющей среднеарифметические длины связей Ti–F между таковыми для начального и конечного состояний, НСМО, как и три орбитали, лежащие выше, локализованы на связях Ti–F. Заметный вклад АО кальция и хлора наблюдается только для СМО, которая расположена на 100 кДж/моль выше НСМО и не может смешиваться с последней. Таким образом, предположение оказывается ошибочным.
Поиск оптимальной структуры переходного состояния для модельной системы CaTiF6 + 12CaCl2 осуществлялся варьированием сжатия связей Ti–F и сдвигом граничных ионов кальция и хлора. Однако в нашем случае структура переходного состояния существенно отличалась от системы MgTiF6 + 12MgCl2. В табл. 1 приведены примеры некоторых возможных переходных состояний титансодержащих модельных систем. Переходное состояние характеризуется величиной сдвига граничных ионов (в скобках указан сдвиг для дальних от мостикового катиона кальция анионов хлора) и величиной сжатия связи Ti–F.
Таблица 1.
Характеристики переходного состояния в модельной системе CaTiF6 + 12CaCl2
| № п/п | Δ d, Å | Δ r, Å | Делокализация НСМО | Ea, кДж/моль | Перенос электрона | |
|---|---|---|---|---|---|---|
| Ca2+ | Сl– | |||||
| 1 | 0 | 0.5 | 0 | Есть | 215 | Невозможен |
| 2 | 0.1 | 0.5 | 0 | Нет | 30 | Невозможен |
| 3 | 0.1 | 0.5 | 0.05 | Есть | 100 | Невозможен |
| 4 | 0 | 0 | 0.05 | Есть | 53 | Невозможен |
| 5 | 0.5 | 0.3(0.5) | 0.01 | Нет | 1 | Невозможен |
| 6 | 0.5 | 0.3(0.5) | 0.02 | Нет | 2 | Невозможен |
| 7 | 0.5 | 0.3(0.5) | 0.03 | Нет | 4 | Невозможен |
| 8 | 0.5 | 0.3(0.5) | 0.05 | Есть | 16 | Маловероятен |
| 9 | 0.5 | 0.5(0.3) | 0.05 | Есть | 36 | Маловероятен |
| 10 | 0.5 | 0.5(0.2) | 0.05 | Есть | 24 | Вероятен |
| 11 | 0.5 | 0.5(0.2) | 0.06 | Есть | 28 | Вероятен |
| 12 | 0.5 | 0.5(0.1) | 0.05 | Есть | 22 | Вероятен |
Анализ электронной структуры исследуемых модельных систем показал, что сдвиг группы ионов, состоящих из 4 ближайших к мостиковому катиону кальция граничных анионов хлора, дестабилизирует свободные орбитали комплекса относительно свободных орбиталей мостикового катиона (структуры 1–3, 5–12 в табл. 1). НСМО также дестабилизируется при сжатии связей комплекса Ti–F (структура 4 в табл. 1). Отметим, при этом, что, несмотря на делокализацию волновой функции НСМО, перенос электрона через структуры 1 и 3 (табл. 1) невозможен вследствие чрезвычайно высокой энергии активации. При уменьшении суммарного сдвига граничных ионов делокализация НСМО между комплексом и мостиковым катионом Ca2+ практически исчезает, однако, при этом существенно снижается энергия активации (структура 2, табл. 1). Анализ распределения волновых функций НСМО в структурах 4–7 показывает, что искомая структура должна иметь смешанный сдвиг анионов хлора (дальние от мостикового катиона кальция анионы хлора имели меньшие значения сдвига) и сжатие связей Ti–F.
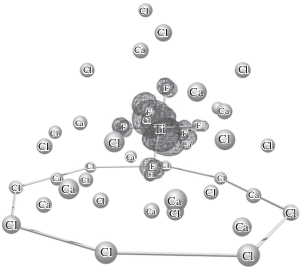
Энергия таких структур (№ 8–12 в табл. 1) близка к энергии исходного состояния, а величины энергии активации находятся в пределах 16–36 кДж/моль, то есть, близки к экспериментальной величине [10]. Структура 10 приведена на рис. 2. Здесь четыре граничных аниона Cl–, ближайшие к мостиковому кальцию, имеют сдвиг 0.5 Å, а остальные 0.3 Å.
Рис. 2.
Граничные орбитали структуры с Δd = 0.5(0.2) Å и Δr = 0.05 Å: Нижняя свободная молекулярная орбиталь до переноса заряда (а) и верхняя занятая молекулярная орбиталь после переноса заряда (б). Величина активационного барьера составляет 24 кДж/моль.
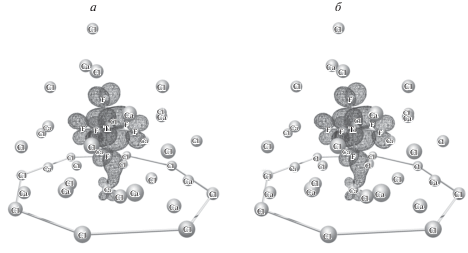
Структуры 8–12 имеют один и тот же тип НСМО (рис. 2a), которая делокализована между комплексом титана и мостиковым катионом кальция. Как уже отмечалось ранее, это указывает на высокую вероятность переноса электрона с катода. Следующая по энергии свободная орбиталь (НСМО + 1) расположена на 10–12 кДж/моль выше и имеет тот же характер, что и НСМО. На 14–16 кДж/моль выше, чем НСМО, находится орбиталь (НСМО + 2), которая принадлежит комплексу титана. Эти три орбитали могут смешиваться. Следующая орбиталь НСМО +3 отделена от НСМО щелью 80–83 кДж/моль и не может смешиваться с НСМО.
Другой, не менее важной, характеристикой структуры является тип верхней занятой молекулярной орбитали (ВЗМО) после переноса электрона в систему (рис. 2б). После переноса электрона в модельную систему, в общем случае, существуют три основных типа ВЗМО для исследуемых модельных систем [11]:
1. ВЗМО полностью локализуется на граничных ионах;
2. ВЗМО делокализована между граничными ионами и комплексом;
3. ВЗМО полностью локализована на комплексе.
В наших расчетах встречались ВЗМО всех перечисленных типов.
В первом случае вероятность захвата электрона комплексом титана очень мала. После диффузии комплекса в глубину расплава электрон остается на граничных ионах и затем возвращается на катод. Этот тип ВЗМО может наблюдаться при недостаточном или чрезмерном сжатии связей Ti–F. Так, например, при ∆r ≥ 0.1 Å расчетная энергия активации (Ea) существенно превышает экспериментальную величину, хотя НСМО до ПЗ может иметь делокализованный характер (но с доминированием вклада в волновую функцию от граничных катионов).
Во втором случае существует значительная вероятность переноса электрона на комплекс через мостиковый катион кальция, и вероятность захвата электрона комплексом близка к 100%. Второй тип ВЗМО всегда соответствует такому же типу НСМО до ПЗ, следовательно, в этом случае перенос электрона на комплекс по мостиковому механизму вполне реален. Тем не менее, и в этом случае следует принимать во внимание энергию активации. Если она имеет слишком высокие значения, то перенос электрона через такие конфигурации крайне маловероятен.
Третий случай реализуется, когда НСМО до ПЗ тоже практически полностью локализована на комплексе. В этом случае перенос электрона невозможен, так как непосредственный доступ комплекса к поверхности электрода блокирован внешнесферными катионами.
Тип ВЗМО после переноса электрона для структур № 8 и 9 (табл. 1) отличается от структур 10–12 (табл. 1). В структурах 8 и 9 ВЗМО практически полностью локализуется на граничном катионе кальция, и, следовательно, захват электрона комплексом титана маловероятен. Структуры 10–12 имеют ВЗМО, делокализованную между граничным катионом кальция и комплексом (рис. 2б). Тип этой ВЗМО совпадает с типом НСМО до переноса электрона. Спиновая плотность неспаренного электрона распределена между комплексом и мостиковым катионом в соотношении ~2 : 1, что также указывает на высокую вероятность переноса электрона на комплекс.
Структура 10 после переноса электрона и релаксации представлена на рис. 3. Структуры 11 и 12 имеют аналогичный характер ВЗМО после переноса электрона и релаксации комплекса. Как можно видеть, после релаксации спиновая плотность ВЗМО полностью локализована на комплексе трехвалентного титана. Таким образом, вероятность переноса электрона в титансодержащих системах через переходные структуры 10–12 (табл. 1) очень высока.
ЗАКЛЮЧЕНИЕ
Метод граничных орбиталей показал высокую информативность для исследования переноса электрона в модельной системе CaTiF6 + 12CaCl2. Варьируя параметры переходного состояния, найдены структуры, с высокой вероятностью переноса электрона с катода на комплекс титана.
Рассмотрены системы как с более упорядоченным, так и с менее упорядоченным граничным слоем. Такой подход позволил выявить диапазоны величин сдвига граничных ионов и сжатия связей Ti–F, которые соответствуют переходному состоянию. Во всех исследованных модельных системах установлено, что структура переходного состояния значительно разупорядочена, в сравнении с исходными структурами. Это соответствует реальному состоянию граничного слоя вблизи поверхности электрода.
Применение метода граничных орбиталей позволило с небольшими затратами машинного времени определить строение переходного состояния комплексной частицы ${\text{TiF}}_{{\text{6}}}^{{{\text{2}} - }}$ вблизи поверхности электрода, используя согласование расчетной и экспериментальной величин энергии активации переноса электрона.
Планируется усовершенствование метода граничных орбиталей для исследования процесса переноса заряда путем перехода от DFT расчетов к многоконфигурационным методам самосогласованного поля.
Список литературы
Fukui K., Yonezawa T., Shingu H. A Molecular Orbital Theory of Reactivity in Aromatic Hydrocarbons // J. Chem. Phys. 1952. 20. P. 722–725.
Kremenetsky V.G., Kuznetsov S.A. // Russian Metallurgy. 2018. 2018. № 2. P. 118–122. https://doi.org/10.1134/S0036029518020118
Kremenetsky V. G., Kuznetsov S. A. // Russ. J. Electrochem. 2018. 54. № 9. P. 676–682. https://doi.org/10.1134/S1023193518090069
Granovsky A.A. Firefly version 8.2.0. Available at: http://classic.chem.msu.su/gran/gamess/index.html.
Schmidt M.W., Baldridge K.K., Boatz J.A., Elbert S.T., Gordon M.S., Jensen J.H., Koseki S., Matsunaga N., Nguyen K.A., Su S., Windus T.L., Dupuis M., Montgomery J.A. The general atomic and molecular electronic structure system // J. Comp. Chem. 1993. 14. P. 1347–1363.
Feller D.J. The role of databases in support of computational chemistry calculations // J. Comp. Chem. 1996. 17. P. 1571–1586.
Schuchardt K.L., Didier B.T., Elsethagen T., Sun, L., Gurumoorthi V., Chase J., Li J., Windus T.L. Basis set exchange: a community database for computational sciences // J. Chem. Inf. Model. 2007. 47. P. 1045–1052.
Pritchard B.P., Altarawy D., Didier B., Gibson T.D., Theresa L. Windus A. New basis set exchange: an open, up-to-date resource for the molecular sciences community // J. Chem. Inf. Model. 2019. 59. № 11. P. 4814–4820.
Galus Z. Fundamentals of Electrochemical Analysis. Ellis Horwood. London 1994.
Vetrova D.A., Kuznetsov S.A. Influence of alkaline earth metal cations on the charge transfer kinetics for the redox couple Ti(IV)/Ti(III) in a chloride–fluoride melt // Russian metallurgy. 2017. 2017. № 2. P. 100–105.
Kremenetsky V.G., Nikolaev A.I., Kuznetsov S.A. // Dokl. Phys. Chem. 2017. 475. № 1. P. 122–125. https://doi.org/10.1134/S001250161707003X
Дополнительные материалы отсутствуют.