Расплавы, 2021, № 5, стр. 482-491
Фазовые превращения в расплавах системы монацит–NaF
Л. М. Делицын a, *, В. А. Синельщиков a, Р. В. Кулумбегов a
a Объединенный институт высоких температур Российской академии наук
Москва, Россия
* E-mail: delitzin@ihed.ras.ru
Поступила в редакцию 22.03.2021
После доработки 18.05.2021
Принята к публикации 05.06.2021
Аннотация
Несмотря на возрастающие потребности в редкоземельной продукции, в России отсутствуют предприятия, перерабатывающие природное сырье и удовлетворяющие запросы промышленности. Основное количество редкоземельных элементов (РЗЭ) > 95% закупается за рубежом, в то время как на территории РФ находится уникальное Томторское месторождение, в котором содержание РЗЭ составляет от 15 до 40%. Проведено исследование фазовых превращений в расплавах системы монацит–NaF с целью получения данных, которые могут быть использованы в разработке технологии переработки монацитового сырья и редкоземельных руд коры выветривания Томторского месторождения. При плавлении моноцитовых руд Томтора образуются два несмешивающихся расплава: силикатный и фосфатно-солевой, в котором концентрируется до 85% РЗЭ. По своим физико-химическим свойствам фосфатно-солевой расплав ликвационной плавки системы руда–NaF практически идентичен расплаву системы монацит–NaF. В расплаве системы монацит–NaF в результате химических реакций кристаллизуются двойной фосфат – Na3Ln[PO4]2 и фторидофосфат – Na2Ln[PO4]F2, которые легко растворяются в слабом растворе азотной кислоты. Из азотно-фосфорнокислых фильтратов получены оксалаты и гидроксиды РЗЭ.
ВВЕДЕНИЕ
Немалую роль в технологическом развитии страны играют технологии с использованием редкоземельных элементов (РЗЭ). Мировое потребление РЗЭ, которые используются в таких высокотехнологичных отраслях промышленности как радиотехника, робототехника, машиностроение, нефтехимия, металлургия, атомная, военная техника и др., постоянно растет. В РФ основное количество РЗЭ (>95%) закупается за рубежом, в то время как на территории РФ находится уникальное Томторское месторождение, в котором содержание РЗЭ составляет от 15 до 40% [1]. По содержанию РЗЭ оно не имеет мировых аналогов. Освоение отечественных месторождений и разработка технологии производства РЗЭ сыграет положительную роль в создании собственной редкоземельной промышленности, что отвечает постановлению Правительства РФ от 30 апреля 2019 г. № 542 “О внесении изменений в Положение о Правительственной комиссии по импортозамещению”.
Исследование реакций, протекающих между монацитом (LnPO4) и NaF, является составной частью технологии переработки монацитовых руд. Эти исследования могут так же быть использованы при технологии ликвационной плавки редкоземельных руд Томторского месторождения, которое характеризуется низким содержанием Th [1]. В процессе ликвации руды с NaF образуются два несмешивающихся расплава: силикатный и фосфатно-солевой, в котором концентрируются не менее 85% РЗЭ и основная часть фтора [2].
По своим физико-химическим свойствам фосфатно-солевой расплав ликвационной плавки системы руда–NaF практический идентичен расплаву системы монацит– NaF. В связи с этим эксперименты были выполнены на базе синтезированного монацита, который по содержанию РЗЭ близок к природному Томторскому монациту [3]. Руды представляют собой тонкозернистое сырье с большим количеством шламов (50–60%), что делает невозможным использовать традиционные методы обогащения (флотация, магнитная сепарация и т.п.) для получения концентратов РЗЭ (30–40%), пригодных для дальнейшего промышленного извлечения. При использовании операции обесшламливания теряется до 30% РЗЭ, и возрастает стоимость конечной продукции. В настоящее время для вскрытия концентратов РЗЭ используют щелочной или сернокислотный методы [4, 5] с последующим извлечением РЗЭ из полученных растворов экстракцией трибутилфосфатом или методом дробной кристаллизации [6‒8]. Однако, кеки, получаемые после щелочного или кислотного вскрытия, отличаются повышенным содержанием ${\text{PO}}_{4}^{{3 - }}$. Известны также методы вскрытия и переработки монацита, включающие: а – вскрытие измельченного монацита 7–10 М раствором азотной кислоты при температуре 150–250°С и давлении 1.5–2.5 МПа, б – вскрытие фосфорной кислотой при температуре от 300 до 550°С [9, 10].
Предлагаемый в данной работе метод плавления монацита с NaF позволяет снизить температуру плавления монацита до ~800°С. Целью исследования является изучение процессов фазовых превращений, протекающих в фосфатно-солевом расплаве, результаты которого могут быть применены в разработке технологии переработки руд Томторского месторождения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для проведения экспериментов были использованы синтезированный монацит и химические реактивы: Н3РО4 (ч. д. а., ООО “Воскресенский завод фосфорных кислот”), карбонаты редкоземельных металлов влажные Ln2(СO3)3 (Ln = La, Ce, Pr, Nd, Sm), (ТУ 1767-009-00545484-2000, лот № 790, ОАО “Соликамский магниевый завод”), HNO3 (ТУ РБ 500036524.109-2004, ООО “Воскресенский завод фосфорных кислот”), H2C2O4 (ООО “РусХим”. 99.78%, вес 1 кг, партия L/18, 12.2018), NaF (ч. д. а., ООО “Группа компаний Химпром”), NH4OH (ч. д. а., 25%, АО “Новомосковский азот”).
Монацит LnPO4, для многих редкоземельных металлов обнаружены только два устойчивых состояния окисления Ln3+ и Ln2+ [11], синтезировали из концентрата карбонатов РЗЭ (табл. 1) и Н3РО4 по следующей методике: 100 г высушенного до постоянного веса концентрата карбонатов перемешивали с 250 мл дистиллированной воды в верхнеприводной мешалке Stegler MB-6 в течение 30 мин до образования однородной пульпы.
Таблица 1.
Содержание карбонатов РЗЭ в концентрате
| Карбонаты РЗЭ | La | Сe | Pr | Nd | Sm | Eu | Gd | Tb | Dy | Ho |
|---|---|---|---|---|---|---|---|---|---|---|
| %, мас. | 26.1 | 54.2 | 5.0 | 13.0 | 0.97 | 0.18 | 0.15 | 0.02 | 0.11 | 0.27 |
К полученной пульпе добавляли 240 мл Н3РО4 (17.0%) и перемешивали полученную смесь в течение 2 ч в механической мешалке (500 об./мин) при комнатной температуре. Образовавшийся осадок отфильтровывали и промывали дистиллированной водой (90–95°С) до полного исчезновения в промывных водах ${\text{PO}}_{4}^{{3 - }}$. Осадок высушивали 6 часов при температуре 120°С и затем прокаливали в течение 5 часов при температуре 650°С. По данным рентгенофазового анализа осадок представляет собой монацит моноклинной сингонии с параметрами решетки: a = 6.785 Å, b = 7.0162 Å, c = 6.467 Å, V = = 299.48 Å3.
EDS анализ материала поверхностей шлифов образцов сплавов монацита c NaF в массовых соотношениях 50/50, 60/40 и 70/30 проводился безэталонным методом на растровом электронном микроскопе NovaNanoSem 650 с использованием системы энергодисперсионного анализа EDAX и кольцевого детектора обратно-рассеянных электронов. Шлифы были предоставлены с углеродным покрытием.
Анализируемые пробы представляли собой смесь порошков монацита и NaF, которые растирали в яшмовой ступе до классов ≤74 мкм в различном массовом соотношении. Экспериментальное изучение системы монацит – NaF, проводили на термоанализаторе STD Q600, который позволяет одновременно проводить термогравиметрический (ТГ) и дифференциальный сканирующий калориметрический (ДСК) анализ. Максимальная температура нагрева составила 1400°С при скорости нагрева 10 °С/мин в атмосфере особо чистого азота в платиновых микротиглях. Сложность исследования системы монацит–NaF заключается в большом различии температур плавления и кипения компонентов: для NaF τпл= 996°С, τкип = 1705°С, для монацита τпл по аналогии с СеPO4 принята в 2045°С. Потеря массы в экспериментах составляла 1.2–2.5 мас. % при температуре до 1200°C, а при температуре выше 1200°C потеря веса увеличивается до 3.0–4.0 мас. %, что недопустимо, поскольку приводит к нарушению состава расплавов. Для удаления NaF сплавы в системе монацит–NaF выщелачивали дистиллированной водой при 20°С, постоянно перемешивая в течение 3 часов в отношении Ж : Тв = 40 : 1. Нерастворимые в воде остатки выщелачивали в 10.0% растворе HNO3 при 80°С при непрерывном перемешивании в течение 2 ч. Для повышения растворимости фосфатно-солевого сплава в азотнокислый раствор добавляли 3%-й раствор Н2О2. Фильтрат, полученный после обработки фосфатно-солевого расплава HNO3 (10%) и Н2О2 (3%), обрабатывали H2C2O4 (11.1%) при температуре 90°C в течение 2 ч. После 12-часового отстаивания пульпу фильтровали на нутч-фильтре, сушили при 120°C до постоянного веса. Полученный концентрат содержал 65.95% оксалатов РЗЭ. Для доизвлечения РЗЭ фильтрат нейтрализовали 4.5% аммиачным раствором при рН 8.8–9.0 с получением пульпы гидроксидов РЗЭ. После фильтрации, сушки и прокаливания осадка при 650°C был получен концентрат гидроксидов РЗЭ. Выход гидроксидов РЗЭ составил 9.04%.
Для повышения содержания РЗЭ в концентрате оксалатов и гидроксидов концентраты подверглись перечистке методом дробной кристаллизации [7].
Полученные в экспериментах образцы исследовали петрографическим методом в прозрачных и полированных шлифах с помощью сканирующего электронного микроскопа JSM-5610LV, оснащенного аналитическим спектрометром INCA – Enеrgy 450, и рентгеновским методом на дифрактометре ДРОН-2, CuKα-излучение, идентификация фаз проводилась на основе базы данных Pcpdfwin – ICPDS.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
За счет химических реакций между монацитом и NaF из расплавов кристаллизуются новые кристаллические фазы: двойные фосфаты РЗЭ и Na, фторидофосфаты РЗЭ и Na, двойные фториды РЗЭ и Na.
Близость ионных радиусов Na+ и Ln3+, O2– и F– допускает возможность протекания химических реакций между компонентами с образованием двойных ортофосфатов и фторидофосфатов Ln и Na и двойных фторидов Ln и Na по схематической реакции:
(1)
$3{\text{LnP}}{{{\text{O}}}_{4}} + 6{\text{NaF}} = {\text{N}}{{{\text{a}}}_{{\text{3}}}}{\text{Ln[P}}{{{\text{O}}}_{{\text{4}}}}{{{\text{]}}}_{2}} + {\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{Ln[P}}{{{\text{O}}}_{{\text{4}}}}{\text{]}}{{{\text{F}}}_{{\text{2}}}} + {\text{NaLn}}{{{\text{F}}}_{4}}.$Содержание перечисленных фаз в образцах приведено в табл. 2. В небольшом количестве установлены оксиды и фториды РЗЭ. На рис. 1 приведена диаграмма монацит– NaF, полученная из анализа ДСК кривых, две из которых в качестве примера приведены в верхней части диаграммы. Компоненты системы полностью взаимнорастворимы в области расплавленного состояния. При температуре 727 ± 2.5°С в системе установлена эвтектика, содержащая, мас. %: 68 монацита и 32 NaF.
Таблица 2.
Фазовый состав сплавов в зависимости от состава шихты
| № | Содержание в шихте, мас. % | Фазовый состав сплавов, мас. % | |||||
|---|---|---|---|---|---|---|---|
| монацит | NaF | монацит | двойной фосфат РЗЭ | фторидо-фосфат РЗЭ | NaF | Се2О3, NaLnF4 и пр. | |
| 1 | 50.0 | 50.0 | 25.0 | 18.0 | 15.0 | 40.8 | 1.0 |
| 2 | 60.0 | 40.0 | 28.0 | 22.9 | 19.9 | 28.5 | 0.7 |
| 3 | 63.0 | 37.0 | 30.0 | 24.0 | 19.6 | 26.3 | 0.1 |
| 4 | 70.0 | 30.0 | 38.1 | 23.5 | 19.8 | 18.5 | 0.1 |
Рис. 1.
Фазовая диаграмма системы монацит–NaF. ◇ – температура разложения монацита; ◼ – температура кристаллизации NaF; ▲ – температура кристаллизации Na3Ln(PO4)2; ⚫ – температура кристаллизации Na2LnPO4F2; ⚪ – температура кристаллизации NaLnF4.
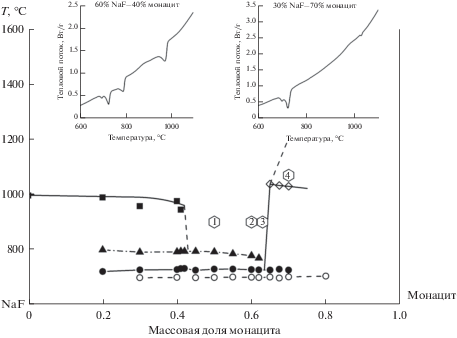
Для исследования фазового состава продуктов кристаллизации из расплава, последовательности выделения фаз и их химического состава выбрано 4 точки, положение которых указано на диаграмме монацит–NaF (рис. 1).
Точки 1, 2 и 3 плавили при 900°С, (точка 3 находится рядом с эвтектикой), точку 4 плавили при 1070°С в высокотемпературной области диаграммы. Кристаллизация расплавов, соответствующих точкам 1, 2 и 3, начинается с выделения первичных кристаллов NaF (т. 4, рис. 2), к которым при 800°C присоединяются реакционные фазы – двойной фосфат Na3Ln[PO4]2 (т. 2, рис. 2) и фторидофосфат Na2LnPO4F2 (т. 3, рис. 2), и заканчивается при 732°С в эвтектике. Кроме того, обнаружено присутствие Na3AlF7 (т. 1, рис. 2). Кристаллизация расплавов, отвечающих точке 4 на рис. 1, начинается с появления первичных кристаллов монацита; при этом расплав обогащается Na и F и к монациту присоединяются Na3Ln[PO4]2 (т. 1, рис. 3) и Na2Ln[PO4]F2 (т. 2, рис. 3). Заканчивается кристаллизация фаз в эвтектике при 727°С. Таким образом, в системе монацит–NaF в результате химических реакций между монацитом и NaF образуются следующие основные фазы: двойные фосфаты РЗЭ и Na; фторидофосфаты РЗЭ и Na и небольшое количество NaLnF4 (табл. 2).
Рис. 2.
Кристаллическая структура расплава 50LnPO4 + 50NaF (мас. %), изначально содержащего: 1 – Na3AlF6, 2 – Na3Ln[PO4]2, 3 – Na2Ln[PO4]F2, 4 – NaF.

Рис. 3.
Кристаллическая структура расплава 70LnPO4 + 30NaF (мас. %), изначально содержащего: 1 – Na3Ln[PO4]2, 2 – Na2Ln[PO4]F2, 3 – Na3AlF6, 4 – CeO2, 5 – NaF.

После растворения в воде полученного сплава в нерастворимых остатках по данным РФА анализа отсутствует NaF. В составе сухих солей после упаривания фильтратов находится только NaF. Проба фенолфталеином на обнаружение в сухих солях Na+ показала его отсутствие. Количество фазы, выщелоченное водой, имеет прямолинейный характер, что говорит о выщелачивании из расплавов только фторида натрия. В отличие от щелочного и сернокислотного методов, применяемых в технологии переработки монацита, где применяются высококонцентрированные растворы [6], для извлечения редких земель фосфатно-солевые сплавы, после удаления NaF, были подвергнуты разложению слабым раствором HNO3 (10%) (табл. 3).
Таблица 3.
Растворимость сплавов системы монацит–NaF в растворе HNO3 (10%), 80°С, 2 ч в зависимости от состава шихты
| № | Содержание в шихте, мас. % | Растворилось, в H2O, мас. % | Растворилось, в HNO3, мас. % | Нерастворимый
в HNO3 остаток, мас. % |
Сумма, % | |
|---|---|---|---|---|---|---|
| монацит | NaF | |||||
| 1 | 50 | 50 | 40.8 | 33.0 | 26.2 | 100.0 |
| 2 | 60 | 40 | 28.5 | 42.8 | 28.7 | 100.0 |
| 3 | 63 | 37 | 26.3 | 43.6 | 30.1 | 100.0 |
| 4 | 70 | 30 | 18.5 | 43.3 | 38.2 | 100.0 |
Из расплава, содержащего 63% монацита и 37% NaF, водой было выщелочено 26.3% фторида натрия, который выводится из системы и повторно используется. Оставшиеся 73.7% солей, были растворены в HNO3 (10%), при этом в раствор (фильтрат) извлекается 59.1% компонентов. Нерастворимый в кислоте остаток согласно РФА представлен фторидами РЗЭ, Се2О3 и монацитом.
В нерастворимых остатках (монацит, Се2О3 и фториды РЗЭ) полностью отсутствуют двойной фосфат Na3Ln[PO4]2 и фторидофосфат Na2Ln[PO4]F2. Присутствие монацита, скорее всего, можно объяснить инконгруэнтным разложением сплавов в растворе азотной кислоты. После растворения сплавов в растворе азотной кислоты количество нерастворимого остатка для образцов 1–3 значительно уменьшилось и составило 26.2–30.1%. Для сплава, содержащего 70% монацита, оно немного выше и равно 38.2%.
Известно, что в слабокислой среде добавление Н2О2 приводит к увеличению растворимости солей РЗЭ [12]. Данные по растворимости сплавов в растворе азотной кислоты с добавлением Н2О2 приведены в табл. 3. В присутствии Н2О2 растворимость солевого сплава возрастает, а содержание нерастворимых остатков значительно уменьшается. Для сплавов, содержащих 50–63% монацита, содержание нерастворимого остатка составило от 3.7 до 7.7%, т.е. уменьшилось ~ в 7 раз (табл. 4). Примечательно, что при содержании 70% монацита в исходной шихте добавление Н2О2 привело к увеличению растворимости лишь в ~1.5 раза. Вероятно, данное обстоятельство связано с трансформацией моноклинного монацита в лантаноиды гексагональной структуры LnPO4 [13].
Таблица 4.
Растворимость сплавов системы монацит–NaF в HNO3 (10%) + Н2О2 (3%), 80°С, 2 ч в зависимости от состава исходной шихты
| № | Содержание в шихте, мас. % | Растворилось в H2O, мас. % | Растворилось,
в HNO3 + Н2О2, мас. % |
Нерастворимый в HNO3 + Н2О2 oстаток, мас. % | Сумма, % | |
|---|---|---|---|---|---|---|
| монацит | NaF | |||||
| 1 | 50.0 | 50.0 | 40.8 | 51.5 | 7.7 | 100.0 |
| 2 | 60.0 | 40.0 | 28.5 | 67.3 | 4.2 | 100.0 |
| 3 | 63.0 | 37.0 | 26.3 | 70.0 | 3.7 | 100.0 |
| 4 | 70.0 | 30.0 | 18.5 | 57.6 | 23.9 | 100.0 |
После растворения водонерастворимых остатков в растворе HNO3 с добавлением Н2О2 в кислотонерастворимых остатках остаются те же фазы, что и при растворении в HNO3, но количество их значительно уменьшается.
Исследование в обратно-рассеянных электронах, чувствительных к среднему атомному номеру, совместно с EDS анализом показало, что на поверхности шлифов присутствуют пять основных образований (рис. 2, 3).
На рис. 2 и 3: 1 – темно-серая фаза, состоящая из отдельных дендритов, длиной в несколько десятков мкм, содержащая преимущественно Al, Na и F; 2 – серая фаза шириной в несколько мкм и длиной до ~60 мкм, содержит все исходные элементы за исключением F–; 3 – светло-серая фаза в виде тонкодисперсных “губчатого” вида колоний из дендритов размерами до нескольких мкм, окружающих ямки от выкрошенных в процессе шлифовки частиц и содержащая все исходные элементы; 4 – темные округлые, достигающие в поперечнике ~150–200 мкм кристаллы, обогащенные в основном Na+ и F– (рис. 2); 5 – яркие выделения неправильной формы и яркие частицы субмикронных и микронных размеров, содержащие в основном Ce4+ и O2– с некоторым количеством La, Nd, Pr (рис. 3, т. 4). Распределение РЗЭ между различными фазами представлено в табл. 5.
Таблица 5.
Распределение основных элементов между фазами в образце 4, (монацита 70% + NaF 30%)
| Фаза | Содержание элементов, мас. % | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| La | Сe | Pr | Nd | Sm | Na | Al | F | P | Σ С, Si, O | |
| 1 | – | – | – | – | – | 30.9 | 9.4 | 42.5 | 0.4 | 16.8 |
| 2 | 10.1 | 8.8 | 2.6 | 6.1 | – | 18.8 | – | 13.4 | 40.2 | |
| 3 | 12.8 | 13.2 | 3.0 | 7.3 | – | 12.3 | – | 7.3 | 8.1 | 36.0 |
| 4 | – | – | – | – | – | 49.2 | – | 32.5 | – | 18.3 |
| 5 | 1.5 | 58.8 | 0.4 | 2.8 | – | – | – | – | 0.9 | 35.6 |
Расплавы с высоким содержанием фтора являются агрессивными и корродируют стенки керамических тиглей, что приводит к небольшому растворению Al2O3 в NaF с образованием криолита Na3AlF6.
ЗАКЛЮЧЕНИЕ
Таким образом, в системе монацит–NaF в результате химических реакций между монацитом и NaF образуются следующие, растворимые в слабокислой среде, основные фазы: двойные фосфаты РЗЭ и Na; фторидофосфаты РЗЭ и Na и небольшое количество NaLnF4. Показано, что NaF позволяет снизить температуру плавки системы монацит–NaF до 800°С (температура плавления монацита ~2050°С). Количество фазы, выщелоченное водой, имеет прямолинейный характер, что говорит о выщелачивании из сплавов только фторида натрия. Очевидно, что метод сплавления монацита с NaF может использоваться вместо сернокислотного и щелочного методов переработки монацитовых руд. Потери полезных компонентов при данном методе меньше, чем при традиционных методах (сернокислотный и щелочной). Фосфатно-солевой сплав предлагается обрабатывать раствором азотной и щавелевой кислот с получением оксалатов РЗЭ.
Работа выполнена при финансовой поддержке гранта РФФФ № 17-08-00583.
Авторы выражают благодарность научному сотруднику ОИВТ РАН Г.А. Сычеву за помощь при проведении ряда экспериментов.
Список литературы
Делицын Л.М. Механизм ликвации в природных и технологических силикатно-солевых расплавах – концентраторах редких земель и ниобия. М.: ГЕОС, 2018. С. 344–390.
Делицын Л.М., Мелентьев Г.Б., Зиновеев Д.В., Дюбанов В.Г. Переработка продуктов ликвационной плавки руды Томторского месторождения // Металлы. 2019. № 4. С. 10–17.
Лазарева Е.В., Жмодик С.М., Добрецов Н.Л., Толстов А.В., Щербов Б.Л., Карманов Н.С., Герасимов Е.Ю., Брянская А.В. Главные рудообразующие минералы аномально богатых руд месторождения Томтор (Арктическая Сибирь) // Геология и геофизика. 2015. 56. № 6. С. 1080–1115.
Локшин Э.П., Тареева О.А., Кашулина Т.Г. Влияние серной кислоты и катионов натрия на растворимость лантаноидов в фосфорной кислоте // Журн. прикладной химии. 2008. 81. № 1. С. 3–9.
Локшин Э.П., Калинников В.Т. Об извлечении редкоземельных элементов при сернокислотной переработке хибинского апатитового концентрата // Химическая технология. 2011. 12. № 1. С. 48–58.
Поляков Е.Г., Нечаев А.В., Смирнов А.В. Металлургия редкоземельных металлов. М.: Металлургия, 2018.
Серебренников В.В. Химия редкоземельных элементов. Т. 2. Томск. Изд-во Томского университета, 1961.
Черемесина О.В. Опытно-промышленная установка для извлечения соединений редкоземельных металлов из растворов фосфорной кислоты // Цветные металлы. 2009. № 12. С. 45–52.
Муслимова А.В., Молоков П.Б., Русаков И.Ю., Буйновский А.С. Патент РФ № 2 633 859. Способ переработки монацита. Опубл. 18.10.2017, бюл. № 29.
Шагалов В.В., Егоров Н.Б., Соболев В.И. Патент РФ № 2 620 229. Способ вскрытия монацитового концентрата. Опубл. 23.05.2017.
Хохлов В.А., Новоселова А.В., Николаева Е.В., Ткачева О.Ю., Салюлев А.Б. Окислительно-восстановительные реакции в расплавленных электролитах, содержащих хлориды редкоземельных металлов // Электрохимия. 2007. 43. № 8. С. 1010–1016.
Большаков К.А. Химия и технология редких и рассеянных элементов. Ч. ІІ. М.: Высшая школа, 1976.
Mooney R.C.L. X-ray diffraction study of cerous phosphate and related crystals. I. Hexagonal modification // Acta Crystallographica. 1950. 3. P. 337–340.
Дополнительные материалы отсутствуют.


