Расплавы, 2021, № 6, стр. 605-617
Циклическая вольтамперометрия на платине в расплавах LiCl–KCl и LiCl–KCl–Li2O
А. Р. Муллабаев a, *, В. А. Ковров a, Н. Г. Молчанова a, Ю. П. Зайков a, b
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
b Уральский федеральный университет имени Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: albert_06@mail.ru
Поступила в редакцию 28.05.2021
После доработки 18.06.2021
Принята к публикации 01.07.2021
Аннотация
Исследованы анодные процессы на платиновом электроде в расплавах 80LiCl–20KCl и 80LiCl–20KCl + Li2O (мол. %) в зависимости от температуры методами циклической вольтамперометрии и потенциостатического электролиза. Результаты экспериментов в расплаве 80LiCl–20KCl (мол. %) без добавки Li2O показали, что платина начинает анодно растворяться с образованием ионов Pt2+ при потенциале 3.14 В и температуре 550°С, и при потенциале 3.04 В относительно Li+/Li при 650°С. В расплавах с добавкой Li2O при потенциалах 2.40–2.43 В относительно Li+/Li происходит двухстадийное окисление платины с образованием Li2PtO3 со скоростью 4.96 мг/см2 · ч. Скорость образования Li2PtO3 и выход по току кислорода при потенциале 2.8 В относительно Li+/Li и температуре 650°С составляют 23.5 мг/см2 · ч и 96.15% соответственно Увеличение температуры электролита приводит к потерям анодного материала.
ВВЕДЕНИЕ
Расплавы галогенидов щелочных и щелочноземельных металлов широко используются для электрохимического восстановления различных металлов из их оксидов. В этом методе щелочной или щелочноземельный металл, получаемый на катоде, восстанавливает оксид восстанавливаемого металла. На практике чаще всего пользуются расплавами хлоридов щелочных металлов. Анодным материалом в этих расплавах является графит [1]. Электролизные испытания углеродных материалов в оксидно-хлоридных расплавах показали, что их использование в качестве анода возможно [2, 3], но образование карбонат-иона в расплаве LiCl–Li2O неизбежно приводит к образованию углерода на катоде, что сопровождается снижением катодного выхода по току и загрязнением целевого продукта углеродом.
В качестве кандидатных материалов инертных анодов для электролиза оксидно-галогенидных расплавов в последние годы рассматриваются металлические электроды, оксиды металлов и их смеси. Практически все исследованные металлические аноды, изготовленные из индивидуальных металлов, таких как железо, никель, медь, хром, и из сплавов на их основе (за исключением некоторых благородных металлов), являются нестойкими в атмосфере кислорода при высокой температуре [4–7]. Продукты коррозии анода загрязняют электролит и катодный продукт.
Известно успешное применение платины как инертного анода при получении алюминия в расплавах на основе KF–NaF–AlF3–Al2O3. В работах [8, 9] показана инертность платины как анодного материала, и высокая стабильность работы в условиях электролиза (750°C и больше), а также высокие рабочие плотности тока [10]. В большинстве работ по пирохимической переработке окисленного ядерного топлива в среде LiCl–Li2O практически всегда используются аноды из платины [11–14]. Следует отметить, что данные разных авторов о природе анодных процессов на платине в расплавах LiCl–KCl–Li2O значительно расходятся, а влияние температуры на анодные процессы изучены мало. Хорошо известно, что снижение температуры процесса электролиза приводит к увеличению коррозионной стойкости анодных материалов. Добавка KCl в расплав LiCl–Li2O в количестве 20 мол. % снижает температуру ликвидуса почти на 100°C, при этом растворимость оксида лития в расплаве при 550°C согласно работам [15–17] имеет значительную величину.
Целью настоящей работы являлось исследование анодных процессов на платине в расплаве 80LiCl–20KCl (мол. %) с добавкой Li2O в зависимости от температуры.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с подготовкой реагентов к работе, и экспериментальные исследования проводили в аргоновом перчаточном боксе “Спекс ГБ” (ЗАО “Спектроскопические системы”, РФ) с контролируемой атмосферой (H2O < 5 ppm, O2 < 10 ppm). KCl (99.8 мас. %, ООО “Михайловский завод химических реактивов”, РФ) предварительно переплавляли в стеклоуглеродном тигле. LiCl (99.5 мас. %, FMC, Великобритания) перед использованием тщательно сушили при нагревании под вакуумом. После сушки LiCl переплавляли в стеклоуглеродном стакане. Сухие и переплавленные реагенты очищали от примесей методом зонной перекристаллизации. После очистки LiCl и KCl имели чистоту 99.90 и 99.95 мас. % соответственно. Li2O (99.5 мас. %, Alfa Aesar) очистке не подвергали. Готовые к работе реагенты хранили в аргоновом перчаточном боксе.
Изучение анодных процессов в расплавах LiCl–KCl–Li2O проводили методом циклической вольтамперометрии. Электрохимическая ячейка представляла собой кварцевую пробирку с газоходом для подачи газа (Ar 99.999%). Сверху пробирку герметично закрывали фторопластовой пробкой, в которой были изготовлены порты для ввода электродов. К нижней части пробки прикрепляли теплоотражающие экраны, изготовленные из листового никеля (марка НП2). Контейнером для расплава служил тигель из MgO. Все керамические изделия перед экспериментами прокаливали при 1000°С для удаления влаги и хранили в аргоновом перчаточном боксе. Газ из ячейки откачивали с помощью мембранного компрессора и подавали в автоматический регулятор парциального давления кислорода Zirconia-M (ООО “Исследовательские Технологии”, РФ). Автоматический регулятор парциального давления кислорода работал в режиме измерения концентрации молекулярного кислорода в газовой фазе.
В качестве рабочего электрода для поляризационных исследований использовали платиновую проволоку диаметром 1.00 мм (чистота 99.99%, ОАО “РЗ ОЦМ”, РФ). Трехфазную границу (платина–расплав–газ) платинового электрода изолировали фрагментом керамической трубки из MgO длиной 50 мм. Потенциал рабочего электрода измеряли относительно свинцового электрода сравнения, представляющего собой металлический свинец (марка С0), находящийся под слоем расплава (LiCl–KCl)эвт–30 мол. % PbCl2. Контейнером для электрода сравнения служил чехол из MgO. Потенциалосъемником служила молибденовая проволока (марка МЧ), экранированная от контакта с хлоридным расплавом керамической трубкой из MgO. Потенциал электрода сравнения калибровали относительно потенциала выделения лития на молибденовом электроде в исследуемом расплаве.
Противоэлектродом служил расплавленный свинец (марка С0), помещенный в чехол из керамики MgO. В чехле над расплавленным свинцом имелись сквозные отверстия для доступа электролита к электроду. Токоподвод к свинцу – молибденовая проволока, изолированная от расплава трубкой из MgO. Такая конструкция противоэлектрода обеспечивала выделение лития в катодном процессе только на границе свинец–солевой расплав с образованием сплава Pb–Li.
Для измерения температуры расплава использовали образцовую термопару типа ППО Pt–Pt(10% Rh) в никелевом чехле. Во всех измерениях колебания температуры электролита не превышали ±3°С. Поляризационные исследования проводили с помощью потенциостата-гальваностата Autolab PGSTAT-302N (Metrohm, Нидерланды).
Навески реагентов взвешивали на аналитических весах Shimadzu АХ200 в аргоновом перчаточном боксе и там же помещали в стакан из MgO. Собранную в аргоновом боксе герметичную ячейку помещали в реторту бокса. Ячейку нагревали до температуры 550 или 650°С. После достижения температуры 550 или 650°С (по показаниям терморегулятора) в расплав погружали термопару и точно устанавливали температуру. После стабилизации температуры расплав оставляли на 1 ч для растворения Li2O.
Концентрацию Li2O в пробах расплавов определяли методом кислотно-основного титрования с потенциометрической индикацией конечной точки титрования. Элементный анализ подготовленных реагентов проводили методом масс-спектрометрии с индуктивно связанной плазмой на приборе NexIon 2000 (Perkin Elmer, США). Рентгенофазовый анализ был выполнен на приборе Miniflex 600 (Rigaku, Япония).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Поляризационные измерения в расплаве 80LiCl–20KCl (мол. %) без добавки Li2O
Поляризационные измерения в расплаве 80LiCl–20KCl (мол. %), не содержащем Li2O, проводили методом циклической вольтамперометрии. На рис. 1 показана катодная кривая, снятая для калибровки электрода сравнения на молибдене в расплаве 80LiCl–20KCl (мол. %) при температуре 650°С. На графике, представленном на рис. 1, наблюдается резкое увеличение тока в катодной области при потенциале –2.23 В относительно свинцового электрода сравнения, связанное с выделением металлического лития на электроде согласно уравнению (1):
Рис. 1.
Катодная кривая на молибдене в расплаве 80LiCl–20KCl (мол. %) без добавки Li2O, температура 650°С, скорость развертки потенциала 0.1 В/с.
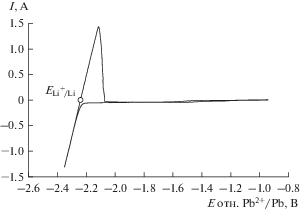
При обратной развертке потенциала происходит растворение металлической фазы лития по уравнению (2):
Таким образом, потенциал свинцового электрода сравнения относительно потенциала металлического лития составляет 2.24 В. Следует отметить, что используемый в этом исследовании электрод сравнения отличается высокой стабильностью и воспроизводимостью потенциала. В данной работе все потенциалы представлены относительно пары Li+/Li.
Ниже представлены суммарные уравнения реакций, которые могут протекать в электрохимической ячейке при электролизе расплава на основе LiCl c платиновым анодом, а также стандартные потенциалы этих реакций при температуре 650°С, которые были рассчитаны из термодинамических данных [18]:
(4)
${\text{Pt}} + 3{\text{LiCl}} = {\text{PtC}}{{{\text{l}}}_{3}} + 3{\text{Li}}\,\,\,\,{{E}_{{650}}} = 3.231\,\,{\text{В,}}$(5)
${\text{Pt}} + 4{\text{LiCl}} = {\text{PtC}}{{{\text{l}}}_{4}} + 4{\text{Li}}\,\,\,\,{{E}_{{650}}} = 3.323\,\,{\text{В}}{\text{.}}$Анодная кривая, снятая на платине в расплаве 80LiCl–20KCl (мол. %), представлена на рис. 2. В области потенциала около 3.0 В наблюдается резкое увеличение тока, связанное с электрохимическим растворением платины по реакции (3), поскольку на аноде в первую очередь, будет протекать электродный процесс с наиболее электроотрицательным потенциалом. При обратной развертке потенциала наблюдается катодная волна при 3.04 В, обусловленная восстановлением ионов Pt2+ до металлической Pt.
Рис. 2.
Анодная кривая, снятая на Pt в расплаве 80LiCl–20KCl (мол. %) без добавки Li2O, температура 650°С. Скорость развертки потенциала 0.1 В/с.
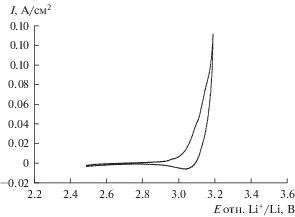
Потенциал растворения платины по реакции (4) с образованием PtCl2, рассчитанный из термодинамических данных, составляет 3.04 В при температуре 650°С. Потенциал анодного растворения Pt, определенный из поляризационных измерений, составил 3.05 В, что хорошо согласуется с расчетным значением.
В расплаве 80LiCl–20KCl (мол. %) при температуре 550°С получены аналогичные кривые для анодного растворения платины и катодного восстановления лития. Потенциал растворения платины, рассчитанный из термодинамических данных, и определенный экспериментально, составляет 3.13 и 3.14 В соответственно.
Анодный процесс на платине в расплаве 80LiCl–20KCl (мол. %) с добавкой Li2O
Анодное поведение платины в расплавах 80LiCl–20KCl c добавкой 1.6Li2O (мол. %) было исследовано методом циклической вольтамперометрии. Типичные циклические вольтамперограммы, полученные на платиновом электроде при температурах 650 и 550°С, показаны на рис. 3 и 4.
Рис. 3.
Циклические вольтамперограммы, снятые на Pt электроде в расплаве 80LiCl–20KCl + 1.58Li2O (мол. %) при температуре 650°С. Скорость развертки потенциала (В/с) указана в легенде графика.
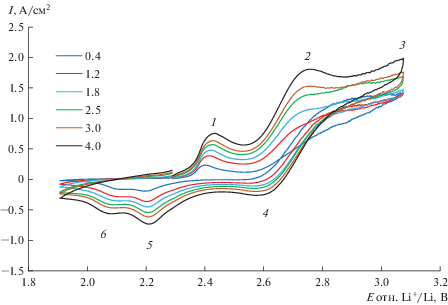
Рис. 4.
Циклические вольтамперограммы, снятые на Pt в расплаве 80LiCl–20KCl + 1.64Li2O (мол. %) при температуре 550°С. Скорость развертки потенциала (В/с) указана в легенде графика.
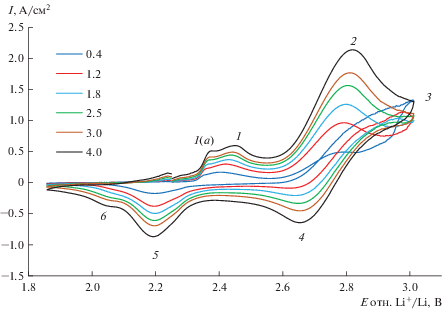
Циклические вольтамперограммы, снятые на платиновом электроде при 650 и 550°С в расплаве 80LiCl–20KCl + 1.58Li2O (мол. %), имеют схожий вид. На всех вольтамперограммах при прямой и обратной развертках потенциала наблюдается несколько пиков. В работах [11, 12, 19, 20] сообщалось об их природе. Согласно данным этих работ, пики 1 и 2 соответствуют следующим электродным реакциям:
(7)
$2{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}} - {\text{4}}e = {{{\text{O}}}_{2}} + 4{\text{L}}{{{\text{i}}}^{ + }}\,\,({\text{пик}}\,\,2).$В данном исследовании природу пиков 1 и 2 устанавливали с помощью потенциостатического электролиза при соответствующем потенциале пика тока. Потенциостатический электролиз при потенциале пика 1 (2.41 В относительно пары Li+/Li) проводили на Pt электроде в виде пластины в расплаве 80LiCl–20KCl + 2.29Li2O (мол. %) в течение 15 часов при температуре 650°С. В результате потенциостатического электролиза на платиновом аноде была получена рыхлая желтая пленка, непрочно связанная с подложкой. Фотографии платинового анода после электролиза показаны на рис. 5. Рентгенофазовый анализ (рис. 6) показал, что продуктом электролиза является платинат лития Li2PtO3.
Рис. 5.
Платиновый анод после потенциостатического электролиза при потенциале 2.41 В относительно Li+/Li в расплаве 80LiCl–20KCl + 2.29Li2O (мол. %) при температуре 650°С. Справа – до отмывки электролита, слева – после отмывки электролита.

Рис. 6.
Дифрактограмма продукта, полученного на Pt аноде в результате потенциостатического электролиза при потенциале 2.41 В относительно Li+/Li.
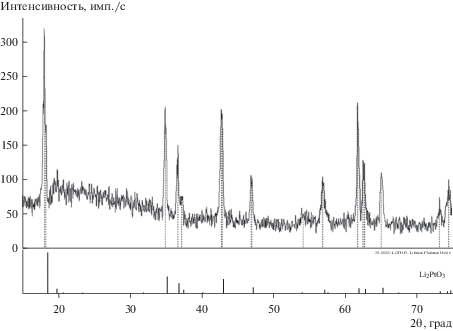
После электролиза Li2PtO3 механически удалили с поверхности электрода, незначительные остатки платината лития удаляли с поверхности электрода обработкой 12 М раствором HCl при температуре 80°С. Согласно данным работы [21], платинат лития хорошо растворяется в 12 М HCl при нагревании, а платина, как известно, в HCl не растворяется. По изменению массы электрода до опыта и после удаления продукта электролиза была оценена скорость образования Li2PtO3, которая составила 6.3 мг/см2 ⋅ ч. Убыль массы платинового анода в условиях эксперимента составляет 4.96 мг/см2 ⋅ ч. В условиях выделения кислорода на платине массовые потери анодного материала возрастают, так как платинат лития плохо сцеплен с подложкой, а газовыделение на поверхности анода будет способствовать постоянному отслаиванию Li2PtO3. Очевидно, что снижение концентрации Li2O в расплаве снизит потери анодного материала. Также следует обратить внимание на высоту пика тока образования платината лития в зависимости от температуры. Поскольку вольтамперограммы были сняты при одинаковых концентрациях Li2O, можно качественно сравнить скорость образования Li2PtO3 при одинаковых скоростях развертки потенциала. Для этого анодного процесса при 650°С плотность пика тока 1 примерно в 1.4 раза больше, чем плотность пика тока этого же процесса при 550°С. Таким образом, снижение температуры электролита на 100°С позволит снизить потери платины.
Найденные литературные данные по использованию платины для электролиза оксидно-галогенидных расплавов также сообщают об образовании оксидных соединений платины на платиновом аноде. В работе [8] сообщается об окислении платины до PtxO в расплаве KF–NaF–AlF3–Al2O3 (температура 750°С). Похожая ситуация наблюдается и в расплавах CaCl2–CaO при температуре 810°С. В этой системе платина окисляется до Pt3O4 [12].
На вольтамперограммах (рис. 3 и 4) предпик 1а (прямая развертка потенциала), пики 5 и 6 (обратная развертка потенциала) связаны с Li2PtO3. Циклические вольтамперограммы, аналогичные нашим, были получены в работе [22]. Мы полагаем, что предпик 1а, вероятнее всего, связан с образованием соединения платины с кислородом, в котором степень окисления платины меньше 4. Эту электрохимическую реакцию можно представить уравнением (8):
(8)
${\text{Pt}} + x{{{\text{O}}}^{{2 - }}} - 2xe = {\text{Pt}}{{{\text{O}}}_{x}}\,\,\left( {{\text{предпик}}\,\,1а} \right).$(9)
$~{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{Pt}}{{{\text{O}}}_{3}} + 2xe = {\text{Pt}}{{{\text{O}}}_{x}} + (3 - x){{{\text{O}}}^{{2 - }}} + 2{\text{L}}{{{\text{i}}}^{ + }}\,\,\left( {{\text{пик}}\,\,5} \right).$(10)
${\text{Pt}}{{{\text{O}}}_{x}} + 2xe = {\text{Pt}} + x{{{\text{O}}}^{{2 - }}}\,\,({\text{пик}}\,\,6).$Из вышеописанного следует, что, как и образование Li2PtO3 в анодном процессе, так и процесс его катодного восстановления, протекают в две стадии. Поэтому уравнение (6) отражает лишь суммарную реакцию процесса окисления Pt до Li2PtO3.
Потенциостатический электролиз при потенциале пика 2 проводили при потенциале 2.80 В в расплаве 80LiCl–20KCl + 2.29Li2O (мол. %) при температуре 650°С. Во время электролиза проводили качественный анализ газовой фазы на наличие молекулярного кислорода. В процессе электролиза происходило значительное увеличение концентрации O2 в выходящем из ячейки аргоне от фоновой в перчаточном боксе (8 ppm) до 0.6 об. %. После завершения электролиза концентрация кислорода в отходящих газах вернулась к значению концентрации O2 в аргоновом боксе. Выход по току кислорода на Pt электроде меньше 100% за счет образования Li2PtO3. По разнице масс Pt электрода до и после электролиза были оценены скорость образования Li2PtO3 и выход по току кислорода, которые оставили 23.5 мг ⋅ см–2 ⋅ ч–1 и 96.15% соответственно. Скорость образования Li2PtO3, и, следовательно, скорость окисления платины при 2.80 В в 3.7 раза больше, чем при 2.41 В. Таким образом, пик тока 2 при потенциале 2.80 В соответствует анодному окислению оксид-ионов до газообразного кислорода. Этот электрохимический процесс описывается уравнением (7).
Анализ вольтамперограмм (рис. 3 и 4) показал, что для расплавов одинакового состава потенциал пика тока разряда оксид-ионов смещается в положительную сторону при снижении температуры расплава. Потенциал пика тока окисления оксид-ионов на платине при температуре 550°С составил 2.78–2.80 В, а при 650°С равен 2.72–2.73 В относительно пары Li+/Li. Такое смещение потенциала пика тока согласуется с теоретическими основами метода хроновольтамперометрии, поскольку потенциал анодного пика тока связан со стандартным потенциалом электрода через величину потенциала полуволны. А стандартный электродный потенциал пары O2(г)/O2– увеличивается при понижении температуры. Согласно термодинамическому расчету с помощью программы [18] при температуре 650°С стандартный потенциал этой пары равен 2.465 В, а при 550°С – 2.538 В относительно пары Li+/Li.
Амплитуда пика тока разряда окисления оксид-ионов на Pt увеличивается со скоростью развертки потенциала, при этом потенциал пика тока не смещается с увеличением скорости развертки потенциала, что говорит о диффузионном контроле электродного процесса. Зависимости пика тока окисления оксид-ионов от корня квадратного из скорости развертки потенциала для расплава 80LiCl–20KCl + 1.6Li2O (мол. %) при температурах 550 и 650°С показаны на рис. 7.
Рис. 7.
Зависимость ${{i}_{p}}$ окисления оксид-ионов на Pt аноде от √υ. Расплав 80LiCl–20KCl + 1.6Li2O (мол. %). Температура указана в легенде графика.
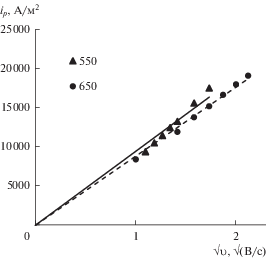
Из графиков, представленных на рис. 7 , был оценен коэффициент диффузии ионов ${{{\text{O}}}^{{2 - }}}$ по уравнению (11):
(11)
${{i}_{p}} = 0.4463\frac{{{{{\left( {zF} \right)}}^{{{3 \mathord{\left/ {\vphantom {3 2}} \right. \kern-0em} 2}}}}}}{{{{{\left( {RT} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}}D_{{{{{\text{O}}}^{{2 - }}}}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}C_{{{{{\text{O}}}^{{2 - }}}}}^{{{\text{vol}}}}{{\upsilon }^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$Для расплава 80LiCl–20KCl + 1.6Li2O (мол. %) при температурах 550 и 650°С оцененное значение коэффициента диффузии оксид-ионов составляет 1.69 ⋅ 10–9 и 1.72 ⋅ · 10–9 м2/с. Для расплава LiCl–1.42 мол. % Li2O при температуре 650°С авторы работы [20] определили коэффициент диффузии ионов ${{{\text{O}}}^{{2 - }}}$, который составил 4.53 ⋅ 10–11 м2/с. Следует отметить, что авторы работы [20] для расчета коэффициента диффузии приняли число электронов, участвующих в реакции равным 4. В уравнении (14) величина z должна соответствовать числу электронов, участвующих в элементарном процессе, а не в суммарном. Анодное окисление оксид-ионов, вероятнее всего, протекает в несколько стадий. Упрощенно этот процесс можно представить следующим образом: 1) из объема расплава к поверхности электрода подводятся оксид-ионы, после чего происходит разряд иона ${{{\text{O}}}^{{2 - }}}$ с образованием адсорбированного атома кислорода на поверхности электрода – элементарная стадия (ур. (12)); 2) в результате реакции рекомбинации на поверхности электрода образуется молекулярный кислород (ур. (13)). Суммарное уравнение разряда оксид-ионов полностью соответствует реакции (7). В работе [22] для расчета коэффициента диффузии принимали число электронов, участвующих в электродной реакции, равны двум.
Пересчет коэффициента диффузии ионов ${{{\text{O}}}^{{2 - }}}$, рассчитанного в работе [20], на 2 электрона дает величину 3.62 ⋅ 10–10 м2/с. Для расплава LiCl с добавкой 1.42 мол. % Li2O коэффициент диффузии ионов ${{{\text{O}}}^{{2 - }}}$ почти в 5 раз меньше по сравнению с расплавом 80LiCl–20KCl + 1.58Li2O (мол. %), если сравнивать эти коэффициенты при одинаковой температуре (650°С) и примерно одинаковых концентрациях Li2O. Из сравнения коэффициентов диффузии, рассчитанных в этой работе для расплавов одинакового состава, но при разной температуре видно, что повышение температуры электролита приводит к незначительному увеличению коэффициента диффузии. Следует отметить, что анодный ток на платиновом электроде, который мы приписываем окислению оксид-ионов до газообразного кислорода, на самом деле приставляет собой сумму анодных токов окисления платины до Li2PtO3 и разряда оксид-ионов до газообразного кислорода. Поэтому возможен только оценочный расчет коэффициента диффузии ионов O2–.
При обратном сканировании на платиновом электроде в исследуемом расплаве при температурах 550 и 650°С наблюдается катодный пик 4 при потенциалах 2.62–2.67 В, соответствующий катодному восстановлению адсорбированного на поверхности электрода кислорода. Реакция протекает по уравнению (7) в обратном направлении. Авторы работы [22] так же относят эту волну к восстановлению кислорода до оксид-ионов при обратной развертке потенциала. В работе [20] сообщается, что волна, соответствующая восстановлению кислорода, не была обнаружена. Отсутствие катодной волны, соответствующей этому процессу, скорее всего, связано с тем, что развертку потенциала проводили далеко в анодную область – до 3.5 В относительно Li+/Li. Это, как мы считаем, и могло привести к удалению кислорода с поверхности электрода в процессе анодного растворения платины за счет взаимодействия кислорода с Pt2+. Потенциал пика тока катодного восстановления кислорода при увеличении температуры смещается в отрицательную область потенциалов. При 650°С величина потенциала пика тока составляет примерно 2.62 В, а при 550°С – 2.67 В.
При смещении потенциала анода в более положительную область, чем потенциал выделения кислорода, начинается анодное растворение платины (волна 3 на рис. 3 и рис. 4) по реакции (14):
(15)
${\text{P}}{{{\text{t}}}^{{2 + }}} + 2{\text{C}}{{{\text{l}}}^{ - }} = {\text{PtC}}{{{\text{l}}}_{2}}.$Было установлено, что платина начинает растворяться при потенциалах положительнее 3.0 В. Эти результаты согласуются с данными, полученными в расплаве 80LiCl–20KCl (мол. %) без добавки Li2O. При обратной развертке потенциала на вольтамперограммах, полученных на платиновом электроде в исследуемых расплавах при температурах 550 и 650°С, не наблюдается процесс, обратный реакции (12). Это связано с тем, что ионы Pt2+ являются неустойчивыми в оксидно-хлоридном расплаве. В процессе анодного растворения платинового электрода, образующийся хлорид платины(II), взаимодействует с Li2O и кислородом, образующимся по реакции (7). Суммарное уравнение этой реакции можно записать следующим образом (16):
(16)
${\text{PtC}}{{{\text{l}}}_{2}} + 2{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}} + \raise.5ex\hbox{$\scriptstyle 1$}\kern-.1em/ \kern-.15em\lower.25ex\hbox{$\scriptstyle 2$} {{{\text{O}}}_{2}} = {\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{Pt}}{{{\text{O}}}_{3}}{\kern 1pt} \downarrow + {\text{ }}2{\text{LiCl}}{\text{.}}$Образование платината лития в процессе анодного растворения платины объясняет отсутствие волны при обратном сканировании потенциала, соответствующей реакции (14), протекающей в обратном направлении.
Как видно из экспериментальных данных, в процессе электролиза расплава LiCl–KCl–Li2O на платиновом аноде одновременно образуются Li2PtO3 и O2. При этом Li2PtO3 образуется при более отрицательном потенциале, чем кислород. Это неизбежно приведет к потерям дорогостоящей платины. Кроме того, при низких концентрациях Li2O в расплаве и высоких анодных потенциалах будет иметь место процесс электрохимического растворения платины. Следовательно, платина не является инертным анодным материалом для электролиза оксидно-хлоридных расплавов на основе LiCl–Li2O.
ЗАКЛЮЧЕНИЕ
Методами циклической вольтамперометрии и потенциостатического электролиза исследованы анодные процессы на платине в расплавах 80LiCl–20KCl и 80LiCl–20KCl (мол. %) с добавкой Li2O при 550 и 650°С. В расплаве 80LiCl–20KCl без добавки Li2O платина анодно растворяется с образованием ионов Pt2+ при потенциалах положительнее 3.1 В при 550°С и 3.0 В (относительно Li+/Li) при 650°С. В расплавах 80LiCl–20KCl с добавкой Li2O при потенциалах 2.40–2.43 В (относительно Li+/Li) происходит двухстадийное окисление платины с образованием Li2PtO3. Выход по току кислорода при потенциале 2.8 В относительно Li+/Li и температуре 650°С составляет 96.15%. Увеличение температуры электролита приводит к увеличению потерь массы платины, поэтому электролиз расплавов 80LiCl–20KCl (мол. %) с добавкой Li2O с применением платиновых анодов рекомендуется вести при температуре 550°С.
Список литературы
Frederic L., Groult H. Molten salts chemistry from lab to applications. Elsevier. 2013. https://doi.org/10.1016/C2012-0-00049-X
Hur J.-M., Cha J.-S., Choi E.-Y. // ECS Electrochemistry Letters. 2014. 3. № 10. P. E5–E7. https://doi.org/10.1149/2.0071410eel
Kim S.-W., Jeon M.K., Kang H.W. et al. // J. Radioanalytical and Nuclear Chemistry. 2016. 310. P. 463–467. https://doi.org/10.1007/s10967-016-4786-5
Tarcy G.P. // Light Metals. 1986. P. 309–320. https://doi.org/10.1002/9781118647745.ch145
Ray S.P. Inert Anodes for Hall Cell // Light Metals. 1986. P. 287–298.
Yin H., Gao L., Zhu H. et al. // Electrochimica Acta. 2011. 56. P. 3296–3302. https://doi.org/10.1016/j.electacta.2011.01.026
Chapman V., Welch B.J., Skyllas-Kazacos M. // Electrochimica Acta. 2011. № 56. P. 1227–1238. https://doi.org/10.1016/j.electacta.2010.10.095
Suzdaltsev A., Khramov A., Kovrov V., Limanovskaya O., Nekrasov V., Zaikov Y. // Materials Science Forum. 2016. 844. P. 19–26. https://doi.org/10.4028/www.scientific.net/MSF.844.19
Nekrasov V.N., Limanovskaya O.V., Suzdal’tsev A.V., Khramov A.P., Zaikov Yu.P. // Russian Metallurgy. 2014. № 4. P. 70–79. https://doi.org/10.1134/S0036029514080084
Kovrov V.A., Shurov N.I., Khramov A.P., Zaikov Y.P. // Russian J. Non-Ferrous Metals. 2009. 50. № 5. P. 492–499. https://doi.org/10.3103/S1067821209050113
Choi E.-Y., Lee J.W., Park J.J., Hur J.-M., Kim J.-K., Jung K.Y., Jeong S.M. // Chemical Engineering J. 2012. 207–208. P. 514–520. https://doi.org/10.1016/j.cej.2012.06.161
Sakamura Y., Kurata M., Inoue T. // J. Electrochemical Society. 2006. 153. № 3. P. D31–D39. https://doi.org/10.1149/1.2160430
Park B.H., Lee I.W., Seo C.-S. // Chem. Engineering Science. 2008. 63. P. 3485–3492. https://doi.org/10.1016/j.ces.2008.04.021
Sakamura Y. // J. Nuclear Materials. 2011. 412. P. 177–183. https://doi.org/10.1016/j.jnucmat.2011.02.055
Kovrov V.A., Mullabaev A.R., Shishkin V.Y., Zaikov Y.P. // Russian Metallurgy. 2018. № 2. P. 169–173. https://doi.org/10.1134/S003602951802009X
Mullabaev A., Tkacheva O., Shishkin V., Kovrov V., Zaikov Y., Sukhanov L., Mochalov Y. // J.Nuclear Materials. 2018. 500. P. 235–241. https://doi.org/10.1016/j.jnucmat.2018.01.004
Sakamura Y. // J. Electrochemical Society. 2010. 157. № 9. P. E135–E139. https://doi.org/10.1149/1.3456631
Roine A., HSC Chemistry [Software], Outotec, Pori 2018. Software available at www.outotec.com/HSC.
Jeong S.M., Shin H.-S., Cho S.-H., Hur J.-M., Lee H.S. // Electrochimica Acta. 2010. 54. P. 6335–6340. https://doi.org/10.1016/j.electacta.2009.05.080
Biju Joseph T., Sanil N., Shakila L., Mohan-das K.S., Nagarajan K. // Electrochimica Acta. 2014. 139. P. 394–400. https://doi.org/10.1016/j.electacta.2014.07.025
Kasuya R., Miki T., Tai Y. // J. Ceramic Society of Japan. 2013. 121. P. 261–264. https://doi.org/10.2109/jcersj2.121.261
Sakamura Y. // J. Nuclear Materials. 2011. 412. P. 177–183. https://doi.org/10.1016/j.jnucmat.2011.02.055
Дополнительные материалы отсутствуют.


