Расплавы, 2021, № 6, стр. 647-655
Электровосстановление смесей хлорида никеля(II) и оксида вольфрама(VI) в термоактивируемом химическом источнике тока
О. В. Волкова a, *, В. В. Захаров a, С. В. Першина a, Б. Д. Антонов a, А. Е. Вахромеева a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: olga@ihte.uran.ru
Поступила в редакцию 28.05.2021
После доработки 16.06.2021
Принята к публикации 01.07.2021
Аннотация
Исследованы разрядные характеристики элементов термоактивируемого химического источника тока, содержащего в качестве положительного электрода смесь NiCl2–WO3. Установлено, что использование смесей вместо чистого хлорида никеля позволяет снизить температуру разряда элемента ТХИТ без потери мощностных характеристик. Максимальная емкость разрядного плато составляет 0.35 А ⋅ ч/г. Оптимальный состав катодной смеси содержит 10 мас. % WO3. Определены состав и морфология продуктов восстановления исследуемых катодных материалов. Установлено, что в процессе разряда элемента ТХИТ происходит восстановление исходных хлорида никеля и оксида вольфрама до металлов. Процесс восстановления сопровождается диффузией галогенидов лития из сепаратора в катодное пространство. Восстановленные металлы (Ni, W) образуют сеть разветвленных дендритов, покрытых солевой пленкой на основе хлорида лития. В зоне катодной реакции в состав солевой фракции входят твердые растворы и смесь комплексных соединений системы Li, Ni, W || Cl, Br, O, которые снижают поляризацию электрода, стабилизируют разрядное плато, и способствуют повышению напряжения разряда элемента ТХИТ. Показано, что процесс восстановления ионов переходных металлов до металлов протекает по расплавному механизму в режиме диффузионной кинетики.
ВВЕДЕНИЕ
При разработке катодных материалов для термоактивируемых химических источников тока (ТХИТ) широко распространена практика введения в состав активных катодных масс электрон- и ион-проводящих добавок [1–7]. Это позволяет повысить мощность батареи ТХИТ за счет снижения внутреннего сопротивления катода. В некоторых случаях введение проводящих добавок позволяет увеличить снимаемую емкость положительного электрода за счет более полного восстановления его активных компонентов. При разработке литиевых ТХИТ с катодами на основе галогенидов переходных металлов, в качестве катодной добавки целесообразно использовать оксиды переходных металлов. Данный выбор обусловлен тем, что в галогенидных расплавах в присутствии ионов лития они могут образовывать литиевые оксидные бронзы. Щелочные оксидные бронзы переходных металлов представляют собой нестехиометрические соединения с общей формулой МхЭОn (М – щелочной металл, Э – переходный металл IV–VIII групп периодической системы, 0 < x ≤ 1). Структурно они близки к своим оксидным прототипам. Однако, присутствие в кристаллической решетке бронз ионов щелочного металла придает им ряд уникальных свойств, в частности, повышенную плотность и высокую электропроводность.
Ранее нами рассматривались катодные материалы на основе галогенидов переходных металлов с добавкой оксида молибдена [8, 9]. Было установлено, что процесс восстановления галогенидов переходных металлов сопровождается снижением степени окисления иона молибдена Mo6+ до Mo4+ и образованием расплавов галогенида лития с молибдатами лития. Полученные результаты свидетельствуют о том, что оксид молибдена(VI) стабилизирует разрядное плато, снижает поляризационные затруднения на катоде и способствует повышению напряжения разряда элемента ТХИТ. Таким образом, оксид молибдена оказывает положительное влияние на электрические характеристики ТХИТ. Поэтому представляет определенный интерес рассмотреть влияние добавки других оксидов переходных металлов на изученные нами ранее катодные материалы.
В данной работе проведено исследование разрядных характеристик и продуктов восстановления элементов ТХИТ на основе смесей хлорида никеля(II) и оксида вольфрама(VI). Галогениды переходных металлов в расплавленных электролитах обладают высокими значениями плотностей токов обмена [10], и в паре с литием дают высокие энергетические показатели электромоторных реакций. Хлорид никеля является одним из наиболее перспективных материалов в данной группе катодов. Электрическая емкость хлорида никеля относительно невелика (0.413 А ⋅ ч/г), однако, особенности восстановления NiCl2 позволяют использовать, в изготавливаемых батареях ТХИТ, до 80% от его теоретической емкости и реализовывать плотности тока порядка 20 кА/м2. Э.д.с. токообразующей реакции NiCl2 + 2Li = Ni + 2LiCl, составляет 2.61 В. В сумме, эти характеристики катода NiCl2 позволяют разрабатывать мощные батареи ТХИТ с удельной энергоемкостью до 140 Вт ⋅ ч/кг. В свою очередь, оксид вольфрама(VI) в процессе восстановления в расплаве, содержащем ионы щелочного металла, способен образовывать оксидные вольфрамовые бронзы [11–13], обладающие полупроводниковыми и каталитическими свойствами.
Целью работы является исследование влияния добавки оксида вольфрама(VI) на электрические характеристики хлорида никеля(II), используемого в качестве катодного материала ТХИТ, определение оптимальных условий разряда и механизма восстановления твердофазного катода.
МЕТОДИКА ЭКСПЕРИМЕНТА
При изготовлении элементов ТХИТ были использованы реактивы марки “ч. д. а.”. Исходные навески хлорида никеля(II) и оксида вольфрама(VI) гомогенизировали в агатовой ступке и спрессовывали в таблетки. При формировании элемента ТХИТ использовали токоотводы чашечной конструкции, в которые помещались активные электродные компоненты. В качестве отрицательного электрода использовали литий – борный композит с содержанием бора 24 мас. % [14]. Анодный материал брали в избыточном количестве, что гарантировало лимитирующую роль катода в разрядных характеристиках элемента ТХИТ. В качестве сепаратора применяли низкоплавкую смесь галогенидов лития 22LiF–31LiCl–47LiBr (мол. %) с температурой плавления 430°С, загущенную γ-LiAlO2. Все операции по изготовлению элемента ТХИТ проводили в сухом аргоновом боксе.
Разряд электрохимических ячеек проводили в гальваностатическом режиме с помощью электрохимической рабочей станции “Zahner IM6”.
Электронно-микроскопический анализ продуктов восстановления катода проводили с помощью сканирующего электронного микроскопа (СЭМ) с энергодисперсионным детектором (Phenom, Нидерланды), пространственное разрешение 10 нм (катод CeB6).
Рентгенофазовый анализ (РФА) образцов проводили при комнатной температуре на дифрактометре “Rigaku D/MAX-2200VL/PC” (Rigaku, Япония) с использованием Cu Kα излучения в диапазоне брегговских углов 2θ от 10° до 85° с шагом 0.02°.
Для синхронного термического анализа (СТА) использовали термический анализатор “STA 449 F1 Jupiter” (NETZSCH). Измерения проводили в графитовых тиглях в интервале температур 35–650°С, скорость нагрева/охлаждения – 10°С/мин. Измерительную ячейку с образцом продували аргоном со скоростью 50 мл/мин. Полученные данные были обработаны с помощью программного обеспечения “NETZSCH Proteus”.
Потенциодинамические кривые снимали на двухэлектродной ячейке при помощи потенциостата/гальваностата “Model 263A”. Площадь рабочего электрода составлял 0.07 см2. В качестве противоэлектрода использовали таблетку Li–B композита площадью 2.3 см2. Поляризация противоэлектрода не превышала 10 мВ. Малая величина поляризации противоэлектрода позволяет использовать его в качестве электрода сравнения.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
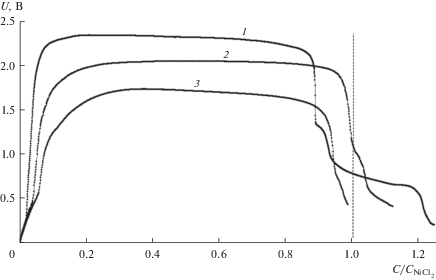
В рамках данной работы были исследованы разрядные характеристики твердофазных катодных смесей NiCl2–WO3 в составе элементов ТХИТ с Li–B анодом. Восстановление катодных материалов проводили в температурном интервале 450–550°С. Верхняя граница, рассматриваемого интервала, является рабочей температурой для ТХИТ с чистым хлоридом никеля [9]. Нижняя граница соответствует началу затвердевания низкоплавкой смеси галогенидов лития в сепараторе. Плотность тока варьировалась от 0.5 до 1.5 А/см2. Из полученных данных следует, что введение оксидной добавки в хлорид никеля позволяет снизить рабочую температуру до 500°С (рис. 1). Максимальная длительность разрядного плато ($0.85{\kern 1pt} {{С}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}$ Uплато = 2.1 ± 0.1 В) при данной температуре соответствует составу катодной смеси NiCl2–WO3 (10 мас. %). При более высокой концентрации WO3 в составе исходной катодной смеси наблюдается снижение напряжения разряда (рис. 1, кривая 4). Мы считаем, что это обусловлено образованием вольфрамовых бронз с меньшим содержанием лития, обладающих более низкой электропроводностью. При температурах выше 500°С и плотности тока менее 1 А/см2 на разрядных кривых наблюдается второе плато с Uплато = 0.65 В (рис. 2). Очевидно, оно относится к восстановлению литий вольфрамовых бронз до металлического вольфрама.
Рис. 1.
Разрядные кривые элементов ТХИТ с различным составом катодной смеси NiCl2–WO3 (х мас. %), где х: 1 – 0; 2 – 5; 3 – 10; 4 – 20. Плотность тока разряда 0.5 A/см2, Тразр = 500°С.
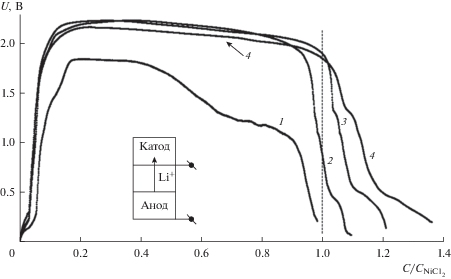
Рис. 2.
Разрядные кривые элементов ТХИТ Li–B/NiCl2–WO3 (10 мас. %), снятые при различных плотностях тока разряда: 1 – 0.5; 2 – 1; 3 – 1.5 A/см2. Тразр = 550°С.
Рентгенофазовый анализ продуктов восстановления катода исследуемых ТХИТ показал, что образцы с разным отбором емкости содержат как металлический Ni, так и W (рис. 3). Это свидетельствует о совместном восстановлении компонентов исходной катодной смеси. На дифрактограммах образцов с отбором емкости менее ${{С}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}$, наряду с линиями исходных компонентов катода, присутствуют линии, которые мы относим к литий содержащим вольфрамовым бронзам. При растворении продуктов восстановления смеси NiCl2–WO3 (20 мас. %) (отбор емкости $1.36{{С}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}$, jразр = 0.5 A/см2, Тразр = 500°С) в дистиллированной воде, образуется солевой раствор и металлический осадок. По данным химического анализа солевой раствор содержит: Cl− – 34.5; OH− – 4.8; Li+ – 60.5; W6+ – 0.2 мол. %. Присутствие ионов вольфрама в солевом растворе свидетельствует о наличие в составе продуктов восстановления катода растворимых вольфраматов лития. Щелочная реакция солевого раствора указывает на наличие в его составе оксида лития. Поскольку линии Li2O на дифрактограммах образцов с максимальным отбором емкости отсутствуют (рис. 3, кривая 2), мы предполагаем образование твердых растворов в системе LiCl–Li2O. Металлический осадок имеет дендритную структуру (рис. 4в). Его состав, определенный методом РФА и СЭМ, соответствует фазам металлического никеля и вольфрама. На СЭМ-фотографиях образцов с отбором емкости менее ${{С}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}$, по морфологии, катод, формально, можно разбить на две зоны (рис. 4а). Зона I, ближайшая к сепаратору и катодному токоотводу, имеет вид металлической матрицы, покрытой тонким слоем солевой фракции. Согласно энергодисперсионному спектру, основным компонентом металлической матрицы является никель. С увеличение отбора емкости, граница зоны I смещается вглубь катода. Зона II менее однородна и включает в себя фрагменты исходных катодных фаз. В этой зоне протекает основной объем электрохимической реакции и происходит формирование дендритной матрицы из солевого расплава. Присутствие анионов брома в солевом расплаве свидетельствует о наличии диффузии галогенидов лития (LiBr, LiF) из сепаратора в катодное пространство.
Рис. 3.
Дифрактограммы продуктов восстановления катодной смеси NiCl2–WO3 (20 мас. %) при различном отборе емкости: 1 – $0.44{{С}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}$; 2 – $1.36{{С}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}$; 3 – образец отмыт в дистиллированной воде ($1.36{{С}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}$). Плотность тока разряда 1 A/см2, Тразр = 500°С.
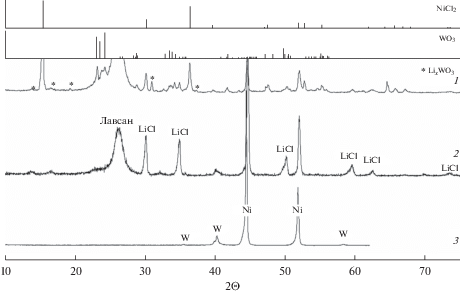
Рис. 4.
СЭМ продуктов катодной реакции элементов ТХИТ, полученных при разряде плотностью тока 0.5 A/см2, Тразр = 480°С: а, б – поперечный скол катода после отбора емкости $0.44{{С}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}$; в – образец с $1.36{{С}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}$, отмытый в дистиллированной воде.

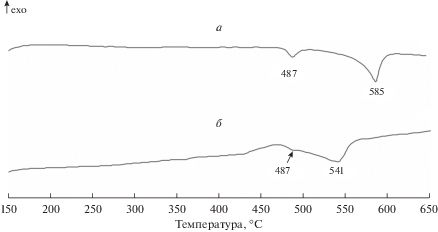
Стационарный режим работы элемента ТХИТ характеризуется наличием плато на разрядной кривой. В этих условиях состав солевого расплава в зоне электрохимической реакции остается постоянным. Соответствующие этому режиму разряда кривые ДСК имеют два пика (рис. 5а). Ранее было показано [15], что при замене сепаратора с низкоплавкой смесью LiF–LiCl–LiBr на твердый электролит, не содержащий галогенидов лития (Li4SiO4–Li3PO4), низкотемпературный пик на кривых ДСК исчезает. Поэтому очевидно, что пик в области 487°С соответствует плавлению смеси на основе галогенидов лития. Высокотемпературный пик (585°С) мы относим к совместному плавлению твердого раствора LiCl–NiCl2 и эвтектики в системе LiCl–Li2WO4. Выход элемента ТХИТ из стационарного режима работы характеризуется смещением высокотемпературного пика на кривых ДСК в область более низких температур (рис. 5б). Очевидно, это связано с растворением оксида лития в системе LiCl–Li2WO4 и снижением концентрации вольфрамата лития вследствие восстановительной реакции.
Рис. 5.
ДСК кривые продуктов восстановления катодной смеси NiCl2–WO3 (20 мас. %) при различном отборе емкости: а – $0.44{{С}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}$; б – $1.36{{С}_{{{\text{NiC}}{{{\text{l}}}_{{\text{2}}}}}}}$. Плотность тока разряда 1 A/см2. Тразр = 500°С.
Для уточнения природы процессов, протекающих при восстановлении катодных смесей, был использован хроновольтамперометрический метод. Съемка потенциодинамических кривых проводилась при температуре 500°С, скорость развертки (υ) варьировалась от 5 до 100 мВ/с, смещение потенциала от НРЦ ±1.5 В. Пять первых циклов служили для формирования поверхности рабочего электрода и исключались из дальнейшего анализа. В качестве рабочих электродов были использованы NiCl2, WO3, и смесь NiCl2–WO3 (20 мас. %). Для всех образцов, на потенциодинамических кривых фиксировались два катодных пика (рис. 6). Первый (от НРЦ) пик соответствует восстановлению комплексных соединений [MeBrxCly]n– (Me – переходный металл), образующихся вследствие диффузии аниона Br– из электролита в солевую фракцию продуктов восстановления рабочего электрода. Этот пик исчезает при использовании электролитов, не содержащих анион Br– [15]. Природа второго пика, очевидно, отвечает процессу восстановления переходных металлов из оксихлоридного расплава LiCl–Li2O–NiCl2–Li2WO4. Пики потенциодинамических кривых, снятые на рабочих электродах из индивидуальных веществ, смещены от НРЦ дальше, чем пики смеси. Это свидетельствует о том, что оксихлоридный расплав позволяет снизить поляризационные затруднения на электроде. Вероятно, восстановления вольфрамат-иона в оксихлоридном расплаве, протекает с образованием электрохимически активной литий-вольфрамовой бронзы ${\text{L}}{{{\text{i}}}_{x}}{\text{WO}}_{4}^{{x{\kern 1pt} - {\kern 1pt} 2}}$, которая препятствует образованию пассивирующей пленки на поверхности металлических дендритов.
Рис. 6.
Циклические вольтамперные кривые, снятые на различных электродах: 1 – NiCl2; 2 – WO3; 3 – NiCl2–WO3 (20 мас. %), скорость развертки 20 мВ/с. Врезка – зависимость плотности тока катодных пиков от скорости развертки потенциала, снятые на электроде NiCl2–WO3 (20 мас. %)
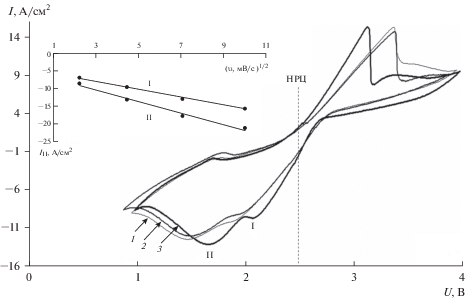
Наблюдаемое уширение катодных пиков обусловлено увеличением дисперсности поверхности рабочего электрода в процессе роста дендритов металлического никеля и вольфрама. Линейная зависимость для смеси NiCl2–WO3 тока катодных пиков от корня квадратного из скорости развертки потенциала говорит о том, что электрохимическая реакция протекает в режиме диффузионной кинетики (рис. 6, врезка).
ЗАКЛЮЧЕНИЕ
Исследованы разрядные характеристики элементов ТХИТ, содержащие в качестве положительного электрода смеси NiCl2–WO3. Установлено, что добавка оксидного компонента в катодный материал позволяет снизить температуру разряда элементов ТХИТ до 500°С. Максимальная емкость разрядного плато 0.35 А ⋅ ч/г (Uплато = 2.1 ± 0.1 В). В процессе разряда элементов ТХИТ наблюдается диффузия аниона Br– из электролита в катодную область. Продукты восстановления исследуемых катодных материалов содержат дендритную губку из металлического никеля и вольфрама, покрытую солевой пленкой на основе хлорида лития. В зоне катодной реакции солевая фракция содержит твердые растворы LiCl–NiCl2–LimWO3 и смесь комплексных соединений [MeBrxCly]n– (Me – Ni, W). Литий-вольфрамовые бронзы (LimWO3) являются промежуточной стадией восстановления WO3 в расплаве твердых растворов LiCl–NiCl2. Они препятствуют пассивации электрода, что способствует снижению поляризационных затруднений. Оксид лития, образующийся при конечной стадии восстановления WO3, входит в состав твердых растворов LiCl–Li2O. Восстановление комплексных соединений [MeBrxCly]n– и твердых растворов LiCl–NiCl2–LimWO3 протекает в режиме диффузионной кинетики.
Исследования выполнены с использованием оборудования ЦКП “Состав вещества” ИВТЭ УрО РАН.
Список литературы
Masset P.J., Guidotti R.A. // J. Power Sources. 2008. 177. P. 595–609.https://doi.org/10.1016/j.jpowsour.2007.11.017
Butler P., Wagner C., Guidotti R., Francis I. // J. Power Sources. 2004. 136. P. 240–245. https://doi.org/10.1016/j.jpowsour.2004.03.034
Nelson P.A. // J. Power Sources. 1990. 29. P. 565–577. https://doi.org/10.1016/0378-7753(90)85026-9
Au M. // J. Power Sources. 2003. 115. P. 360–366. https://doi.org/10.1016/S0378-7753(02)00627-4
Guidotti R., Reinhardt F.W., Dai J., Reisner D.E. // J. Power Sources. 2006. 160. P. 1456–1464. https://doi.org/10.1016/j.jpowsour.2006.02.025
Masset P.J., Guidotti R.A. // J. Power Sources. 2008. 178. P. 456–466. https://doi.org/10.1016/j.jpowsour.2007.11.073
Masset P.J. // Z. Naturforsch. 2008. 63a. P. 596–602. https://doi.org/10.1515/zna-2008-0911
Volkova O.V., Zakharov V.V. Electroreduction of chromium(III) chloride and molybdenum(VI) oxide mixtures in a thermally activated battery // Russian Metallurgy. 2018. № 2. P. 201–204.
Волкова О.В., Захаров В.В., Вовкотруб Э.Г., Плаксин С.В., Першина С.В. Электровосстановление смесей хлорида никеля(II) и оксида молибдена(VI) в термоактивируемом химическом источнике тока // Расплавы. 2019. № 5. С. 411–422.
Барабошкин А.Н. Электрокристаллизация металлов из расплавленных солей. М.: Наука. 1976.
Шановая Ю.К., Кушхов Х.Б. Влияние катиона Li+ на кинетику восстановления ${\text{WO}}_{4}^{{2 - }}$ в эквимолярном расплаве // Укр. хим. журнал. 1979. 45. № 8. С. 698–701.
Ротиян А.Л., Шишкина С.В., Тихонов К.И. Катодное восстановление окиси вольфрама в N, N-диметилацетамиде // Электрохимия. 1975. 11. № 7. С. 1094–1096.
Кукоз Ф.И., Гончаров В.И., Асфацадурьян М.Ю. // Высокотемпературная физ. химии и электрохимии: III Уральская конференция. 1981.
Захаров В.В. и др. Способ изготовления литий-борного композита и реактор. Патент РФ № 2 395 603, 2010.
Волкова О.В., Захаров В.В., Ильина Е.А., Панкратов А.А. Электровосстановление смесей хлорида никеля(II) и хлорида кобальта(II) в термоактивируемом химическом источнике тока // Расплавы. 2021. № 2. С. 118–128.
Дополнительные материалы отсутствуют.


