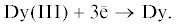Расплавы, 2022, № 4, стр. 373-383
Изучение механизма электрохимического восстановления ионов диспрозия(III) на инертном и активном электродах в расплавленном хлориде цезия
А. В. Новоселова a, b, *, В. В. Смоленский a, b, А. Л. Бове a, b
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
b Уральский федеральный университет им. Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: alena_novoselova@list.ru
Поступила в редакцию 24.02.2022
После доработки 03.03.2022
Принята к публикации 10.03.2022
- EDN: TIMUZL
- DOI: 10.31857/S0235010622040077
Аннотация
Методами циклической, квадратно-волновой вольтамперометрии и потенциометрии при нулевом токе исследована реакция катодного восстановления ионов Dy(III) до металла в расплавленном хлориде цезия в интервале температур 963–1063 K на инертном молибденовом и активном галлиевом электродах в атмосфере инертного газа. Все операции по сборке экспериментальной ячейки проводили в сухом боксе, исключающем попадание примесей кислорода и влаги на используемые реактивы. Циклические вольтамперограммы расплавленной смеси CsCl–DyCl3, полученные на молибденовом инертном электроде при различных скоростях сканирования при 987 K, характеризуются наличием одного пика тока восстановления и соответствующего ему пика тока окисления. Это указывает на то, что реакция катодного восстановления ионов Dy(III) до металла протекает в одну стадию с возможным участием трех электронов. На квадратно-волновой вольтамперограмме фиксируется асимметричная катодная кривая гауссовой формы с одним четко выраженным пиком тока. Число электронов реакции электрохимического восстановления, рассчитанное из ширины полупика катодной кривой, было близко к трем (n = 2.89 ± 0.05). Установлен механизм катодного осаждения металлического диспрозия на инертном Mo электроде. Показано, что электродная реакция протекает необратимо, в одну стадию и контролируется скоростью переноса заряда. Рассчитаны коэффициенты диффузии комплексных ионов [DyCl6]3– при разных температурах и определена энергия активации процесса диффузии. Зависимость коэффициентов диффузии ионов диспрозия(III) от температуры подчиняется закону Аррениуса и описывается уравнением $\lg D = - 3.15 - \frac{{2010}}{T} \pm 0.02.$ Рассчитана энергия активации процесса диффузии, равная –38.7 кДж/моль. Установлена экспериментальная зависимость условного стандартного потенциала пары Dy(III)/Dy от температуры. Она описывается линейным уравнением: $E_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{{\text{*}}} = - \left( {3.921 \pm 0.007} \right) + \left( {6.8 \pm 0.1} \right) \cdot {{10}^{{ - 4}}}T \pm 0.005\,\,{\text{В}}.$ Рассчитаны основные термодинамические характеристики трихлорида диспрозия. Установлено, что реакция электрохимического осаждения диспрозия на активном галлиевом электроде связана с процессом сплавообразования и протекает с деполяризацией. Измерены равновесные потенциалы сплава Dy–Ga и определена температурная зависимость условного стандартного потенциала сплава, которая описывается линейным уравнением: $E_{{{\text{Dy}}\left( {{\text{Ga}}} \right)}}^{{{\text{**}}}} = - \left( {3.069 \pm 0.005} \right) + \left( {3.2 \pm 0.2} \right) \cdot {{10}^{{ - 4}}}T \pm 0.006\,\,{\text{B}}{\text{.}}$ Предложена схема реакции образования интерметаллических соединений Dy–Ga. Рассчитаны коэффициенты активности и избыточная парциальная энергия Гиббса для диспрозия в жидком галлии.
ВВЕДЕНИЕ
Редкоземельные металлы (РЗМ) высокой степени чистоты применяют в различных отраслях промышленности: радиоэлектронике, приборо- и машиностроении, металлургии, химической и керамической промышленности и др. В природе РЗМ разделены на две группы: цериевая, включающая легкие лантаноиды: от лантана до гадолиния, и иттриевая, состоящая из иттрия и остальных лантаноидов. Из-за высокой химической активности соединений лантаноидов невозможно получить чистые металлы или их сплавы из водных растворов, поэтому их получают методами металлотермии и электролизом расплавленных сред. Для разработки и совершенствования технологических операций электролитического получения и рафинирования РЗМ необходимо иметь всесторонние сведения о физико-химических характеристиках солевых расплавов, содержащих редкоземельные элементы, в частности, знать электрохимические и термодинамические свойства [1–3].
Расплавленные хлориды щелочных металлов являются хорошими реакционными средами для селективного растворения или осаждения РЗМ. Они представляют собой ионные жидкости с дальнодействующим кулоновским взаимодействием частиц. Растворение многозарядных катионов в расплавленных хлоридных средах сопровождается образованием комплексных ионов различной конфигурации, например, тетраэдрических или октаэдрических [4, 5].
В литературе имеются противоречивые сведения об электрохимических свойствах соединений диспрозия в расплавленных солевых смесях. Электронные спектры поглощения ионов редкоземельных металлов Sm(III), Dy(III), Ho(III) и Er(III) были исследованы в ряду от LiCl до CsCl [6]. Показано, что в расплавах происходит образование комплексных группировок $[{\text{LnCl}}]_{6}^{{3 - }}.$ Изучено электрохимическое поведение ионов Dy(III) в галогенидных электролитах на инертных и активных электродах. Установлено, что на активных электродах катодные реакции протекают с деполяризацией с образованием интерметаллических соединений разного состава [7–13]. В [14] изучено электровосстановление ионов Dy(III) в расплаве 3LiCl–2KCl на инертном вольфрамовом и активном алюминиевом электродах. Так, на инертном электроде процесс протекает в две последовательные стадии: Dy(III) + ē → Dy(II) и Dy(III) + 2ē → Dy, а на активном электроде – в одну стадию с деполяризацией. Стационарными и нестационарными электрохимическими методами изучено электрохимическое поведение и эффективность извлечения диспрозия из растворов 3LiCl–2KCl, содержащих DyCl3 и GdCl3. Установлено, что на W электроде ионы Dy(III) восстанавливаются до металлического состояния в две последовательные стадии [15]. В работе [16] исследованы механизмы восстановления ионов Sm(III) и Dy(III) на вольфрамовом и бинарном Bi–Pb электродах. Было обнаружено, что восстановление Dy(III) и Sm(III) на инертном электроде протекает в одну стадию для диспрозия, а для самария – в две ступени. Позднее было доказано [17–19], что процесс катодного восстановления ионов Dy(III) до металла на инертных электродах протекает необратимо, в одну стадию с участием трех электронов.
Целью данного исследования является установление механизма катодного восстановления ионов Dy(III) до металла на инертном Mo и активном Ga электродах и расчет термодинамических характеристик соединений диспрозия в расплаве CsCl.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Хлорид цезия квалификации “х. ч.” (99.9%) ООО “Невский химик”, металлический галлий (99.9999%) ОАО “Пикалевский глиноземный завод” и все реагенты использовали без дополнительной очистки. Все операции по сборке ячейки и загрузке реагентов осуществляли в перчаточном боксе SPEKS GB02 (содержание кислорода <1 ppm и влаги <1 ppm).
Эксперименты проводили в трехэлектродной кварцевой ячейке в тигле из стеклоуглерода под атмосферой сухого аргона в интервале температур 963–1063 K. Противоэлектродом служил стержень из стеклоуглерода диаметром 3 мм. В качестве рабочего электрода использовали молибденовую проволоку диаметром 1 мм и кварцевый микротигель с жидким галлием. Площадь поверхности твердого электрода рассчитывали по глубине погружения, а жидкого – по диаметру микротигля. Измерения осуществляли относительно стандартного хлорного электрода сравнения.
Электрохимическое поведение ионов Dy(III) в расплавленном хлориде цезия исследовали методами циклической, квадратно-волновой вольтамперометрии и потенциометрии при нулевом токе. Измерения выполняли на потенциостате-гальваностате AUTOLAB PGSTAT302N с программным обеспечением (NOVA 1.11).
Образцы растворов проб, содержащие диспрозий, анализировали методом ICP-MS на оптическом эмиссионном спектрометре с индуктивно-связанной плазмой Perkin Elmer OPTIMA 4300 DV.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Первая часть работы связана с изучением механизма катодного восстановления ионов Dy(III) до металла. Эти исследования необходимы для поиска оптимальных условий электролитического получения металлического диспрозия высокой степени чистоты в расплавленных солях. Стабильные степени существования соединений диспрозия определяли различными электрохимическими методами. Циклические вольтамперограммы расплавленной смеси CsCl–DyCl3, полученные на инертном молибденовом электроде при различных скоростях сканирования при 987 K, приведены на рис. 1. Они характеризуются наличием одного катодного пика восстановления и одним анодным пиком окисления. Это указывает на то, что реакция катодного восстановления ионов Dy(III) до металла протекает в одну стадию с возможным участием трех электронов. Увеличение скорости сканирования приводило к смещению потенциала катодного пика тока в отрицательную сторону, в тоже время катодные пики токов были прямо пропорциональны корню квадратному от скорости сканирования.
Рис. 1.
Циклические вольтамперограммы расплава CsCl–DyCl3, полученные на Mo электроде (S = 0.15 см2) при разных скоростях сканирования, В/с: 1 – 0.1; 2 – 0.2; 3 – 0.3. m(DyCl3) = 2.64 мас. %. T = 987 K.
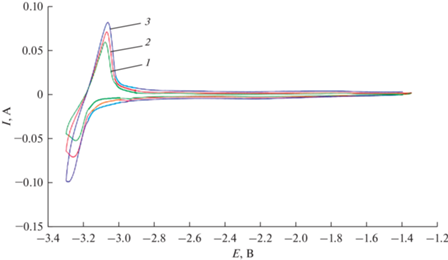
Для определения числа электронов электродной реакции был использован метод квадратно-волновой вольтамперометрии. Асимметричная катодная кривая гауссовой формы была получена в растворе CsCl–DyCl3 при 695 K, рис. 2. Вставка на рис. 2 показывает взаимосвязь между катодным пиком тока и корнем квадратным из частоты. Данная зависимость линейна и проходит через начало координат, что позволяет использовать уравнение (1) для расчета числа электронов электродной реакции в диапазоне частот (10–18 Гц):
где W1/2 – ширина полупика, В; R – универсальная газовая постоянная, Дж/моль · K; T – абсолютная температура, K; n – число электронов, участвующих в реакции; F – постоянная Фарадея, Кл/моль.Рис. 2.
Квадратно-волновая вольтамперограмма расплава CsCl–DyCl3 при частоте 14 Гц, высота импульса 25 мВ; шаг потенциала 1 мВ. m(DyCl3) = 2.93 мас. %. T = 1023 K. Вставка: Соотношение между пиком тока и корнем квадратным из частоты.
Рассчитанное число электронов катодной реакции было близко к трем (n = 2.89 ± ± 0.05).
На основании анализа полученных результатов и в соответствии с теорией циклической вольтамперометрии можно сделать вывод о том, что реакция катодного восстановления ионов Dy(III) до металла на инертном электроде протекает необратимо, в одну стадию и контролируется скоростью переноса заряда [20] и в разбавленных растворах описывается уравнением:
Коэффициенты диффузии комплексных ионов [DyCl6]3– в солевом расплаве определяли методом циклической вольтамперометрии по уравнению (3) [20], справедливого для случая необратимой системы при использованных скоростях сканирования.
где Ip – ток пика, А; S – площадь рабочего электрода, см2; C0 – концентрация ионов диспрозия, моль/см3; D – коэффициент диффузии, см2/с; υ – скорость сканирования, В/с.Зависимость коэффициента диффузии от температуры подчиняется закону Аррениуса и описывается следующим уравнением:
Найденные значения коэффициентов диффузии были использованы для расчета энергии активации процесса диффузии.
где EA – энергия активации процесса диффузии, кДж/моль; D0 – предэкспоненциальный член, см2/с; Δ – ошибка эксперимента.Значения коэффициентов диффузии и энергии активации ионов диспрозия(III) в расплавленном хлориде цезия при разных температурах приведены в табл. 1.
Таблица 1.
Коэффициенты диффузии и энергия активации ионов ${\text{\;}}{{[{\text{DyC}}{{{\text{l}}}_{6}}]}^{{3 - }}}$ в расплавленном CsCl при разных температурах
| T, K | D · 105, cм2/с | EA,кДж/моль |
|---|---|---|
| 963 | 0.60 ± 0.03 | –38.7 |
| 995 | 0.68 ± 0.03 | |
| 1023 | 0.77 ± 0.03 | |
| 1063 | 0.94 ± 0.03 |
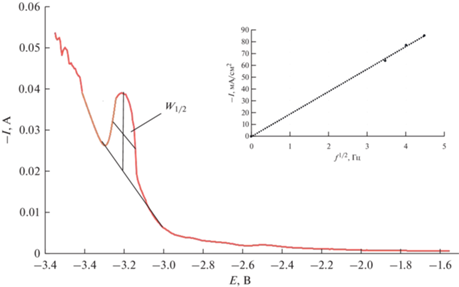
Определение равновесного электродного потенциала пары Dy(III)/Dy при разных температурах проводили методом потенциометрии при нулевом токе. Для этого инертный молибденовый электрод поляризовали током 25–75 мА в течение 20–35 с, а затем снимали зависимость потенциал–время. Типичная хронопотенциограмма расплава CsCl–DyCl3 представлена на рис. 3. Для расчета условного стандартного потенциала применяли уравнение Нернста:
(6)
$~{{E}_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}{\text{\;}}}}} = E_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{*} + \frac{{RT}}{{nF}}{\text{ln}}{{С}_{{{\text{DyC}}{{{\text{l}}}_{3}}}}},$(7)
$E_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{{\text{*}}} = E_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{{\text{o}}} + \frac{{RT}}{{nF}}{\text{ln}}{{\gamma }_{{{\text{DyC}}{{{\text{l}}}_{3}}}}}.$Рис. 3.
Зависимости потенциал–время, полученные после кратковременной катодной поляризации инертного Мо электрода в расплаве CsCl–DyCl3. I = 25–75 мА; τ = 20–35 с. m(DyCl3) = 2.72 мас. %. 1 – равновесный потенциал пары Dy(III)/Dy при Т = 1007 K; 2 – равновесный потенциал пары Dy(III)/Dy при Т = 965 K.
Экспериментальная зависимость, полученная с использованием программного обеспечения Origin Pro версия 7.5 в диапазоне температур 963–1063 K описывается линейным уравнением:
(8)
$E_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{*} = - \left( {3.921 \pm 0.007} \right) + \left( {6.8 \pm 0.1} \right) \cdot {{10}^{{ - 4}}} \cdot T \pm 0.005\,{\text{В}}{\text{.}}$Изменение условной стандартной энергии Гиббса при образовании трихлорида диспрозия из элементов рассчитывали по уравнению (9). Полученная зависимость описывается выражением (10):
(9)
$\Delta G_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{{\text{*}}} = nFE_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{{\text{*}}},$(10)
$\Delta G_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{{\text{*}}} = - 1135.1 + 0.197 \cdot T \pm 1.1\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}{\text{.}}$Полученные результаты обобщены в табл. 2.
Таблица 2.
Условные стандартные потенциалы пары Dy(III)/Dy и условная стандартная энергия Гиббса образования трихлорида диспрозия в расплавленном CsCl при разных температурах
| T, K | $E_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{*},\,\,{\text{B}}$ | $\Delta G_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{*},$ кДж/моль | $\Delta H_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{*},$ кДж/моль | $\Delta S_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{*},~$ Дж/моль |
|---|---|---|---|---|
| 963 | –3.255 ± 0.005 | –945.6 ± 1.1 | –1135.1 | 197.0 |
| 995 | –3.244 ± 0.005 | –939.2 ± 1.1 | ||
| 1023 | –3.225 ± 0.005 | –933.7 ± 1.1 | ||
| 1063 | –3.187 ± 0.005 | –925.9 ± 1.1 |
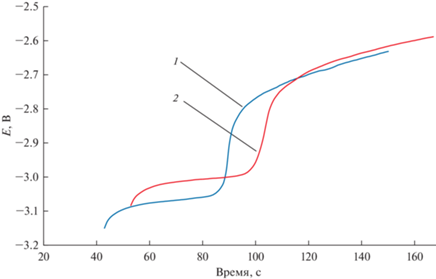
На рис. 4 представлены хронопотенциограммы расплава CsCl–DyCl3, снятые на молибденовом и галлиевом электродах при 965 K. На рис. 4 (1) приведена зависимость потенциал–время после кратковременной поляризации Ga электрода. Плато при потенциале –2.58 В отвечает равновесному потенциалу катодного продукта, т.е. сплаву Dy–Ga. В случае катодной поляризации инертного Mo электрода на хронопотенциограмме четко фиксируется плато, которое соответствует равновесному потенциалу пары Dy(III)/Dy, рис. 4 (2). Проведенные исследования показали, что величина деполяризации при разряде ионов диспрозия на галлиевом электроде находилась в диапазоне 0.50–0.55 В. Это связано с процессом сплавообразования при использовании активных катодов во время электролиза расплава.
Рис. 4.
Зависимости потенциал–время, снятые после кратковременной катодной поляризации Ga (1) и Mo (2) рабочего электрода в расплаве CsCl–DyCl3. m(DyCl3) = 2.57 мас. %. Т = 961 K. I = 25–75 мА; τ = 20–35 с. 1 – равновесный потенциал сплава Dy–Ga пары Dy(III)/Dy; 2 – равновесный потенциал пары Dy(III)/Dy.
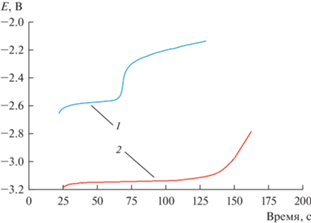
Значение равновесного стандартного потенциала сплава определяли методом потенциометрии при нулевом токе, рис. 4 (1). Для расчета условного стандартного потенциала сплава применяли уравнение Нернста:
(11)
${{E}_{{{\text{Me}}\left( {{\text{сплав}}} \right)}}} = E_{{{\text{Me}}\left( {{\text{сплав}}} \right)}}^{{{\text{*}}{\kern 1pt} {\text{*}}}} + \frac{{RT}}{{3F}}\ln \frac{{{{c}_{{{\text{M}}{{{\text{e}}}^{{3 + }}}}}}}}{{{{x}_{{{\text{Me}}\left( {{\text{сплав}}} \right)}}}}},$Изменение условных стандартных потенциалов сплавов в зависимости от температуры определяли с использованием Origin Pro версия 7.5. Полученные зависимости аппроксимируются линейным уравнением:
(12)
$E_{{{\text{Dy}}\left( {{\text{Ga}}} \right)}}^{{{\text{*}}{\kern 1pt} {\text{*}}}} = - \left( {3.069 \pm 0.005} \right) + \left( {3.2 \pm 0.2} \right) \cdot {{10}^{{ - 4}}} \cdot T \pm 0.006\,\,{\text{B}}.$Коэффициенты активности диспрозия в жидком галлиевом сплаве рассчитывали по уравнению (13) [21]. Его температурная зависимость описывается уравнением (14):
(13)
${\text{lg}}{{\gamma }_{{{\text{Dy}}\left( {{\text{Ga}}} \right)}}} = \frac{{nF}}{{{\text{2}}{\text{.303}}RT}}\left( {E_{{{{{\text{Dy}}\left( {{\text{III}}} \right)} \mathord{\left/ {\vphantom {{{\text{Dy}}\left( {{\text{III}}} \right)} {{\text{Dy}}}}} \right. \kern-0em} {{\text{Dy}}}}}}^{{\text{*}}} - E_{{{\text{Dy}} - {\text{Ga}}}}^{{{\text{*}}{\kern 1pt} {\text{*}}}}} \right),$(14)
${\text{lg}}{{\gamma }_{{{\text{Dy}}\left( {{\text{Ga}}} \right)}}} = 5.45 - \frac{{12{\kern 1pt} 905}}{T} \pm 0.14.{\text{\;}}$Низкие значения коэффициентов активности указывают на сильное взаимодействие между диспрозием и жидким галлием. Возрастание температуры приводило к упорядочению системы [22].
Избыточную парциальную энергию Гиббса для диспрозия в жидком галлии рассчитывали по уравнению (16) [21]:
(15)
$\Delta G_{{{\text{Dy}}\left( {{\text{Ga}}} \right)}}^{{\text{*}}} = \Delta H_{{{\text{Dy}}\left( {{\text{Ga}}} \right)}}^{{\text{*}}} - T\Delta S_{{{\text{Dy}}\left( {{\text{Ga}}} \right)}}^{{\text{*}}},$(16)
$\Delta G_{{{\text{Dy}}\left( {{\text{Ga}}} \right)}}^{{\text{*}}} = nFE_{{{\text{Dy}}\left( {{\text{Ga}}} \right)}}^{{\text{*}}},$(17)
$\Delta G_{{{\text{Dy}}\left( {{\text{Ga}}} \right)}}^{{\text{*}}} = - {\text{383}}{\text{.4}} + {\text{0}}{\text{.241}} \cdot T \pm {\text{2}}{\text{.5}}\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}.$Схема реакции образования интерметаллических соединений Dy–Ga может быть представлена следующим образом [23]:
(18)
$x{\text{Dy}} + 3x\bar {e} + y{\text{Ga}} = {\text{D}}{{{\text{y}}}_{x}}{\text{G}}{{{\text{a}}}_{y}}{\text{.}}$Термодинамические характеристики жидкого сплава Dy–Ga приведены в табл. 3.
Таблица 3.
Условные стандартные потенциалы сплава Dy–Ga, коэффициенты активности и термодинамические характеристики диспрозия в жидком галлии в расплавленном CsCl при разных температурах
| T, K | $E_{{{\text{Dy}} - {\text{Ga}}}}^{{**}},\,\,{\text{B}}$ | lg γDy–Ga | $\Delta G_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{*},$ кДж/моль | $\Delta H_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{*},~$ кДж/моль | $\Delta S_{{{\text{DyC}}{{{\text{l}}}_{3}}}}^{*},$ Дж/моль |
|---|---|---|---|---|---|
| 963 | –2.761 ± 0.006 | –7.95 | –151.9 ± 2.5 | –383.4 | 240.6 |
| 995 | –2.750 ± 0.006 | –7.52 | –143.7 ± 2.5 | ||
| 1023 | –2.741 ± 0.006 | –7.16 | –136.9 ± 2.5 | ||
| 1063 | –2.729 ± 0.006 | –6.69 | –127.8 ± 2.5 |
ВЫВОДЫ
Методами циклической, квадратно-волновой вольтамперометрии и потенциометрии при нулевом токе проведено исследование реакции катодного восстановления ионов Dy(III) до металла в расплаве CsCl в интервале температур 963–1063 K на молибденовом и галлиевом электродах. Установлен механизм катодного осаждения металлического диспрозия на инертном Mo электроде. Показано, что электродная реакция протекает необратимо, в одну стадию и контролируется скоростью переноса заряда. Определена температурная зависимость коэффициентов диффузии ионов диспрозия(III) и установлено, что она подчиняется закону Аррениуса. Рассчитана энергия активации процесса диффузии. Определена температурная зависимость условного стандартного потенциала пары Dy(III)/Dy. Рассчитаны основные термодинамические характеристики трихлорида диспрозия.
Установлено, что реакция электрохимического осаждения диспрозия на активном Ga электроде связана с процессом сплавообразования и протекает с деполяризацией. Измерены равновесные потенциалы сплава Dy–Ga и определена зависимость условного стандартного потенциала сплава от температуры. Предложена схема реакции образования интерметаллических соединений Dy–Ga. Рассчитаны коэффициенты активности и избыточная парциальная энергия Гиббса для диспрозия в жидком галлии.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-03-00743.
Список литературы
Yezhovska-Trshebiatowska B., Kopacz S., Mikulski T. Rare Elements. Warsaw: Polish Academy of Sciences, 1976.
Михайличенко А.И. Редкие металлы. М.: Металлургия, 1987.
Зеликман А.Н., Коршунов Б.Г. Металлургия редких металлов. М.: Металлургия. 1991.
Барабошкин А.Н. Электрокристаллизация металлов из расплавленных солей. М.: Наука, 1976.
Смирнов М.В. Электродные потенциалы в расплавленных хлоридах. М.: Наука, 1973.
Fujii T., Nagai T., Uehara A., Yamana H. Electronic absorption spectra of lanthanides in a molten chloride. III. Absorption characteristics of trivalent samarium, dysprosium, holmium, and erbium in various molten chlorides // J. Alloys Compd. 2007. 441. P. L10–L13.
Kouji Ya., Kobayashi S., Nohira T., Hagiwara R. Electrochemical formation of Dy–Ni alloys in molten NaCl–KCl–DyCl3 // Electrochim. Acta. 2013. 106. P. 293–300.
Yang Y., Zhang M., Han W., Sun P., Liu B., Jiang H., Jiang T., Peng S., Li M., Ye K., Yan Y. Selective electrodeposition of dysprosium in LiCl–KCl–GdCl3–DyCl3 melts at magnesium electrodes: Application to separation of nuclear wastes // Electrochim. Acta. 2014. 118. P. 150–156.
Su L.-L., Liu K., Liu Y.-L., Wang L., Yuan L.-Y., Wang L., Li Z.-J., Zhao X.-L., Chai Z.-F., Shi W.-Q. Electrochemical behaviors of Dy(III) and its co-reduction with Al(III) in molten LiCl–KCl salts // Electrochim. Acta. 2014. 147. P. 87–95.
Konishi H., Nohira T., Yto Y. Kinetics of DyNi2 film growth by electrochemical implantation // Electrochim. Acta. 2003. 48. P. 563–568.
Yasuda K., Kobayashi S., Nohira T., Hagiwara R. Electrochemical formation of Dy–Ni alloys in molten NaCl–KCl–DyCl3 // Electrochim. Acta. 2013. 106. P. 293–300.
Kobayashi S., Nohira T., Kobayashi K., Yasuda K., Hagiwara R., Oishi T., Konishi H. Electrochemical formation of Dy–Ni alloys in molten LiF–CaF2–DyF3 // J. Electrochem. Soc. 2012. 159. P. E193–E197.
Saïla A., Gibilaro M., Massot L., Chamelot P., Taxil P., Affoune A.M. Electrochemical behaviour of dysprosium(III) in LiF–CaF2 on Mo, Ni and Cu electrodes // J. Electroanal. Chem. 2010. 642. P. 150–156.
Castrillejo Y., Bermejo M.R., Barrado A.I., Pardo R., Barrado E., Martínez A.M. Electrochemical behavior of dysprosium in the eutectic LiCl–KCl at W and Al electrodes // Electrochim. Acta. 2005. 50. P. 2047–2057.
Yang Y., Zgang M., Han W., Sun P., Liu B., Jiang H., Jiang T., Peng S., Li M., Ye K., Yan Y. Selective electrodeposition of dysprosium in LiCl–KCl–GdCl3–DyCl3 melts at magnesium electrodes: Application to separation of nuclear wastes // Electrochim. Acta 2014. 118. P.150–156.
Li Z., Nang D., Meng S., Gu L., Dai Y., Liu Z. Electrolytic separation of Dy from Sm in molten LiCl–KCl using Pb-Bi eutectic alloy cathode // Separation and Purification Technology. 2021. 276. 119045.
Novoselova A., Smolenski V., Volkovich V.A. Electrochemical Behavior of Dysprosium in Fused LiCl–KCl Eutectic at Solid Inert Mo and Liquid Active Ga Electrodes // J. Electrochem. Soc. 2020. 167. 112510.
Smolenski V., Novoselova A. Electrochemical Separation of Uranium from Dysprosium in Molten Salt/Liquid Metal Extraction System // J. Electrochem. Soc. 2021. 168. 062505.
Novoselova A., Smolenski V., Volkovich V.A., Ryzhov A., Yan Y., Xue Y., Ma F. Speciation of dysprosium in molten LiCl–KCl–CsCl eutectic: An electrochemistry and spectroscopy study // J. Electroanal. Chem. 2022. 904. 115955.
Bard A.J, Faulkner L.R. Electrochemical Methods Fundamentals and Applications. N.Y.: John Wiley & Sons, 1980.
Лебедев В.А. Избирательность жидкометаллических электродов в расплавленных галогенидах. Челябинск: Металлургия, 1993.
Kaptay G. On the tendency of solutions to tend toward ideal solutions at high temperatures // Metall. Mater. Trans. A. 2012. 43. P. 531–543.
HSC Chemistry 6 Software, Outotec Research Oy (Pori, Finland).
Дополнительные материалы отсутствуют.