Расплавы, 2022, № 6, стр. 609-621
Термодинамическое моделирование реакции окисления UCl3 хлоридом свинца и восстановления UCl4 металлическим ураном в расплавленной эвтектике LiCl–KCl
А. М. Потапов a, *, В. А. Кесикопулос a, А. Е. Дедюхин a, Ю. П. Зайков a
a Институт высокотемпературной электрохимии УрО РАН
Екатеринбург, Россия
* E-mail: a.potapov_50@mail.ru
Поступила в редакцию 02.07.2022
После доработки 19.07.2022
Принята к публикации 28.07.2022
- EDN: VBSCDN
- DOI: 10.31857/S0235010622060111
Аннотация
Методами термодинамического моделирования рассчитан равновесный состав системы (LiCl–KCl)эвт + 1 мол. % UCl3 при его титровании хлоридом свинца при температурах 773, 873 и 973 K. Расчеты выполнены с учетом коэффициентов активности хлоридов свинца и урана в расплавленной эвтектике LiCl–KCl. При 773 K использовали коэффициенты активности γ(PbCl2) = 0.42; γ(UCl3) = 5.73 · 10–3 и γ(UCl4) = = 7.54 · 10–5. С увеличением температуры коэффициенты активности возрастают. Так, при 973 K коэффициенты активности уже γ(PbCl2) = 0.49; γ(UCl3) = 0.020 и γ(UCl4) = 3.04 · 10–4. Найдено, что в расплаве LiCl–KCl хлорид свинца лишь частично окисляет UCl3 до UCl4. Это связано с тем, что разница между условными стандартными потенциалами $E_{{{{{\text{P}}{{{\text{b}}}^{{2 + }}}} \mathord{\left/ {\vphantom {{{\text{P}}{{{\text{b}}}^{{2 + }}}} {{\text{Pb}}}}} \right. \kern-0em} {{\text{Pb}}}}}}^{*}$ и $E_{{{{{{{\text{U}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{{{\text{U}}}^{{4 + }}}} {{{{\text{U}}}^{{3 + }}}}}} \right. \kern-0em} {{{{\text{U}}}^{{3 + }}}}}}}^{*}$ всего около 0.2 B. Поэтому PbCl2 в данном случае является слабым окислителем. Разница между потенциалами $E_{{{{{\text{P}}{{{\text{b}}}^{{2 + }}}} \mathord{\left/ {\vphantom {{{\text{P}}{{{\text{b}}}^{{2 + }}}} {{\text{Pb}}}}} \right. \kern-0em} {{\text{Pb}}}}}}^{*}$ и $E_{{{{{{{\text{U}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{{{\text{U}}}^{{4 + }}}} {{{{\text{U}}}^{{3 + }}}}}} \right. \kern-0em} {{{{\text{U}}}^{{3 + }}}}}}}^{*}$ увеличивается с ростом температуры. Поэтому равновесная доля UCl4 возрастает с увеличением температуры и избытка PbCl2. Например, при 773 K и трехкратном от стехиометрии избытке PbCl2 средняя валентность урана n = 3.27. А при 973 K и том же избытке PbCl2, средняя валентность урана возрастает до n = 3.36. Также выполнено моделирование процесса восстановления UCl4 до UCl3 металлическим ураном в расплавленной эвтектике LiCl–KCl с учетом коэффициентов активности компонентов. В рассмотренном интервале, 773–973 K, восстановление не имеет термодинамических затруднений и протекает нацело. Для термодинамических расчетов был использован программный комплекс HSC-9.9.
ВВЕДЕНИЕ
Переработка отработавшего ядерного топлива сложный многостадийный процесс [1, 2]. Одной из стадий переработки является электрорафинирование, при котором металлический сплав, содержащий актиниды (U, Pu), благородные металлы (Ru Rh, Pd) и другие примеси, подвергают анодному растворению, переводя в расплав плутоний и большую часть урана. В результате этой операции остается пористый анодный остаток, в котором содержание благородных металлов уже сравнимо с содержанием урана [3, 4].
Для доизвлечения урана из анодных остатков предлагается их хлорировать в расплавленной эвтектике LiCl–KCl хлоридом свинца. Предполагается, что уран будет окисляться и переходить в расплав в виде UCl3, а благородные металлы останутся в неизменном виде. Однако, наряду с окислением урана до UCl3, возможна, по-видимому, побочная реакция окисления UCl3 до UCl4.
Целью настоящей работы является изучение процесса окисления трихлорида урана хлоридом свинца в расплавленной эвтектике LiCl–KCl методом термодинамического моделирования.
Были рассчитаны равновесные составы расплава (LiCl–KCl)эвт + 1 мол. % UCl3 при его титровании хлоридом свинца при температурах 773, 873 и 973 К.
Хлорид свинца является окислителем по отношению к UCl3:
(1)
$E_{{{{{\text{P}}{{{\text{b}}}^{{2 + }}}} \mathord{\left/ {\vphantom {{{\text{P}}{{{\text{b}}}^{{2 + }}}} {{\text{Pb}}}}} \right. \kern-0em} {{\text{Pb}}}}}}^{*} = - 1.300{\text{ В }}\left[ 5 \right]~\, > ~\,E_{{{{{{{\text{U}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{{{\text{U}}}^{{4 + }}}} {{{{\text{U}}}^{{3 + }}}}}} \right. \kern-0em} {{{{\text{U}}}^{{3 + }}}}}}}^{*} = - 1.448\,\,{\text{В}}\,\,\left[ 6 \right]$Предполагается, что если в системе уже нет металлического урана (свободного или в составе сплава), то при добавлении навесок PbCl2 к расплаву, содержащему UCl3, будет происходить ступенчатое окисление UCl3 до UCl4 согласно реакции:
(2)
${\text{UC}}{{{\text{l}}}_{3}} + 0.5{\text{PbC}}{{{\text{l}}}_{2}} = {\text{UC}}{{{\text{l}}}_{4}} + 0.5{\text{Pb,}}\,\,\,\,\Delta G = + 21.8\,\,{\text{кДж}}\,\,{\text{при}}\,\,773\,\,{\text{К}}{\kern 1pt} .$Положительное изменения энергии Гиббса указывает на то, что реакция не идет в прямом направлении. Однако, в этом расчете по умолчанию коэффициенты активности веществ были приняты равными единице. Для более точного моделирования следует учесть коэффициенты активности ионов вследствие их участия в комплексообразовании.
КОЭФФИЦИЕНТЫ АКТИВНОСТИ PbCl2, UCl3 И UCl4 В РАСПЛАВЛЕННОЙ ЭВТЕКТИКЕ LiCl–KCl
Хорошо известно, что ионы поливалентных металлов в растворах, включая расплавленные соли, связываются в комплексы, в результате чего их активность существенно понижается по сравнению с их концентрацией [7, 8]. Этот факт необходимо обязательно учитывать, так как термодинамические уравнения строго выполняются именно для активностей.
Коэффициент активности PbCl2 в расплаве LiCl–KCl
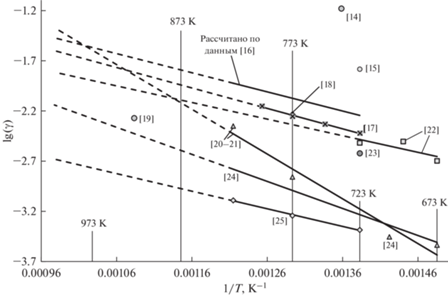
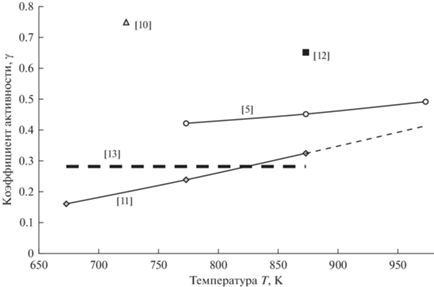
Ионный потенциал катиона (отношение заряда к радиусу) Pb2+ равен 2/0.119 = 16.8 нм–1. Ионные потенциалы Li+ и K+ равны 1/0.076 = 13.2 и 1/0.138 = 7.25 нм–1, соответственно. Здесь и далее радиусы по [9]. Ионный потенциал катиона свинца лишь немного превышает ионный потенциал катиона лития, поэтому в расплаве LiCl–KCl ионы Pb2+ является слабыми комплексообразователями. Имеющиеся в литературе данные по коэффициентам активности PbCl2 сопоставлены на рис. 1. Для расчетов мы используем данные [5], которые до сих пор остаются наиболее подробными и систематическими.
Рис. 1.
Коэффициенты активности PbCl2 в расплавленной эвтектике LiCl–KCl по данным разных авторов. Коэффициент активности [12] найден экстраполяцией данных рисунка Fig. 9 в этой статье и поэтому весьма неточен. Коэффициенты активности [13] найдены из рисунков Fig. C-1. Эти коэффициенты оказались температурно-независимыми. Их можно рассматривать как очень ориентировочные.
Коэффициент активности UCl3 в расплаве LiCl–KCl
Катион U3+ является сильным комплексообразователем, так как значения его ионного потенциала 3/0.103 = 29.1 нм–1 превышает ионный потенциал катиона Li+ более чем вдвое. В литературе имеется большое количество публикаций, в которых коэффициенты активности UCl3 либо рассчитаны, либо их можно рассчитать с использованием приводимых данных [14–31]. Эти данные сопоставлены на рис. 2. Кроме того, часть существенно отличных данных собрана в табл. 1. Как видно из рисунка, данные противоречивы. Так, например, по данным [20, 21] γ(UCl3) = 1.39 · 10–3 (1173 K), а по данным [25] γ(UCl3) = 5.7 · 10–4 (1173 K). Обе работы современные и результаты выглядят одинаково достоверными.
Таблица 1.
Коэффициенты активности UCl3 в расплавленной эвтектике LiCl–KCl. Данные, которые сильно отличаются от приведенных на рис. 2
Если же сопоставить все имеющиеся данные, то расхождения достигают четыре порядка величины.
Мы будем использовать данные работы [17], т.к. эти данные самые новые и потому, что они согласуются с упомянутыми работами [20, 21, 25].
Коэффициент активности UCl4 в расплаве LiCl–KCl
Ионный потенциал катиона U4+ равен 4/0.089 = 44.9 нм–1. Эта величина в 3.4 раза больше ионного потенциала иона Li+ и в полтора раза больше ионного потенциала U3+. То есть этот катион в расплаве LiCl–KCl является очень сильным комплексообразователем. Его коэффициент активности должен быть существенно меньше коэффициента активности U3+. Можно априорно записать:
(3)
$\gamma ({\text{UC}}{{{\text{l}}}_{4}}) < \gamma ({\text{UC}}{{{\text{l}}}_{3}}) \sim {{10}^{{ - 3}}}.$Литературные данные по γ(UCl4) в расплавленной эвтектике LiCl–KCl собраны в табл. 2.
Таблица 2.
Коэффициенты активности UCl4 в расплавленной эвтектике LiCl–KCl по данным разных авторов
| γ(UCl4) | ||||
|---|---|---|---|---|
| Источник | 673 К | 773 К | 873 К | 973 К |
| Kisza, 1964 [28] | 3.17 · 10–2 | 2.76 · 10–2 | 2.68 · 10–2* | 2.55 · 10–2* |
| Martinot, 1975 [24] | 4.48 · 10–7 | 2.20 · 10–6 | 7.52 · 10–6 | 2.00 · 10–5 |
| Chiotti, 1975 [31] | 3.6 · 10–5* | 1 · 10–4 | 2 · 10–4 | 4.00 · 10–4 |
| Смирнов, 1979 [32 ] | 2.76 · 10–5* | 7.54 · 10–5 | 1.64 · 10–4 | 3.04 · 10–4 |
| Masset, 2005 [20, 21] | 1.71 · 10–2 | 1.48 · 10–2 | 1.22 · 10–2* | 1.08 · 10–2* |
| Xu, 2020 [33 ] | 4.06 · 10–12 | 3.26 · 10–10 | 9.53 · 10–9 | 1.39 · 10–7* |
| Xu, 2022 [34 ] | 0.981 | 0.986 | 0.989* | 0.991* |
Данные, приводимые в статьях [20, 21] γ(UCl3) = 0.00139 и γ(UCl4) = 0.0148 (оба 773 К), не рассматривали, т.к. они не удовлетворяют неравенству (3).
Для проведения моделирования были выбраны значения коэффициентов активности UCl4, рассчитанные нами по данным [32 ] . Они удовлетворяют неравенству (3) и практически совпадают с данными Chiotti [31].
РАВНОВЕСНЫЙ СОСТАВ СИСТЕМЫ (LiCl–KCl)эвт + 1 мол. % UCl3 ПРИ ЕЕ ТИТРОВАНИИ ХЛОРИДОМ СВИНЦА
Исходные данные
Расчет равновесных составов был выполнен с использованием программного комплекса HSC-9.9 [35 ] . Исходные данные для моделирования собраны в табл. 3.
Результаты моделирования
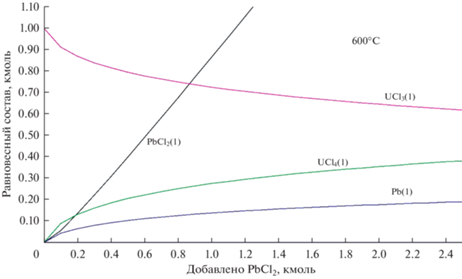
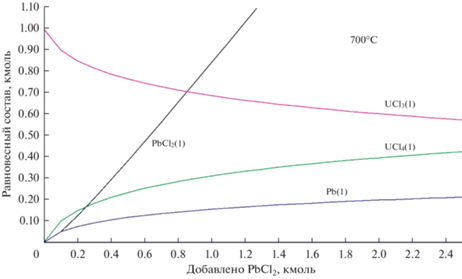
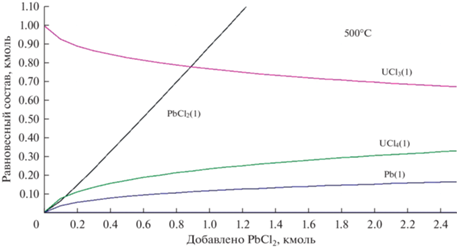
На рис. 3–5 показан равновесный состав смеси (LiCl–KCl)эвт + 1 мол. % UCl3 при ее титровании хлоридом свинца при 773, 873 и 973°C соответственно. При всех температурах по мере добавления PbCl2 доля UCl4 возрастает, а доля UCl3, соответственно, уменьшается. Хлорид свинца расходуется на окисление UCl3 лишь частично, то есть реакция (2) протекает не полностью. Большая часть PbCl2 накапливается в расплаве. Прореагировавшая часть PbCl2 дает пропорциональное количество металлического свинца. При рассматриваемых температурах свинец жидкий (Tm(Pb) = 600 K). В системе накапливается жидкая металлическая фаза, которая не смешивается с солевым расплавом. После добавления стехиометрического (по реакции (2)) количества PbCl2 при 773 K окисляется около 7% UCl3, при 873 K – 14%, при 973 K – 14%. При трехкратном избытке PbCl2 результат аналогичный.
Рис. 3.
Равновесный состав смеси (LiCl–KCl)эвт + 1 мол. % UCl3 при ее титровании хлоридом свинца при 773 K.
РАВНОВЕСНЫЙ СОСТАВ СИСТЕМЫ (LiCl–KCl)эвт + 1 мол. % UCl4 ПРИ ТИТРОВАНИИ МЕТАЛЛИЧЕСКИМ УРАНОМ
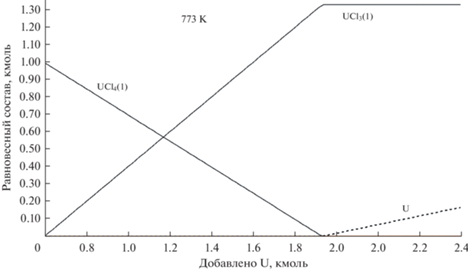
Было также проведено моделирование обратного процесса. В расплавленную эвтектику LiCl–KCl, содержащую 1 мол. % UCl4, добавляли порциями металлический уран. Фактически это то же самое, как если бы в этот расплав опустили стержень из металлического урана. Протекает реакция:
(4)
${\text{UC}}{{{\text{l}}}_{4}} + 0.333{\text{U}} = 1.333{\text{UC}}{{{\text{l}}}_{3}},\,\,\,\,\Delta G = - 130\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}},\,\,{\text{при}}\,\,773\,\,{\text{K}}.$В этой реакции изменение энергии Гиббса рассчитано без учета влияния среды, т.е. коэффициенты активности всех веществ принимались равными единице. Для уточнения результатов было выполнено термодинамическое моделирование равновесного состава расплава (LiCl–KCl)эвт + 1 мол. % UCl4 при его титровании металлическим ураном. Использовали коэффициенты активности UCl3 и UCl4 приведенные в табл. 3. На рис. 7 показан результат моделирования при 773 K. При 873 и 973 K получается совершенно аналогичная картина. Восстановление UCl4 до UCl3 происходит строго пропорционально количеству добавленного урана, согласно уравнению (4). Избытка урана не требуется.
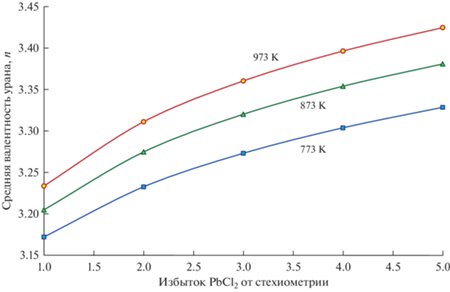
Рис. 6.
Средняя валентность урана в зависимости от избытка PbCl2 и температуры по данным термодинамического моделирования. Избыток PbCl2 – это отношение количества добавленного PbCl2 к стехиометрическому количеству по уравнению (2).
ОБСУЖДЕНИЕ
Причиной неполного окисления UCl3 по реакции (2) является образующийся в ходе этой реакции восстановитель – металлический свинец. Реакция идет до выравнивания потенциалов:
(5)
${{E}_{{{{{\text{U(IV)}}} \mathord{\left/ {\vphantom {{{\text{U(IV)}}} {{\text{U(III)}}}}} \right. \kern-0em} {{\text{U(III)}}}}}}}{\text{\;}} = {{E}_{{{{{\text{Pb(II)}}} \mathord{\left/ {\vphantom {{{\text{Pb(II)}}} {{\text{Pb}}}}} \right. \kern-0em} {{\text{Pb}}}}}}}.$При добавлении хлорида свинца в расплав (LiCl–KCl)эвт + 1 мол. % UCl3 выделяется свинец, то есть появляется фаза металлического свинца. Потенциал такой системы определяется парой Pb2+/Pb, в соответствии с выражением (6):
(6)
$E = E_{{{{{\text{P}}{{{\text{b}}}^{{2 + }}}} \mathord{\left/ {\vphantom {{{\text{P}}{{{\text{b}}}^{{2 + }}}} {{\text{Pb}}}}} \right. \kern-0em} {{\text{Pb}}}}}}^{*} + \frac{{RT}}{{2F}}{\text{ln}}\left[ {{\text{PbC}}{{{\text{l}}}_{2}}} \right],$Этот потенциал определяет отношение концентраций U(IV)/U(III) в соответствии с выражением (7):
(7)
$E_{{{{{\text{P}}{{{\text{b}}}^{{2 + }}}} \mathord{\left/ {\vphantom {{{\text{P}}{{{\text{b}}}^{{2 + }}}} {{\text{Pb}}}}} \right. \kern-0em} {{\text{Pb}}}}}}^{*} + \frac{{RT}}{{2F}}{\text{ln}}\left[ {{\text{PbC}}{{{\text{l}}}_{2}}} \right] = E_{{{{{{{\text{U}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{{{\text{U}}}^{{4 + }}}} {{{{\text{U}}}^{{3 + }}}}}} \right. \kern-0em} {{{{\text{U}}}^{{3 + }}}}}}}^{*} + \frac{{RT}}{F}{\text{ln}}\frac{{\left[ {{\text{UC}}{{{\text{l}}}_{4}}} \right]}}{{\left[ {{\text{UC}}{{{\text{l}}}_{3}}} \right]}}.$Чем больше концентрация PbCl2, тем больше доля UCl4.
Разница между потенциалами $E_{{{{{\text{P}}{{{\text{b}}}^{{2 + }}}} \mathord{\left/ {\vphantom {{{\text{P}}{{{\text{b}}}^{{2 + }}}} {{\text{Pb}}}}} \right. \kern-0em} {{\text{Pb}}}}}}^{*}$ и $E_{{{{{{{\text{U}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{{{\text{U}}}^{{4 + }}}} {{{{\text{U}}}^{{3 + }}}}}} \right. \kern-0em} {{{{\text{U}}}^{{3 + }}}}}}}^{*}$ невелика. Так при 773 K $E_{{{{{\text{P}}{{{\text{b}}}^{{2 + }}}} \mathord{\left/ {\vphantom {{{\text{P}}{{{\text{b}}}^{{2 + }}}} {{\text{Pb}}}}} \right. \kern-0em} {{\text{Pb}}}}}}^{*}$ = = –1.300 B, a $E_{{{{{{{\text{U}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{{{\text{U}}}^{{4 + }}}} {{{{\text{U}}}^{{3 + }}}}}} \right. \kern-0em} {{{{\text{U}}}^{{3 + }}}}}}}^{*}$ = –1.507 B. При 973 K $E_{{{{{\text{P}}{{{\text{b}}}^{{2 + }}}} \mathord{\left/ {\vphantom {{{\text{P}}{{{\text{b}}}^{{2 + }}}} {{\text{Pb}}}}} \right. \kern-0em} {{\text{Pb}}}}}}^{*}$ = –1.187 B [5], a $E_{{{{{{{\text{U}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{{{\text{U}}}^{{4 + }}}} {{{{\text{U}}}^{{3 + }}}}}} \right. \kern-0em} {{{{\text{U}}}^{{3 + }}}}}}}^{*}$ = –1.465 B [36 ] . Разница составляет 0.207 B при 773 K и 0.278 B при 973 К. Поэтому PbCl2 является слабым окислителем для UCl3. Разница потенциалов увеличивается с ростом температуры и соответственно увеличивается доля четырехвалентного урана.
Формально, причина более глубокого протекания реакции окисления при более высокой температуре связана с разной температурной зависимостью потенциалов трех- и четырехвалентного урана.
Повышение температуры приводит к диссоциации комплексов. Ион-комплексообразователь, U3+ или U4+, становится более свободным, его коэффициент активности увеличивается. Однако более прочные комплексы четырехвалентного урана диссоциируют в меньшей степени, чем менее прочные комплексы трехвалентного урана. В результате коэффициент активности UCl3 снижается более существенно, чем коэффициент активности UCl4, что приводит к сдвигу равновесия реакции (2) вправо.
В реакции (4) потенциалы окислителя и восстановителя равны $E_{{{{{{{\text{U}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{{{\text{U}}}^{{4 + }}}} {{{{\text{U}}}^{{3 + }}}}}} \right. \kern-0em} {{{{\text{U}}}^{{3 + }}}}}}}^{*}$ = –1.507 B и $E_{{{{{{{\text{U}}}^{{3 + }}}} \mathord{\left/ {\vphantom {{{{{\text{U}}}^{{3 + }}}} {\text{U}}}} \right. \kern-0em} {\text{U}}}}}^{*}$ = –2.514 B при 773 K и $E_{{{{{{{\text{U}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{{{\text{U}}}^{{4 + }}}} {{{{\text{U}}}^{{3 + }}}}}} \right. \kern-0em} {{{{\text{U}}}^{{3 + }}}}}}}^{*}$ = –1.465 B [36 ] и $E_{{{{{{{\text{U}}}^{{3 + }}}} \mathord{\left/ {\vphantom {{{{{\text{U}}}^{{3 + }}}} {\text{U}}}} \right. \kern-0em} {\text{U}}}}}^{*}$ = –2.406 B при 973 K [36 ] . Разница составляет 1.007 B при 773 K и 0.941 B при 973 K. При столь большой разнице потенциалов окислителя и восстановителя, реакция (4) протекает нацело. Тот факт, что разница уменьшается с температурой ничего не меняет, т.к. она остается значительной.
С термодинамической точки зрения, изменение энергии Гиббса при протекании реакции (4) ΔG ~ –130 кДж/моль вполне достаточно для протекания реакции нацело.
ВЫВОДЫ
Проведено термодинамическое моделирование реакции окисления трихлорида урана в расплавленной эвтектике LiCl–KCl хлоридом свинца. Установлено, что хлорид свинца частично окисляет UCl3 до UCl4. Глубина протекания зависит от избытка PbCl2 и температуры.
Хлорид свинца является слабым окислителем для UCl3. При 773 K при добавлении стехиометрического количества PbCl2 окисляется до UCl4 лишь 7% от исходного количества UCl3. С повышением температуры степень окисления увеличивается и при 973 K достигает ~12%. Избыток окислителя также увеличивает долю UCl4. Так, при пятикратном (от стехиометрии) избытке PbCl2 доля UCl4 достигает ~42% (973 K).
Термодинамическое моделирование восстановления тетрахлорида урана при помощи металлического урана показало, что реакция протекает нацело, в соответствии с уравнением реакции.
Список литературы
Potapov A., Karimov K., Mazannikov M., Shishkin V., Zaykov Y. Opening of nitride spent nuclear fuel // TECHNOGEN-2019. IV Congress “Fundamental research and applied developing of recycling and utilization processes of technogenic formations”. 2020. P. 7.
Zaykov Yu.P., Mochalov Yu.S., Khokhlov V.A., Shishkin V.Yu., Potapov A.M., Kovrov V.A., Gerasimenko M.N., Zhidkov A.S., Terent’ev S.G. Pyrochemical recycling of the nitride SNF of fast neutron reactors in molten salts as a part of the short-circuited nuclear fuel cycle. Fast reactors and related fuel cycles: next generation nuclear systems for sustainable development // FR17 Proceedings of an International Conference. Yekaterinburg. 2017. P. 4.
Galashev A.Y. Processing of fast neutron reactor fuel by electrorefining: Thematic overview // Int. J. Energy Res. 2021. 45. P. 11459–11478.
Iizuka M., Moriyama H. Analyses of anodic behavior of metallic fast reactor fuel using a multidiffusion layer model // J. Nucl. Sci. Techn. 2010. 47. № 12. P. 1140–1154.
Yang L., Hudson R.G. Equilibrium electrode potentials of some metal-chlorine galvanic cells and activities of some metal chlorides in LiCl–KC1 eutectic melt // Trans. Met. Soc. AIME. 1959. 215. P. 589–601.
Hoover R.O., Shaltry M.R., Martin S., Sridharan K., Phongikaroon S. Electrochemical studies and analysis of 1–10 wt. % UCl3 concentrations in molten LiCl–KCl eutectic // J. Nucl. Mat. 2014. 452. № 1–3. P. 389–396.
Смирнов M.B. Электродные потенциалы в расплавленных хлоридах. M.: Наука, 1973.
Смирнов M.B., Кудяков B.Я. Термодинамическая активность тетрахлорида циркония, растворенного в расплавах хлоридов щелочных металлов, магния и стронция // Труды Института электрохимии. 1970. № 14. С. 32–37.
Shannon R.D. Revised effective ionic radii and systematic studies of interatomie distances in halides and chaleogenides // Acta crystallogr. 1976. A32. № 5. P. 751–767.
Laintinen H.A., Liu C.H. An electromotive force series in molten lithium chloride-potassium chloride eutectic // J. American Chemical Society. 1957. 80. № 5. P. 1015–1020.
Takahashi M. On the chemical properties of the fused PbCl2 (l) – [LiCl–KCl(s)] (l) system and the single electrode potential of Pb(l)/PbCl2(l) electrode (1. 400 ~ 600°C) // J. Electrochemical Society of Japan. 1957. 25. № 9. P. 481–486.
Hino M., Kelly M.G., Toguri J.M. Activities of lead chloride in molten PbCl2–KCl–NaCl and PbCl2–KCl–LiCl ternary systems // Canadian Metallurgical Quarterly. 1990. 29. № 3. P. 177–184.
Skeaff J.M., Bale C.W., Pelton A.D., Thompson W.T. Selection of ternary fused chlorides for the electrowinning of lead and zinc based on calculated thermodynamic properties // CANMET Rep. 1979.
Inman D., Hills G.J., Young L., Bockris J.O’M. Electrode reactions in molten salts: The uranium + + uranium trichloride system // Trans. Faraday Soc. 1959. 55. Р. 1904–1914.
Zhou W., Zhang J. Direct calculation of concentration-dependent activity coefficient of UCl3 in molten LiCl–KCl // J. Electrochem. Soc. 2015. 162. P. E199–E204.
Shirai O., Uozumi K., Iwai T., Arai Y. Electrode reaction of the U3+/U couple at liquid Cd and Bi electrodes in LiCl–KCl eutectic melt // Analyt.Sci. 2001. 17. P. I959–I962.
Yoon D., Phongikaroon S. Measurement and analysis of exchange current density for U/U3+ reaction in LiCl–KCl eutectic salt via various electrochemical techniques // Electrochimica Acta. 2017. 227. P. 170–179.
Koyama T., Johnson T.R., Fischer D.F., Distribution of actinides in molten chloride salt/cadmium metal systems // J. Alloys and Compounds. 1992. 189. P. 37–44.
Fukasawa K., Uehara A., Nagai T., Sato N., Fujii T., Yamana H. Thermodynamic properties of trivalent lanthanide and actinide ions in molten mixtures of LiCl and KCl // J. Nuclear Materials. 2012. 424. P. 17–22.
Masset P., Konings R.J.M., Malmbeck R., Serp J., Glatz J.P. Thermochemical properties of lanthanides (Ln = La, Nd) and actinides (An = U, Np, Pu, Am) in the molten LiCl–KCl eutectic // J. Nuclear Materials. 2005. 344. P. 173–179.
Masset P., Bottomley D., Konings R., Malmbeck R., Rodrigues A., Serp J., Glatz J.P. Electrochemistry of uranium in molten LiCl–KCl eutectic // J. Electrochem. Soc. 2005. 152. № 6. P. A1109–A1115.
Roy J.L., Grantham L.F., Grimmet D.L., Fusselman S.P., Krueger C.L., Storvick T.S., Inoue T., Sakamura Y., Takahashi N. Thermodynamic properties of U, Np, Pu, and Am in molten LiCl–KCI eutectic and liquid cadmium // J. Electrochem. Soc. 1996. 143. № 8. 2487.
Gruen D.M., Osteryoung R.A. Measurement of the uranium–uranium(III) potential in LiCl–KCl eutectic // Ann. N.Y. Acad. Sci. 1960. 79. P. 897–907.
Martinot L. Some thermodynamic properties of dilute of actinide chlorides in (Li–K)Cl and in (Na–K)Cl eutectics // J. Inorg. Nucl. Chem. 1975. 37. P. 2525–2528.
Kuznetsov S.A., Hayashi H., Minato K., Gaune-Escard M. Electrochemical transient techniques for determination of uranium and rare-earth metal separation coefficients in molten salts // Electrochim. Acta. 2006. 51. P. 2463–2470.
Inman D., Bockris J.O’M. The reversible electrode potential of the system U/UCl3 in molten chloride solvents // Canadian J. Chem. 1961. 39. № 5. P. 1161–1163.
Kisza A., Trzebiatowski W. Termodynamic properties of uranium(III) chloride in diluted solutions of the melted eutectic mixture LiCl–KCl // Bull. Acad. Pol. Sci. Ser. Phys. Chem. 1962. 10. P. 387–393.
Kisza A. Thermodynamic properties of uranium(IV) chloride in diluted fused eutectic LiCl–KC1 solutions // Bull. Acad. Pol. Sci. Ser. Phys. Chem. 1964. 12. № 3. P. 177–182.
Knacke O., Krahe J., Muller F. Anodic polarization of UCl3 in the melt LiCl–KCl // Phys. Chem. Neue Folge. 1966. 50. P. 91–104.
Смирнов М.В., Алексеев В.Н., Комаров В.Е. Равновесные потенциалы урана в расплавленных хлоридах щелочных металлов // ВИНИТИ. 1970. № 2011-70Деп.
Chiotti P., Jha M. C., Tschetter M.J. Reaction of thorium and ThCl4 with UO2 and (Th, U)O2 in fused chloride salts // J. Less-Common Metals. 1975. 42. P. 141–161.
Смирнов M.B., Кудяков B.Я., Комаров B.E., Салюлев A.Б. Равновесный электродный U(IV)–U и окислительно-востановительный U(IV)–U(III) потенциалы в среде расплавленных хлоридов щелочных металлов // Электрохимия. 1979. 15. № 2. С. 269–272.
Xu M., Smolenski V., Liu Q., Novoselova A., Jiang K., Yu J., Liu J., Chen R., Zhang H., Zhang M., Wang J. Thermodynamics, solubility and the separation of uranium from cerium in molten In/3LiCl–2KCl system // J. Electrochem. Soc. 2020. 167. P. 136506.
Xu H., Zhang W., Wang C., Yang M., Yan T., Yan Y., Zhang M. Molten salt/liquid metal extraction: Electrochemical behaviors and thermodynamics properties of La, Pr, U and separation factors of La/U and Pr/U couples in liquid gallium cathode // Applied Radiation and Isotopes. 2022. 182. P. 110149.
Roine A. HSC Chemistry [Software], Outotec, Pori. 2018. URL: www.outotec.com/HSC.
Kuznetsov S.A., Hayashi H., Minato K., Gaune-Escard M. Electrochemical behavior and some thermodynamic properties of UCl4 and UCl3 dissolved in a LiCl–KCl eutectic melt // J. Electrochem. Soc. 2005. 152. № 4. P. C203–C212.
Дополнительные материалы отсутствуют.