Растительные ресурсы, 2019, T. 55, № 1, стр. 85-101
Закономерности экотопического распределения сосудистых растений в импактной зоне медеплавильного комбината (Карабаш, южный Урал)
Е. В. Коротеева 1, *, Е. И. Вейсберг 1
1 Ильменский государственный заповедник
Челябинская область, г. Миасс, Россия
* E-mail: leschka60@gmail.com
Поступила в редакцию 22.01.2018
После доработки 29.06.2018
Принята к публикации 06.09.2018
Аннотация
Проанализирована локальная флора сосудистых растений в зоне аэрального переноса Карабашского медеплавильного комбината, где основными техногенными факторами являются загрязнение грунта тяжелыми металлами и его закисление. Показана значительная степень трансформации флоры по сравнению с флорой контрольного участка в Ильменском государственном заповеднике с остепненными сосново-лиственничными редкостойными лесами и реликтовыми горными степями, характерными для выходов серпентинитов на Южном Урале. Выявлена неравномерность распределения видов на исследованном полигоне, обусловленная гетерогенностью среды, связанной главным образом с естественными факторами (геоморфология, эдафические условия). Формирование структуры флористических комплексов различных местообитаний происходит путем реализации различных жизненных стратегий видов, что подтверждается сравнительным анализом структуры флористических компонентов. Влияние техногенного загрязнения выражается в уменьшении числа видов в градиенте содержания тяжелых металлов в субстрате и его кислотности.
Техногенное воздействие в настоящее время является одним из основных антропогенных факторов, влияющих на динамику природных сообществ. Район города Карабаша (Челябинская обл.) служит примером экологических катастроф, связанных с промышленным производством. Импактная зона Карабашского медеплавильного комбината (КМК) охватывает более 35 км2. Загрязнение среды, связанное с медеплавильным производством, обусловлено поступлением газообразных, жидких и твердых отходов [1]. Работа предприятия с начала XX в. привела к значительной деградации природных сообществ на прилегающей территории вплоть до образования техногенных пустошей. В значительной степени токсическое воздействие на природные сообщества территории обусловлено газово-пылевыми выбросами. Газообразные отходы предприятия на 98% состоят из сернистого газа – источника кислотного загрязнения. Пылевая составляющая дымов содержит комплекс тяжелых металлов. Вследствие преобладания ветров юго-западных направлений обширная территория в 15 км2 к северо-востоку от предприятия пострадала от воздействия этого деструктивного фактора.
На ультраосновных породах, распространенных на исследованной территории, создаются специфические условия, связанные с химизмом грунта. Участки с хорошо развитым почвенным покровом заняты зональной растительностью, в местах выходов серпентинитов формируется так называемая серпентинитовая флора. Ее своеобразие, отмеченное в работах по различным регионам, определяется особенностями состава подстилающих пород в совокупности с климатическими факторами. Эдафические условия в таких местообитаниях считаются стрессовыми: к ним способно адаптироваться ограниченное число аборигенных видов, и этим обусловлено невысокое флористическое богатство местообитаний на выходах ультраосновных пород [2–4].
Примером могут служить Демидовские сопки, расположенные на территории Ильменского государственного заповедника (ИГЗ) на расстоянии 44 км от г. Карабаша, где признаков загрязнения не наблюдается [5]. Для них характерны интрозональные сообщества остепненных сосново-лиственничных редколесий и реликтовых горных степей [6, 7]. Большинство видов растений, произрастающих здесь, являются типичными для подобных местообитаний в Уральском регионе и обладают механизмами устойчивости к повышенному содержанию тяжелых металлов, характерному для подстилающих пород [8]. В зоне аэрального загрязненения КМК неблагоприятные условия, связанные с естественными факторами, усугубляются дополнительным загрязнением тяжелыми металлами и воздействием закисления.
Большинство предыдущих исследований в зоне влияния КМК касаются особенностей накопления поллютантов в субстрате и ответной реакции представителей различных таксономических групп организмов на токсикологическую нагрузку. Меньше внимания уделено изучению растительных сообществ и зависимости их пространственного распределения от комплекса антропогенных и природных факторов. Реакция лесной растительности окрестностей г. Карабаша на промышленное загрязнение изучалась Т.В. Черненьковой [9]. Авторами в предыдущих работах отражены некоторые характеристики состояния травянистых растительных группировок зоны импакта КМК [10]. В данной работе представлены результаты исследования структуры локальной флоры в зоне максимального аэрального загрязнения, связанного с медеплавильным производством.
Цель исследований – анализ локальной флоры сосудистых растений, ее компонентной структуры и особенностей распределения экологических, ценотических групп и видов разных жизненных форм по типам местообитаний и в зависимости от уровня загрязнения в импактной зоне Карабашского медеплавильного комбината.
МАТЕРИАЛ И МЕТОДЫ
Исследования проводились в непосредственной близости от основного производства КМК, на хребте горы Золотой, представляющем гипербазитовый массив сложного морфологического и геологического строения, состоящий в основном из серпентинитов [1]. Согласно ботанико-географическому районированию [11], эта территория относится к району светлохвойных лесов восточных предгорий Южного Урала. Полигон исследований вытянут с северо-востока на юго-запад и ограничен следующими координатами: 55.490738° N, 60.244049° E; 55.451805° N, 60.214149° Е; 55.442840° N, 60.243551° Е; 55.482258° N, 60.283767° Е. Его площадь составила около 6 км2. Растительность представлена в основном разреженными группировками с небольшим покрытием грунта. В средних и верхних частях склонов в составе многовидовых растительных группировок представлены скально-петрофитно-степные ксеромезофиты и опушечно-лесные и луговые мезофиты (Scorzonera glabra Rupr., Lactuca tatarica (L.) C.A. Mey., Silene amoena L., Elytrigia reflexiaristata (Nevski) Nevski, E. repens (L.) Nevski, Eremogone micradenia L., Sanguisorba officinalis L., Seseli libanotis (L.) Koch. и др.). Нижние части западных склонов, расположенные с наветренной стороны от источника загрязнения, заселены несомкнутыми маловидовыми мезофитными растительными группировками, состоящими из злаков Calamagrostis arundinacea L. (Rotch.), Elytrigia repens, E. intermedia (Host) Nevski с участием Lactuca tatarica, Silene amoena. Только подошва западного склона, примыкающая к селитебной и промышленной зоне, заселена разнотравными синантропизированными многовидовыми растительными группировками с доминированием Calamagrostis epigeios L. (Rotch.), Poa angustifolia L., P. pratensis L., Elytrigia repens, Tussilago farfara L., Polygonum aviculare L., Potentilla anserina L., P. supinа L., Equisetum arvense L.
Древесные растения и кустарники представлены редкими или единичными угнетенными экземплярами Pinus sylvestris L., Betula pendula Roth., Populus tremula L., P. nigra L., Chamaecytisus ruthenicus (Fisch. ex Wolosz.) Klaskova, Salix cinerea L., S. bebbiana Sarg., Cotoneaster melanocarpus Fisch. ex Blytt на подветренных склонах хребта, а так же в нижних частях склонов любой экспозиции. О наличии древостоев в прошлом свидетельствуют сохранившиеся в ложбинах пни сосны (Pinus sylvestris) и лиственницы (Larix archangelica Laws.).
Ранее методом кластерного анализа с применением индекса сходства Чекановского–Съеренсена для количественных данных был обработан массив геоботанических описаний, собранных на исследуемой территории и охватывающих разнообразие ее условий [10]. На этом основании были выделены следующие типы местообитаний (табл. 1): a – полоса, прилегающая к долине р. Сак-Елга, к промышленной и жилой зонам с немногочисленными сохранившимися участками почв с нарушенными горизонтами; b – нижние и средние части западных склонов хребта, расположенные с наветренной стороны от источника эмиссии, сложенные незакрепленными глинистыми или каменисто-глинистыми грунтами и пересеченные оврагами глубиной до 2 м; c – вершины и верхние части крутых склонов с понижениями и наносами делювиального грунта; d – высокие каменистые вершины и прилегающие к ним крутые каменистые осыпи; e – средние и верхние части склонов, в основном восточной экспозиции, а также невысокие вершины с глинисто-щебнистым субстратом, с фрагментами деградированных почв на выровненных участках; f – нижние пологие части восточных склонов, со щебнистым субстратом и фрагментарными деградированными почвами в ложбинах. Растительные группировки, приуроченные к местообитаниям, различающимся по положению в рельефе, почвенным и гидрологическим условиям, формируются в широком диапазоне уровня загрязнения (табл. 1).
Таблица 1.
Характеристика типов местообитаний в зоне аэрального загрязнения Карабашского медеплавильного комбината Table 1. Characteristics of habitat types in the zone of aerial pollution by Karabash copper smelting plant
| Тип
местообитания Habitat types |
H, м | α/exp | KI | pH | N | S, % | L, м |
|---|---|---|---|---|---|---|---|
| a | 280–370 | – | 45.1–174 | 4.5–5.5 | 71 | 70 | 2043 ± 258 (836–4424) |
| b | 400–430 | 5–10°/З, В 5–10°/W, E |
42.7–203 | 4.5–5.2 | 39 | 5 | 2088 ± 286 (436–4554) |
| c | 450–500 | 25°/В, вершины 25°/E, tops |
24.8–55.8 | 2.9–5.5 | 22 | 12 | 2988 ± 168 (1991–3641) |
| d | 380–520 | 30–40°/вершины 30–40°/tops |
57.8–257 | 2.7–4.5 | 5 | <1 | 2366 ± 229 (1397–3774) |
| e | 400–480 | 20°/В, З, вершины 20°/E, W, tops |
21.6–67.4 | 2.8–6.0 | 50 | 25 | 2754 ± 133 (2052–3716) |
| f | 320–380 | 5–10°/В 5–10°/E |
19.0–67.4 | 4.5–6.2 | 43 | 8 | 3413 ± 227 (1932–4728) |
Примечание. H – высота над уровнем моря; α/exp – крутизна/экспозиция склона; KI – интегральный показатель загрязнения; pH – водородный показатель водной вытяжки из грунта; N – число видов; S – площадь покрытия растительными группировками; L – среднее расстояние от источника эмиссии, в скобках – диапазон значений. Note. H – altitude above sea level; α/exp – slope angle/slope exposure; KI – integral indicator of pollution; pH – potential of hydrogen of water ground extract; N – number of species; S – area of coverage by plant groupings; L – distance from emission source.
Для сравнения флор импактной зоны и контрольного участка использованы литературные данные [6, 7]. На Демидовских сопках произрастают остепненные и богато-разнотравные сосново-лиственничные редколесья с вкраплениями степных участков. Настоящие степи представлены злаково-разнотравными, перистоковыльно-полынными сообществами, в которых основной фон образуют злаки (Stipa pennata L., S. dasyphylla (Lindem.) Trautv., Helictotrichon desertorum (Less.) Nevski, H. schellianum (Hack.) Kitag., Phleum phleoides (L.) Karst.). Каменистые степи представлены в основном сибирсковасильково-холоднополынными, холоднополынно-перистоковыльными вариантами сообществ и сообществами петрофильно-разнотравных формаций (мордовниково-полынно-разнотравная (Artemisia commutate + A. frigid + Echinops ruthenicus), иглолистногвоздично-мордовниково-холоднополынная (Artemisia frigid + Echinops ruthenicus + Dianthus acicularis), полынно-извилистобурачково-сибирсковасильковая (Centaurea sibirica + Alissum tortuosum + Artemisia frigida), типчаково-иглолистногвоздично-холоднополынная (A-rtemisia frigid + Dianthus acicularis + Festuca valesiaca), разнотравно-ластовневая (Vincetixicum albovianum + Artemisia commutate + A. frigid + Clausia aprica + Dianthus acicularis + Festuca valesiaca + Helictotrichon desertorum + Galium verum). Распределение сообществ зависит от положения в рельефе, свойств субстрата и условий увлажнения.
В данной статье анализируются материалы флористических описаний 2006–2014 гг. на сети из 70 пробных площадей размером 100 м2, отражающих разнообразие экологических условий. Объем таксонов, их ценотическая принадлежность в регионе и группы по отношению к фактору увлажнения принимались согласно сводке П.В. Куликова [11]. Жизненные формы даны по И.Г. Серебрякову [12]. Для оценки значимости компонентов флоры вычислялась доля участия видов определенных групп с учетом их встречаемости. Встречаемость определялась на 20 учетных квадратах размером 0.25 м2 на каждой пробной площади методом случайного выбора. Использовалась стандартная равномерная шкала классов встречаемости: 1 – менее 20%, 2 – 21–40, 3 – 41–60, 4 – 61–80, 5 – 81–100%.
При анализе материалов использован метод кластерного анализа с применением коэффициента сходства Чекановского–Съеренсена (Ics) для количественных данных в форме b, дендрограммы построены методом присоединения по среднему [13].
Зависимость уровня загрязнения субстрата от расстояния от источника эмиссии анализировалась методом простой регрессии с определением коэффициента корреляции Пирсона (R) на основании анализа 17 проб в северо-восточном направлении и 7 проб в восточном направлении в соответствии с основными направлениями переноса аэральных выбросов. Интегральный коэфициент загрязнения тяжелыми металлами KI [14] вычислен по содержанию семи элементов (Fe, Cu, Zn, Mn, Cd, Pb, Sr) в водной вытяжке из грунта по формуле:
где Сi – концентрация i-го элемента на соответствующей ПП, Сфi – фоновая концентрация i-го элемента, n (элементы) = 7. За фоновые приняты концентрации элементов на площадке, где их суммарная концентрация минимальна.Кроме того, определялся pH водной вытяжки из грунта. Использованы данные химического анализа С.В. Гаврилкиной, П.В. Чащина.
При ранжировании данных показателей приняты следующие градации: для KI – I (0–50), II (51–100), III (100–150, единичные точки – 174, 203, 257); для pH – I (5.1–6.2), II (4.1–5) III (3.1–4), IV(2–3).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выявленная локальная флора сосудистых растений на выходах гипербазитовых пород в зоне аэрального загрязнения КМК включает 105 видов из 67 родов и 25 семейств (табл. 2, рис. 1). На аналогичном контрольном участке в ИГЗ разнообразие растений составляет 109 видов из 87 родов и 30 семейств [6]. Несмотря на существующее мнение, что при долговременном техногенном воздействии флористическое разнообразие должно уменьшаться [15], существенного сокращения числа видов не отмечено, хотя состав семейств и родов обеднен. На нарушенной территории по степени представленности лидируют два семейства: Poaceae (22 вида, 21%) и Asteraceae (14 видов, 13%), далее следуют 5 семейств: Fabaceae, Rosaceae, Caryophyllaceae, Euphorbiaceae, Polygonaceae, на долю которых приходится по 6% (6 видов). На контрольной территории наиболее представительны три семейства – Asteraceae (19 видов, 17%), Poaceae (16 видов, 15%) и Caryophyllaceae (11 видов, 10%). Доля последующих 3 семейств составляет: Fabaceae – 6% (7 видов), Rosaceae, Ranunculaceae – по 5.5% (6 видов). Из десяти ведущих семейств, представленных на контрольном участке, в импактной зоне отмечено выпадение Rubiaceae, Brassicaceae, Scrophulariaceae и появление Euphorbiaceae, Apiaceae, Cyperaceae. Таким образом, произошла частичная смена видового состава и таксонов надвидового ранга, структура флоры импактной зоны значительно отличается от флоры ненарушенного участка. Сходство видовых списков оказалось низким – величина Ics составляет всего 0.3, что указывает на значительную техногенную трансформацию флоры.
Таблица 2.
Травянистые сосудистые растения зоны аэрального загрязнения Карабашского медеплавильного комбината Table 2. Herbaceous vascular plants in the zone of aerial pollution by Karabash copper smelting plant
| Вид Species |
Класс встречаемости в различных типах
местообитаний Occurrence frequency class in different types of habitats |
|||||
|---|---|---|---|---|---|---|
| a** | b | c | d | e | f | |
| Achillea asiatica Serg. | – | – | – | – | 1 | – |
| A. millefolium L. | 1 | – | – | – | – | 1 |
| Aconogonon alpinum (All.) Schur | – | – | – | – | 2 | 1 |
| Agrostis vinealis Schreb. | 1 | 1 | – | – | – | – |
| *Alchemilla tubulosa Juz. | 1 | – | – | – | – | – |
| Allium rubens Schard. ex Willd. | – | – | – | – | 1 | 1 |
| A. strictum Schard. | 1 | 1 | – | – | – | – |
| Alopecurus pratensis L. | 1 | – | – | – | – | – |
| Amoria montana (L.) Soják | – | – | – | – | 1 | – |
| *A. repens (L.) C. Presl | 1 | – | – | – | – | 1 |
| *Arctium tomentosum Mill. | 1 | – | – | – | – | – |
| Artemisia latifolia Ledeb. | 1 | 1 | 2 | 1 | 2 | 1 |
| Bistorta officinalis Delarbre | – | – | – | – | – | 1 |
| Brachypodium pinnatum (L.) Beauv. | 1 | – | – | – | 1 | – |
| Bromopsis inermis (Leyss.) Holub. | 1 | 2 | – | – | – | – |
| Calamagrostis arundinacea (L.) Roth | 1 | 5 | 1 | – | 4 | 5 |
| C. epigeios (L.) Roth | 2 | – | – | – | – | 1 |
| *Carduus crispus L. | 1 | – | – | – | – | 1 |
| Carex leporine | 2 | – | – | – | – | – |
| C. montana L. | – | – | 1 | – | – | – |
| C. pediformis C. A. Mey. | – | – | 1 | – | – | – |
| C. praecox Schreb. | – | – | – | – | 1 | – |
| С. supina Wahlenb. | – | – | – | – | – | 1 |
| *Carum carvi L. | 1 | – | – | – | – | – |
| Cerastium arvense L | 1 | – | – | – | – | – |
| Chamaenerion angustifolium (L.) Scop. | 1 | – | – | – | 2 | – |
| *Chenopodium album L. | 1 | 1 | – | – | – | 1 |
| *C. rubrum L. | 1 | – | – | – | – | – |
| *C. urbicum L. | 1 | – | – | – | – | 1 |
| Chrysaspis aurea (Poll) Greene | 1 | – | – | – | – | – |
| *Cirsium setosum (Willd.) Bess. | 2 | 1 | – | – | 1 | 1 |
| *Convolvulus arvensis L. | 2 | 1 | – | – | 1 | 1 |
| Deschampsia caespitosa (L.) Beauv | 2 | 1 | – | – | 1 | – |
| Dianthus acicularis Fisch. ex Ledeb. | – | – | – | – | 1 | – |
| Echinops crispus S. Majorov | – | 1 | 1 | – | 1 | – |
| Elymus caninus (L.) L. | 1 | – | – | – | 1 | – |
| Elytrigia elongatiformis (Drob.) Nevski | – | – | – | – | 1 | 1 |
| E. intermedia (Host) Nevski | 1 | 1 | 1 | – | 1 | 2 |
| E. lolioides (Kar. et Kir.) Nevski | – | 2 | 1 | – | 1 | – |
| E. reflexiaristata (Nevski) Nevski | – | 1 | 4 | 1 | 4 | 1 |
| *E. repens (L.) Nevski | 2 | 4 | – | – | 4 | – |
| Epilobium adenocaulon Hausskn. | 1 | – | – | – | – | – |
| Equisetum arvense L. | 2 | 2 | – | – | – | 1 |
| E. fluviatile L. | 1 | – | – | – | – | 1 |
| E. palustre L. | – | – | – | – | – | 1 |
| Eremogone micradenia (P. Smirn) Ikonn. | 1 | 1 | 5 | – | 2 | 2 |
| E. saxatilis (L.) Ikonn. | – | 1 | 2 | 1 | 1 | 1 |
| *Erodium cicutarium (L) L’Her. | 1 | – | – | – | – | – |
| Euphorbia caesia Kar. et Kir. | – | – | 1 | – | 1 | – |
| Е. cyparissias L. | 1 | 1 | – | – | – | – |
| E. gmelinii Steud. | – | – | 1 | – | 1 | 1 |
| E. seguieriana Neck. | – | – | 1 | – | 1 | – |
| E. subtilis Prokh. | – | – | 1 | – | 1 | – |
| E. virgata Waldst. et Kit. | – | 1 | – | – | 1 | – |
| Festuca ovina L. | 1 | – | – | – | – | – |
| F. rubra L. | 2 | 1 | – | – | – | – |
| Galium verum L. | 1 | 1 | – | – | 1 | 1 |
| Geranium sibiricum L. | 1 | – | – | – | – | – |
| *Glechoma hederaceae L. | 1 | – | – | – | – | – |
| Helictotrichon desertorum (Less.) Nevski | – | – | – | – | 1 | – |
| Hierochloе arctica C. Presl | – | – | – | – | 1 | – |
| Juncus compressus Jack. | 1 | – | – | – | – | – |
| *Lactuca tatarica (L.) C.A. Mey. | 2 | 2 | 2 | – | 1 | 3 |
| *Lappula squarrosa (Retz.) Dumort. | 1 | – | – | – | – | – |
| *Leontodon autumnalis L. | 1 | – | – | – | – | – |
| *Linaria vulgaris Mill. | 1 | – | – | – | – | 1 |
| Lupinaster albus Link | 1 | – | – | – | 1 | – |
| Persicaria lapathifolia (L.) S.F. Gray | – | – | – | – | 1 | – |
| *Pimpinella saxifraga L. | 1 | 1 | – | – | – | 1 |
| *Plantago major L. | 2 | – | – | – | – | – |
| *P. media L. | 1 | – | – | – | – | 1 |
| P. urvillei Opiz | 1 | – | – | – | – | – |
| Poa angustifolia L. | 4 | 1 | 4 | – | 1 | 1 |
| *P. annua L | 2 | – | – | – | – | 1 |
| P. pratensis L. | 2 | 1 | – | 1 | – | – |
| Polygonatum odoratum (Mill.) Druce | – | 1 | – | – | 1 | 1 |
| *Polygonum aviculare L. | 2 | – | – | – | – | – |
| *Potentilla anserinа L. | 1 | – | 1 | – | – | – |
| P. argentea L. | 1 | – | – | – | – | – |
| *P. norvegica L. | 1 | 1 | – | – | 2 | – |
| *P. supinа L. | 3 | – | – | – | 1 | – |
| *Ranunculus polyanthemos L. | 1 | – | – | – | – | – |
| *Rumex acetosella L. | 1 | 1 | – | – | – | – |
| R. confertus Willd. | 2 | 1 | – | – | 1 | – |
| Sanguisorba officinalis L. | – | 1 | 5 | – | 2 | 5 |
| Scorzonera glabra Rupr. | 1 | 1 | 5 | 5 | 5 | 3 |
| Seseli krylovii (V. Tichomirov) M. Pimen. et Sdobnina | – | – | – | – | 3 | – |
| S. ledebourii G. Don fil. | – | – | – | – | 1 | 2 |
| S. libanotis (L.) Koch | – | 1 | 3 | – | – | – |
| Silene amoena L. | 1 | 1 | 3 | – | 1 | 4 |
| Solanum dulkamara L. | 1 | 1 | – | – | 1 | 1 |
| *Sonchus arvensis L. | 2 | – | – | – | 2 | – |
| *S. oleraceus L. | 2 | – | – | – | – | – |
| Stellaria graminea L. | 1 | – | – | – | – | – |
| Stipa dasyphylla (Lindem.) Trautv. | – | – | – | – | 1 | 1 |
| S. pennata L. | – | – | – | – | 1 | – |
| *Taraxacum officinale Wigg. | 4 | – | – | – | – | 1 |
| Thalictrum foetidum L. | – | 1 | – | – | 1 | – |
| T. minus subsp. flexuosum (Bernh. ex reichenb.) Krupkina | – | 1 | 1 | – | 2 | 2 |
| T. simplex L. | – | 1 | – | – | – | 1 |
| Trifolium pratense L. | 1 | – | – | – | – | 1 |
| *Tussilago farfara L. | 4 | 1 | – | – | – | 1 |
| *Urtica dioica L. | 2 | 1 | – | – | 1 | 1 |
| Verbascum thapsus L. | 1 | – | – | – | – | – |
| *Vicia cracca L. | 1 | – | – | – | – | – |
Рис. 1.
Структура локальной сосудистой флоры на участках выходов серпентинитовых пород (Южный Урал). a – зона аэрального загрязнения КМК, b – контрольный участок на территории ИГЗ. Семейства: 1 – Poaceae, 2 – Asteraceae, 3 – Fabaceae, 4 – Rosaceae, 5 – Caryophyllaceae, 6 – Euphorbiaceae, 7 – Polygonaceae, 8 – Apiaceae, 9 – Cyperaceae, 10 – Ranunculaceae, 11 – остальные, 12 – Rubiaceae, 13 – Brassicaceae, 14 – Scrophulariaceae. Fig. 1. The structure of local vascular flora in plots of outcrops of serpentinite rocks (South Ural). a – zone of aerial pollution by Karabash copper smelting plant, b – control plot in Ilmen State Reserve. Families: 1 – Poaceae, 2 – Asteraceae, 3 – Fabaceae, 4 – Rosaceae, 5 – Caryophyllaceae, 6 – Euphorbiaceae, 7 – Polygonaceae, 8 – Apiaceae, 9 – Cyperaceae, 10 – Ranunculaceae, 11 – others, 12 – Rubiaceae, 13 – Brassicaceae, 14 – Scrophulariaceae.

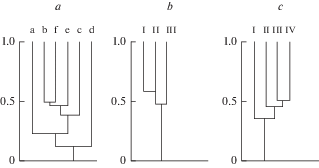
На исследованном полигоне выявлено неравномерное распределение видов вследствие гетерогенности среды, подтвержденное низким сходством флористических списков различных типов местообитаний (рис. 2а), что вполне ожидаемо вследствие многообразия природных условий, связанных со сложностью рельефа. Флористическое богатство и площадь, занятая растительными группировками значительно варьируют в разных типах местообитаний – от 5 до 71 вида (a > e > f > b > c >d) и 1–70% (a > > e > c > f > b > d) соответственно (табл. 1).
Рис. 2.
Дендрограммы сходства (Ics) флористических комплексов в зоне аэрального загрязнения КМК по видовому составу с учетом встречаемости. a – в разных типах местообитаний, a–f – типы местообитаний (см. табл. 1); b – при различных показателях загрязнения грунта ТМ (KI), I–III – уровень загрязнения (см. “Материал и методы”); c – при различном закислении грунта (pH), I–IV – уровень закисления (см. “Материал и методы”). Fig. 2. Dendrogram of similarity of floristic complexes by species cjmposition with account for a frequency occurrence of species (Ics) in the zone of aerial pollution by Karabash copper smelting plant. a – in different habitats, a–f – habitats types (см. Table 1); b – at various ground pollution by heavy metals М (KI), I–III – pollution degree (see “Material and methods”); c – at various ground acidification (pH), I–IV – acidification degree (see “Material and methods”).
Выявленные флористические комплексы отличаются структурой компонентов: экологических групп по отношению к фактору увлажнения, фитоценотических групп и жизненных форм видов. Из экологических групп у подножий преобладают мезофиты; на средних частях склонов усиливают позиции ксеромезофиты, которые на крутых каменистых вершинах доминируют (рис. 3a); стабильно присутствие мезоксерофитов, особенно на фрагментах деградированных почв выровненных участков. Повсюду, кроме каменистых вершин и верхних частей крутых склонов, характерно небольшое присутствие гидрофитной группы – гигромезофитов, мезогигрофитов, гигрофитов.
Рис. 3.
Соотношение экологических групп растений по отношению к фактору увлажнения с учетом встречаемости видов в зоне аэрального загрязнения КМК. a, b, c – см. рис. 2. Экологические группы: 1 – мезоксерофиты, 2 – ксеромезофиты, 3 – мезофиты, 4 – гигромезофиты, 5 – мезогигрофиты, 6 – гигрофиты. Fig. 3. The percentage of ecological groups of plants in relation to the humidification cjmposition with account for a frequency occurrence of species in the zone of aerial pollution by Karabash copper smelting plant. a, b, c – see figure 2. Ecological groups: 1 – mesoxerophytes, 2 – xeromesophytes, 3 – mesophytes, 4 – hygromesophytes, 5 – mesohygrophytes, 6 – hygrophytes.

Высокое разнообразие жизненных форм наблюдается в речной долине (рис. 4a). Преобладают различные виды поликарпиков, характерных как для естественной, так и для синантропной флоры. Здесь же заметно присутствие монокарпиков-антропофитов, которые выпадают в нижних частях склонов, находящихся под прямым влиянием дымов. На всех частях склонов и на невысоких вершинах произрастают преимущественно стержнекорневые, короткокорневищные и рыхлокустовые поликарпики. На самых высоких каменистых вершинах и осыпях преобладает стержнекорневой поликарпик Scorzonera glabra при незначительном участии прочих поликарпиков.
Рис. 4.
Соотношение жизненные форм растений с учетом встречаемости видов в зоне аэрального загрязнения КМК. a, b, c – см. рис. 2. Жизненные формы: 1 – длиннокорневищные поликарпики, 2 – рыхлокустовые поликарпики, 3 – стержнекорневые поликарпики, 4 – короткокорневищные поликарпики, 5 – корнеотпрысковые поликарпики, 6 – однолетние и двулетние монокарпики, 7 – кистекорневые поликарпики, 8 – длиннокорневищныe хвощи, 9 – плотнокустовые поликарпики, 10 – ползучие поликарпики, 11 – длиннокорневищные рыхлокустовые поликарпики. Fig. 4. The percentage of life forms of plants with account for a frequency occurrence of species in the zone of aerial pollution by Karabash copper smelting plant. a, b, c – see figure 2. Life forms: 1 – long-rooted, 2 – loosely bunched, 3 – tap-rooted, 4 – short-rooted, 5 – creeping-rooted, 6 – annual and biennial monocarpic, 7 – raceme-rooted, 8 – long-rooted horsetails, 9 – dense bunched, 10 – climbing, 11 – long-rooted loosely bunched.

Из фитоценотических групп в долине преобладают луговой, опушечный и сорный компоненты (рис. 5a). В нижних частях склонов к ним присоединяются апофитные опушечно-лесные, а также скально-петрофитно-степные виды, которые выходят на первые позиции на крутых склонах и вершинах.
Рис. 5.
Соотношение фитоценотических группы растений с учетом встречаемости видов в зоне аэрального загрязнения КМК. a, b, c – см. рис. 2. Фитоценотические группы: 1 – опушечно-луговые, опушечно-луговые и сорные, 2 – сорные, сегетально-сорные, 3 – петрофитно-степные, скально-петрофитно-степные, 4 – лугово-степные, 5 – луговые, 6 – луговые и сорные, сорно-луговые, 7 – опушечно-лесные, опушечно-лесные и сорные, 8 – скальные, опушечно-скальные, 9 – опушечно-лугово-степные, 10 – степные, степные и сорные, 11 – галофитно-луговые и сорные. Fig. 5. The percentage of phytocenotic groups of plants with account for a frequency occurrence of species in the zone of aerial pollution by Karabash copper smelting plant. a, b, c – see figure 2. Phytocenotic groups: 1 – forest marginal–meadow, 2 – weed, segetal-weed, 3 – petrophytic-steppe, 4 – meadow-steppe, 5 – meadow, 6 – meadow and weed, 7 – forest marginal-forest, 8 – rocky, forest-marginal-rocky, 9 – forest marginal- meadow-steppe, 10 – steppe, steppe and weed, 11 – halophytic–meadow, weed.

Долина, прилегающая к селитебно-промышленной зоне, выделяется на общем фоне повышенным видовым богатством в основном за счет присутствия синантропных видов (около 30%) (табл. 2). Немаловажную роль в этом играют выровненность рельефа, наличие мягких грунтов и умеренное увлажнение. На остальных участках превалирует обедненная группа аборигенных видов. Она особенно характерна для высоких вершин и примыкающих к ним крутых склонов с самыми экстремальными условиями (сухость, бедность незакрепленного субстрата). Почти все виды здесь являются ксеромезофитами, корневищными или стержнекорневыми поликарпиками; преобладают петрофитно-степной и скальный элементы. Умеренный уклон, менее экстремальные эдафические условия обусловливают увеличение доли участия мезофитов и высокое разнообразие фитоценотических элементов, включая луговой, опушечно-лесной и сорный. На дендрограмме сходства видно (рис. 2a), что видовая структура растений долины резко отличается от таковой остальных местообитаний. Флористические комплексы возвышенных форм рельефа более сходны между собой; среди них существенно выделяются по флористическому составу лишь наиболее высокие и каменистые вершины и склоны.
Распределение поллютантов на исследованном полигоне вследствие сложности рельефа оказалось неравномерным. В частности, зависимость между уровнем загрязнения грунта тяжелыми металлами (KI) и расстоянием от источника эмиссии по направлению преобладающих ветров (северо-восточное направление) отсутствует (R = –0.27, P = 0.29, SE = 0.25). В каждом типе местообитаний присутствуют участки с разными значениями показателей KI и pH. Количество видов по градациям интегрального коэффициента загрязнения почв тяжелыми металлами KI (I – 0–50, II – 51–100, III – 100–150, ед. 170–260) уменьшается, составляя соответственно 78, 58, 47. Та же закономерность наблюдается в градиенте уменьшения значений pH водной вытяжки (I – 5.1–6.2, II – 4.1–5, III – 3.1–4, IV – 2–3), на котором число видов составляет соответственно 61, 66, 36, 39. Тем не менее, по данным факторного анализа, различие между средними значениями числа видов на отдельных площадках по градиенту загрязнения субстрата тяжелыми металлами, а также уровня кислотности незначимы (F = 0.71, P = 0.49; F = 1.90, P = 0.17)
Сходство флористических комплексов разных типов местообитаний (рис. 2a) меньше (Ics = 0.22–0.51), чем на участках с разным уровнем загрязнения тяжелыми металлами (Ics = 0.49–0.61) и разной кислотностью субстрата (Ics = 0.36–0.52) (рис. 2b, c). Происходит унификация флористических списков при общем обеднении видового состава. Таким образом, на территории исследований фактор загрязнения тяжелыми металлами имеет меньшее влияние на распределение видов, чем особенности условий местообитаний.
Анализ распределения компонентов флоры по градиенту загрязнения выявил следующее. Из экологических групп на всех уровнях значений KI преобладают ксеромезофиты и мезофиты, но при наиболее высоком уровне загрязнения (III) роль последних заметно возрастает (рис. 3b). Участие других групп меняется незначительно.
При различном уровне кислотности субстрата в целом преобладают те же группы, но при наиболее низких значениях pH (IV уровень) усиливается роль ксеромезофитов (рис. 3c). Отмечается стабильное присутствие мезогигрофитной группы на I–III уровнях значений pH, гигрофитной группы на I–II уровнях; на III и IV уровнях гигрофиты исчезают.
На всех уровнях значений KI в составе жизненных форм преобладают длиннокорневищные, рыхлокустовые, стержнекорневые, короткокорневищные поликарпики, но при наиболее высоком уровне загрязнения (III) значительно возрастает встречаемость однолетних и двулетних монокарпиков и увеличивается присутствие корнеотпрысковых поликарпиков (рис. 4b).
При всех уровнях кислотности грунта стабильно присутствуют стержнекорневые поликарпики и постоянно встречаются рыхлокустовые поликарпики; при самых низких значениях pH (IV уровень) увеличивают присутствие и начинают преобладать длиннокорневищные поликарпики. При понижении pH от I к IV уровню заметно увеличивается встречаемость короткокорневищных поликарпиков (рис. 4c). На наименее кислых субстратах (I уровень) велика встречаемость одно- и двулетних монокарпиков, представленных синантропными видами, которая снижается по мере уменьшения pH.
При всех уровнях KI чаще встречаются опушечно-луговые, сорные, сегетально-сорные элементы, роль которых еще и возрастает на наиболее загрязненных субстратах (III уровень) (рис. 5b). Присутствие петрофитно-степной и скально-петрофитно-степной групп, частое при наиболее низком уровне содержания тяжелых металлов в субстрате (I уровень), уменьшается по мере усиления загрязненности. Присутствие группы опушечно-лесных, опушечно-скальных и скальных видов несколько снижается при наиболее высоком (III) уровне загрязнения.
На менее кислых субстратах (I уровень) высоко участие в составе растительного покрова опушечно-луговых, сорных и сегетально-сорных элементов (рис. 5c). И если присутствие первой группы стабильно во всем диапазоне уровня кислотности субстрата (I–IV), то вторая группа резко снижает присутствие, реагируя на повышение кислотности. При повышении кислотности (от II к IV уровню) увеличивается встречаемость скальных и опушечно-скальных видов.
Уменьшение числа видов в градиенте загрязнений указывает на наличие влияния этих факторов на видовой состав растительных группировок, что подтверждается анализом структуры флористических компонентов. Изменения в основном прослеживаются при наиболее высоком уровне загрязнения тяжелыми металлами и, в особенности, закисления.
Для исследованной локальной флоры характерно наличие ядра аборигенных видов (Artemisia latifolia, Calamagrostis arundinacea, C. еpigeios, Elytrigia lolioides, Eremogone micradenia, E. saxatilis, Euphorbia gmelinii, Galium verum, Sanguisorba officinalis, Silene amoena, Seseli ledebourii, S. libanotis, Thalictrum minus subsp. flexuosum) смешанной эксплерент-патиентной стратегии [16], толерантных к создавшейся комбинации природных и техногенных факторов. Наиболее приспособленным к условиям обитания в импактной зоне оказался ксеромезофит, опушечно-скальный, стержнекорневой поликарпик, Scorzonera glabra – вид, редкий в естественных местообитаниях на серпентинитовых выходах, а в зоне аэрального загрязнения имеющий самый высокий показатель встречаемости при значительном снижении конкуренции с другими видами. Исключение составляет синантропизированная долина, где велико присутствие видов эксплерентной первичной стратегии, неконкурентноспособных, но осваивающих нарушенные местообитания благодаря высокому репродуктивному усилию.
ЗАКЛЮЧЕНИЕ
В импактной зоне Карабашского медеплавильного комбината на участке, где главным техногенным фактором является аэральный перенос, на месте остепненных сосново-лиственничных редкостойных лесов с участками горных степей за более чем вековой период сформировались разреженные растительные группировки, структура которых значительно отличается от естественных растительных сообществ контрольного участка на территории Ильменского государственного заповедника с аналогичным геоморфологическим строением.
Несмотря на почти одинаковое видовое богатство локальных флор контрольного участка и исследованного полигона (109 и 105 видов соответственно), отмечено разное количество родов (87 и 67) и семейств (30 и 25). Обеднение на надвидовом уровне и низкий уровень сходства локальных флор (Ics = 0.3) указывают на трансформацию растительного покрова под воздействием загрязнения тяжелыми металлами и закисления грунта.
На территории импактной зоны отсутствует достоверная связь между уровнем загрязнения и расстоянием от источника эмиссии. Выявлено неравномерное распределение видов по разным типам местообитаний. Видовой состав растительных группировок зависит, прежде всего, от положения в рельефе и эдафических условий и в значительно меньшей степени – от уровня загрязнения, что подтверждается сравнением величин коэффициента сходства Чекановского–Съеренсена. Сходство флористических комплексов разных типов местообитаний (Ics = 0.22–0.51) меньше, чем на участках с разным уровнем загрязнения тяжелыми металлами (Ics = 0.49–0.61) и разной кислотностью субстрата (Ics = 0.36–0.52). В импактной зоне изменения в основном прослеживаются при наиболее высоком уровне загрязнения тяжелыми металлами и, в особенности, закисления. В частности, происходит уменьшение количества видов в градиенте уровня загрязнения KI с 0–50 до 100–150 (78, 58, 47 видов соответственно) и закисления с 5.1–6.2 pH до 2–3 (61, 66, 36, 39). Тем не менее, по данным факторного анализа, различие между средними значениями числа видов на отдельных площадках в градиенте загрязнений незначимы. Следовательно, изменения в видовом составе происходят в основном на качественном уровне, что согласуется с анализом представленности различных флористических компонентов (экологических групп по отношению к фактору увлажнения, жизненных форм, фитоценотических групп). При общей трансформации флоры импактной зоны структура флористических комплексов в первую очередь связана с природной гетерогенностью среды и формируется путем реализации жизненных стратегий видов.
Список литературы
Белогуб Е.В., Удачин В.Н., Кораблев Г.К. 2003. Карабашский рудный район (Южный Урал). Материалы к путеводителю геолого-экологической экскурсии. Миасс. 40 с.
Brooks R.R. 1987. Serpentine and its Vegetation. A Multidisciplinary Approch. USA. 332 p.
Proctor J. 1992. The vegetation over ultramafic rocks. – In: The ecology of areas with serpentinized rocks. Amsterdam. P. 249–270.
Proctor J. 1971. Plant ecology of serpentine II. Plant response to serpentine soils. – J. Ecology. 59: 397–410.
Коротеева Е.В., Веселкин Д.В., Куянцева Н.Б., Чащина О.Е. 2015. Подход к зонированию нарушенных территорий на основе содержания тяжелых металлов в органах сосны обыкновенной (на примере региона Карабашского медеплавильного комбината). – Вестн. СВНЦ ДВО РАН. 3: 86–93.
Горчаковский П.Л., Золотарева Н.В. 2004. Реликтовая степная растительность Ильменских гор на Южном Урале. Екатеринбург. 120 с.
Горчаковский П.Л., Золотарева Н.В., Коротеева Е.В., Подгаевская Е.Н. 2005. Фиторазнообразие Ильменского заповедника в системе охраны и мониторинга. Екатеринбург. 192 с.
Тептина А.Ю., Пауков А.Г. 2012. Петрофитно-степная флора и растительность гипербазитов Южного Урала. – Изв. Самарского НЦ РАН. 14(1(7)): 1860–1863.
Черненькова Т.В. 2002. Реакция лесной растительности на промышленное загрязнение. М. 191 с.
Коротеева Е.В., Вейсберг Е.И., Гаврилкина С.В., Чащин П.В. 2014. Трансформированная растительность в зоне аэрального загрязнения Карабашского медеплавильного комбината (Южный Урал). – Проблемы региональной экологии. 6: 96–103.
Горичев Ю.П. 2015. О ботанико-географическом районировании Южного Урала. – Изв. Самарского НЦ РАН. 17(5): 107–110.
Серебряков И.Г. 1962. Экологическая морфология растений. М. 378 с.
Песенко Ю.А. 1982. Принципы и методы количественного анализа в фаунистических исследованиях. М. 286 с.
Снакин В.В., Присяжная А.А. 1995. Экологическая оценка состояния почв: Попытка количественного подхода. – Изв. РАН. Сер. биол. 1: 105–109.
Магомедова M.А., Морозова Л.М., Эктова С.Н., Ребристая О.В., Чернядьева И.В., Потемкин А.Д., Князев М.С. 2006. Полуостров Ямал: растительный покров. Тюмень. 360 с.
Grime J.P., Hodson J.G., Hunt R. 1988. Comparative plant ecology: a functional approach to common British species. London. 742 p.
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


