Растительные ресурсы, 2021, T. 57, № 2, стр. 176-185
Фенольные соединения растений Potentilla alba и Potentilla megalantha (Rosaceae), полученных in vitro
Н. А. Поляков 1, *, Е. А. Калашникова 2, Р. Н. Киракосян 2, Ф. М. Хазиева 1
1 ФГБНУ “Всероссийский научно-исследовательский институт лекарственных и ароматических растений” (ВИЛАР)
Москва, Россия
2 Российский государственный аграрный университет – МСХА им. К.А. Тимирязева
Москва, Россия
* E-mail: polakov@yandex.ru
Поступила в редакцию 13.11.2020
После доработки 12.12.2020
Принята к публикации 07.03.2021
Аннотация
В последнее время все острее встает вопрос поиска альтернативных путей производства целевых лекарственных соединений из растений, которые составляют основу лекарственных препаратов. Среди известных методов сохранения и получения растительного лекарственного сырья для массового производства необходимых для человека фитопрепаратов, широкое распространение получил метод клонирования растений in vitro, а именно клональное микроразмножение. Перспективными растениями для изучения в культуре in vitro являются растения рода лапчатка Potentilla, которые принадлежат к многочисленному семейству Розоцветных (Rosaceae). Экстракты растений рода Potentilla обладают высокой биологической активностью, благодаря присутствию большого количества разнообразных фенольных соединений. Препараты из лапчатки используют при лечении различных заболеваний. Поэтому изучение особенностей размножения лапчатки белой Potentilla alba L. и лапчатки крупноцветковой Potentilla megalantha L. в условиях in vitro, а также анализ компонентного состава экстрактивных веществ выращенных растений является актуальным. В результате проведенных исследований установлено, что для образования максимального количества адвентивных микропобегов P. alba и P. megalantha in vitro необходимо добавление в состав питательной среды 6-бензиламинопурина (БАП) в концентрации 1 мг/л. Фитохимический анализ полученных растений был проведен с помощью ультра-эффективной жидкостной хроматографии в комбинации с масс-спектрометром высокого разрешения (УЭЖХ-ДАД-МСВР). Определено более десятка фенольных соединений, принадлежащие флаванолам, производным оксикоричных кислот, гидролизуемым таниннам и проантоцианидинам или конденсированным таниннам.
Широкий спектр фармакологического действия является достоинством фитопрепаратов, поэтому использование лекарственных растений в медицине становится все более актуальным. Одними из интересных и перспективных видов лекарственных растений являются представители рода Potentilla. Название Potentilla произошло от латинского слова “potents” – “могущественный”, “сильный”. Благодаря целебным свойствам растений этого рода их в течение длительного времени использовали в традиционной медицине [1, 2].
При изучении фитохимического состава сырья лапчатки белой обнаружены различные вторичные соединения: фитостерины, полисахариды, терпеноиды [3, 4]. Наибольшее количество работ, посвященных растениям рода Potentilla, связаны с изучением их фенольного метаболизма [5–10]. Одним из первых соединений, обнаруженных в растениях лапчатки, является катехин, относящийся к флаванолам [9]. Позднее были идентифицированы дубильные вещества, фенолкарбоновые кислоты, многочисленные флавоноиды и их гликозиды [4, 5]. В образцах лапчатки, собранных в разных регионах восточной Сибири обнаружены кофейная и эллаговая кислоты, эллагитаннин агримонин, а также гликозиды мирицитин и кемпферол [6]. Для некоторых представителей растений рода Potentilla свойственно высокое содержание различных типов проантоцианидинов [2, 7], общее количество которых в лапчатке составляет 20% [10].
Кроме того, в результате исследований установлена антимикробная активность экстрактов лапчатки [11, 12].
Основной недостаток природных лекарственных препаратов – это ограниченность сырья для их изготовления. Их крупномасштабное использование может быть затруднено в связи с недостаточным восполнением вида естественным путем. Культивирование в полевых условиях в производственных масштабах лапчатки белой проблематично в связи с плохой всхожестью семян, низкой жизнеспособностью проростков растений из-за неподходящих климатических условий [1]. Поэтому важнейшей задачей для развития фармацевтической промышленности является обеспечение возобновляемым сырьем с необходимыми свойствами. Многолетние исследования доказали высокую эффективность метода клонирования растений in vitro, а именно клонального микроразмножения, обеспечивающего независимость процесса от влияния различных факторов окружающей среды (климат, сезон, погода, почвенные условия, вредители).
В связи с этим, целью работы являлось изучение особенностей размножения лапчатки белой P. alba и P. megalantha в условиях in vitro и их фитохимический анализ.
МАТЕРИАЛ И МЕТОДЫ
В качестве исходного материала использовали семена P. alba и P. megalantha, которые были собраны в 2016, 2017 гг. До начала проведения опытов их хранили в бумажных пакетиках при комнатных условиях.
Семена стерилизовали 0.1%-ым раствором сулемы в течение 8 мин, после чего трижды промывали стерильной дистиллированной водой. Для проращивания семян использовали безгормональную среду Мурасиге–Скуга (MС), содержащие 3% сахарозы и 0.7% агара.
Стерильные экспланты и семена культивировали в стеклянных сосудах с питательной средой.
Питательные среды для культивирования эксплантов
В работе использовали питательные среды, соответствующие прописи MС, в том числе среды с добавлением фитогормонов различной природы, в концентрациях от 0.1 до 2 мг/л: 6-бензиламинопурин (БАП) и индолил-3-уксусная кислота (ИУК).
Для начала процесса морфогенеза в качестве экспланта применяли органы растения, предварительно прошедшие стерилизацию.
Условия выращивания
Изолированные экспланты помещали в стеклянные емкости (пробирки или колбы) и выращивали при освещении белыми люминесцентными лампами с интенсивностью 3 тыс. люкс, 16-часовом фотопериоде, температуре 23 °C и влажности воздуха 68%.
Анализ фенольных соединений
Для анализа фенольных соединений в растениях-регенерантах P. alba и P. megalantha, выращенных in vitro на питательной среде MС без гормонов и с добавлением гормонов (ИУК 0.2 мг/л и БАП 1 мг/л), использовали высокоэффективную жидкостную хроматографию с масс-спектрометром высокого разрешения (УЭЖХ-МСВР).
Навеску измельченного растительного материала (50 мг) экстрагировали 3 раза раствором вода–ацетон (1 : 4, по объему) при температуре 25 °C и постоянном перемешивании. Экстракты отделяли центрифугированием при 2000 g в течение 10 мин и переносили в колбы на 50 мл. Полученные экстракты отгоняли до сухого остатка, добавляли в них 1 мл воды, встряхивали на вортексе, центрифугировали и очищали через специальный фильтр с размером пор 0.2 µm. Объем инжекции – 5 мкл.
Анализ проводили на хроматографе Waters Acquity UPLC® 2.9.0 (Waters Corporation, Милфорд, США), совмещенном с масс-спектрометром высокого разрешения Thermo Scientific QExactive Orbitrap 2.5, оснащенным источником нагреваемой электрораспылительной ионизации (HESI). Масс-спектрометр работал в режиме регистрации отрицательно заряженных ионов, которые сканировали в диапазоне 150–2000 Да при разрешении 140 000 (разрешение на полной ширине на полувысоте). Для градуировки масс-спектрометра использовали Pierce-TM ESI negative ion раствор (Thermo Fischer Scientific Inc., Waltham, MA, USA). Полученные данные анализировали с помощью программы Thermo Xcalibur (Version 3.0.63, Thermo Fisher Scientific Inc., Waltham, MA, USA). Все растворители получены от Sigma-Aldrich.
Условия хроматографического разделения: колонка ACQUITY UPLC BEH Phenyl (100 × 2.1 мм, 1.7 мкм; Waters, Ирландия), температура колонки – 40 °С, скорость потока подвижной фазы – 0.5 мл/мин. Компоненты подвижной фазы: 0.1% (по объему) раствор муравьиной кислоты в воде (растворитель А) и 0.1% (по объему) раствор муравьиной кислоты в ацетонитриле (растворитель Б). При выполнении всех анализов использовали градиентный режим элюирования. В процессе анализа состав подвижной фазы менялся следующим образом (растворитель Б, % по объему): 0–0.5 мин – 0.1%, 0.5–5 мин – 0.1 → 30%, 5–6 мин – 30 → 35%, 6.0–9.5 мин, промывка и стабилизация колонки.
Статистическая обработка результатов
Статистическую обработку результатов проводили по стандартным методикам на основе критериев Стьюдента и Дункана, использовали программу AGROS, пакет программ Windows Excel 2010. Исследования были проведены в 3 биологических повторностях.
Рассчитывали средние арифметические значения и стандартные отклонения количества побегов на одно растение для каждого варианта культивирования.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Ранее установлено, что растения P. alba в природной среде плохо размножаются семенами вследствие их низкой всхожести. Кроме того, сформировавшиеся проростки обладают медленным ростом и, как правило, достаточно длительное время не могут перейти во взрослую фазу развития [1]. Для ускорения роста и развития представителей рода Potentilla нами были проведены исследования по оптимизации условий, обеспечивающие быстрое размножение растений in vitro. Известно, что гормональный состав питательной среды является одним из главных факторов регулирующий морфогенетические процессы в культуре in vitro. Исходя из этого, первоначально нами был проведен скрининг различных регуляторов роста с цитокининовой активностью (препарат Дропп, БАП, кинетин, препарат Цитодеф) на коэффициент размножения исследуемых видов рода Potentilla. Экспериментально установлено, что из всех изучаемых регуляторов роста, только БАП (1 мг/л) в сочетании с ИУК (0.2 мг/л) оказывали существенное влияние на учитываемый показатель. В этом варианте растения характеризовались активным ростом и высоким коэффициентом размножения [13].
Далее были определены оптимальные концентрации БАП, при которых морфогенетический потенциал изолированных эксплантов является максимальным. Результаты исследований представлены на рис. 1. В качестве контроля была питательная среда без гормонов.
Рис. 1.
Влияние различных концентраций БАП на побегообразование лапчатки. По вертикали – среднее количество побегов на одно растение, шт. Fig. 1. The effect of different concentrations of benzylaminopurine (BAP) on the in vitro shoot formation. Y-axis – average number of shoots per plant, pcs.
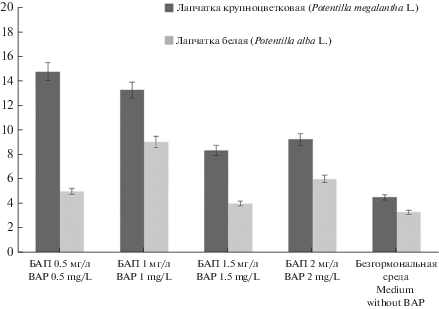
Установлено, что коэффициент размножения зависит от видовых особенностей экспланта и гормонального состава питательной среды. Так, для P. megalantha наивысший коэффициент размножения отмечался на среде с БАП 0.5–1 мг/л, а для P. alba – 1–2 мг/л.
Известно, что фармакологические свойства лапчатки обусловлены накоплением в органах и тканях биологически активных метаболитов в основном фенольной природы [11, 12].
Биосинтез вторичных метаболитов и их накопление в клетке in vitro может регулироваться изменением минерального или гормонального состава питательной среды. Если в питательной среде имеются необходимые компоненты, наблюдается активный синтез вторичных метаболитов. Как показали наши исследования, морфогенетический потенциал исследуемых растений зависит от видовых особенностей экспланта и от гормонального состава питательной среды. Поэтому исследования по содержанию фенольных соединений были проведены на растениях-регенерантах разных видов, культивируемых на разных питательных средах (рис. 2).
Рис. 2.
Внешний вид микрорастений, полученных in vitro. (a) – Potentilla megalantha, (b) – Potentilla alba. Fig. 2. Microplants propagated in vitro. (a) – Potentilla megalantha, (b) – Potentilla alba.

Экспериментально установлено, что растения P. alba, полученные на разных питательных средах, имеют схожий компонентный состав, о чем свидетельствует идентичность их хроматографических профилей (рис. 3).
Рис. 3.
Масс-спектрометрический профиль фенольных соединений. a – экстракт Potentilla alba, выращенной на питательной среде с добавлением БАП, b – экстракт Potentilla alba, выращенной на безгормональной питательной среде. Fig. 3. MS phenolic profile of the crude extract. a – Potentilla alba cultivated on the nutrient medium with BAP, b – Potentilla megalantha cultivated on the nutrient medium without BAP.
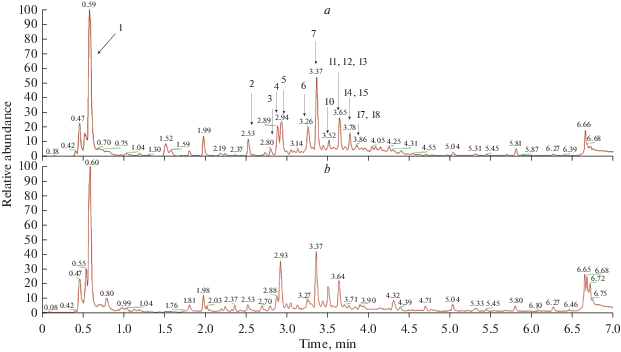
Данные по идентификации фенольных соединений, обнаруженных в экстрактах, представлены в табл. 1.
Таблица 1.
Масс-спектрометрические данные фенольных соединений в экстрактах из in vitro культур лапчатки белой и крупноцветковой Table 1. Mass spectrometric analysis of phenolic compounds in extracts from in vitro cultures of Potentilla alba and Potentilla megalantha
| Номер Number |
Время, мин Time, min |
Образец Plant species |
[M-H]– | Масс-спектрометрические
данные: значения m/z аддуктов или фрагментов Mass-spectrometry data: m/z fragment |
Определенная моноизотопная масса, Да Calculated monoisotopic mass, Da (m/z [M-H]– + 1.0072[H]) |
Химическая формула Formula |
Рассчитанная моноизотопная масса, Да Monoisotopic mass, Da |
Ошибка PPM Delta mass (ppm) |
Фенольное соединение Phenolic compound |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 0.59 | Potentilla alba | 341.1080 | 191.0544; 683.2262 | 342.1153 | C12H22O11 | 342.1162 | –2.63 | Производное хинной кислоты Quinic acid derivative |
| 2 | 2.53 | Potentilla alba | 353.0880 | 191.0544 [Quinic acid – H]–; 707.1791 [2M-H]– | 354.0953 | C16H18O9 | 354.0951 | 0.56 | Хлорогеновая кислота Chlorogenic acid |
| 3 | 2.80 | Potentilla alba | 577.1367 | 289.0719 [Catechin-H]- | 578.1440 | C30H26O12 | 578.1424 | 2.77 | ПА-димер типа “Б”,
изомер 1 B-type PA-dimer, isomer 1 |
| 4 | 2.92 | Potentilla alba | 289.0716 | 245.08; 205.05 | 290.0789 | C15H14O6 | 290.0790 | –0.34 | (+) – Катехин (+) – Catechin |
| 5 | 2.95 | Potentilla alba | 577.1358 | 1151.2445 [2M-H]– | 578.1431 | C30H26O12 | 578.1424 | 1.21 | ПА-димер типа “Б”,
изомер 2 B-type PA-dimer, isomer 2 |
| 6 | 3.25 | Potentilla alba | 577.1368 | 1155.2775 [2M-H]– | 578.1441 | C30H26O12 | 578.1424 | 2.94 | ПА-димер, “Б” B-type PA-dimer |
| 7 | 3.35 | Potentilla alba | 289.0717 | 579.1483 [2M-H]–; 245.08; 205.05 | 290.0790 | C15H14O6 | 290.0790 | 0.00 | (–) – Эпикатехин (–) – Epicatechin |
| 8 | 3.43 | Potentilla alba | 1153.2622 | 576.1288 [M-2H]2– | 1154.2695 | C60H50O24 | 1154.2692 | 0.26 | ПА-тетрамер типа “Б”
изомер1 B-type PA-tetramer, isomer1 |
| 9 | 3.45 | Potentilla alba | 865.1979 | 866.2052 | C45H38O18 | 866.2058 | –0.69 | ПА-тример типа “Б”,
изомер 2 B-type PA-trimer, isomer 2 |
|
| 10 | 3.50 | Potentilla alba | 1153.2622 | 576.1287 [M-2H]2– | 1154.2695 | C60H50O24 | 1154.2692 | 0.26 | ПА-тетрамер типа “Б”, изомер2 B-type PA-tetramer, isomer2 |
| 11 | 3.61 | Potentilla alba | 1441.3258 | 720.1611 [M-2H]2– | 1442.3331 | C75H62O30 | 1442.3326 | 0.35 | ПА-пентамер, типа “Б”,изомер 1 B-type PA-pentamer, isomer 1 |
| 12 | 3.64 | Potentilla alba | 1729.3903 | 864.1909 [M-2H]2– | 1730.3976 | C90H74O36 | 1730.3960 | 0.93 | ПА-гексамер, “Б” B-type PA-hexamer |
| 13 | 3.65 | Potentilla alba | 863.1790 | 864.1863 | C52H32O13 | 864.1843 | 2.31 | ПА-тример, “А” A-type PA-trimer |
|
| 14 | 3.76 | Potentilla alba | 1153.2616 | 576.1288 [M-2H]2– | 1154.2689 | C30H26O12 | 1154.2692 | –0.26 | ПА-тетрамер, типа “Б”, изомер3 B-type PA-tetramer, isomer3 |
| 15 | 3.78 | Potentilla alba | 595.1271 | 1153.2655 | 596.1344 | C33H24O11 | 596.1317 | 4.53 | Кверцетин 3- глюкози
7- ксилозид Quercetin 3-glucoside 7-xyloside |
| 16 | 3.80 | Potentilla megalantha | 1567.1411 | 783.0652 [М-2Н]2– | 1568.1484 | C68H48O44 | 1568.1518 | –2.17 | Сангуин H10 Sanguin H10 |
| 17 | 3.84 | Potentilla alba | 1441.3255 | 720.1610 [M-2H]2– | 1442.3328 | C75H62O30 | 1442.3326 | 0.14 | ПА-пентамер, типа “Б”, изомер2 B-type PA-pentamer, isomer-2 |
| 18 | 3.87 | Potentilla alba | 1441.3273 | 720.1553[М-2Н]2– | 1442.3346 | C75H62O30 | 1442.3326 | 1.39 | ПА-пентамер типа “Б”, изомер-3 B-type PA-pentamer, isomer-3 |
| 19 | 4.17 | Potentilla megalantha | 1869.1552 | 934.0693 [M-2H]2– | 1870.1625 | C82H54O52 | 1870.1581 | 2.35 | Агримонин Agrimonin |
Важным условием при масс-спектрометрической идентификации фенольного соединения является определение сигнала масс-спектра, который соответствует иону [М-Н]–. Точное значение [М-Н]– дает возможность идентифицировать соединение, используя различные базы масс-спектрометрических данных (ChemSpider; The Human Metabolome Database; METLIN; PubChem). Дополнительную информацию дает также изучение фрагментов, которые являются продуктами распада молекулярных ионов. У двух видах растения рода Potentilla определено 19 фенольных соединений, принадлежащих к различным классам. Например, сигналы масс-спектра с m/z 341.1080 и 683.2262 фенольного соединения 1 соответствуют значениям [М-Н]– и 2[М-Н]– ионов молекулы дисахарида, однако дополнительный фрагмент с m/z 191.0544, соответствующий хинной кислоте, свидетельствует о более сложной структуре фенольного соединения. В связи с этим соединение 1 предварительно идентифицировали как производное хинной кислоты (табл. 1). Фенольное соединение 2 было идентифицировано в экстракте лапчатки белой как хлорогеновая кислота. В его масс-спектре обнаружены два характерных для этого соединения пика 353.0880 и 707.1791 ионов [М-Н]– и 2[М-Н]–. Дополнительный фрагмент хинной кислоты с m/z 191.0544 в масс-спектре фенольного соединения 2 также свидетельствует о том, что это хлорогеновая кислота, которая представляет собой эфир кофейной и хинной кислоты. Изучение масс-спектра фенольных соединений 4 и 7 показало, что пик 289.07 соответствуют иону [М-Н]– флаван-3-ола. Исходя из положения на хроматограмме соединения идентифицировали как (+)-катехин и его изомер (+)-эпикатехин. Однако, наряду с ними, в масс-спектре обнаружили пики 245.08 и 205.05. Подтверждением того, что эти фрагменты относятся к молекулярному иону 4 и 7 является совпадение их масс-спектров.
Наряду с мономерами флаван-3-ола в экстракте P. alba обнаружено большое число олигомерных проантоцианидинов, состоящих из мономерных звеньев флаван-3-лов. Ионы ди-, три-, тетра-, пента- и гексамеры проантоцианидинов были идентифицированы в результате регистрации сигналов масс-спектра 577.1368, 865.1979, 1153.2616, 1441.3258, 1729.3903, которые соответствовали значениям m/z ионов [М-Н]–. Для исследованных олигомерных проантоцианидинов характерна регистрация сигналов масс-спектра, соответствующих ионам [M-2H]2–. Особенностью проантоцианидинов типа “Б” является наличие одной химической связи между структурными звеньями флаван-3-ола. К другому типу олигомерных соединений относятся проантоцианидины типа “А”, которые отличаются, тем, что образуют дополнительную эфирную связь между структурными единицами, в результате чего их масса уменьшается пропорционально увеличению степени полимеризации. В экстракте P. alba, полученной in vitro, определяется только одно соединение 13, которое относится к проантоцианидинам типа “А”. Проантоцианидины типа “А” не так часто встречаются в растениях, как проантоцианидины типа “Б”, но обладают более высокой биологической активностью [2]. В экстракте P. alba определено более десятка фенольных соединений, принадлежащих к флаванолам, производным оксикоричных кислот, но основное большинство фенольных соединений является проантоцианидинами или конденсированными таннинами.
В изученных ранее видах Potentilla показано высокое содержание проантоцианидинов типа “Б” прежде всего в корнях и корневищах. Конденсированные таннины содержатся в таких видах, как Potentilla viscosa, P. erecta и P. alba [2, 10].
В связи с тем, что разные виды лапчатки являются источником ценных вторичных метаболитов, представляет интерес исследования и других видов растения рода Potentilla. Таким перспективным видом, с точки зрения источника нового сырья, может являться плохо исследованная на сегодняшний день P. megalantha. Ввиду филогенетического родства с P. alba может иметь место сходство их вторичных метаболитов.
На рис. 4 представлен УЭЖХ-МСВР профиль фенольных соединений экстракта, полученного из растений-регенерантов P. megalantha, культивируемых in vitro на питательной среде, содержащей регуляторы роста. Хорошо видно, что в экстракте P. megalantha содержится гораздо меньше фенольных соединений, чем в P. alba. Обнаружено только два основных соединения, которые отсутствуют в растениях P. alba.
Рис. 4.
Масс-спектрометрический профиль фенольных соединений экстракта Potentilla megalantha, выращенной на питательной среде с добавлением гормона. Fig. 4. MS phenolic profile of the crude extract of Potentilla megalantha cultivated on the nutrient medium with BAP.

В экстракте P. megalantha было идентифицировано 2 гидролизуемых таннина. В масс-спектре соединения 16 обнаружены два сигнала 1567.1411 и 783.0652, которые соответствуют [М-Н]– и [М-2Н]2– ионам Сангуина H10 (табл. 1). В масс-спектре следующего фенольного соединения 19 из группы гидролизуемых таннинов присутствуют пики 1869.1552 и 934.0693, которые соответствуют ионам [М-Н]– и [M-2H]2– агримонина. Подтверждением того, что два иона принадлежат одному соединению агримонину, является совпадение их масс-спектрометрических профилей.
Гидролизуемые таннины стали широко известны благодаря подтвержденным разнообразным лечебным свойствам (противораковым, антибактериальным и противовоспалительным) [14].
Фенольное соединение агримонин, наряду с другими соединениями этого класса природных полифенолов, определено еще в трех видах растений рода Potentilla: P. erecta, P. discolor и P. anserina [2, 6].
ЗАКЛЮЧЕНИЕ
Проведен сравнительный анализ состава экстрактивных фенольных соединений Potentilla alba и P. megalantha, полученных методом клонального микроразмножения в условиях in vitro. В результате методом УЭЖХ-МСВР определены и идентифицированы соединения, принадлежащие флаваноидам, оксикоричным кислотам, гидролезуемым таниннам и проантоцианидинам.
Показано, что состав питательной среды, а именно наличие гормонов, не оказывает влияния на качественный состав фенольных соединений в растениях-регенерантах P. alba, полученных в условиях in vitro, но, как показано на хроматограмме, количество фенольных соединений значительно больше в растении, выращенном на питательной среде с гормонами.
Растения-регенеранты P. megalantha содержит значительно меньше число фенольных соединений, чем P. alba. При этом P. alba накапливает в основном проантоцианидины, тогда как P. megalantha – эллагитаннины.
Список литературы
Смык Г.К. 1976. Использование лапчатки белой как нового лекарственного растения, восстановление запасов ее в природе и возможности культуры. В кн.: Новые культуры в народном хозяйстве и медицине. Ч. 1. С. 41–42.
Tomczyk M., Lattéb K.P. 2009. Potentilla – A review of its phytochemical and pharmacological profile. – J. Ethnopharm. 122(2): 184–204. https://doi.org/10.1016/j.jep.2008.12.022
Шериева Ф.К. 2015. Фармакогностическое изучение лапчатки белой – Potentilla alba L., интродуцированной на Северном Кавказе: Дис. … канд. фармац. наук. Волгоград. 121 с.
Xu J.F., Liu W.D., Du R.F. 2010. Flavonol glycosides and monoterpenoids from Potentilla anserine. – J. Asian Nat. Prod. Res. 6: 529–534. https://doi.org/10.1080/10286020.2010.489826
Mari A., Lyon D., Fragner L., Montoro P. 2013. Phytochemical composition of Potentilla anserina L. analyzed by an integrative GC-MS and LC-MS metabolomics platform. – Metabolomics. 3: 599–607. https://doi.org/10.1007/s11306-012-0473-x
Olennikov D.N., Kashchenko N.I., Chirikova N.K., Kuzmina S.S. 2015. Phenolic profile of Potentilla anserina L. (Rosaceae) herb of Siberian origin and development of a rapid method for simultaneous determination of major phenolics in P. anserina pharmaceutical products by microcolumn RP-HPLC-UV. – Molecules. 20: 224–248. https://doi.org/10.3390/molecules20010224
Matkowski A., Swiader K., Slusarczyk S. 2006. Free radical scavenging activity of extracts obtained from cultivated plants of Potentilla alba L. and Waldsteinia geoides L. – Herbapolonica. 52(4): 44–46.
Oszmianski J., Wojdylo A., Lamer-Zarawska E., Swiader K. 2007. Antioxidant tannins from Rosaceae plant roots. – Food Chem. 100(2): 579–583. https://doi.org/10.1016/j.foodchem.2005.09.086
Gritsenko O.M., Smik G.K. 1977. Phytochemical study of Potentilla alba. – Farmatsevtichnii Zhurnal (Kiev). 1: 88–89.
Осипов В.И., Поляков Н.А., Сидельников А.Н. 2017. Проантоцианидины корней и корневищ Рotentilla alba (Rosaceae). – Растительные ресурсы. 53(1): 114–125.
Tomczyk, M., Leszczyńska K., Jakoniuk P. 2008. Antimicrobial activity of Potentilla species. – Fitoterapia. 79: 592–594. https://doi.org/10.1016/j.fitote.2008.06.006
Tomczyk M., Pleszczynska M., Wiater A. 2010. Variation in total polyphenolics contents of aerial parts of Potentilla species and their anticariogenic activity. – Molecules. 15(7): 4639–4651. https://doi.org/10.3390/molecules15074639
Поляков Н.А., Калашникова Е.А., Киракосян Р.Н., Хазиева Ф.М. 2020. Особенности размножения лапчатки белой (Potentilla alba L.) и лапчатки крупноцветковой (Potentilla megalantha L.) в условиях in vitro. – Вопросы биологической, медицинской и фармацевтической химии. 5: 50–56. https://doi.org/10.29296/25877313-2020-03-09
Gasperotti M., Masuero D., Guella G. 2013. Evolution of ellagitannin content and profile during fruit ripening in Fragaria spp. – J. Agric. Food Chem. 61(36): 8597–8607. https://doi.org/10.1021/jf402706h
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


