Растительные ресурсы, 2022, T. 58, № 1, стр. 43-57
Морфогенез и рост вегетативного побега Pseudotsuga menziesii (Pinaceae), интродуцированной в Санкт-Петербурге
В. Б. Скупченко *
1 Санкт-Петербургский государственный лесотехнический университет им. С.М. Кирова
г. Санкт-Петербург, Россия
* E-mail: vlask@VS16579.spb.edu
Поступила в редакцию 12.07.2021
После доработки 28.09.2021
Принята к публикации 03.12.2021
- EDN: LLBLTV
- DOI: 10.31857/S0033994622010149
Аннотация
У псевдотсуги Мензиса (Pseudotsuga menziesii Mirb. Franco), интродуцированной в Санкт-Петербурге, изучены процессы формирования апикальной меристемой новой почки, зачатка охвоенного побега, рост зачатков стебля и хвои в почке и после ее раскрывания, до завершения вегетации. При наступлении положительных средних суточных температур в начале апреля апекс побега увеличивается по объему в 2—3 раза и приступает к формированию новой почки, которое завершается в середине третьей декады августа. Затем апекс многократно разрастается в объеме, приобретает полуэллипсоидальную форму и приступает к заложению зачатка охвоенного побега. В апексе, от основания до апикальных инициалей развивается широкий слой периферической меристемы, обеспечивающей возможность одновременного заложения большого числа примордиев хвои, что существенно ускоряет процесс морфогенеза зачатка побега. В отличие от катафиллов почки, в примордиях хвои формируется прокамбиальный пучок. Рассматриваются факторы, обусловливающие возможность транспорта метаболитов по прокамбию в меристемах. Весной рост зачатков стебля и хвои в почке и после ее раскрывания до конца второй декады мая происходит в основном путем деления клеток, при этом в проводящих пучках значительно преобладает развитие первичной флоэмы над первичной ксилемой. В этот период наблюдается прямолинейная зависимость от температуры средней суточной скорости удвоения длины хвои и стебля, которая у последнего в 1.72 раза ниже. Рост хвои в длину возможен уже при средней суточной температуре воздуха порядка 1.23 °C, а у стебля при 2.9 °C. Завершение продольного роста стебля, формирования почки и начало заложения зачатка охвоенного побега наступает в середине третьей декады августа, что на месяц позже, чем условиях Британской Колумбии Канады. Благодаря высокой активности морфогенеза апикальная меристема до конца вегетационного периода осуществляет в полном объеме формирование зачатка нового побега в почке.
Многолетий древесный организм ежегодно формирует новые вегетативные побеги, количество, размеры и функциональная активность почек, стебля и хвои которых развиваются в соответствии с конкретными уровнями действия экологических факторов в зоне жизнедеятельности апикальных меристем, что составляет важное звено адаптации растения к постоянно изменяющимся условиям окружающей среды. В связи с этим большое теоретическое и практическое значение имеют сведения о биологии развития и роста вегетативных побегов интродуцентов в новых условиях их выращивания.
Рост многоклеточного растения осуществляется путем увеличения числа клеток в результате их деления, а также увеличения размеров клеток за счет их растяжения. На ранних этапах развития органов преобладают клеточные деления, а затем наступает фаза, на которой начинается увеличение размеров клеток путем их роста растяжением [1]. Клеточное деление в растениях контролируется множеством внешних и внутренних регуляторов, при этом важнейшая роль отводится эндогенным (генетическим) факторам [2]. Известно, что митотическое деления ядер и последующий цитокинез, приводящий к образованию новых клеток, осуществляются в результате сложных биохимических подготовительных процессов, протекающих в продолжении G1, S и G2 периодов интерфазы митоза [3–5]. Происходит синтез и накопление ДНК, РНК, структурных, энзиматических, двигательных белков, липидов биологических мембран [6]. Накопление энергетических продуктов и образование строительных молекулярных блоков для синтеза комплекса веществ осуществляется в результате активизации дыхания [7]. Для этого клетка наряду с углеводами должна быть обеспечена достаточным резервом минеральных элементов [8]. Эти процессы протекают при наличии соответствующего соотношения фитогормонов.
Процесс дифференциации и объемного роста клетки осуществляется иным набором питательных веществ и фитогормонов – для построения полисахаридной оболочки клетка больше нуждается в снабжении продуктами фотосинтеза и, вероятно, в меньшей мере, чем при митозе, минеральными элементами. Это установлено в результате подробных цитологических исследований основ дифференциации клеток ксилемы корня ели (Picea abies Karst.) [9].
Получены сведения о том, что у ели обыкновенной за период от начала вегетационного периода до момента максимального набухания почки, в зачатке побега степень удвоения исходной длины стебля равная 2.830, практически совпадает с величиной удвоения количества клеток – 2.834. Следовательно, на основании показателей роста в длину зачатка побега ели в почке допускается возможность делать заключение о темпе деления клеток сердцевины перегородками поперечными оси стебля [10].
Псевдотсуга Мензиса (Pseudotsuga menziesii Mirb. Franco) в США и Канаде является одним из самых важных источников древесины. Она успешно интродуцирована в Россию и по своим техническим показателям ее древесина значительно превосходит ель и пихту, приближаясь к показателям лиственницы [11]. Культуры псевдотсуги имеются в Московской, Ленинградской, Липецкой, Воронежской, Калининградской областях, в Республике Татарстан. Псевдотсуга Мензиса в условиях Башкирского Предуралья продемонстрировала высокую продуктивность, успешное естественное возобновление, хорошее жизненное состояние, нормальный ритм сезонного развития, а по темпу роста она существенно превысила пихту [12]. В парке Санкт-Петербургского Лесотехнического Университета псевдотсуга впервые испытана Э.Л. Вольфом [13].
Установлено, что в Канаде (район Виктория, Британская Колумбия) цикл развития вегетативных побегов псевдотсуги Мензиса весной начинается в середине третьей декады марта с процесса активизации вегетативных почек. Раскрывание вегетативных почек происходит через семь недель в середине мая. Завершение продольного удлинения побега – в середине третьей декады июня, а инициация кроющих чешуй почки в середине первой декады июля. От середины июля до середины ноября происходит инициация листьев. Область сердцевинной диафрагмы начинает формироваться в августе после того, как большинство листовых примордиев было инициировано. Она состоит из толстостенных клеток и простирается через сердцевину между прокамбиальными тяжами и в кору в основании зачатка побега. В конце ноября вегетативная почка переходит в состояние покоя [14].
Цель исследования состоит в изучении процессов заложения, гистогенеза и клеточного роста почек, стебля и хвои вегетативного побега псевдотсуги Мензиса, в течение годичного цикла морфогенеза и их взаимосвязи с температурным режимом в условиях Санкт-Петербурга. Эти данные позволят более точно разрабатывать практические мероприятия по стимулированию физиологических процессов в период роста структур побегов путем деления клеток, и в период их роста растяжением клеток на различных этапах морфогенеза. Полученные сведения по биологии роста псевдотсуги Мензиса могут быть использованы при биоиндикационных исследованиях и мониторинге окружающей среды.
МАТЕРИАЛ МЕТОДЫ
Объектами исследования служили 41-летние экземпляры Pseudotsuga menziesii (Mirb.) Franco высотой порядка 10 м, произрастающие в верхнем дендросаде на территории Ботанического сада Санкт-Петербургского Государственного лесотехнического университета. Изучение процессов морфогенеза и роста выполнялось в нижней части кроны на побегах 3-го порядка ветвления 1–2-ой терминальных мутовок ветвей, обращенных к периферии биогруппы на северо-восток. Фенологические наблюдения, взятие образцов побегов, измерение их параметров и гистологическая фиксация осуществлялись регулярно от начала до завершения вегетационного периода в 12 сроков. По каждому сроку наблюдения выполнялось предварительное измерение размеров стебля, количества и размеров хвои и почек 2–3 годичных побегов текущего и предшествующего вегетационных периодов, которые фиксировали и хранили в 70%-м этаноле для последующего анатомо-морфологического исследования. Постоянные микропрепараты готовили на основе срезов толщиной 20–30 мкм, которые изготавливали на вибрационном микротоме [15]. Срезы окрашивали нуклеальными красителями метиловым зеленым – пиронином и заключали в пихтовый бальзам [16, 17]. Микропрепараты изучали с помощью микроскопа “Биомед 5” в обычном и поляризованном свете для выявления клеточных структур с двойным светопреломлением. Проведена цифровая микросъемка. Морфометрический анализ объектов выполнен путем измерения окулярным микрометром под микроскопом размеров клеток и органов на срезах побега, а также при помощи программного обеспечения обработки изображений для цифровых камер Levenhuk.
Средняя суточная скорость удвоения длины стебля и хвои (Iудв.) определялась по формуле:
Метеорологические данные получены на сайте www.atlas-yakutia.ru [19] (Архив погоды в городах России за последние полвека). Все измерения выборочных средних выполнены с ошибкой не более 5% [20].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Формирование почки
Согласно современным представлениям о растениях как модульных организмах, типичным органом метамерного строения является побег, причем модульность его имеет две степени: 1 – фитомеры, 2 – приросты. Фитомеры при большом их количестве (выражающемся в розеточном строении побега) могут располагаться мутовчато или спирально, приросты же – всегда последовательны, метамерны [21]. Побег псевдотсуги, как и других хвойных типа пихты, ели, имеющий многочисленную хвою, также целесообразно рассматривать как совокупность фитомеров. Каждый из них включает игловидный лист и относящийся к нему стеблевой сектор. В составе почки к фитомеру относится катафилл – кроющая чешуя и стеблевой сектор, расположенный в его основании.
Цикл морфогенеза нового побега псевдотсуги Мензиса начинается весной после зимнего покоя с заложения молодой почки апикальной меристемой, расположенной на верхушке меристематического зачатка побега в зрелой материнской почке, которые сформированы в предшествующем вегетационном периоде. При повышении температуры выше 0 °С под покровами материнской почки начинается рост путем клеточных делений всех структур меристематического зачатка побега – апекса, стебля и листовых бугорков. Апекс побега имеет полуэллипсоидальную форму и минимальный сезонный объем (рис. 1, № 1). Его гистологическая зональность соответствует “типу гинкго”, характерного для голосеменных растений [22, 23]. На верхушке апекса расположена группа апикальных инициальных клеток. Ниже нее – зона центральных материнских клеток. Поверхность апекса покрыта одним слоем клеток протодермы. На внешней стороне их наружной стенки имеется тонкий слой кутикулы, предохраняющей апекс от высыхания. Глубже расположена периферическая меристема – органогенная зона, которая формирует боковые зачатки кроющих чешуй, состоящая из двух периклинальных слоев клеток. Последняя окружает два периклинальных слоя клеток прокамбия, отделяющих ее от сердцевинной меристемы, которая занимает осевое положение в апексе.
Рис. 1.
Формирование апикальной меристемой структур вегетативного побега и их рост у Pseudotsuga menziesii (Pinaceae), интродуцированной в Санкт-Петербург. № 1. Апекс побега в начале вегетационного периода: 1 – апикальные инициальные клетки, 2 – центральные материнские клетки, 3 – протодерма, 4 – периферическая меристема, 5 – прокамбий, 6 – сердцевинная меристема. № 2. Молодая терминальная вегетативная почка в начале июля при длине стебля 68% от годичного прироста: 1 – первый ярус кроющих чешуй, 2 – разрастающаяся чашеобразная поверхность коры стебля почки, 3 – ряды растущих клеток паренхимы коры почки, 4 – молодой зачаток кроющей чешуи, 5 – апекс побега. № 3. Терминальная вегетативная почка в начале этапа формирования структур будущего охвоенного побега. 1 – зачатки хвои, 2 – прокамбий ценрального цилиндра зачатка стебля, 3 – периферическая меристема апекса, 4 – сердцевинная меристема с осевыми рядами уплощенных клеток, 5 – инициальная группа клеток будущего листового зачатка в периферической меристеме, 6 – сердцевинная диафрагма, 7 – верхняя граница зачатка охвоенного побега, 8 – чашеобразное окружение корой стебля почки зачатка побега и апекса. № 4. Стебель в начале третьей декады мая длиной 19% от общего сезонного осевого прироста: 1 – эпидерма, 2 – паренхима первичной коры, 3 – смоляное вместилище, 4 – клетки с таниновыми вакуолями, 5 – флоэма, 6 – камбиальная зона, 7 – ксилема, 8 – тонкостенные клетки сердцевины, 9 – склереиды. № 5. Стебель в начале июня длиной 54.7% годичного прироста: 1– эпидерма, 2 – пробка, 3 – феллоген, 4 – паренхима первичной коры, 5 – смоляное вместилище, 6 –клетки с таниновыми вакуолями, 7 – флоэма, 8 – камбиальная зона, 9 – ксилема, 10 – паренхима сердцевины, 11 – листовая подушка. № 6. Стебель в начале третьей декады сентября длиной 100% годичного прироста: 1 – первичная ксилема, 2 – ранняя вторичная ксилема, 3 – поздняя вторичная ксилема, 4 – флоэма. № 7. Зачаток побега в начале вегетационного периода: 1 – примордий хвои, 2 – прокамбий хвои, 3 – прокамбий центрального цилиндра стебля, 4 – паренхима сердцевины, 5 – апикальная меристема. № 8. Зачаток хвои в период раскрывания материнской почки в начале второй декады мая: 1– эпидерма, 2 – меристема столбчатого мезофилла, 3 – ксилема, 4 – камбиальная зона, 5 – флоэма, 6 – меристема губчатого мезофилла. № 9. Зрелая хвоя в первой декаде сентября: 1 – эпидерма, 2 – гиподерма, 3 – столбчатый мезофилл, 4 – губчатый мезофилл, 5 – эндодерма, 6 – ксилема, 7 – флоэма, 8 – смоляное вместилище. Масштабная линейка: № 1 – 50 мкм, № 2, 3 – 200 мкм, № 4 – 100 мкм, № 5, 6 – 500 мкм, № 7 – 200 мкм, № 8 – 50 мкм, № 9 – 200 мкм. Fig. 1. Initiation in apical meristem, and growth of vegetative shoot structures in Pseudotsuga menziesii (Pinaceae) introduced to St. Petersburg. No. 1. The apex of the shoot at the beginning of the growing season: 1 – apical initial cells, 2 – central mother cells, 3 – protoderm, 4 – peripheral meristem, 5 – procambium, 6 – pith meristem. No. 2. Young terminal vegetative bud in early July; stem is 68% of the annual length increment: 1 – the first layer of bud scales, 2 – the expanding cup-shaped surface of the stem primary bark, 3 – rows of growing parenchymal cells of the bud cortex, 4 – newly initiated cataphyll primordia, 5 – shoot apex. No. 3. Terminal vegetative bud at the stage of shoot initiation. 1 – primordial needles, 2 – procambium of the central cylinder, primordium stem unit, 3 – peripheral apex meristem, 4 – ground meristem with columns of flattened cells, 5 – is the initial group of cells of the future leaf primordium in the peripheral meristem, 6 – diaphragm – cell layer at the base of stem apical meristem, 7 – is the upper limit of the primordium shoot with needles, 8 – bark surrounding stem of the primordium apical shoot bud. No. 4. The stem at the beginning of the third decade of May; stem is 19% of the annual length increment: 1 – epidermis, 2 – parenchyma of the primary cortex, 3 – resin receptacle, 4 – cells with tannin vacuoles, 5 – phloem, 6 – cambial zone, 7 – xylem, 8 – pith parenchyma cell with thin walls, 9 – sclereids. No. 5. Stem at the beginning of June; stem is 54.7% of the annual length increment: 1 – epidermis, 2 – cork, 3 – phellogen, 4 – parenchyma of the primary cortex, 5 – resin receptacle, 6 – cells with tannin vacuoles, 7 – phloem, 8 – cambial zone, 9 – xylem, 10 – pyth parenchyma, 11 – leaf cushion. No. 6. Stem at the beginning of the third decade of September; stem is 100% of the annual length increment: 1 – primary xylem, 2 – early secondary xylem, 3 – late secondary xylem, 4 – phloem. No. 7. Primordial shoot at the beginning of the growing season: 1 – primordium needles, 2 – procambium of needles, 3 – procambium of the stele, 4 – pyth parenchyma, 5 – apical meristem. No. 8. Primordial needle during maternal bud burst at the beginning of the second decade of May: 1 – epidermis, 2 – meristem of palisade mesophyll, 3 – xylem, 4 – cambial zone, 5 – phloem, 6 – meristem of spongy mesophyll. No. 9. Mature needles in the first decade of September: 1 – epidermis, 2 – hypoderm, 3 – palisade mesophyll, 4 – spongy mesophyll, 5 – endoderm, 6 – xylem, 7 – phloem, 8 – resin receptacle. Bar: No. 1 – 50 μm, No. 2, 3 – 200 μm, No. 4 – 100 μm, No. 5, 6 – 500 μm, No. 7 – 200 μm, No. 8 – 50 μm, No. 9 – 200 μm.
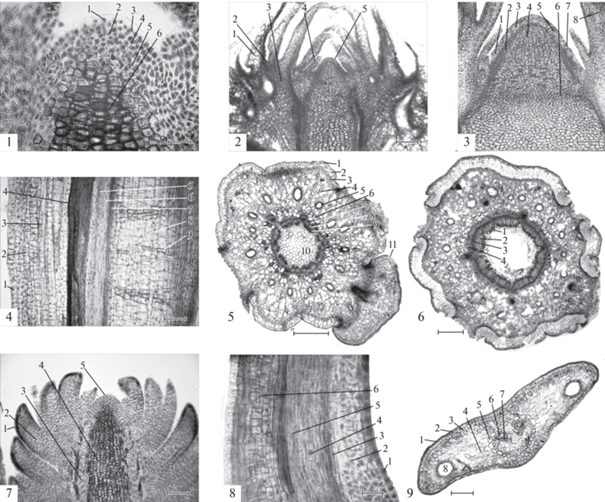
Клетки прокамбия образуют периклинальные ряды, направленные к верхушке апекса. Они являются продолжением прокамбиальных пучков центрального цилиндра стебля зачатка побега, которые сформировали элементы первичных флоэмы и ксилемы. Клетки прокамбия удлинены вдоль рядов с коэффициентом прозенхимности 2–3, благодаря чему образуют структурную анизотропию. Наряду с этим продольные стенки клеток прокамбия обладают более высоким двойным светопреломлением, чем у поперечных стенок, что связано с присутствием в них большего количества фибрилл с кристаллической целлюлозой. По данным К. Эзау [24], двойным лучепреломлением оболочек растительных клеток обладает кристаллическая форма целлюлозы.
Весной апекс побега первоначально начинает объемный рост и к концу второй декады апреля (например, в 2010 г.) при длине зачатка стебля 3.5% от его годичного прироста увеличивается по объему в 3 раза по отношению к ранневесеннему состоянию (рис. 2). Наряду с этим он приступает к закладке фитомеров кроющих чешуй новой почки в виде бугорков и принадлежащих им стеблевых структур, из которых сформировался их первый ярус. Примордии кроющих чешуй – катафиллов после заложения начинают активный продольный рост первоначально путем пролиферации клеток, а затем их объемным ростом с дальнейшей дифференциацией.
Рис. 2.
Сезонный цикл динамики изменения объема терминального апекса вегетативного побега Pseudotsuga menziesii (Pinaceae), интродуцированной в Санкт-Петербург. По горизонтали – дата; по вертикали – объем апекса, мм3. Fig. 2. Seasonal dynamics of the vegetative shoot apex volume in Pseudotsuga menziesii (Pinaceae) introduced to St. Petersburg. X-axis – date; y-axis – the volume of the apex, mm3.

К периоду раскрывания материнской почки в начале второй декады мая апекс сформировал укороченный стебель и два слоя кроющих чешуй новой почки, что составляет 17% от их будущего общего числа. Паренхима коры стебля почки сложена типичными мелкими меристематическими клетками, способными к активному делению.
Процесс закладки апексом новых разрастающихся фитомеров кроющих чешуй почки продолжается по мере активного продольного роста охвоенного стебля побега. Поверхность стебля почки, несущая кроющие чешуи, первоначально приобретает плоскую форму. Затем в процессе роста рядов клеток паренхимы коры в направлении параллельном продольной оси поверхность стебля почки приобретает чашевидную форму и приподнимается над основанием апекса.
К началу июля (2 июля) при длине листонесущего стебля 68.6% от общего годичного прироста апекс формирует 6 слоев кроющих чешуй, что составляет 50% от их общего числа в зрелой почке. Причем основания средних слоев кроющих чешуй оказываются приподнятыми выше основания апекса побега в результате разрастания коры стебля почки (рис. 1, № 2).
В период завершения активного продольного роста охвоенного стебля, достигшего 88.4% от его полного сезонного прироста в начале третьей декады июля, сформировалось больше половины (7–8 слоев) кроющих чешуй почки. Верхний край чашевидной коры стебля почки превышает высоту апекса в два раза. В паренхиме коры почки сформировалось множество крупных смоляных вместилищ. Проводящий цилиндр укороченного стебля почки вырос по диаметру больше цилиндра удлиненного охвоенного стебля. Процесс заложения фитомеров почки завершается к середине третьей декады августа, формированием 11–12 слоев кроющих чешуй.
В последующем апекс приступает к этапу формирования меристематических структур охвоенного побега новой генерации, который продолжит развитие в почке в следующем вегетационном периоде. Первоначально апекс включается в активный объемный рост, увеличившись в 14.6 раза по отношению к началу вегетационного периода (рис. 1, № 3). В апексе в 2.5–3 раза по сравнению с предыдущим этапом расширяется периферическая меристема на всем ее протяжении до апикальных инициальных клеток. Периферическая меристема обладает периодичностью структуры в виде широких антиклинальных областей с большей интенсивностью окраски нуклеальными красителями, которые разделяются узкими зонами с низкой базофилией. Это свидетельствует о том, что еще до вычленения в виде боковых примордиев в периферической меристеме формируются зоны материнских клеток листовых фитомеров, что также наблюдалось в апексах побегов ели [25]. При переходе апекса псевдотсуги к морфогенезу нового охвоенного побега, в его основании происходит вычленение зачатков листовых фитомеров, которые, в отличие от фитомеров кроющих чешуй, растут в основном путем деления клеток, сохраняющих меристематичность. При заложении каждого зачатка хвои в его оси формируется прокамбиальный пучок, чего не происходит при заложении катафиллов почки.
К концу первой декады сентября в терминальных почках апекс сформировал четыре яруса примордиев хвои, расположенных на зачатке стебля, имеющего форму усеченного конуса. Диаметр листовых примордиев, параллельный продольной оси стебля превышает их высоту в два раза. При заложении листовых фитомеров расширилась подстилающая периферическую меристему зона прокамбия. В основании сердцевинной меристемы зачатка листонесущего побега началось формирование диафрагмы, которая отделяет его от зрелых структур стебля почки.
К началу третьей декады сентября сформировалось 7 ярусов примордиев хвои, и при этом апекс уменьшился в объеме более чем в два раза. Темп нарастания числа примордиев хвои при средней суточной температуре 14.0 °C в этот период составил 1 ярус в 4 дня. Наряду с этим в результате пролиферативного роста длина ранее заложенных зачатков хвои стала равной их ширине. Прокамбиальные пучки центрального цилиндра стебля значительно увеличились по ширине до 6–7 периклинальных слоев клеток, расположенных в виде правильных радиальных рядов. В сердцевинной меристеме сформировались осевые ряды уплощенных клеток с коротким диаметром параллельным продольной оси стебля, которые обеспечивают ее преимущественно продольный рост. Сердцевинная диафрагма непосредственно контактирует с прокамбиальными пучками, следующими в центральный цилиндр стебля зачатка побега, обеспечивая трофику меристемы сердцевины. В почке в основании первых внешних кроющих чешуй образовалась перидерма.
Процесс формирования апексом зачатков фитомеров охвоенной части побега новой генерации продолжился до середины третьей декады октября. В общем итоге за вегетационный период в терминальной почке побегов 3 порядка ветвления апекс сформировал полный набор – 10–11 их ярусов зачатков фитомеров хвои. В продолжение зимнего периода при отрицательных средних суточных температурах морфогенез апекса полностью затормаживается.
Рост меристематических структур зачатка стебля после зимнего покоя
Весной при повышении средних суточных температур воздуха выше 0 °C все структуры зачатка побега в почке сохраняют меристематичность и начинают рост путем деления клеток. Основной объем в зачатке стебля составляют элементы паренхимы – сердцевина, радиальные лучи, листовые лакуны, первичная кора и листовые подушки, которые обеспечивают его продольный и радиальный рост в начале вегетационного периода. Меристема паренхимы представляет собой совокупность материнских клеток, каждая из которых в результате деления оболочкой поперечной продольной оси стебля дает начало будущей осевой колонке. В колонках образуются уплощенные клетки, с более коротким диаметром параллельным продольной оси стебля. Таким образом, в стебле формируется анизотропная структурная система клеток, которая под действием осмотических процессов и тургора создает механический вектор осевого удлинения стебля. Прокамбий центрального цилиндра начинает формирование элементов первичной флоэмы и ксилемы.
В конце первой декады апреля при сумме положительных температур 95 °C зачаток стебля имеет длину 2.6% от годичного прироста. В центральном цилиндре стебля сформировалось 2 слоя кольчатых трахеид первичной ксилемы и 3 слоя ситовидных клеток первичной флоэмы (рис 1, № 7). Они разделены прокамбиальной зоной шириной 4 слоя клеток. Клетки прокамбия центрального цилиндра и листовых следов образуют правильные радиальные ряды. Поверхность стебля целиком покрыта основаниями зачатков хвои.
Первоначально в центральном цилиндре стебля проводящие пучки осуществляют радиальный рост преимущественно за счет более активного увеличения числа периклинальных слоев клеток прокамбия и первичной флоэмы, чем первичной ксилемы. Максимум расширения прокамбиальной зоны до 7–8 слоев клеток происходит в период распускания почки в начале второй декады мая при длине стебля в 7.2% от общего годичного прироста. Затем число слоев клеток прокамбия уменьшается в результате ускорения их дифференциации в проводящие ткани. Двукратное преобладание числа слоев клеток флоэмы над ксилемой сохраняется до начала июня, когда длина стебля достигает около половины годичного продольного прироста (54.7%) (рис. 1, № 5). К этому времени происходит объединение проводящих пучков стебля в единый цилиндр. Под эпидермой образовался один слой клеток феллемы, положивший начало развитию перидермы. Большой объем в стебле занимает паренхима первичной коры с множеством смоляных ходов [26, 27]. В последующем затормаживается новообразование флоэмы, в результате чего к периоду завершения активного продольного роста стебля в начале третьей декады июня число ее периклинальных слоев клеток составляет около 80% от ксилемы. Общий радиальный прирост ксилемы проводящего цилиндра стебля за вегетационный период в начале третьей декады сентября достигает 14–15 периклинальных слоев клеток, из которых 4 составляют позднюю часть годичного прироста.
Рост стебля псевдотсуги по продольной оси в начальный период вегетации тесно коррелирует с температурой. В частности установлено, что средняя суточная скорость удвоения длины стебля имеет прямолинейную зависимость от температуры воздуха при его росте внутри почки и в начальный период после распускания почки до начала третьей декады мая, когда он достигает длины около 19% от общего сезонного осевого прироста (рис. 1, № 4; рис. 3). В этот период рост стебля осуществляется главным образом путем деления клеток паренхимы, занимающей основной объем стебля, сохраняющих меристематичность и варьирующих по размерам в небольшом интервале величин. Например, в начале вегетационного периода в конце первой декады апреля продольный диаметр клеток сердцевинной меристемы составляет 13.4 мкм, в периферической меристеме – 12.3 мкм, а в период распускания почки при длине стебля 7.2% от сезонного прироста продольный диаметр клеток сердцевинной меристемы составляет 13.8 мкм, паренхимы коры – 13.3 мкм, паренхимы листовых подушек 9.3 мкм. Таким образом, у псевдотсуги в этот период зависимость удвоения длины стебля от температуры может рассматриваться в тесной корреляции со скоростью удвоения числа клеток стебля. Линейное уравнение скорости удвоения длины стебля показывает, что теоретически деление клеток стебля начинается при средней суточной температуре воздуха равной 2.9 °C. В интервале средних суточных температур 10–20 °C скорость удвоения длины стебля псевдотсуги возрастает в 3 раза, а в интервале 5.8–15.8 °C – 4.33 раза. Это соответствует известному в физической химии термическому коэффициенту Q10, согласно которому скорость химических реакций при повышении температуры на каждые 10 градусов возрастает в 2–3 раза [28].
Рис. 3.
Температурная зависимость средней суточной скорости удвоения длины зачатка стебля охвоенного побега псевдотсуги Мензиса в начале вегетационного периода условиях Санкт-Петербурга. По вертикали – средняя суточная скорость удвоения длины зачатка стебля; по горизонтали – средняя суточная температура воздуха, °C. 1 – удвоение длины стебля; 2 – линейная (удвоение длины стебля). Fig. 3. Relationship between average daily temperature and average daily rate of primordial twofold shoot elongation in Pseudotsuga menziesii (Pinaceae) at the beginning of the growing season in St. Petersburg. Y-axis – the average daily rate of twofold primordial shoot elongation; x-axis – the average daily air temperature, °C. 1 – twofold stem elongation; 2 – linear (twofold stem elongation).

Рост меристематических структур зачатков хвои после зимнего покоя
Ранней весной меристематический зачаток побега содержит полный набор – 10–11 ярусов примордиев хвои будущего годичного прироста побега. Зачатки хвои плотно примыкают между собой, практически не имея свободных участков поверхности стебля между основаниями. Общий объем зачатков хвои превышает объем стебля в 1.4 раза. При сумме положительных температур 96.2 °C в конце первой декады апреля средняя длина зачатков хвои составляет около 2.0% от длины зрелой хвои (рис. 1, № 7). В прокамбиальных тяжах хвои сформировалось по одному слою ситовидных клеток первичной флоэмы. Все клетки центрального цилиндра зачатков хвои узкие и более длинные, с узкими и более длинными ядрами, чем в эндодерме и мезофилле. Клетки гиподермы также более вытянутые, чем в эпидерме. Внешняя стенка клеток эпидермы с тонкой кутикулой. В мезофилле на дорсальной стороне на концах хвоинок появились мелкие двоякосветопреломляющие апопластные включения оболочек клеток. Подобные включения, содержащие липидный компонент в кристаллической форме, который окружает водорастворимую часть и представляющие собой некоторый фонд метаболитов, участвующих в поддержании активных ростовых процессов меристематических структур зачатков побегов, расположенных под покровами почки наблюдались у ели [29].
В зачатках хвои, достигших 3.7% от длины зрелой хвои к концу второй декады апреля, в проводящих пучках образовалось по 3 периклинальных слоя ситовидных клеток флоэмы и 2 периклинальных слоя трахеид ксилемы. Над флоэмой проводящих пучков сформировались клетки с таниновыми вакуолями. Клетки центрального цилиндра хвои вытянуты вдоль продольной оси хвои. Произошло накопление апопластных включений оболочек клеток на дорсальной стороне хвои от основания до ее окончания, где их содержится особенно много. В мезофилле клетки квадратного сечения образуют продольные ряды. Их ядра имеют высокую спирализацию хроматина, что является признаком активности деления клеток. Большинство ядер в основном сплющены по оси хвои и вытянуты поперек нее. Это свидетельствует о том, что экваториальная плоскость митотического веретена хромосом большинства клеток мезофилла располагается поперек оси хвои, что и определяет такое же положение клеточной пластинки, разделяющей новые клетки.
К концу третьей декады апреля длина примордиев хвои достигла 5.13% от сезонного прироста, на их дорсальной стороне в основании началось формирование листовой подушки и отделительного слоя над ней. В период раскрывания материнской почки в начале второй декады мая листовые примордии достигли длины порядка 13.7% от зрелой хвои (рис. 1, № 8). Клетки эпидермы квадратного сечения снаружи покрыты кутикулой. Их антиклинальные стенки содержат больше кристаллической целлюлозы, чем периклинальные, что способствует свободному продольному росту хвои. Мезофилл имеет клетки квадратного сечения со спирализованным хроматином ядер, которые делятся оболочками поперечными продольной оси хвои. В нем произошло накопление большого количества крахмала. В ксилеме образовалось 2–3 слоя трахеид, во флоэме – 4–5 слоев ситовидных клеток. В проводящем цилиндре все клетки длинные узкие с длинными ядрами. В зоне отделительного слоя в листовой подушке и в основании хвои на дорсальной стороне клетки эпидермы столбчатые антиклинально вытянутые. В листовой подушке паренхимные клетки с большими ядрами и крупными округлыми начинающими развитие таниновыми вакуолями.
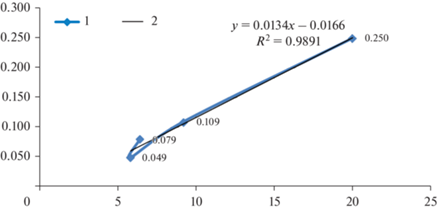
Рост листовых зачатков в период развития под покровами материнской почки и после ее раскрывания до 54.9% длины от зрелой хвои в конце второй декады мая осуществляется в основном путем деления слагающих их меристематических клеток, размер которых имеет небольшое варьирование. Например, в начале второй декады мая в мезофилле, занимающем основной объем хвои, диаметр клеток параллельный продольный оси хвои колеблется в интервале 14–16 мкм. Поэтому, так же, как и в случае весеннего развития зачатка охвоенного стебля, есть основание считать скорость удвоения длины хвои показателем темпа ее клеточного деления. Установлено, что в этот период средний суточный показатель удвоения длины хвои в интервале средней суточной температуры воздуха 6–20 °C имеет практически прямолинейную зависимость (рис. 3). Согласно этой зависимости, начало роста хвои в длину теоретически может осуществляться путем деления клеток уже при средней суточной температуре воздуха порядка 1.23 °C (у стебля 2.9 °C), что значительно ниже, чем начало роста в длину стебля путем клеточных делений в 2.4 раза. Причем в интервале средних суточных температур 10–20 °C средняя суточная скорость удвоения длины хвои составляет 0.19, а этот же показатель для стебля меньше в 1.72 раза. Это свидетельствует о том, что в начале периода вегетации темп роста зачатков хвои молодого побега в почке существенно преобладает над темпом роста зачатка стебля. При этом в интервале средних суточных температур 10–20 °C средняя суточная скорость удвоения длины хвои возрастает в 2.1 раза, а в диапазоне средних суточных температур 5.81–15.81 °C средняя суточная скорость удвоения длины хвои возрастает в 4.06 раза.
Таким образом, в данный период роста зачатков хвои, так же, как и у стебля, выполняется известное правило физической химии, согласно которому повышение температуры на каждые 10 °C соответствует увеличению скорости химических и биологических реакций в 2–3 раза [28].
В начале вегетационного периода общий объем примордиев хвои зачатка побега преобладает над объемом стебля в 1.4 раза. Ввиду более активного начального роста листовых примордиев над ростом стебля внутри почки это соотношение резко возрастает до 5.4 при длине зачатка стебля 5.1% от полного сезонного прироста. Продольный рост и дифференциация хвои завершается к середине июня.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Терминальный апекс побега псевдотсуги Мензиса (Pseudotsuga menziesii Mirb. Franco), интродуцированной в Санкт-Петербурге, после зимнего покоя начинает морфогенез с пролиферативного роста своего объема в 2–3 раза, после чего приступает к закладке фитомеров новой почки примордиев катафиллов – кроющих чешуй и принадлежащих им элементов стебля. Аналогичный порядок начала морфогенеза почки из терминального апекса установлен у Picea obovata в подзоне средней тайги европейского Северо-Востока [30].
Характерно, что прокамбий апекса псевдотсуги сложен периклинально удлиненными клетками, и образует структурную анизотропию, при которой на единицу длины продольного пути метаболитов приходится меньшее число оболочек и мембран клеток, вероятно, в этом направлении возможен облегченный продольный транспорт метаболитов по их протопластам, чем в поперечном. Клетки прокамбия также накапливают больше кристаллической целлюлозы в продольных удлиненных стенках по сравнению с поперечными. Известно, что целлюлозно-пектиновые оболочки неодревесневших клеток сложены из относительно рыхло расположенных фибрилл с многочисленными пустотами и ходами, вытянутыми параллельно волокнам, по которым может распространяться вода и растворенные в ней вещества, омывая внешний периметр клеток [31]. Кроме того, целлюлозно-пектиновые оболочки клеток образуют внеплазматическое пространство с большой внутренней поверхностью, функционирующее как активный адсорбент [32, 33]. Таким образом, есть основание утверждать, что удлиненные стенки клеток прокамбия с накоплением фибрилл кристаллической целлюлозы способны создавать благоприятные условия для апопластного транспорта веществ вдоль рядов клеток в апикальную меристему из проводящего цилиндра побега, несущего апекс, что соответствует уже известным сведениям о прокамбии. К признакам прокамбиальных клеток в апикальной меристеме, например у Linum perenne, относятся узкие клетки с густым содержимым, вытянутые параллельно продольной оси органа [24]. У Sequoia прокамбиальные пучки всегда связаны с ранее образовавшимися, расположенными ниже. Пучки прокамбия дифференцируются в акропетальном порядке, достигая верхушечной меристемы до возникновения зачатков, в которых они в последующем формируются [34]. Установлена непрерывность прокамбия между местами формирования листовых зачатков в апексе и проводящим осевым цилиндром стебля льна. При этом прокамбий распространяется во все более высоко расположенные междоузлия и в развивающиеся листовые примордии акропетально [35].
У псевдотсуги Мензиса в Санкт-Петербурге в середине этапа развития почки – в начале июля, паренхима коры стебля включается в продольный рост, что приводит к формированию окружения апекса чашевидной формы, несущего на себе средние слои кроющих чешуй. Вогнутый стебель почки, несущий кроющие чешуи, также формируется у сеянцев прибрежной (Pseudotsuga menziesii var. menziesii (Mirb.)), выращиваемых условиях быстрого перехода к короткому 8-ми часовому дневному периоду освещенности. [36]. При выращивании саженцев Douglas-fir (Pseudotsuga menziesii) в камерах с контролируемой средой в течение 4 лет установлено, что двукратное увеличение концентрации CO2 в воздухе выше окружающей среды не оказывает влияния на морфологию вегетативных почек, в то время как при температуре на 4 °C выше окружающей среды обнаружились необычные морфологические признаки – розеточные почки с отогнутыми и ослабленными внешними чешуйками, извилистые внутренние чешуйки, скопления мелких почек, иглы, удлиненные между чешуйками, игольчатые примордии с белыми, гиалиновыми верхушечными выступами и почки с затвердевшими чешуйками внутри неповрежденных почек [37]. У однолетних сеянцев прибрежной (Pseudotsuga menziesii), выращенных в контейнерах, зональность апекса во время развития эмбрионального побега, в состоянии покоя и выхода из состояния покоя имела общий характер, но видимость отдельных зон варьировала. В сентябре было завершено инициирование кроющих чешуй почек. [38]
У псевдотсуги Мензиса в Санкт-Петербурге переход от инициации кроющих чешуй к закладке листовых зачатков в середине третьей декады августа сопровождается многократным увеличением объема апекса – в 14.6 раза по отношению к началу вегетационного периода. Его форма при этом изменяется от конической до полуэллипсоидальной. Подобные изменения структуры апекса побега при переходе к инициации листовых примордиев, приобретающим вид “верхушки молочной железы”, в результате разрастания на верхушке апекса зоны апикальных инициальных и центральных материнских клеток, обнаружены у Pseudotsuga taxifolia (Lamb.) Britt. в Канаде [23]. На этапе заложения листовых примордиев апекс побега пихты сибирской в подзоне средней тайги европейского Северо-Востока также значительно увеличивается в объеме и приобретает полуэллипсоидальную форму [39].
У псевдотсуги Мензиса в Санкт-Петербурге переход от этапа инициации кроющих чешуй почки к закладке листовых зачатков будущего охвоенного побега в середине третьей декады августа сопровождается увеличением в 2.5–3 раза толщины зоны периферической меристемы апекса на всем ее протяжении до апикальных инициальных клеток. В ней гистохимически выявляются зоны материнских клеток листовых фитомеров. В отличие от псевдотсуги, у ели апекс на этапе формирования листовых фитомеров сохраняет коническую форму, а его периферическая меристема имеет наибольшую толщину только в его основании в зоне “инициального кольца” – по H. Camefort [40], узкой области начала вычленения примордиев хвои – к верхушке апекса она уменьшается по толщине. У ели переход от морфогенеза почки к морфогенезу охвоенного побега начинается раньше, чем у псевдотсуги – в первой декаде июля. Это свидетельствует о том, что у ели процесс формирования структур меристематического зачатка вегетативного побега более продолжительный и медленный, чем у псевдотсуги. По сравнению с елью, у псевдотсуги в результате развития большей толщины периферической меристемы на обширной поверхности апекса одновременно происходит формирование большего числа материнских групп клеток фитомеров, что существенно ускоряет инициацию листовых примордиев. Таким образом, благодаря более активной стратегии меристематического роста при более позднем наступлении этапа заложения листовых фитомеров псевдотсуга в Санкт-Петербурге за более короткое время до конца вегетационного периода успешно осуществляет в полном объеме морфогенез зачатка побега.
У псевдотсуги Мензиса в Санкт-Петербурге в конце первой декады сентября в начале этапа формирования листовых фитомеров в основании меристематического зачатка вегетативного побега началось формирование сердцевинной диафрагмы, которая отделяет его от зрелых структур стебля почки. В Британской Колумбии у пихты дугласии область сердцевинной диафрагмы вегетативного зачатка побега начинает формироваться в августе после того, как было инициировано большинство листовых примордиев. Клеточные стенки диафрагмы пропитаны необычно большим количеством пектиновых веществ [14].
В Санкт-Петербурге у псевдотсуги гистогенез проводящей системы центрального цилиндра меристематических зачатков стебля и хвои ранней весной начинается в первую очередь с заложения ситовидных клеток первичной флоэмы. После заложения некоторого количества слоев первичной флоэмы, начинается заложение трахеид первичной ксилемы. Причем преобладание степени развития элементов флоэмы над ксилемой сохраняется в продолжение меристематического роста стебля и хвои до периода раскрывания материнской почки в начале второй декады мая. Такой порядок развития проводящей системы в меристематических зачатках стебля и хвои также наблюдался у Picea obovata Ledeb. и P. abies (L.) H. Karst. [10, 41]. У покрытосеменных растений также установлено, что в прокамбии развитие элементов флоэмы начинается еще до того, как обнаруживаются признаки дифференцирующейся ксилемы [24].
В Санкт-Петербурге у псевдотсуги рост стебля и хвои зачатка побега в почке и в начальный период после ее распускания, до начала третьей декады мая осуществляется главным образом путем деления клеток паренхимы, занимающей их основной объем, сохраняющих меристематичность и варьирующих по размерам в небольшом интервале величин. В этот период средняя суточная скорость удвоения длины стебля и хвои имеет прямолинейную зависимость от температуры воздуха (рис. 2, 4). Следовательно, есть основание считать, что эта зависимость в данный период морфогенеза может рассматриваться в непосредственной связи со скоростью деления клеток паренхимы стебля и хвои, оболочками поперечными их продольной оси. На возможность такой интерпретации наших результатов наблюдений указывают данные исследований по определению оптимальной температуры деления и роста клеток на основании скорости роста корней [42]. Причем согласно уравнению этой зависимости, начальная средняя суточная температура, при которой возможно деление клеток стебля составляет порядка 2.9 °C. У Picea abies в Санкт-Петербурге установлено, что появление митозов клеток сердцевинной меристемы возможно при средней суточной температуре воздуха 2.5 °C [42]. Начало роста хвои в длину теоретически может осуществляться путем деления клеток уже при средней суточной температуре воздуха порядка 1.23 °C, что в 2.4 раза ниже, чем начало аналогичного роста в длину стебля. Причем в интервале средних суточных температур 10–20 °C средняя суточная скорость удвоения длины хвои составляет 0.19, для стебля этот показатель меньше в 1.72 раза, что обусловливает преимущественный рост листовых зачатков над стеблем в период их развития внутри почек и некоторое время после раскрывания почек. Преобладание роста зачатков хвои над стеблем в весенний период также происходит и у Picea abies в Санкт Петербурге [10].
Рис. 4.
Температурная зависимость средней суточной скорости удвоения длины хвои псевдотсуги Мензиса в начале вегетационного периода в Санкт-Петербурге. По вертикали – средняя суточная скорость удвоения длины зачатков хвои; по горизонтали – средняя суточная температура воздуха, °C. 1 — среднесуточное удвоение длины хвои; 2 — линейная (среднесуточное удвоение длины хвои). Fig. 4. Relationship between average daily temperature and average daily rate of twofold needles elongation in Douglas fir at the beginning of the growing season in St. Petersburg. Y-axis – the average daily rate of twofold primordial needles elongation; x-axis – the average daily air temperature of the °C. 1 — average daily rate of twofold needles elongation; 2 — linear (average daily rate of twofold needles elongation).
В целом цикл развития вегетативных побегов псевдотсуги Мензиса (Pseudotsuga menziesii Mirb. Franco) в Санкт-Петербурге от начала весеннего роста до момента распускания почек по календарным срокам имеет сходный характер с морфогенезом в условиях Канады (Британская Колумбия) [14]. Однако завершение продольного роста побега, инициации кроющих чешуй почки и начало заложения меристематических структур зачатка нового охвоенного побега в Санкт-Петербурге наступает на месяц позже – к середине третьей декады августа и продолжается до третьей декады октября. При этом формирование меристематических структур новых побегов в почках осуществляется в полном объеме.
ВЫВОДЫ
У псевдотсуги Мензиса (Pseudotsuga menziesii Mirb. Franco), интродуцированной в Санкт-Петербурге, при наступлении положительных температур после зимнего покоя апикальная меристема, расположенная на верхушке зачатка побега в материнской почке, разрастается по объему в 2–3 раза и, варьируя незначительно по объему, осуществляет формирование зачатков быстро разрастающихся фитомеров новой почки – кроющих чешуй и их стеблевых элементов. Морфогенез почки завершается в середине третьей декады августа формированием 11–12 слоев кроющих чешуй; фитомеры катафиллов закладываются при минимальной толщине периферической меристемы. Переход к заложению зачатков фитомеров хвои сопровождается многократным увеличением объема апекса, он приобретает полуэллипсоидальную форму. От основания апекса до апикальных инициалей формируется массивная периферическая меристема, имеющая в 2.5–3 раза больше периклинальных слоев клеток. Это обеспечивает условия одновременного заложения большого числа материнских групп клеток листовых фитомеров, из которых формируются примордии хвои, что существенно ускоряет процесс морфогенеза зачатка побега. Примордии хвои осуществляют медленный пролиферативный рост. При заложении каждого зачатка хвои в его оси формируется прокамбиальный пучок, чего не происходит при заложении катафиллов почки. Прокамбий сложен рядами периклинально удлиненных клеток и образует структурную анизотропию, благодаря которой вероятно возможен облегченный продольный транспорт метаболитов по их протопластам. В продольных удлиненных стенках клеток прокамбия накапливается больше кристаллической целлюлозы, чем в поперечных, что создает внеплазматическое пространство апопласта, по которому также вероятно возможен транспорт в апекс метаболитов из центрального цилиндра нижерасположенного стебля почки. До конца вегетационного периода апекс в ускоренном темпе формирует полный набор меристематических зачатков листовых фитомеров будущего охвоенного побега. После зимнего покоя все структуры меристематического зачатка побега в почке начинают рост путем деления клеток. Гистогенез прокамбия зачатка побега ранней весной начинается с заложения ситовидных клеток первичной флоэмы. В продолжение пролиферативного роста стебля и хвои внутри почки и в начальный период после ее распускания в проводящих пучках флоэма имеет большее развитие, чем ксилема. В этот период средняя суточная скорость удвоения длины стебля и хвои прямолинейно зависит от температуры. Причем в интервале средних суточных температур 10–20 °C средняя суточная скорость удвоения длины хвои составляет 0.19, для стебля этот показатель меньше в 1.72 раза. Согласно данной зависимости, начало роста хвои в длину теоретически может осуществляться путем деления клеток уже при средней суточной температуре воздуха порядка 1.2 °C, а у стебля – при 2.9 °C. В целом цикл развития вегетативных побегов псевдотсуги Мензиса (Pseudotsuga menziesii Mirb. Franco) в Санкт-Петербурге от начала весеннего роста до момента распускания почек по календарным срокам имеет сходный характер с морфогенезом в условиях Канады (Британская Колумбия). Но завершение продольного роста стебля побега, инициация кроющих чешуй почки и начало заложения меристематических структур зачатка нового охвоенного побега в Санкт-Петербурге наступает на месяц позже – к середине третьей декады августа и продолжается до третьей декады октября. Формирование меристематических структур новых побегов в почках осуществляется в полном объеме благодаря высокой активности морфогенеза апикальной меристемы.
Список литературы
Медведев С.С. 2004. Физиология растений. СПб. 336 с.
Кулуев Б.Р. 2017. Регуляторы деления и пролиферации клеток в растениях. – Биомика. 9(2): 119–135. https://biomicsj.ru/upload/iblock/c60/7.pdf
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. Д. 1994. Молекулярная биология клетки. Т.1. Пер. с англ. М. 517 с. http://biology.org.ua/files/lib/Alberts_et_al_vol1.pdf
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. Д. 1994. Молекулярная биология клетки. Т.2. Пер. с англ. М. 539 с. http://biology.org.ua/files/lib/Alberts_et_al_vol2.pdf
Альбертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. Д. 1994. Молекулярная биология клетки. Т.3. Пер. с англ. М. 504 с. http://biology.org.ua/files/lib/Alberts_et_al_vol3.pdf
Hall J.L., Flowers T.J., Roberts R.M. 1981. Plant cell structure and metabolism. London, New York. 543 p.
Galston A.W., Davies P.J., Satter R.L. 1980. The life of the green plant. Englewood Cliffs. NJ. 552 p.
Мэзия Д. 1963. Митоз и физиология клеточного деления. М. 427 с.
Гамалей Ю.В. 1972. Цитологические основы дифференциации ксилемы. Л. 144 с.
Скупченко В.Б. 2019. Клеточный рост основной паренхимы стебля в морфогенезе побега Piceа abies (Pinaceae). – Растительные ресурсы. 55(2): 195–212. https://www.elibrary.ru/item.asp?id=38252920
Булыгин Н.Е., Ярмишко В.Т. 2008. Дендрология. Издание третье, дополненное. М. 535 с.
Абрарова А.Р., Вафин Р.В., Путенихин В.П. 2011. Псевдотсуга Мензиса в Башкирском Предуралье: Биологические и лесоводственные особенности. Уфа. 188 с.
Вольф Э.Л. 1915. Декоративные кустарники и деревья для садовъ и парковъ. Петроградъ. 464 с.
Allen G.S., Owens J.N. 1972. The life history of Douglas fir. Ottawa. 139 p.
Скупченко В.Б. 1979. Вибрационная микротомия мягких тканей. Сер. препринт. сообщ. “Новые научные методики”. Сыктывкар: Коми фил. АН СССР, Вып. 2. 56 с.
Пирс Э. 1962. Гистохимия. Теоретическая и прикладная. Пер. с англ. М. 963 с.
Дженсен У. 1965. Ботаническая гистохимия. Пер. с англ. М. 378 с.
Fiorani F., Beemster G.T.S. 2006. Quantitative analyses of cell division in plants. – Plant Molecular Biology. 60(6): 963–979. https://doi.org/10.1007/s11103-005-4065-2
Архив погоды в городах России за последние полвека. www.atlas-yakutia.ru
Лакин Г.Ф. 1980. Биометрия. М. 293 с.
Хохряков А.П. 1997. Растения как модульные организмы. – В кн.: Труды международной конференции по анатомии и морфологии растений. 2–6 июня 1997 г. Санкт-Петербург. 371.
Foster A.S. 1938. Structure and growth of the shoot apex in Ginkgo biloba. – Bull. Torrey Bot. Club. 65(8): 531–556. https://doi.org/10.2307/2480793
Sterling C. 1946. Organization of the shoot of Pseudotsuga taxifolia (Lamb.) Britt. I. Structure of the shoot apex. – Amer. J. Bot. 33(9): 742–750. https://doi.org/10.1002/j.1537-2197.1946.tb12935.x
Эзау К. 1969. Анатомия растений. Пер. с англ. М. 585 с.
Скупченко В.Б. 1985. Органогенез вегетативных и репродуктивных структур ели. Л. 80 с.
Еремин В.М., Чавчавадзе Е.С. 2015. Анатомия вегетативных органов сосновых (Pinaceae Lindl.). Брест. 692 с.
Лотова Л.И. 1987. Анатомия коры хвойных. М. 150 с.
Кнорре Д.Г., Крылова Л.Ф., Музыкантов В.С. 1990. Физическая химия: Учеб. для биол. факультетов ун-тов и пед. вузов. М. 416 с.
Скупченко В.Б. 2016. Включения апопласта с двойным светопреломлением развивающихся структур побегов Picea obovata и p. Abies (Pinaceae). Известия Санкт-Петербургской лесотехнической академии. Вып. 215. 64–79. https://www.elibrary.ru/item.asp?id=26180937
Скупченко В.Б., Ладанова Н.В., Тужилкина В.В. 1997. Формирование побегов и их функциональная организация в кроне Picea obovata (Pinaceae). Бот. Журн. 82(5): 16–27. http://arch.botjournal.ru/?t=issues&id=19970505&rid=pdf_0005051
Курсанов А.Л. 1976. Транспорт ассимилятов в растении. М. 647 с
Саляев Р.К. 1969. Поглощение веществ растительной клеткой. М. 206 с.
Саляев Р.К., Швецова И.В. 1969. Адсорбционные свойства изолированных стенок растительной клетки. – Физиол. Растений. 16(3): 447–451.
Sterling Cl. 1945. Growth and vascular development in the shoot apex of Sequoia sempervirens (Lamb.) Endl.1: I Structure and growth of the shoot apex. – Amer. J. Bot. 32(3): 118–126. https://doi.org/10.1002/j.1537-2197.1945.tb05095.x
Эзау К. 1980. Анатомия семенных растений. Кн. 2. Пер. с англ. М. 558 с.
MacDonald J.E., Owens J.N. 1993. Bud development in coastal Douglas-fir seedlings under controlled-environment conditions. – Canadian Journal of Forest Research. 23(6): 1203–1212. https://doi.org/10.1139/x93-152
Apple M.E., Lucash M.S., Olszyk D.M., Tingey D.T. 1998. Morphogenesis of Douglas-fir buds is altered at elevated temperature but not at elevated CO2. – Environmental And Experimental Botany. 40(2): 159–172. https://doi.org/10.1016/S0098-8472(98)00031-8
Krasowski M.J., Owens J.N. 1990. Seasonal changes in the apical zonation and ultrastructure of coastal douglas fir seedlings (Pseudotsuga menziesii). – Amer. J. Bot. 77(2): 245–260. https://doi.org/10.1002/j.1537-2197.1990.tb13550.x
Скупченко В.Б. 1974. Морфофункциональная характеристика меристем почек ели, сосны, лиственницы и пихты в подзоне средней тайги Коми АССР. Биологические исследования на Северо-Востоке Европейской части СССР (ежегодник- 1973) Коми филиал АН СССР. Сыктывкар. С. 47–53.
Camefort H. 1956. Etude de la structure du point végétatif et des variation phillotaxique chez quelques gymnosperms. – In: Théses présentées a la Faculté des sciences de l`Université de Paris. Masson et Cie Éditéur. Paris. P. 1–185.
Скупченко В.Б., Ладанова Н.В. 1984. Развитие хвои Picea obovata (Pinaceae) – Бот. журн. 69(2): 203–206. http://arch.botjournal.ru/?t=issues&id=19840202&rid=pdf_0005233
Гриф В.Г., Иванов В.Б., Мачс Е.М. 2002. Клеточный рост и его параметры у цветковых растений. – Цитология. 44 (10): 936–980.
Дополнительные материалы отсутствуют.
Инструменты
Растительные ресурсы


