Записки Российского минералогического общества, 2022, T. 151, № 4, стр. 87-101
Кристаллохимические особенности катионно-упорядоченного калиевого аналога аквалита из Ковдорского массива (Кольский полуостров)
Р. К. Расцветаева 1, *, д. чл. Н. В. Чуканов 2, **, почетн. чл. И. В. Пеков 3, 4, М. Ф. Вигасина 3
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
117333 Москва, Ленuнскuй пр., 59, Россия
2 Институт проблем химической физики РАН
142432 Черноголовка, просп. Семенова, 1, Россия
3 Московский университет, Геологuческuй факультет
119991 Москва, ГСП-1, Ленинские горы, 1, Россия
4 Институт геохимии и аналитической химии РАН
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: rast@crys.ras.ru
** E-mail: chukanov@icp.ac.ru
Поступила в редакцию 16.05.2022
После доработки 16.06.2022
Принята к публикации 20.06.2022
- EDN: OMSCNG
- DOI: 10.31857/S0869605522040074
Аннотация
Изучены химический состав, кристаллическая структура и характеристики рамановского спектра высокогидратированного аквалитоподобного минерала группы эвдиалита из Ковдорского массива (Кольский п-ов), в котором калий и оксониевая группа Н3О+ являются видообразующими внекаркасными катионами. Упрощенная формула минерала (H3O)8Na5K2Zr3Ca6[Si24O69(OH)3][Si2]Mn(OH)2Cl·2H2O. Он характеризуется пространственной группой R3 и параметрами элементарной ячейки а = 14.184(1), с = 30.797(1) Å, V = 5366.27(1) Å3. Особенностью данного минерала, отличающей его от всех других представителей группы эвдиалита, является высокая степень упорядоченности в распределении крупных внекаркасных катионов (Na+, K+, Sr2+, Ba2+, Ln3+ и H3O+) по расщепленным позициям структуры. В изученном минерале часть ионов оксония образует комплексы с молекулами воды с экстремально прочными водородными связями, аналогичными тем, которые реализуются в гидратных комплексах протона типа катионов Цунделя и Айгена.
ВВЕДЕНИЕ
Оксоний-доминантные минералы группы эвдиалита (МГЭ) относительно редки (Johnsen, Grice, 1999; Расцветаева и др., 2012; Rastsvetaeva et al., 2020; Rastsvetaeva, Chukanov, 2020; Chukanov et al., 2022). В частности, низкое содержание щелочных элементов при высоком содержании H2O было установлено в минерале с формулой (H3O)8(Na,K,Sr)5Ca6Zr3Si26O66(OH)9Cl из пегматитов Инаглинского щелочного массива (Республики Саха-Якутия), который был утвержден Комиссией по новым минералам, номенклатуре и классификации ММА в качестве нового минерального вида под названием аквалит (Хомяков и др., 2007). Позже был утвержден еще один минерал, относящийся к так называемым “H-эвдиалитам” – илюхинит (H3O,Na)14Ca6Mn2Zr3Si26O72(OH)2·3H2O (Чуканов и др., 2016). Как было показано нами, в природе “H-эвдиалиты” образуются в результате ионного обмена Na+ на ион оксония H3O+. Высокое содержание ионов оксония (при общем доминировании натрия в позициях внекаркасных катионов) установлено также в икраните (Na,H3O)15(Ca,Mn,REE)6Fe3+2Zr3(□,Zr)(□,Si)Si24O66(O,OH)6Cl⋅nH2O (Расцветаева и др., 2003).
В настоящей работе изучен калиевый аналог аквалита, найденный в Ковдорском щелочно-ультраосновном массиве на Кольском полуострове. Его особенностью, как и инаглинского аквалита, является высокое содержание оксониевых групп, замещающих внекаркасные крупные катионы. Состав минерала неоднородный, его эмпирическая формула с учетом пределов содержания катионов следующая (Пеков, 2005; Chukanov, 2014): (H3O)xNa3.7–5.3K1.4–1.8Sr0–0.4Ba0.3–0.5Ca5.4–6.0Ln0–0.4Fe0–0.2Mn0.2–0.4Zr2.6–3.0Ti0.1–0.4(Si24O72) (Si1.6–1.8Nb0.2–0.4)(OH,O)y(SO4)0.1Cl0.5–0.7·nH2O.
Вхождение оксония в МГЭ на протяжении долгого периода времени было дискуссионным, т.к. прямых доказательств этого у исследователей не было. Присутствие ионов Н3О+ в “Н-эвдиалитах” косвенно подтверждается данными ИК-спектроскопии, однако полосы оксония в ИК-спектре слабые и перекрываются с полосами обертонов и молекул воды, что затрудняет их однозначное отнесение. Согласно данным квантовохимических расчетов, ион оксония способен к образованию гидратированных форм, включая катионы Цунделя ${{{\text{H}}}_{{\text{5}}}}{\text{O}}_{2}^{ + }$ и Айгена ${{{\text{H}}}_{{\text{9}}}}{\text{O}}_{4}^{ + }$ с очень прочными водородными связями и расстояниями O···O в пределах ∼2.4–2.6 Å (Asthagiri, 2005), для которых предсказаны частоты O–H-валентных колебаний в диапазоне 1300–2800 см–1 (Sobolewski, Domcke, 2002). В отличие от ИК-спектроскопии, спектроскопия КРС (рамановская) оказалась весьма чувствительным методом обнаружения гидратированных форм протона вследствие аномально высокой поляризуемости связей O–H в этих комплексах. В частности, комплексы оксония с расстояниями O···O в указанных выше пределах найдены нами в структурах ряда “H-эвдиалитов”, включая аквалит (Chukanov et al., 2022), и, таким образом, результаты рентгеноструктурного анализа подтверждают сделанный на основе данных рамановской спектроскопии вывод о вхождении групп Н3О+ в структуру МГЭ в результате их гидролитического преобразования.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Изученный в настоящей работе МГЭ обнаружен авторами (Н.В.Ч. и И.В.П.) в 2003 году в жиле сильно измененного агпаитового пегматита, секущей монтичеллит-диопсид-флогопитовые породы, вскрытые карьером рудника Слюда, разрабатывавшего Ковдорское флогопитовое месторождение. Главный минерал осевой части жилы – сколецит, вероятно, заместивший более ранние алюмосиликаты. Аквалитоподобный минерал врастает в сколецит в виде коричнево-красных с сиреневой каймой изометричных обособлений размером до 3 см в поперечнике и более мелких розовых и сиреневых уплощенных зерен. С ним ассоциируют эгирин-авгит, пектолит, луешит и поздние стевенсит и кальцит (Пеков, 2005; Моисеев, Чуканов, 2006). В этих работах минерал кратко описан как аквалит. Его представительный химический состав, по электронно-зондовым данным, приведен в работе (Пеков, 2005; мас. %): Na2O 5.64, K2O 2.84, CaO 10.83, SrO 1.36, BaO 1.95, MnO 0.77, FeO 0.32, Ce2O3 0.55, SiO2 52.66, TiO2 0.48, ZrO2 11.86, Nb2O5 1.69, SO3 0.17, Cl 0.72, –O=Cl2 0.16, сумма 91.68 мас. %. Атомные соотношения определяемых электронно-зондовым методом компонентов, таковы (в формульных коэффициентах, рассчитанных на сумму атомов Si + Zr + Ti + + Nb = 29): Na5.32K1.76Sr0.38Ba0.37Ca5.65Ce0.10Fe0.13Mn0.32Zr2.82Ti0.18Si25.64Nb0.37S0.06Cl0.59. Корректно рассчитать соотношения O2–, O- и H-содержащих групп (O2–/OH–/ H2O0/H3O+) в этой эмпирической формуле на основании имеющихся данных не представляется возможным; сведения о пределах колебаний состава изученного образца приведены выше.
Для уточнения кристаллической структуры минерала в качестве стартовых использованы координаты атомов Zr, Si и Ca каркаса, а также входящих в их полиэдры атомов кислорода аквалита из Инаглинского массива (Расцветаева, Хомяков, 2002). Расщепленные позиции М(3), М(4), Х(1), Х(2) атомов на оси 3 порядка и позиции внекаркасных катионов N1–N5 найдены из серии разностных синтезов электронной плотности. Распределение по позициям внекаркасных катионов, анионов Cl–, OH-групп и молекул воды определено на основе уточнения электронного содержания позиций, анализа межатомных расстояний в полиэдрах и данных химического состава изученного минерала. Уточнение состава ряда позиций проводилось с учетом их частичной заселенности и контролировалось параметрами атомных смещений и R-фактором достоверности модели.
Кристаллическая структура уточнена до финального фактора расходимости R = = 4.7% по 3537 отражениям с F > 3σ(F) в анизотропном приближении атомных смещений. Все расчеты выполнены с использованием системы кристаллографических программ AREN (Андрианов, 1987). Кристаллографические характеристики, данные монокристального эксперимента и параметры уточнения структуры приведены в табл. 1. Координаты внекаркасных атомов, параметры их атомных смещений, заселенность и состав позиций содержатся в табл. 2. Данные для Si-атомов каркаса и атомов О, уточненные МНК в анизотропном приближении, не приводятся и в настоящей работе не обсуждаются, поскольку они близки к аналогичным данным для аквалита из Инаглинского массива (Расцветаева, Хомяков, 2002). Межатомные расстояния для некоторых координационных полиэдров катионов в ключевых позициях структуры представлены в табл. 3.
Таблица 1.
Кристаллографические характеристики, данные монокристального эксперимента и параметры уточнения структуры K-аналога аквалита Table 1. Crystal data, data collection information and refinement details for the crystal structure of the aqualite K analogue
| Упрощенная формула | (H3O)7Na5K2(Ba,Sr)Zr3Ca6[Si24O70(OH)2] [Si2]Mn(OH)3Cl·2H2O |
| Сингония, пространственная группа, Z | Тригональная, R3, 3 |
| Параметры элементарной ячейки, Å | a = 14.184(2), с = 30.797(1) |
| V, Å3 | 5366.3(1) |
| Дифрактометр | Xcalibur Oxford Diffraction CCD |
| Излучение; λ, Å | MoKα; 0.71073 |
| Sin θ /λ | <0.87 |
| Интервалы сканирования | –20 ≤ h ≤ 20, –20 ≤ k ≤ 17, –52 ≤ l ≤ 52 |
| Число рефлексов измеренных/независимых с F > 3σ(F) | 35035/3537 (Rint = 0.031) |
| Метод уточнения | МНК по F |
| R-фактор уточнения | 0.047 |
| Программа уточнения | AREN (Андрианов, 1987) |
Таблица 2.
Координаты, эквивалентные параметры смещений (Bэкв, Å2) атомов, заселенности (q) и состав позиций в структуре K-аналога аквалита Table 2. Coordinates, equivalent displacement parameters (Beq, Å2) of atoms, site occupancy factors (q) and site contents in the structure of the aqualite K analogue
| Позиция | x | y | z | Beq/iso* | q | Состав |
|---|---|---|---|---|---|---|
| Zr | 0.3337 | 0.1669 | 0.1669 | 1.70(2) | 1.0 | Zr3.0 |
| M1.1 | 0.4058(1) | 0.3310(1) | 0.3335(1) | 1.81(4) | 1.0 | Ca3.0 |
| M1.2 | 0.4034(1) | 0.0723(1) | 0.3335(1) | 1.40(5) | 1.0 | Ca3.0 |
| M2a | –0.0063(9) | 0.5037(7) | –0.0028(1) | 1.8(2) | 0.10(1) | Fe0.3 |
| M2b | 0.4812(6) | 0.5192(7) | 0.0036(2) | 0.4(1) | 0.11(1) | Mn0.33 |
| M2c | 0.501(1) | 0.510(1) | 0.0079(2) | 1.1(5) | 0.11(1) | Na0.33 |
| M3a | 03334 | 0.6667 | 0.2743(4) | 2.4(1) | 0.55(1) | Si0.55 |
| M3b | 03334 | 0.6667 | 0.2445(6) | 2.8(2) | 0.30(1) | Si0.30 |
| M3c | 03334 | 0.6667 | 0.291(1) | 5.3(2) | 0.15(1) | Ti0.15 |
| M4a | 03334 | 0.6667 | 0.0579(2) | 2.3(2) | 0.49(1) | Si0.49 |
| M4b | 03334 | 0.6667 | 0.0368(2) | 3.81(5) | 0.30(1) | Nb0.30 |
| M4c | 03334 | 0.6667 | 0.092(1) | 4.7(2) | 0.20(2) | Si0.20 |
| N1a | 0.1050(4) | 0.2127(5) | 0.1552(1) | 2.3(1) | 0.60(1) | Na1.8 |
| N1b | 0.076(2) | 0.1734(3) | 0.1702(6) | 2.2(3) | 0.15(1) | Na0.45 |
| N1c | 0.124(1) | 0.244(1) | 0.1633(7) | 3.5(3) | 0.25(2) | (H3O)0.75 |
| N2a | 0.5621(4) | 0.4400(4) | 0.1797(2) | 2.9(1) | 0.10(1) | Ba0.3 |
| N2b | 0.567(1) | 0.109 (1) | 0.1716(5) | 0.20(1) | 0.2 (1) | Na0.6 |
| N2c | 0.567(1) | 0.456(1) | 0.1876(4) | 2.2(1) | 0.42(1) | (H3O)1.26 |
| N2d | 0.5835(8) | 0.4283(8) | 0.1702(4) | 2.1(2) | 0.28(1) | Na0.84 |
| N3a | 0.179(1) | 0.090(1) | 0.2997(3) | 2.2(2) | 0.27(1) | Na0.81 |
| N3b | 0.151(2) | 0.075(2) | 0.2821(4) | 2.4(3) | 0.19(2) | Na0.57 |
| N3c | 0.1996(3) | 0.1001(3) | 0.2847(1) | 2.4(1) | 0.54(1) | K1.62 |
| N4a | 0.4472(7) | 0.2227(6) | 0. 0538(2) | 2.5(1) | 0.10(1) | Sr0.3 |
| N4b | 0.4873(4) | 0.2449(3) | 0.0487(1) | 2.3(1) | 0.10(1) | Ce0.3 |
| N4c | 0.496(2) | 0.250(2) | 0.0325(7) | 3.4(2) | 0.40(2) | (H3O)1.2 |
| N4d | 0.533(2) | 0.259(2) | 0.0581(9) | 5.2(8) | 0.40(2) | (H3O)1.2 |
| N5a | 0.206(2) | 0.606(3) | 0.1607(8) | 1.9(5) | 0.21(1) | (H3O)0.63 |
| N5b | 0.293(4) | 0.561(2) | 0.1704(7) | 3.4(5) | 0.22(1) | (H3O)0.66 |
| N5c | 0.433(3) | 0.672(5) | 0.167(1) | 4.9(4) | 0.22(1) | (H3O)0.66 |
| N6 | 0.247(3) | 0.501(7) | 0.329(2) | 3.9(3)* | 0.28(6) | (OH)0.84 |
| N7 | 0.194(4) | 0.591(3) | 0.0061(9) | 5.7(3) | 0.33(2) | (OH)0.99 |
| N8 | 0 | 0 | 0.008(5) | 5.5(4)* | 0.28(6) | (H3O)0.28 |
| OH1 | 0.3334 | 0.6667 | 0.0079(8) | 2.5(6)* | 0.44(5) | (OH)0.44 |
| OH2 | 0.3334 | 0.6667 | 0.134(2) | 5.1(6)* | 0.41(6) | (OH)0.41 |
| OH3 | 0.3334 | 0.6667 | 0.181(2) | 3.4(6)* | 0.41(6) | (OH)0.41 |
| OH4 | 0.3334 | 0.6667 | 0.325(7) | 3.0(7)* | 0.23(2) | (OH)0.23 |
| X1a | 0 | 0 | 0.221(3) | 5.4(6)* | 0.53(6) | (Н2О)0.53 |
| X1b | 0 | 0 | 0.188(1) | 4.7(6) | 0.52(4) | (Н2О)0.52 |
| X2a | 0.6667 | 0.3334 | 0.138(1) | 2.(4) | 0.42(3) | (Н2О)0.42 |
| X2b | 0.6667 | 0.3334 | 0.1045(6) | 6.1(1) | 0.58(2) | Cl0.58 |
Таблица 3.
Межатомные расстояния (Å) в некоторых ключевых позициях структуры K-аналога аквалита Table 3. Selected interatomic distances (Å) in the structure of the aqualite K analogue
| Zr–O4 | 2.019(6) | N1a–O2 | 2.49(1) |
| –O5 | 2.032(9) | –O22 | 2.555(9) |
| –O1 | 2.044(6) | –O3 | 2.60(1) |
| –O23 | 2.044(6) | –O23 | 2.64(1) |
| –O3 | 2.130(8) | –O23* | 2.670(8) |
| –O2 | 2.145(7) | –O16 | 2.718(8) |
| ❬2.069❭VI | –O11 | 2.777(8) | |
| –O10 | 2.76(1) | ||
| ❬2.65❭VIII | |||
| M1.1–O7 | 2.256(8) | N2a–O5 | 2.450(8) |
| – O14 | 2.342(3) | –O6 | 2.52(1) |
| – O9 | 2.344(9) | –O4 | 2.535(8) |
| – O9 | 2.365(5) | –O1 | 2.614(9) |
| – O9 | 2.413(7) | –O1* | 2.669(6) |
| – O9 | 2.429(3) | –O12 | 2.77(1) |
| ❬2.358❭VI | –O19 | 2.80(1) | |
| –O20 | 2.82(1) | ||
| – X2a | 2.90(1) | ||
| ❬2.68❭IX | |||
| M1.2–O7 | 2.237(7) | N3c–O18 | 2.499(9) |
| –O8 | 2.328(7) | –O17 | 2.502(9) |
| –O24 | 2.352(4) | –O14 | 2.663(9) |
| –O14 | 2.385(8) | –O3 | 2.809(8) |
| –O17 | 2.401(4) | –O2 | 2.877(9) |
| –O15 | 2.457(7) | ❬2.66❭V | |
| ❬2.427❭VI | |||
| M2a–N7 | 1.98(7) | N4a–O8 | 2.21(1) |
| –O17 | 2.005(9) | –O91 | 2.24(1) |
| –O18 | 2.12(1) | –O15 | 2.75(1) |
| –O8 | 2.39(1) | –O24 | 2.79(1) |
| –O9 | 2.48(5) | –O4 | 2.88(1) |
| –N6 | 2.51(1) | –O5 | 2.92(1) |
| ❬2.25❭VI | ❬2.63❭VI | ||
| M2b–N7 | 1.91(4) | N4b–O9 | 2.39(1) |
| –O17 | 2.118(8) | –O8 | 2.41(1) |
| –O18 | 2.145(8) | –X2b | 2.79(1) |
| –O8 | 2.497(9) | –OH4 | 2.817(5) |
| –O9 | 2.51(1) | –O15 | 2.843(8) |
| –N6 | 2.53(5) | ❬2.64❭V | |
| ❬2.28❭VI | |||
| M2c–O17 | 2.19(1) | N8–O22 | 2.6(1) × 3 |
| –N6 | 2.20(6) | –O24 | 2.92(6) × 3 |
| –O8 | 2.23(1) | –O7 | 3.07(6) × 3 |
| –N7 | 2.27(4) | –O6 | 3.08(9) × 3 |
| –O18 | 2.31(1) | ❬2.92❭XII | |
| –O9 | 2.36(1) | ||
| ❬2.26❭VI |
КР-спектроскопическое изучение выполнено на рамановском микроскопе “EnSpector R532” (Россия), установленном на кафедре минералогии геологического факультета МГУ имени М.В. Ломоносова. Длина волны лазерного излучения составляла 532 нм, выходная мощность луча – около 15 мВт при съемке спектра аквалитоподобного минерала и около 9 мВт при съемке спектра эвдиалита. Голографическая дисперсионная решетка имела 1800 штр./мм, спектральное разрешение составляло 6 см–1, при 40-кратном увеличении диаметр фокального пятна на образце аквалита был около 20 мкм и на образце эвдиалита – около 2 мкм. Спектры получены в интервале от 100 до 4000 см–1 на неориентированных образцах в режиме накопления сигнала в течение 1 с при усреднении по 200 и 50 экспозициям при регистрации спектров аквалитоподобного минерала и эвдиалита соответственно.
РЕЗУЛЬТАТЫ
Полученное распределение компонентов по структурным позициям соответствует следующей кристаллохимической формуле (Z = 3):
N1–N5[(H3O)6.36Na5K1.62Sr0.3Ba0.3Ce0.3]N8[H3O]0.3M1Ca6M2[□2.1VI(Fe)0.3VI(Mn)0.3VI(Na)0.3)]Zr3 [Si3O9]2[Si9O25.5(O,OH)1.5]2M3–M4[IV(Si1.55)VI(Ti0.15Nb0.3)](OH)2.9Cl0.6·2H2O. Эта формула хорошо согласуется с данными электронно-зондового анализа в пределах вариаций неоднородности состава. С учетом главных компонентов и их распределения по позициям более общая упрощенная кристаллохимическая формула минерала может быть записана в виде N1,N5(Na,H3O)6N2(Na,H3O,Ba)3N3(K,Na)3N4(H3O,Sr,Ce)3Ca6MnZr3[Si24O66(OH,O)6][Si2] (OH)3Cl·2H2O.
Идеализированная до главных компонентов формула – (H3O)8Na5K2Zr3 Ca6[Si24O69(OH)3][Si2]Mn(OH)2Cl·2H2O.
По химическому составу изученный в настоящей работе “H-эвдиалит” из Ковдорского массива близок к голотипному аквалиту из Инаглинского массива с упрощенной формулой (H3O)9Na3(K,Sr,Ba,Ce)2Zr3Ca6[Si24O72][Si2]Fe3+(OH,Cl,H2O)5 (Хомяков и др., 2007). Оба минерала высококремнистые, относительно высококальциевые и преимущественно вакансионные в М2-области. В то же время, K-аналог аквалита из Ковдора характеризуется рядом индивидуальных кристаллохимических особенностей. Оба минерала Na-дефицитные, однако в ковдорском образце количество H3O несколько меньше суммы других внекаркасных катионов (Na + K + Ва + Sr + Ce), а не превышает ее, как в инаглинском аквалите. С этим, очевидно, связаны различия в параметрах элементарных ячеек этих минералов. В гидратированных эвдиалитах с-параметр ячейки обычно больше 30.3 Å, в отличие от обычных (высоконатриевых) МГЭ, для которых он лежит в пределах 29.9–30.3 Å. В частности, параметры элементарной ячейки, определенные для монокристалла голитипного образца аквалита при комнатной температуре, таковы: а = 14.078(3), с = 31.24(1) Å, а по порошковым данным а = = 14.128(2), с = 31.514(8) Å (Хомяков и др., 2007). Для другого образца “H-эвдиалита” из Инагли, структура которого была уточнена при 110 K, а = 14.1435(4), с = 31.410(1) Å (Расцветаева и др., 2018). Для изученного в настоящей работе K-аналога аквалита из Ковдора а = 14.184(1), с = 30.797(1) Å.
Понижение симметрии от R3m или R-3m до R3 чаще всего наблюдается в низкокальциевых минералах группы эвдиалита, где оно обусловлено распределением различных катионов, восполняющих дефицит Са в двух независимых октаэдрах шестичленного кольца (Расцветаева и др., 2012). В структуре высококальциевых эвдиалитов такое понижение симметрии может быть связано с присутствием в N-позициях оксониевых групп, пространственное распределение которых нарушает плоскость симметрии. Как и в случае ранее исследованного инаглинского аквалита, рентгеноструктурный анализ ковдорского МГЭ в пространственной группе R3 позволил локализовать на разностных синтезах ряд расщепленных позиций и получить информацию о деталях распределения катионов. При этом два независимых октаэдра в шестичленном кольце имеют близкие размеры (табл. 3), что подтверждает их одинаковую заселенность ионами Ca2+. Небольшая разница средних размеров (0.07 Å) может быть связана с вхождением небольших примесей в один из октаэдров.
В структуре исследованного минерала, как и других представителей группы эвдиалита, содержатся крупные полости пяти типов, обозначенные символами N1–N5 (рис. 1).
Рис. 1.
Общий вид структуры K-аналога аквалита. Fig. 1. The structure of the aqualite K-analogue: a general view.
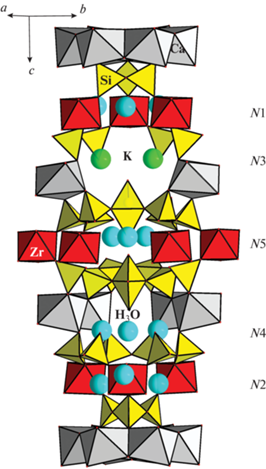
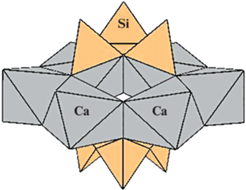
В случае вакантности М2-октаэдров, что является характерной особенностью многих “H-эвдиалитов”, в том числе аквалита и его калиевого аналога, имеются дополнительные внекаркасные позиции N6 и N7 в вершинах осевых М3- и М4-октаэдров, связанных с вершинами М2-октаэдров, которые могут быть частично заселены оксониевыми группами, но в аквалите и его K-аналоге позиции N6 и N7 имеют низкую заселенность с преобладанием вакансий. В большинстве других МГЭ, к которым относятся минералы с заполненным M2-октаэдром, аналогичные позиции заняты ОН-группами или молекулами воды. В структуре K-аналога аквалита реализуется заполнение дополнительной полости N8, которая находится на оси 3 порядка внутри 6‑членного кольца из Са-октаэдров, прикрытого сверху и снизу тройными кольцами [Si3O9] (рис. 2). Она иногда заполняется катионами калия, оксония или молекулами воды, как, например, в гидратированных образцах № 3 из Хибинского массива и № 6 из Кондерского массива, где в позиции с координатами [0 0 0] содержится 0.22 и 0.20 Н3О+ соответственно (Rozenberg et al., 2005). В структуре K-аналога аквалита в N8-полости также содержится небольшое количество (0.28) групп Н3О+ в 12-вершиннике с расстояниями H3O···O в пределах 2.6–3.1 Å.
Рис. 2.
Полость N8 в структуре K-аналога аквалита. Fig. 2. The N8 cage in the structure of the aqualite K-analogue.
Другое отличие K-аналога аквалита от голотипного аквалита заключается в высокой степени упорядочения всех внекаркасных катионов по расщепленным позициям N-полостей, включая оксониевые группы, хотя в позициях K и Ba допускается небольшая примесь оксония (табл. 2, 3). В инаглинском аквалите, наоборот, все позиции смешанные, как например, N1-позиция, имеющая состав 2.45H3O + 0.25Na + + 0.2Ce + 0.1Sr. Позиция N2a характеризуется составом 1.2K + 0.55Na + 0.2Ba. В K-аналоге аквалита позиции N1–N4 расщепляются на три или четыре подпозиции с расстояниями между ними в пределах от 0.31(1) до 1.06(2) Å. Анализ распределения катионов и уточнение их позиций, выполненныe в соответствии с критериями, сформулированными выше (см. раздел “методы исследования”), привели к выводу о высокой степени упорядоченности компонентов в N-позициях. По этой причине при уточнении структуры заселенность каждой подпозиции определялась для соответствуюшего доминирующего там катиона.
Столь высокая степень упорядоченности N-катионов встречена в МГЭ впервые. Оксоний присутствует во всех N-полостях структуры K-аналога аквалита, кроме N3, но преобладает только в полостях N4 и N5 (табл. 4). В полости N3 доминирует калий в координации пятивершинника со средним расстоянием K–O, равным 2.66 Å. При этом в данном минерале калия значительно больше (1.62 атома вместо 1.2 атома в аквалите), и этот элемент доминирует над натрием в этой полости. Полость N5 заселена оксонием не полностью и содержит также ОН-группы, входящие в тетраэдры вокруг дополнительных Si атомов в позициях M3b и M4c на оси 3 порядка. Позиции N6 и N7 содержат ОН-группы в вершинах Ti- и Nb-центрированных октаэдров на оси третьего порядка и молекулы воды в вершинах октаэдра NaO6 в М2-микрообласти.
Таблица 4.
Доминирующие катионы в позициях N1–5 аквалита из Инагли и его K-аналога из Ковдора Table 4. Dominant cations at the N1–5 sites in aqualite from Inagli and its K-dominant analogue from Kovdor
| Минерал | N1 | N2 | N3 | N4 | N5 |
|---|---|---|---|---|---|
| Аквалит1 | H3O | Na | H3O | H3O | □ |
| K-аналог аквалита2 | Na | Na | K | H3O | H3O |
Отличие изученного образца от инаглинского аквалита и в заселенности Х-позиций на оси 3 порядка. В K-аналоге аквалита они содержат главным образом Н2О и Cl при незначительном количестве S, в то время как в аквалите из Инагли в Х-позиции присутствует сера (сульфатная группа) с заселенностью 0.2 (Расцветаева, Хомяков, 2002).
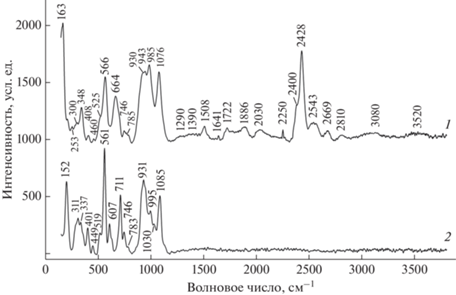
Рамановский спектр K-аналога аквалита приведен на рис. 3. Там же для сравнения приведен спектр “классического” эвдиалита из Хибинского массива. Оба спектра содержат полосы в областях валентных и деформационных колебаний колец из тетраэдров SiO4 (900–1100 и 500–800 см–1 соответственно), M2+–O-валентных колебаний, где M2+ = Ca, Fe, Mn (300–500 см–1) и колебаний с участием координационных полиэдров N-катионов (ниже 300 см–1). Рамановский спектр K-аналога аквалита существенно отличается от спектра эвдиалита присутствием серии полос в диапазоне 1200–3000 см–1, относящихся к очень прочным водородным связям, а также полос при 3080 и 3520 см–1, относящихся к водородным связям средней силы (Chukanov et al., 2022).
Рис. 3.
Рамановские спектры K-аналога аквалита (1) и типичного эвдиалита (2). Fig. 3. Raman spectra of the aqualite K-analogue (1) and common eudialyte (2).
ОБСУЖДЕНИЕ
Ранее исследованные “H-эвдиалиты” из Инаглинского, Хибинского, Ловозерского, Прихубсугульского и Кондерского массивов (Rozenberg et al., 2005) характеризуются разной степенью замещения натрия на оксоний. Изученный в настоящей работе минерал отличается от других “H-эвдиалитов” высокой степенью упорядоченности крупных катионов в полостях N1–N5. В частности, калий концентрируется в полости N3, с общей заселенностью K1.62Na1.38. При этом калий и натрий занимают собственные подпозиции. Позиция N3c, занятая калием, отстоит от позиций N3a и N3b, занятых атомами натрия, на расстояния 0.52(1) и 0.59(2) Å соответственно. Голотип аквалита характеризуется существенно более низким содержанием калия (1.2 атома на формулу). Таким образом, “H-эвдиалит” из Ковдора является K-доминантным (в позиции N3) и Na-доминантным (в позиции N1) аналогом аквалита (табл. 4).
Ранее высокая степень упорядоченности внекаркасных катионов (в позициях А, В и С) была установлена нами для ряда минералов группы лабунцовита, относящихся к подгруппе гутковаита (Расцветаева, Чуканов, 2022), тогда как в большинстве минералов этой группы позиции А, В и С имеют смешанную заселенность. Такая особенность делает минералы подгруппы гутковаита наиболее эффективными “разделителями” щелочных и щелочноземельных катионов не только среди членов группы лабунцовита, но и, вероятно, среди природных соединений вообще. Так, алсахаровит-Zn демонстрирует уникальный случай “структурной сепарации” химических элементов: пять щелочных и щелочноземельных катионов с хорошей селективностью занимают собственные позиции, в том числе, позиция B заселена только калием, в позиции C1 находится весь барий, а позиция C2 содержит только молекулы воды. Леммлейнит-Ba Na4K4Ba2Ti8(Si4O12)4O4(OH)4⋅8H2O также характеризуется высокой степенью упорядочения атомов Na, K и Ba (Чуканов и др., 2001).
Рис. 4.
Примеры локальных ситуаций в микрообласти N4. Указаны расстояния O···O (Å) для водородных связей. Fig. 4. Examples of local situations in the N4 microregion. The O···O distances (Å) are indicated.
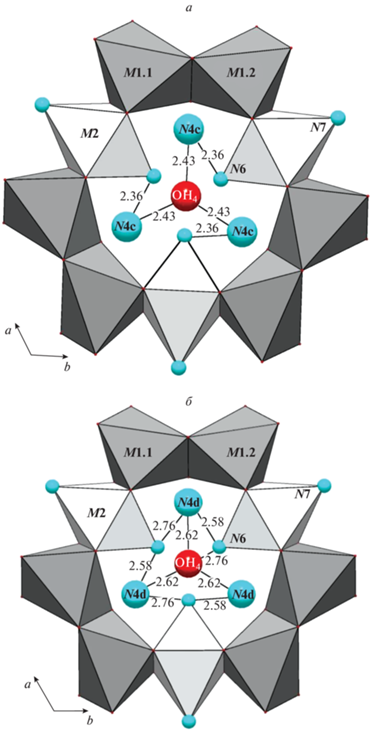
Рис. 5.
Примеры локальных ситуаций в микрообласти N5. Указаны расстояния O···O (Å) для водородных связей. Fig. 5. Examples of local situations in the N5 microregion. The O···O distances (Å) are indicated.
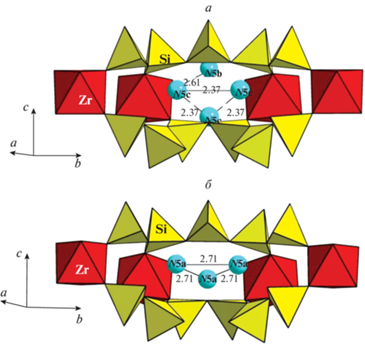
В структуре K-аналога аквалита можно выделить три группы сближенных позиций, содержаших OH–, H2O и/или H3O+, с расстояниями O···O ∼2.4, ∼2.6 и ∼2.7–2.8 Å. Согласно корреляциям между расстоянием O···O в водородной связи и волновым числом O–H-валентных колебаний в колебательном спектре (McClellan, Pimentel, 1960; Libowitsky, 1999), этим группам можно поставить в соответствие три группы полос рамановского спектра в диапазонах 1700–2100, 2400–2900 и 3000–3600 см–1 соответственно (рис. 3, табл. 5). Короткие расстояния в первых двух группах соответствуют очень прочным водородным связям, аналогичным тем, которые реализуются в гидратных комплексах протона типа катионов Цунделя и Айгена (Chukanov et al., 2022). В K-аналоге аквалита подобные комплексы могут возникать в тех случаях, когда одна из сближенных позиций занята ионом оксония, а другая содержит OH-группу или молекулу воды. С учётом этого факта можно предположить, что образование молекул воды в N-полостях связано с частичной диссоциацией катионов оксония на H2O и H+, возможно, сопровождающейся протонированием свободных вершин тетраэдров колец Si9O27 с образованием силанольных групп Si–OH.
Таблица 5.
Волновые числа (см–1) полос O–H-валентных колебаний в рамановском спектре K-аналога аквалита и соответствующие им расстояния O···O для водородных связей (dO···O, Å) в парах сближенных позиций, содержащих OH–, H2O и/или H3O+Table 5. Wavenumbers (cm–1) of the bands of O–H stretching vibrations in the Raman spectrum of the aqualite K analogue and corresponding O···O distances (dO···O, Å) for hydrogen bonds in pairs of close sites bearing OH–, H2O, and/or H3O+
| Волновое число | dO···O (выч)* | dO···O (выч)** | dO···O (РСА)*** | Пары позиций |
|---|---|---|---|---|
| 1722, 1886, 2030 | 2.50, 2.51, 2.52 |
2.38, 2.42, 2.46 | 2.36(4) | N4c–N6 |
| 2.37(4) × 2 | N5c–N5c | |||
| 2.43(2) | N4c–OH4 | |||
| 2428, 2543, 2669, 2810 | 2.56, 2.57, 2.59, 2.62 | 2.54, 2.56, 2.59, 2.62 | 2.58(8) | N4d–N6 |
| 2.61(5) | N5b–N5c | |||
| 2.62(2) | N4d–OH4 | |||
| 3080, 3520 | 2.67, 2.94 | 2.68, 2.77 | 2.71(2) × 2 | N5a–N5a |
| 2.76(5) | N4d–N6′ |
Характерной особенностью “H-эвдиалитов”, образовавшихся в результате природного ионного обмена значительной части натрия в исходном МГЭ на ионы оксония, является присутствие бария – элемента, в целом не характерного для состава первичных (высоконатриевых) МГЭ. Наиболее высокие содержания бария обнаруживаются в составе “H-эвдиалитов” из ультраагпаитовых ассоциаций комплексов щелочно-ультраосновных пород с карбонатитами – Ковдорского, Кондерского и Инаглинского (Расцветаева, Хомяков, 2002; Rozenberg et al., 2005; Расцветаева и др., 2012; Хомяков и др., 2007; Chukanov et al., 2022), что может быть связано с геохимическими особенностями среды, в которой происходил ионный обмен на этих объектах, в частности, с максимумом активности бария на гидротермальной стадии (Моисеев, Чуканов, 2006).
Как показали наши эксперименты (Чуканов и др., 2010, 2011а, 2020; Chukanov et al., 2012, 2021; Turchkova et al., 2012; Lykova et al., 2013), при ионном обмене натрийсодержащих силикатных минералов с низкоплотными микропористыми структурами Ba2+ и другие крупные двухзарядные катионы (Sr2+, Pb2+) легко замещают Na+ в крупных внекаркасных позициях. После предварительного выщелачивания из таких минералов натрия ионообменные процессы протекают с более высокими скоростями (Чуканов и др., 2011б). Аналогичные закономерности характерны для ионообменных процессов в природных условиях. Например, при гидротермальном преобразовании пневматолитовых ассоциаций, связанных с базальтами Айфеля (Германия) происходит выщелачивание части натрия из дельхайелита и минералов группы гюнтерблассита, а в ряде случаев имеет место вхождение в их структуры бария, мобилизованного в результате разложения ассоциирующих минералов группы лампрофиллита (Zubkova et al., 2016). Ярчайшим же примером можно считать природный ионный обмен в минералах группы пирохлора, при котором сначала Na+, а затем Ca2+ выщелачиваются, заменяясь более крупными и/или высоковалентными катионами, в первую очередь Ba2+ и Sr2+, а также K+, H3O+, Pb2+, U4+, REE3+; характерно возникновение таким путем гидратированных форм этих минералов с существенным дефицитом крупных катионов металлов. Ионообменные процессы происходят в любых природных объектах, где минеральные ассоциации, содержащие оксиды группы пирохлора, подвергаются воздействию низкотемпературных водных растворов. Наибольших масштабов он достигает в зонах гидротермального изменения и корах выветривания пирохлорсодержащих карбонатитов, где гидратированные бариопирохлор или стронциопирохлор подчас становятся главными рудными минералами ниобия (Пеков, 2005; Christy et al., 2021).
Список литературы
Андрианов В.И. AREN-85 – система кристаллографических программ РЕНТГЕН на ЭВМ NORD, CM-4 и EC // Кристаллография. 1987. Т. 32. №. 1. С. 228–232.
Моисеев М.М., Чуканов Н.В. Минералогия щелочных пегматитов и гидротермалитов Ковдорского массива // Новые данные о минералах. 2006. Т. 41. С. 56–70.
Пеков И.В. Генетическая минералогия и кристаллохимия редких элементов в высокощелочных постмагматических системах. Дис. … докт. геол.-минер. наук, М., МГУ, 2005. 652 с.
Расцветаева Р.К., Хомяков А.П. Особенности структуры Na,Fe-декатионированного эвдиалита с симметрией R3 // Кристаллография. 2002. Т. 47. № 2. С. 267–271.
Расцветаева Р.К., Чуканов Н.В. Икранит: особенности состава и строения нового минерала группы эвдиалита // Кристаллография. 2003. Т. 48. № 5. С. 775–778.
Расцветаева Р.К., Чуканов Н.В., Аксенов С.М. Минералы группы эвдиалита: кристаллохимия, свойства, генезис. Нижний Новгород: Изд-во Нижегородского государственного университета им. Н.И. Лобачевского, 2012. 230 с.
Расцветаева Р.К., Викторова К.А., Аксенов С.М. Новые данные об изоморфизме в минералах группы эвдиалита. II. Уточнение структуры аквалита при 110 K // Кристаллография. 2018. Т. 63. № 6. С. 884–889.
Расцветаева Р.К., Чуканов Н.В. Кристаллохимия минералов группы лабунцовита // Кристаллография. 2022. Т. 67. № 4. (в печати).
Хомяков А.П., Нечелюстов Г.Н., Расцветаева Р.К. Аквалит (Н3О)8(Na,К,Sr)5Сa6Zr3Si26O66(OH)9Сl – новый минерал группы эвдиалита из щелочного массива Инагли, Саха-Якутия, Россия, и проблема оксония в гидратированных эвдиалитах // ЗРМО. 2007. Т. 136. № 2. С. 39–55.
Чуканов Н.В., Пеков И.В., Расцветаева Р.К., Задов А.Е., Неделько В.В. Леммлейнит-Ва Nа2K2Ba1+хTi(Si4О12)2(O,OH)4·5H2O – новый минерал группы лабунцовита // ЗВМО. 2001. Т. 130. № 3. С. 36–43.
Чуканов Н.В., Казаков А.И., Пеков И.В., Григорьева А.А. Кинетика катионного обмена аморфизованного терскита // Ж. физ. химии. 2010. Т. 84. № 12. С. 2353–2358.
Чуканов Н.В., Казаков А.И., Пеков И.В., Григорьева А.А. Кинетика катионного обмена на гетерокаркасных микропористых титано- и цирконосиликатах // Химическая физика. 2011а. Т. 30. № 4. С. 50–55.
Чуканов Н.В., Тарасов В.П., Казаков А.И., Червонная Н.А., Возчикова С.А., Пеков И.В. Кинетика и механизм выщелачивания натрия из A-терскита и его влияние на ионообменные свойства // Химическая физика. 2011б. Т. 30. № 4. С. 56–61.
Чуканов Н.В., Расцветаева Р.К., Розенберг К.А., Аксенов С.М., Пеков И.В., Белаковский Д.И., Кристиансен Р., Ван К.В. Илюхинит (H3O,Na)14Ca6Mn2Zr3Si26O72(OH)2·3H2O – новый минерал группы эвдиалита // ЗРМО. 2016. Т. 145. № 2. С. 44–57.
Чуканов Н.В., Червонная Н.А., Кажева О.Н., Ермолаева В.Н., Варламов Д.А., Ван К.В. Ионообменные свойства гюнтерблассита и гмелинита – прототипов микропористых материалов для очистки вод // Журн. прикл. химии. 2020. Т. 93. № 4. С. 591–599. https://doi.org/10.31857/S0044461820040143
Дополнительные материалы отсутствуют.
Инструменты
Записки Российского минералогического общества


