Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 1, стр. 121-134
Влияние лекарственного средства пептидной структуры для коррекции гипернатриемии на репродуктивную функцию самцов и самок аутбредных крыс
Е. А. Гайдай 1, *, Д. С. Гайдай 1, К. Л. Крышень 1, Я. А. Гущин 2, А. А. Мужикян 2, А. В. Рыбакова 2, М. Н. Макарова 2, В. Г. Макаров 2
1 Институт доклинических исследований
Ленинградская область, Кузьмоловский, Россия
2 НПО “Дом фармации”
Ленинградская область, Кузьмоловский, Россия
* E-mail: gajdaj.ea@doclinika.ru
Поступила в редакцию 02.08.2018
После доработки 01.10.2018
Принята к публикации 22.10.2018
Аннотация
В статье приведены результаты исследования влияния лекарственного средства на основе deamino-Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Arg-Gly-NH2 на репродуктивную функцию при многократном внутривенном и внутримышечном введении в исследуемых дозах половозрелым самцам и самкам аутбредных крыс. Проведена оценка способности экспериментальных животных на фоне введения тестируемого объекта к оплодотворению и зачатию. Изучено влияние лекарственного средства на морфофункциональное состояние сперматозоидов, на пред- и постимплантационную смертность, а также проведена оценка физического и зоопсихологического развития потомства животных, получавших тестируемый объект в период гаметогенеза. Полученные результаты предполагают ограничение применения лекарственного средства на основе deamino-Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Arg-Gly-NH2 в период планирования беременности.
Концентрация натрия в сыворотке и ее осмоляльность контролируются водным балансом организма. Поддержание баланса определяется жаждой, синтезом вазопрессина (антидиуретического гормона), образованием эндогенной воды в процессе обмена и реабсорбционными возможностями почек. Дисбаланс в работе данной системы сопровождается патологией обмена натрия – гипо- или гипернатриемией [1].
Под гипернатриемией понимают повышение уровня сывороточного натрия свыше 145 ммоль в литре. Важно отметить, что гипернатриемия в подавляющем большинстве случаев (за исключением ятрогенных причин) является нарушением водного обмена, а не следствием нарушения обмена натрия [2].
Гипернатриемия (более 145 ммоль/л) возникает не только в экстремальных физиологических условиях [9], но и сопровождает некоторые тяжелые патологические состояния [4–6]. В настоящее время в клинической практике для коррекции дисэлектролитных расстройств используются, главным образом, петлевые диуретики (фуросемид; торасемид; этакриновая кислота) Однако их эффект может быть разным и, в зависимости от волемического статуса, приводить как к гипо-, так и гипернатриемии. Дегидратационная терапия мочегонными у больных с нарушением сознания (при инсультах, черепно-мозговых травмах и т.п.) сопровождается высоким риском развития гипернатриемии из-за отсутствия чувства жажды и неадекватного потребления воды. В итоге возможен летальный исход из-за гиперосмолярной комы.
Необходим поиск лекарственных средств для уменьшения объема внеклеточной жидкости, усиления выведения ионов натрия почками, но при увеличении обратного всасывания осмотически свободной воды в почечных канальцах.
Стремительный прогресс в области синтеза биологически активных пептидов создал основу для получения химическим путем соединений, обладающих избирательной биологической активностью, значительной стабильностью и продолжительностью действия.
Нонапептид – деамино-цистеил-тирозил-изолейцил-глутамил-аспарагил-цистеил-пролил-аргинил-глициламин, является синтетическим пептидом, обладающим способностью корректировать гипернатриемию.
Механизм действия нонапептида основан на угнетении реабсорбции ионов натрия в дистальном сегменте нефрона и повышении обратного всасывания воды в собирательных трубках за счет взаимодействия с V1a- и V2-рецепторами вазопрессина, что вызывает усиление выведения ионов натрия почкой при сохранении воды в организме. Перспективным является создание на его основе лекарственного средства для коррекции гипернатриемии.
Изучение репродуктивной токсичности фармакологических веществ является частью обязательных доклинических токсикологических исследований [7].
Целью данной работы являлась оценка влияния лекарственного средства на основе deamino-Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Arg-Gly-NH2 на генеративную функцию при многократном внутривенном и внутримышечном введении в исследуемых дозах половозрелым самцам и самкам аутбредных крыс.
Задачи исследования:
1. Оценить способность экспериментальных животных на фоне введения тестируемого объекта к оплодотворению и зачатию;
2. Оценить морфофункциональное состояние сперматозоидов;
3. Оценить пред- и постимплантационную смертность;
4. Оценить физическое и зоопсихологическое развитие потомства.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проводили в соответствии с руководством по проведению доклинических исследований лекарственных средств [7] и руководством OECD One-Generation Reproduction Toxicity Study № 415 [8].
В качестве тест-системы были использованы аутбредные крысы обоих полов, полученные из питомника ЗАО “НПО “ДОМ ФАРМАЦИИ” (возраст 12–16 недель; 20 групп; 10 самцов или 20 самок/группа; всего 300 особей). Животных содержали в стандартных условиях в соответствии с санитарно-эпидемиологическими правилами СП 2.2.1.3218-14 [9] и с Директивой 2010/63/EU от 22 сентября 2010 г. по охране животных, используемых в научных целях [10]. В качестве корма использовали “Корм для содержания лабораторных животных” ПК-120-1, приготовленный по ГОСТ Р50258-92. Воду в стандартных поилках со стальными крышками-носиками давали ad libitum.
В качестве подстила использовали кукурузные гранулы. В качестве материала для гнездования использовали сено.
На основании результатов исследований специфической активности, высшая эффективная доза тестируемого объекта составляет 1 мкг/кг (≈0.08 мл/кг), что эквивалентно ≈29 мкл готового раствора на крысу массой 350 г. Поскольку введение таких малых объемов животным без нарушения готовой лекарственной формы не представляется возможным, в исследовании использовали более высокие дозы тестируемого объекта: 3 мкг/кг (предполагаемая высшая терапевтическая доза) и 10 мкг/кг (10ТД).
В данном исследовании тестируемый объект вводили внутривенно в хвостовую вену и внутримышечно в мышцы бедра в двух дозах. В качестве контроля использовали физиологический раствор. Период введения для самцов составил 60 дней, для самок 15 дней. Объемы для введения были рассчитаны на основании последних данных массы тела животных. Поскольку препарат представляет собой готовый раствор, дополнительной подготовки не проводилось. Разовый объем для введения составил 90 мкл для крысы массой 350 г для дозы 3 мкг/кг и 290 мкл для крысы массой 350 г для дозы 10 мкг/кг.
В течение всего периода введения проводили еженедельный осмотр животных (самцов и самок аутбредных крыс) в клетке содержания, в руках и на открытой площадке с целью выявления признаков интоксикации.
По окончании периода введения тестируемого объекта самок подсаживали к самцам в соотношении 2 : 1 сроком на два эстральных цикла (14 дней). Оплодотворение регистрировали с помощью вагинальных мазков. В период беременности наблюдали за поведением самок крыс.
По окончании периода спаривания самцов контрольных и опытных групп подвергали эвтаназии в СО2-камере: у половины животных было изучено функциональное состояние сперматозоидов, у остальных была проведена гистологическая оценка семенников и придатков семенников.
Животных вскрывали и извлекали придатки семенников (эпидидимисы), максимально отделяя их от брыжейки. Далее каждый эпидидимис помещали на предметное стекло и, зажав лапками пинцета, надрезали обе его доли, после чего оба придатка (с надрезанными долями) помещали в пробирку и заливали 3 мл PBS (фосфатно-солевой буфер) (температура 37°С). Затем производили инкубацию при 37°С и 5%-ном содержании СО2 в течение 15 мин, после чего производили оценку спермограммы.
Исследование спермограммы проводили согласно следующим методикам:
– Подсчет сперматозоидов на предметном стекле в трех полях зрения микроскопа (×400): полученное усредненное значение считали равным концентрации сперматозоидов в 1 мл эякулята (×106/мл) [11];
– Определение подвижности сперматозоидов (подсчитывали число сперматозоидов, совершающих активные поступательные и колебательные движения, и число неподвижных сперматозоидов. Полученный результат выражали в процентах от общего числа подсчитанных сперматозоидов);
– Проведение гипоосмотического теста. Тест основан на набухании живых сперматозоидов, помещенных в гипотонический раствор, мертвые сперматозоиды при этом не набухают [11]. Подсчитывали число видоизмененных сперматозоидов с загнутыми хвостами (живых), в виде четких “птичек"-V (незрелых) и число сперматозоидов, не изменивших свою форму (мертвых). Полученные данные выражали в процентах от общего числа подсчитанных сперматозоидов.
На 20–21-й день беременности с целью оценки эмбрио- и фетотоксического действия тестируемого объекта по показателям пред- и постимплантационной смертности эвтаназировали 50% беременных самок каждой группы. Также у эвтаназированных животных проводили гистологическое исследование органов репродуктивной системы (матки и яичников). Остальные оплодотворенные самки были оставлены до родов с целью дальнейшего наблюдения за постнатальным развитием потомства.
После вскрытия брюшной полости удаляли матку и переносили ее в чашку Петри. После вскрытия матки подсчитывали число мест имплантации, количество живых и мертвых эмбрионов. В яичниках подсчитывали число желтых тел. На основании этих данных определяли уровень пред- и постимплантационной смертности.
Предимплантационную смертность определяли по разности между количеством желтых тел и количеством мест имплантации в матке и определяли, какую долю составило это число от числа желтых тел в %; постимплантационную смертность – по разности между числом мест имплантации и количеством живых плодов, соотнесенной на число мест имплантации в %.
Материал для гистологического исследования фиксировали в 10%-ном растворе нейтрального формалина в течение 24 часов, после чего по общепринятой методике заливали в парафин и изготавливали гистологические срезы толщиной 5–7 мкм. Полученные срезы окрашивали гематоксилином и эозином.
Морфологическое исследование гистологических препаратов проводили при помощи светооптического микроскопа Carl Zeiss Axio Scope A1 (Германия). При необходимости делали микрофотографии при помощи цифровой фотокамеры A-xioCam ICc 1 и программного обеспечения AxioVision Rel. 4.8 (Германия).
У самок, оставленных до родов, наблюдали за физическим и зоопсихическим развитием потомства до 45 дня после рождения.
Проводили ежедневное наблюдение за развитием потомства. В каждом помете регистрировали количество крысят, распределение по полу, выживаемость. Взвешивание детенышей проводили на 1-й день (в пределах 24 ч после окончания родов), 3-й, 6-й, 9-й и 12-й дни после рождения. Со 2-го дня проводили общие наблюдения за физическим развитием потомства. Отмечали день проявления следующих признаков: отлипания ушной раковины, появления первичного волосяного покрова, прорезывания резцов, открытия глаз, опускания семенников у самцов или открытия влагалища у самок.
Кроме этого оценивали скорость созревания сенсорно-двигательных рефлексов и эмоционально-двигательное поведение по следующим параметрам: переворачивание на плоскости, отрицательный геотаксис, избегание обрыва, маятниковый рефлекс, открытое поле-1, реакция на акустический стимул, зрачковый рефлекс, избегание обрыва, вызванное визуальным стимулом, обонятельная реакция, мышечная сила, переворачивание в свободном падении, удержание на вращающемся цилиндре и открытое поле-2.
Статистический анализ выполняли с помощью программного обеспечения Statistica 10.0. (StatSoft, США). Для всех данных была применена описательная статистика: данные проверены на соответствие закону нормального распределения. В случае нормального распределения были подсчитаны среднее значение и стандартная ошибка среднего, которые вместе со значением n представлены в итоговых таблицах. В случае несоответствия данных закону нормального распределения были рассчитаны медиана и квартильный размах. Для оценки данных с признаками нормального распределения был использован однофакторный дисперсионный анализ (ANOVA), с последующим межгрупповым сравнением (post hoc) с использованием теста Тьюки. Для данных, не подчиняющихся закону нормального распределения – ранговый критерий Краскела–Уоллиса, с последующим множественным сравнением средних рангов. Различия были определены при 0,05 уровне значимости.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В результате проведенных исследований по оценке влияния лекарственного средства на основе deamino-Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Arg-Gly-NH2 на репродуктивную функцию самцов аутбредных крыс, получавших тестируемый объект внутривенно и внутримышечно, в двух изученных дозах в течение 60 дней были выявлены клинические проявления токсичности, которые выражались в статистически значимом снижении массы тела у самцов крыс по сравнению с животными контрольной группы к 29-му дню исследования при внутривенном введении и 8-му дню при внутримышечном. У самок крыс наблюдали статистически значимое снижение массы тела в двух исследованных дозах при внутривенном введении в течение 15 дней. Внутримышечное введение тестируемого объекта в изученных дозах не повлияло на массу тела самок крыс. Также при внутривенном введении тестируемого объекта в дозе 10 мкг/кг у самок отмечали угнетение общего состояния, начиная с 8-го дня введения. Изменений в поведенческих реакциях самцов выявлено не было.
В период введения тестируемого объекта была зафиксирована гибель животных. Так в группе самок крыс, получавших тестируемый препарат внутривенно в дозе 10 мкг/кг, погибли 4 самки и 1 самка в группе крыс, получавших это вещество внутримышечно в той же дозе. Среди самцов крыс смертность была зафиксирована в группе с дозой 3 мкг/кг внутривенно и составила 10% (1 самец из 10). В остальных экспериментальных группах смертность отсутствовала.
По результатам макроскопического исследования у всех исследованных трупов животных были обнаружены признаки сердечной недостаточности (отек и геморрагии в легких, отек мозга, венозное полнокровие внутренних органов), которая стала непосредственной причиной смерти животных.
При спаривании с интактными самками крыс изменений полового поведения самцов крыс, получавших препарат внутривенно и внутримышечно в исследованных дозах, не наблюдали по сравнению с контрольными животными. Во всех экспериментальных группах независимо от введения препарата регистрировали факт копуляции половых партнеров. Наибольшее число случаев копуляции во всех экспериментальных группах было зафиксировано на второй–четвертый день после подсадки самок к самцам.
По окончании периода спаривания у половины самцов было изучено функциональное состояние сперматозоидов, у остальных была проведена гистологическая оценка семенников и придатков семенников. Результаты анализа спермограммы представлены в табл. 1 и 2.
Таблица 1.
Влияние тестируемого препарата на функциональное состояние сперматозоидов аутбредных крыс-самцов при внутривенном и внутримышечном введении, (M ± m, n = 5)
| № группы | Доза, мкг/кг | Объект | Концентрация сперматозоидов, ×106/мл |
Доля подвижных сперматозоидов, % |
Доля неподвижных
сперматозоидов, % |
|---|---|---|---|---|---|
| Внутривенное введение | |||||
| 1 | 0 | Физиологический раствор | 31 ± 2.6 | 80 ± 3.3 | 20 ± 3.3 |
| 2 | 3 | Теститруемый препарат | 31 ± 2.0 | 36 ± 11.9* | 64 ± 11.9* |
| 3 | 10 | 7.0 ± 1.5* | 40 ± 5.4* | 60 ± 5.4* | |
| Внутримышечное введение | |||||
| 11 | 0 | Физиологический раствор | 29 ± 1.9 | 80 ± 1.8 | 20 ± 1.8 |
| 12 | 3 | Тестируемый препарат | 22 ± 2.7 | 73 ± 11.4 | 28 ± 11.4 |
| 13 | 10 | 17 ± 6.3 | 77 ± 2.5 | 23 ± 2.5 | |
Таблица 2.
Влияние тестируемого препарата на функциональное состояние сперматозоидов аутбредных крыс-самцов при внутривенном и внутримышечном введении. Гипоосмотический тест, (n = 5), M ± m
| № группы |
Доза, мкг/к г | Объект | Доля живых сперматозоидов, % | Доля мертвых сперматозоидов, % | Доля незрелых сперматозоидов, % |
|---|---|---|---|---|---|
| Внутривенное введение | |||||
| 1 | 0 | Физиологический раствор | 79 ± 3.0 | 10 ± 1.6 | 12 ± 2.2 |
| 2 | 3 | Тестируемый препарат | 45 ± 10.7* | 46 ± 10.7* | 9 ± 1.4 |
| 3 | 10 | 45 ± 7.8* | 43 ± 6.4* | 13 ± 2.1 | |
| Внутримышечное введение | |||||
| 11 | 0 | Физиологический раствор | 77 ± 3.3 | 14 ± 2.7 | 9 ± 2.1 |
| 12 | 3 | Тестируемый препарат | 77 ± 8.5 | 12 ± 5.7 | 11 ± 2.9 |
| 13 | 10 | 75 ± 6.2 | 14 ± 2.9 | 12 ± 3.4 | |
Внутривенное введение тестируемого препарата в дозе 10 мкг/кг привело к снижению общего количества сперматозоидов на 77% по сравнению с контрольными животными, также регистрировали достоверное снижение доли подвижных сперматозоидов на 50%, по сравнению с контрольными животными. У самцов, получавших препарат внутривенно в дозе 3 мкг/кг также достоверно снижалась доля подвижных сперматозоидов (на 45%).
Оценка жизнеспособности сперматозоидов при уменьшенном осмотическом давлении окружающей среды выявила снижение доли живых сперматозоидов и достоверное увеличение количества мертвых сперматозоидов по сравнению с результатами в контрольной группе. На основании полученных данных можно заключить, что многократное внутривенное введение лекарственного средства на основе deamino-Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Arg-Gly-NH2 в дозах 3 мкг/кг (ВТД) и 10 мкг/кг (10ТД) самцам аутбредных крыс приводит к статистически значимому снижению подвижности сперматозоидов.
Внутримышечное введение препарата в дозах 3 и 10 мкг/кг не оказало негативного влияния на функционирование репродуктивной системы животных.
Патоморфологическое и гистологическое исследование семенников и придатков семенников самцов крыс, получавших тестируемый объект в двух исследованных дозах показало наличие изменений в исследованных органах. Так, у 25% самцов крыс, получавших тестируемый объект внутривенно в дозе 3 мкг/кг, и у 50% самцов, получавших тестируемый объект внутримышечно в дозе 3 мкг/кг, была выявлена дистрофия семенников и придатков семенников, а также наличие в просвете канальцев “клеточного мусора" – дегенеративных герминтативных клеток и остатков погибших и разрушенных клеток. У остальных животных строение семенников и придатков семенников соответствовало норме.
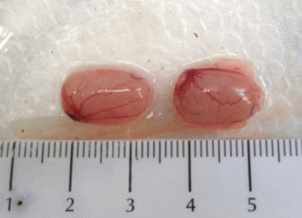
У трупов животных, получавших тестируемый препарат внутривенно в дозе 10 мкг/кг, семенники были уменьшены в объеме, дряблой консистенции, цианотичные, что характерно для двусторонней гипоплазии. Единичные случаи такой же патоморфологической картины были отмечены у животных при внутримышечном введении в дозе 10 мкг/кг (рис. 1, 2 ).
Рис. 1.
Эвисцерированные семенники и придатки семенников: семенники уменьшены в объеме, цианотичны. Двусторонняя гипоплазия. Крыса-самец №3.8.
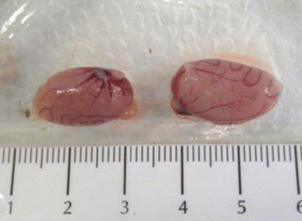
Рис. 2.
Эвисцерированные семенники и придатки семенников: семенники значительно уменьшены в объеме. Двусторонняя гипоплазия. Крыса-самец №12.6.
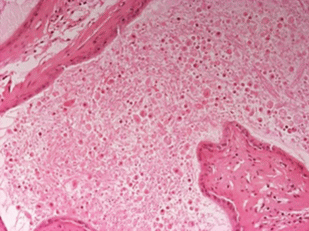
У 80% животных при внутривенном введении в дозе 10 мкг/кг и у 60% при внутримышечном введении в дозе 10 мкг/кг было выявлено резко выраженное нарушение строения семенных канальцев: полное нарушение стратификации (рядности), гипоплазия и дистрофические изменения сперматогенного эпителия в виде вакуолизации цитоплазмы, полиморфизма ядер, появления гигантских клеток (деформированные клетки Сертоли) (рис. 3 ). Также, у 60% животных, получавших тестируемый объект внутривенно и внутримышечно в дозе 10 мкг/кг, и 25% животных, получавших тестируемый объект внутривенно и внутримышечно в дозе 3 мкг/кг в придатках семенников часть канальцев расширена с уплощенным эпителием, с наличием в просвете неструктурированного эозинофильного материала и клеточного детрита (рис. 4 ).
Рис. 3.
Срез семенников самца крысы № 3.8. Гипоплазия и дистрофические изменения сперматогенного эпителия. Ув. ×100. Окр. гематоксилин-эозин.
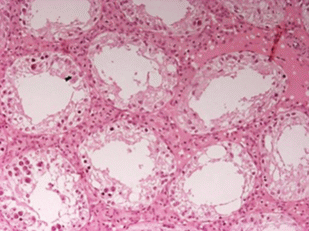
Рис. 4.
Срез придатка семенника крысы-самца № 13.6. В просвете расширенных канальцев определяется неструктурированный эозинофильный материал и клеточный детрит. Ув. ×100. Окр. гематоксилин-эозин.
По результатам патоморфологического и гистологического исследования органов репродуктивной системы самцов аутбредных крыс можно заключить, что внутривенное и внутримышечное введение препарата в дозах 3 и 10 мкг/кг оказывает токсическое действие на ткани семенника и придатка семенника.
Далее было изучено влияние лекарственного средства на основе deamino-Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Arg-Gly-NH2 в дозах 3 и 10 мкг/кг при внутривенном и внутримышечном путях введения на репродуктивную функцию самок крыс.
После эвтаназии половины оплодотворенных крыс-самок (т.е. тех самок, для которых был зафиксирован факт копуляции) на 20–21-й день беременности оценивали эффективность оплодотворения: рассчитывали индекс плодовитости и индекс беременности для каждой группы животных. Также оценивали оплодотворяющую способность самцов (табл. 3).
Таблица 3.
Эффективность оплодотворения в группах животных, получавших тестируемый препарат внутривенно и внутримышечно
| № группы |
Доза препарата мкг/кг | Число ссаженных самок | Число оплодотворенных самок | Число беременных самок | Индекс
плодовитости самок,% |
Индекс беременности, % | Оплодотворяющая способность самцов, % |
|---|---|---|---|---|---|---|---|
| Внутривенное введение | |||||||
| 6 | 0 | 20 | 20 | 15 | 100 | 75 | 75 |
| 7 | 3 (вводили самцам) | 20 | 20 | 14 | 100 | 70 | 70 |
| 8 | 10 (вводили самцам) | 20 | 20 | 3 | 100 | 15 | 15 |
| 9 | 3 (вводили самкам) | 20 | 20 | 18 | 100 | 90 | 90 |
| 10 | 10 (вводили самкам) | 16 | 16 | 15 | 100 | 94 | 94 |
| Внутримышечное введение | |||||||
| 16 | 0 | 20 | 20 | 19 | 100 | 95 | 95 |
| 17 | 3 (вводили самцам) | 20 | 20 | 13 | 100 | 65 | 65 |
| 18 | 10 (вводили самцам) | 20 | 20 | 11 | 100 | 55 | 55 |
| 19 | 3 (вводили самкам) | 20 | 20 | 18 | 100 | 90 | 90 |
| 20 | 10 (вводили самкам) | 19 | 19 | 15 | 100 | 79 | 79 |
Расчеты показали, что отличия ИП для групп животных, получавших тестируемый объект внутривенно и внутримышечно, от контрольной группы животных отсутствуют. Установлено, что не все животные были беременны (при зафиксированном ранее факте копуляции): так, в группе самок, спаренных с самцами, получавшими тестируемый препарат внутривенно в дозе 10 мкг/кг, индекс оплодотворяющей способности составил 15%, что в 5 раз меньше показателя контрольной группы животных. В группе, где самцы получали тестируемый объект внутримышечно в дозе 10 мкг/кг значения этого индекса были снижены ≈ в 2 раза, относительно контрольной группы, однако, данные не выходили за пределы физиологической нормы животных. Согласно данным литературы, эффективность спаривания здоровых животных может варьировать в диапазоне от 50 до 95% [12].
По остальным показателям не отмечено ни закономерного снижения, ни зависимости наблюдаемых отклонений от введения или дозы тестируемого объекта.
На 20–21-й день беременности эвтаназировали половину оплодотворенных самок каждой группы с целью оценки состояния матки и яичников. У всех исследованных самок крыс были выявлены признаки беременности. Макроскопически видимых изменений обнаружено не было (рис. 5 ). Гистологическое строение матки и яичников всех исследованных животных соответствовало норме.
Рис. 5.
Вскрытая брюшная полость, матка и яичники выведены за пределы брюшной полости. Стрелками указаны оба рога матки, в которых находятся плоды. Беременность. Крыса-самка №9.13.
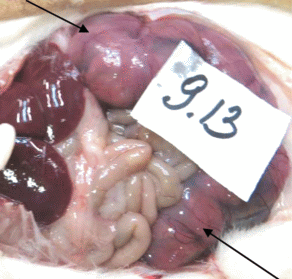
По результатам патоморфологического и гистологического исследования органов репродуктивной системы самок крыс можно заключить, что внутривенное и внутримышечное введение тестируемого препарата в дозах 3 и 10 мкг/кг не оказало токсического действия. Все выявленные изменения соответствовали нормальному течению беременности.
С целью оценки влияния тестируемого объекта на пренатальное развитие потомства аутбредных крыс для каждой экспериментальной группы беременных животных было подсчитано число желтых тел в яичниках, число мест имплантации в матке, число живых и погибших плодов, рассчитаны значения пред- и постимплантационной смертности (показателей эмбрио- и фетотоксического действия тестируемого объекта, соответственно) (табл. 4 и 5).
Таблица 4.
Оценка влияния внутривенного и внутримышечного введения тестируемого препарата на пренатальное развитие, (M ± m)
| № | Доза препарата мкг/кг | Число самок (n) |
Число желтых тел | Число мест имплантации | Число живых плодов | Предимплантационная смертность,% |
Постимплатационная смертность, % |
|---|---|---|---|---|---|---|---|
| Внутривенное введение | |||||||
| 6 | 0 | 7 | 19 ± 2.0 | 11 ± 1.4 | 10 ± 1.3 | 42 | 9 |
| 7 | 3 (вводили самцам) | 5 | 20 ± 2.0 | 14 ± 0.5 | 13 ± 0.4 | 30 | 7 |
| 8 | 10 (вводили самцам) | 1# | 20 | 2 | 2 | 90 | 0 |
| 9 | 3 (вводили самкам) | 9 | 18 ± 2.4 | 11 ± 1.1 | 10 ± 1.5 | 39 | 9 |
| 10 | 10 (вводили самкам) | 7 | 15 ± 1.0 | 10 ± 1.2 | 10 ± 1.1 | 33 | 0 |
| Внутремышечное введение | |||||||
| 16 | 0 | 9 | 18 ± 2.0 | 12 ± 1.3 | 12 ± 1.4 | 33 | 0 |
| 17 | 3 (вводили самцам) | 7 | 16 ± 1.4 | 10 ± 1.8 | 10 ± 1.8 | 38 | 0 |
| 18 | 10 (вводили самцам) | 5 | 19 ± 1.2 | 11 ± 1.6 | 11 ± 1.6 | 42 | 0 |
| 19 | 3 (вводили самкам) | 9 | 16 ± 1.2 | 12 ± 0.7 | 12 ± 0.7 | 25 | 0 |
| 20 | 10 (вводили самкам) | 8 | 19 ± 1.7 | 12 ± 1.0 | 12 ± 1.0 | 37 | 0 |
Таблица 5.
Оценка влияния внутривенного и внутримышечного введения тестируемого препарата на пренатальное развитие, (Me (Q1; Q3))
| № группы |
Доза, лекарственное средство на основе deamino-Cys-Tyr-Ile-GlnAsn-Cys-Pro-Arg-Gly-NH2, мкг/кг | Число самок (n) | Число погибших плодов |
|---|---|---|---|
| Внутривенное введение | |||
| 6 | 0 | 7 | 0(0; 0) |
| 7 | 3 (вводили самцам) | 5 | 0(0; 0) |
| 8 | 10 (вводили самцам) | 1# | 0 |
| 9 | 3 (вводили самкам) | 9 | 0(0; 0) |
| 10 | 10 (вводили самкам) | 7 | 0(0; 0) |
| Внутримышечное введение | |||
| 16 | 0 | 9 | 0 (0; 0) |
| 17 | 3 (вводили самцам) | 7 | 0 (0; 0) |
| 18 | 10 (вводили самцам) | 5 | 0 (0; 0) |
| 19 | 3 (вводили самкам) | 9 | 0 (0; 0) |
| 20 | 10 (вводили самкам) | 8 | 0 (0; 0) |
Как видно из представленных данных, гибель плодов крыс существенно не отличалась от смертности в контрольных группах животных, что позволяет сделать вывод об отсутствии эмбрио- и фетотоксического действия тестируемого объекта при внутривенном и внутримышечном введении в двух дозах самцам и самкам крыс.
После эвтаназии группы оплодотворенных самок крыс вторая половина животных была оставлена до родов с целью выявления возможных нарушений эмбрионального развития, проявляющихся только в постнатальном периоде.
На данном этапе эксперимента у потомства крыс оценивали общее физическое состояние по мере развития животных в период грудного вскармливания и после его окончания до полуторамесячного возраста. У полученного потомства оценивали выживаемость (табл. 6) и прирост массы тела.
Таблица 6.
Выживаемость потомства в группах животных, получавших тестируемый объект внутривенно и внутримышечно (с рождения до 12-го дня)
| № | Доза, препарата мкг/кг | Число самок (n) |
Число рожденных в одном помете (M ± m) |
Общее число рожденных в группе |
Распределение по полу, самцов/самок |
Число выживших детенышей в группе |
Смертность потомства, % |
|---|---|---|---|---|---|---|---|
| Внутривенное введение | |||||||
| 6 | 0 | 8 | 10.4 ± 1.52 | 83 | 39/42 | 81 | 2.4 |
| 7 | 3 (вводили самцам) | 9 | 8.7 ± 1.35 | 78 | 37/40 | 77 | 1.3 |
| 8 | 10 (вводили самцам) | 2# | 4.0 ± 1.00 | 8 | 3/5 | 8 | 0 |
| 9 | 3 (вводили самкам) | 9 | 9.1 ± 1.70 | 87 | 48/39 | 87 | 0 |
| 0 | 10 (вводили самкам) | 8 | 11.5 ± 1.52 | 92 | 40/47 | 87 | 5.4 |
| Внутримышечное введение | |||||||
| 16 | 0 | 10 | 11.4 ± 1.2 | 114 | 57/56 | 113 | 0.9 |
| 17 | 3 (вводили самцам) | 6 | 10.2 ± 0.87 | 61 | 30/31 | 61 | 0 |
| 18 | 10 (вводили самцам) | 6 | 8.8 ± 2.32 | 53 | 27/25 | 52 | 1.9 |
| 19 | 3(вводили самкам) | 9 | 10.8 ± 0.98 | 97 | 48/49 | 97 | 0 |
| 20 | 10 (вводили самкам) | 7 | 13.1 ± 1.34 | 92 | 45/43 | 88 | 4.3 |
Среднее число живых новорожденных в одном помете опытных групп достоверно не отличалось от такового в контрольной группе. Уровень смертности потомства за весь период наблюдения (от рождения до 12-го дня) во всех группах не превышал 5–6% и значительно не отличался между группами. Соотношение самцов и самок в потомстве во всех группах практически идентично и составило примерно 1 : 1.
Достоверных отличий по массе тела детенышей выявлено не было. Масса тела крысят изменялась в пределах физиологических колебаний [12, 13].
Показателями уровня физического развития потомства являются не только масса тела и ее динамика, но и сроки проявления физических признаков таких, как отлипание ушной раковины, появление первичного волосяного покрова, прорезывание резцов, открытие глаз, начало полового созревания (опускание семенников у самцов или открытие влагалища у самок).
Сроки отлипания ушной раковины, появления первичного волосяного покрова, прорезывания резцов были синхронны в пометах опытных и контрольной групп. Открытие глаз в пометах опытных групп произошло практически в те же сроки, что и в контрольной группе. Опускание семенников и открытие влагалища по срокам также были сопоставимы в изучаемых группах.
Отдельно взятые индивидуальные значения исследуемых показателей, полученные для потомства разных групп, не выходили за пределы физиологической нормы [7, 13].
Скорость созревания сенсорно-двигательных рефлексов в период вскармливания у потомства, родившегося от самок и самцов, получавших тестируемый препарат внутривенно и внутримышечно в двух дозах, отличалась от животных контрольных групп.
Показатели эмоционально-двигательного поведения и способности к тонкой координации движений потомства всех экспериментальных групп в период грудного вскармливания вплоть до 45-го дня после рождения не отличались от контрольных животных.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Лекарственное средство на основе deamino-Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Arg-Gly-NH2 при многократном внутривенном и внутримышечном введении в дозах 3 мкг/кг (ВТД) и 10 мкг/кг (10ТД) оказывало негативное влияние на общее состояние самок крыс и не оказало негативного влияния на общее физическое состояние самцов. В период отмены введения тестируемого объекта было установлено, что выявленные симптомы интоксикации носили обратимый характер.
Также на фоне введения исследуемого препарата были зафиксированы летальные эффекты. В группе самок крыс, получавших препарат внутривенно в дозе 10 мкг/кг, погибли 4 самки и 1 самка в группе крыс, получавших тестируемый объект внутримышечно в дозе 10 мкг/кг. Среди самцов крыс смертность была зафиксирована в дозе 3 мкг/кг внутривенно и составила 10% (1 самец из 10). Непосредственной причиной смерти животных стала острая сердечная недостаточность. В остальных экспериментальных группах смертность отсутствовала.
Курсовое внутривенное и внутримышечное введение тестируемого препарата дозах 3 и 10 мкг/кг приводило к достоверному снижению массы тела крыс по сравнению с животными контрольной группы, получавшими физиологический раствор.
Внутривенное введение тестируемого объекта в дозах 3 мкг/кг (ВТД) и 10 мкг/кг (10ТД), в течение 60 дней самцам аутбредных крыс оказало негативное влияние на строение и функционирование репродуктивной системы самцов, в частности повлияло на функциональное состояние сперматозоидов. Так, многократное внутривенное введение 3 и 10 мкг/кг самцам аутбредных крыс привело к дозозависимому снижению подвижности сперматозоидов, к снижению доли живых сперматозоидов, а также к достоверному увеличению неподвижных и мертвых сперматозоидов. Также, многократное внутривенное введение лекарственного средства на основе deamino-Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Arg-Gly-NH2 в дозе 10 мкг/кг самцам оказало негативное влияние на фертильность самцов аутбредных крыс, с выраженным снижением индекса беременности и оплодотворяющей способности самцов по сравнению с животными контрольной группы в 5 раз. Фертильность животных остальных групп соответствовала физиологической норме для данного вида лабораторных животных.
Тестируемый объект в дозах 3 и 10 мкг/кг при внутривенном и внутримышечном путях введения самцам и самкам крыс до спаривания не повлиял на протекание беременности у самок аутбредных крыс и не имел выраженного эмбрио- и фетоксического действия.
Курсовое внутривенное и внутримышечное введение лекарственного средства на основе deamino-Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Arg-Gly-NH2 в исследованных дозах самцам и самкам аутбредных крыс до спаривания не повлияло на роды, рождаемость, выживаемость потомства и их физическое развитие. При оценке зоопсихологического развития потомства не зафиксировано повреждающего действия тестируемого объекта, вводимого самцам и самкам аутбредных крыс в дозах 3 и 10 мкг/кг до спаривания, на постнатальное развитие их потомства.
Вывод: в ходе эксперимента по изучению репродуктивной токсичности показано, что лекарственное средство на основе deamino-Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Arg-Gly-NH2 в дозах, превышающих терапевтические при внутривенном способе введения, оказывает негативное влияние на генеративную систему самцов крыс. Полученные результаты предполагают ограничение применения лекарственного средства на основе deamino-Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Arg-Gly-NH2 в период планирования беременности.
Данная работа была выполнена в рамках государственного контракта № 14.N08.12.0050 от “13" ноября 2015 в ЗАО "Санкт-Петербургский институт фармации”.
Список литературы
Hyponatremia and hypernatremia. In: H.J. Adrogue, D.E. Wesson. Salt & water. Boston. Blackwell Scientific. 205–284. 1994.
Feig P.U., McCurdy D.K. The hypertonic state. N. Engl. J. Med. 297: 1444–1454. 1977.
Bentley P.J. Endocrines and osmoregulation. A comparative account in vertebrates. Berlin, New York. Springer. 2002.
Кутина А.В., Кузнецова А.А., Наточин Ю.В. Катионы в сыворотке крови человека. Успехи физиол. наук. 36(3) : 3–32. 2005. [Kutina A.V., Kuznetsova A.A., Natochin Yu.V. Cations in the Human Blood Serum. Usp. Fiziol. Nauk. 36(3) : 3–32. 2005 (In Russ.)].
Наточин Ю.В., Виленский Б.С., Шустин В.А., Барсуков С.Ф., Семенова Г.М., Гриневич Т.В., Красноружский А.И. Осмоляльность и концентрация ионов в ликворе и сыворотке крови при эпилепсии и ишемическом инсульте. Журн. невропатол. и психиатрии им. С.С. Корсакова. 96(5): 77–80. 1996. [Natochin Yu.V., Vilenskij B.S., Shustin V.A., Barsukov S.F., Semenova G.M., Grinevich T.V., Krasnoruzhskij A.I. Ostolality and concentration of ions in liquor and blood serum in patients with epilepsy and ischemic stroke. S.S. Korsakov J. Neurol. Psychiatry 96(5): 77–80. 1996. (In Russ.)].
Шейман Д.А. Патофизиология почки. М. Бином. 1999. [Shayman J.A. Renal Pathophysiology. J.B. Lippincott Company. (Russ Ed.: Shayman J.A. Patofiziologiya pochki. M. Binom. 1999)].
Руководство по проведению доклинических исследований лекарственных средств. Часть первая. М. Гриф и К. 2012. [Rukovodstvo po provedeniyu doklinicheskih issledovanii lekarstvennyh sredstv. Chast pervaya [Guideline on conducting preclinical trials of the drugs. Vol. 1.] М.Grif i K. 2012.].
OECD GUIDELINE FOR THE TESTING OF CHEMICALS. One-Generation Reproduction Toxicity Study № 415 / OECD № 415. 2007.
Санитарно-эпидемиологические правила СП 2.2.1.3218-14 “Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)” (утв. постановлением Главного государственного санитарного врача РФ от 29 августа 2014 г. № 51) [SP 2.2.1.3218-14 Sanitary and epidemiological requirements to arrangement, equipment and maintenance of biological clinics (vivariums)].
Директива 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях. [Directive 2010/63/EU of the European parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union, 20.10.2010. I. 276/33–276/79].
WHO laboratory manual for the examination and processing of human semen. 5th ed. World Health Organization. 2010.
Тышко Н.В., Селяскин К.Е., Мельник Е.А., Пашорина В.А., Жминченко В.М. Оценка репродуктивной функции крыс при раздельном и сочетанном воздействии алиментарного и токсического факторов. Вопр. питания. 1: 33–43. 2012. [Tyshko N.V., Selyaskin K.E., Melnik E.A., Pashorina V.A., Zhminchenko V.M. The separate and combined effects of calcium pantothenate deficiency and cadmium intoxication on rat reproductive function. Vopr. Pitan. 1: 33–43. 2012. (In Russ.)].
Справочник. Физиологические, биохимические и биометрические показатели нормы экспериментальных животных. ООО “Издательство "ЛЕМА”. Под редакцией проф. Макарова В.Г., Макаровой М.Н. СПб, 2013. [Spravochnik. Fiziologicheskie, biokhimicheskie i biometricheskie pokazateli normy eksperimentalnyh zhivotnyh. JSC “Izdatelstvo "LEMA”. SPb. 2013].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


