Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 11, стр. 1406-1416
Опыт применения оптогенетических подходов к исследованию функций мозга и протезированию дегенеративной сетчатки
А. Ю. Малышев 1, *, М. А. Островский 2, 3
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Институт биохимической физики им. Н.М. Эмануэля РАН
Москва, Россия
* E-mail: malyshev@ihna.com
Поступила в редакцию 28.06.2019
После доработки 02.08.2019
Принята к публикации 03.08.2019
Аннотация
Оптогенетика, которую можно определить как метод, позволяющий осуществлять управление при помощи света активностью нейронов за счет экспрессии в них светоактивируемых белков, является мощным инструментом в нейрофизиологических исследованиях. Оптогенетика определила значительный прогресс в изучении функций мозга в последнюю декаду. Прогресс оптогенетики решающим образом зависит от разработки новых молекулярных инструментов – светоактивируемых белков. Для возбуждения клеток в оптогенетике наиболее часто используется природный светоактивируемый катионный канальный родопсин2 (ChR2). В 2015 г. был идентифицирован природный светоактивируемый хлорный канал GtACR2, способный в оптогенетических экспериментах с высокой эффективностью подавлять активность нейронов. Мы обнаружили уникальные свойства данного канала, показав, что в GtACR2-экспрессирующих нейронах световой стимул, помимо сильного торможения, также может вызывать генерацию потенциалов действия, которая происходит, по всей видимости, в аксонных терминалях нейрона за счет измененного потенциала реверсии хлора в этих отделах клетки. В своей работе мы применяем оптогенетичекие методы для изучения клеточных механизмов обучения и памяти. И-спользуя экспрессию канального родопсина2 в сети пресинаптических нейронов, мы применяли в рамках одного эксперимента световую стимуляцию для изучения свойств синаптических связей и их пластичности в целой популяции нейронов. Одним из перспективных направлений клинического применения оптогенетики является ее использование для протезирования дегенеративной сетчатки. Вариантом такого подхода является воссоздание ON/OFF рецептивного поля ганглиозных клеток сетчатки путем таргетированной экспрессии возбуждающего светоактивируемого белка в центральной части ганглиозной клетки, а тормозного – в периферической. В рамках данного подхода нами была создана бицистронная конструкция, несущая гены возбуждающего и тормозного опсинов, экспрессия которой была способна привести к восстановлению ON/OFF взаимодействий, характерных для ганглиозного нейрона.
Оптогенетика, которую можно определить как управление при помощи света активностью нейронов за счет экспрессии в них светоактивируемых белков, является мощным инструментом в нейрофизиологических исследованиях, определившим значительный прогресс в изучении функций мозга в последнее десятилетие. Прогресс оптогенетики решающим образом зависит от разработки новых молекулярных инструментов – светоактивируемых белков. Для активации нейронов в оптогенетических экспериментах с самого рождения оптогенетики, дату которой можно определить сентябрем 2005 г. – по выходу основополагающей статьи группы K. Diesseroth [1], и по настоящее время наиболее часто применяется канальный родопсин2, изначально выделенный из одноклеточной водоросли хламидомонады. Несмотря на то, что в настоящее время появилось множество модификаций канального родопсина2 с улучшенными кинетическими характеристиками и большей амплитудой фототока [2], канальный родопсин2 до сих пор является популярным оптогенетическим инструментом. Так, если в поисковой системе Google Scholar ввести запрос, содержащий перечисление наиболее популярных альтернативных канальному родопсину2 возбуждающих светоактивируемых каналов (H134R OR ChETA OR VChR1 OR ChEF OR ChIEF OR ChD) и слова “neuron AND optogenetics”, то с 2018 г. поисковая система выдает 1420 статей. В то же время, если ввести запрос, содержащий “neuron AND optogenetics AND ChR2" и ограничить его условием, чтобы в статье не содержалось ни одного из альтернативных каналов, перечисленных выше, то получается приблизительно 2330 публикаций. Хотя данный поисковый запрос не учитывает статьи, использующие менее распространенные канальные родопсины, тем не менее, из него становится понятно, что в настоящее время весьма значительная часть оптогенетических работ выполняется с использованием немодифицированного канального родопсина2. Канальный родопсин2 представляет собой неспецифический катионный светоактивируемый канал, который открывается под действием света и обеспечивает деполяризацию клетки за счет входа внутрь клетки катионов, преимущественно натрия [3]. Для торможения нейронной активности в оптогенетических экспериментах наиболее широко применялись светоактивируемые ионные помпы: галородопсин (хлорная помпа) и бактериородопсин (протонная помпа) [4 ] . Эффективность светоактивируемого канала существенно выше, чем помпы: поглотив один фотон, канал открывается на какое-то время, позволяя зайти внутрь клетки нескольким ионам, в то время как ионная помпа, поглотив один квант света, перекачивает через мембрану только один ион. Поэтому со времени зарождения оптогенетики не прекращались поиски светоактивируемых ионных каналов, пригодных для торможения нейронной активности в оптогенетических экспериментах. И вот, в 2014 г., одновременно двумя группами ученых путем точечного мутагенеза канального родопсина2 был создан искусственный светоактивируемый ионный канал, получивший название slow ChloCk (iC1C2 в другой работе). Эти две работы вышли одновременно в одном и том же выпуске журнала Science [5, 6]. Вскоре после этого, в 2015 г. из криптофитовых водорослей был выделен природный анионный канальный родопсин GtACR2 [7]. Мы провели сравнительное изучение этих двух светоактивируемых анионных каналов, экспрессированных в пирамидных нейронах неокортекса крыс методом in utero электропорации [8]. Трансфицированные нейроны регистрировались внутриклеточно методом пэтч-клампа в конфигурации целая клетка в режиме фиксации тока и потенциала. Было обнаружено, что, хотя оба канала обеспечивают надежное светоиндуцированное подавление спайковой активности нейронов, между двумя данными опсинами существуют значительные различия. Во-первых, канал slow ChloCk характеризуется гораздо более медленной кинетикой инактивации по сравнению с GtACR2. Короткий световой импульс длительностью 1 мс вызывает в нейронах, экспрессирующих slow ChloCk, подавление спайковой аткивности, длящееся десятки секунд (рис. 1А). В то же самое время световая стимуляция нейронов, содержащих GtACR2, вызывала торможение клеток, длящееся ровно столько, сколько действовал световой стимул (рис. 2А). Во-вторых, потенциал реверсии светоиндуцированных токов различался для каналов slow ChloCk и GtACR2 и составлял –64.5 ± 1.9 мВ (n = 9) и –86.4 ± 2.3 мВ (n = 11) соответственно. Потенциал реверсии тока, протекающего через канал GtACR2, довольно точно соответствовал потенциалу реверсии для хлора, в то время как потенциал реверсии slow ChloCk был существенно выше, что, по всей видимости, объясняется остаточной проводимостью этого канала для некоторых катионов [8]. Таким образом, проведенное нами сравнительное исследование светоактивируемых каналов slow ChloCk и GtACR2 показало существенное преимущество последнего для использования в оптогенетических экспериментах как по кинетическим характеристикам, так и по эффективности тормозного воздействия на активность нейронов вследствие более высокой селективности к ионам хлора.
Рис. 1.
Светоактивируемое подавление генерации потенциалов действия в нейронах, экспрессирующих анионный канальный опсин slow ChloCk, полученный путем генной модификации канального родопсина2, и природный анионный светоактивируемый канал GtACR2. А – в нейронах, несущих светоактивируемый канал slow ChloCk, короткий световой стимул вызывает длительное торможение импульсной активности, вызванной инъекцией деполяризующего тока (сплошная горизонтальной линия); цифра над линией обозначает амплитуду инъецируемого тока. Пунктирной линией обозначен уровень мембранного потенциала до начала внутриклеточной стимуляции. Б – в нейронах, экспрессирующих GtACR2, длительность торможения точно соответствует по времени длительности светового стимула.
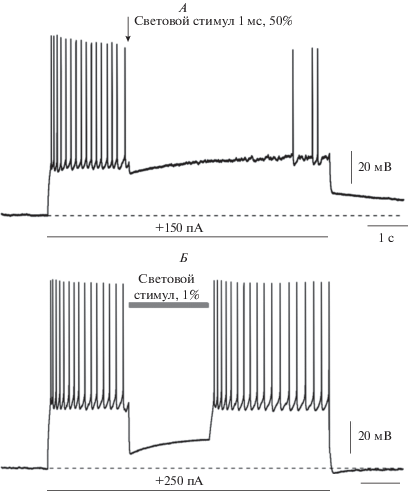
Рис. 2.
Световая стимуляция нейронов, экспрессирующих анионный опсин GtACR2, может вызывать как ингибирование клеток, так и генерацию потенциалов действия. А – световая стимуляция всего поля зрения (горизонтальная серая полоска) GtACR2-положительного нейрона 2–3 слоя вызывает прекращение генерации потенциалов действия, вызванной внутриклеточной инъекцией деполяризующего тока (нижняя кривая). Б – небольшой фрагмент записи, показанный на А (a–b), с более высоким временным разрешением показывает вызванный световой стимуляцией потенциал действия в начале светоиндуцированной гиперполяризации. В – последовательность коротких световых стимулов с частотой 10 Гц надежно индуцирует потенциалы действия в экспрессирующих GtACR2 нейронах в течение нескольких секунд непрерывной ритмической стимуляции. Время нанесения световых стимулов показано серыми стрелками внизу. Г – картирующая световая стимуляция пространственно ограниченными световыми стимулами (40 × 40 мкм) показывает распределение мест, в которых свет может вызвать генерацию потенциалов действия в нейроне, экспрессирующем GtACR2 (серые квадраты). Черный треугольник обозначает положение тела клетки. Слева приведено обозначение слоев коры.
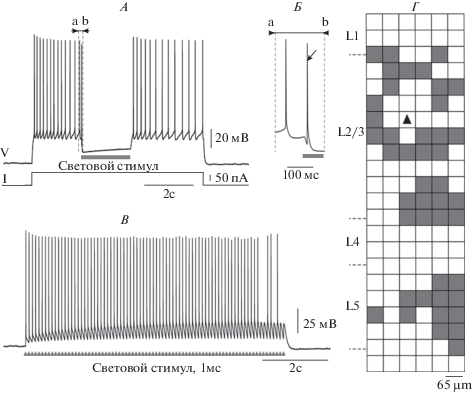
Исследуя более подробно функциональные свойства анионного канала GtACR2 мы обнаружили, что световая стимуляци GtACR2-экспрессирующих нейронов, помимо сильного торможения, также может вызывать генерацию потенциала действия, которая происходит в самом начале действия светового стимула (рис. 2А, Б) [9]. Более того, оказалось, что если на нейрон, экспрессирующий данный опсин, подавать короткие световые стимулы, то каждый из них способен вызывать генерацию потенциалов действия с частотами вплоть до 10–15 Гц (рис. 2В). Детальный анализ формы потенциалов действия, вызванных световой стимуляцией GtACR2-экспрессирующих нейронов, показал, что светоиндуцированные потенциалы действия начинаются прямо от потенциала покоя клетки без фазы препотенциала. Известно, что такая форма потенциалов действия характерна для ретроградно распространяющихся спайков, место генерации которых находится на значительном удалении от тела клетки. Для выяснения расположения мест, в которых происходит генерация спайков при световой активации GtACR2, нами была произведена картирующая световая стимуляция нейронов, экспрессирующих данный канал. Стимуляция производилась квадратными световыми стимулами размером 40 × 40 мкм, в псевдослучайном порядке таким образом, чтобы к окончанию стимуляции световыми стимулами была бы покрыта вся область расположения отростков регистрируемой клетки. Картирующая световая стимуляция показала, что генерация потенциалов действия в GtACR2-экспрессирующих нейронах происходит лишь в определенных местах среза (рис. 2Г). Наложение расположения этих мест на карту морфологии типичного пирамидного нейрона 2–3-го слоя показало, что световые стимулы способны вызвать потенциалы действия только в местах, соответствующих зонам интенсивного ветвления аксонных терминалей нейрона, располагающихся во 2–3 и 5-го слоях неокортекса. Известно, что в этих компартментах клетки наблюдается локальное повышение внутриклеточной концентрации ионов хлора, что приводит к сдвигу потенциала реверсии для хлора выше порога генерации потенциала действия. Таким образом, вызываемое светом открытие анионного канала GtACR2 в терминалях приводит не к входу отрицательно заряженных ионов хлора внутрь клетки, а наоборот, к их выходу из терминали, что вызывает локальную деполяризацию и локальную генерацию потенциала действия, который затем распространяется к телу нейрона.
Таким образом, из полученных нами данных можно сделать несколько важных выводов, касающихся применения анион-селективного светоактивируемого канала GtACR2 в оптогенетических экспериментах. Прежде всего, при использовании GtACR2 необходимо учитывать его способность генерировать потенциалы действия при световой стимуляции аксонных терминалей нейронов, в которых экспрессируется канал. С другой стороны, применяя разный паттерн стимуляции, можно использовать GtACR2 как для торможения, так и для активации клетки. В самом деле, длительная и непрерывная световая стимуляция нейрона будет вызывать его торможение, тогда как прерывистая стимуляция короткими световыми стимулами – возбуждение. Для решения проблемы периферической генерации потенциалов действия при световой стимуляции GtACR2-экспрессирующих нейронов было предложено использование химерных генетических конструкций, в которых ген GtACR2 соединен с фрагментом гена калиевого канала Kv2.1, который обеспечивает преимущественно центральную локализацию белкового продукта [10].
Одним из многообещающих применений оптогенетики является ее использование для исследования механизмов синаптической передачи и синаптической пластичности. При исследовании данных феноменов классическими методами на первичной диссоциированной культуре нейронов или на переживающих срезах мозга часто используют методику двойного пэтч-клампа, когда пара синаптически связанных нейронов регистрируется внутриклеточно при помощи пэтч-пипеток. Данный метод позволяет наиболее точно контролировать тип и активность пресинаптического нейрона, чего нельзя достигнуть, применяя методы экстраклеточной стимуляции аксонов пресинаптических нейронов – метод, наиболее часто применяемый в исследованиях механизмов синаптической пластичности. Однако существенным недостатком внутриклеточной регистрации с использованием метода пэтч-кламп является перфузия клетки, при которой происходит вымывание внутриклеточного содержимого клетки, включающего различные сигнальные молекулы, протеинкиназы, фосфатазы и т.д., все то, что необходимо для формирования пластических перестроек синапсов. При использовании оптогенетческих подходов проблему перфузии пресинаптической клетки во время синаптической стимуляции можно решить. Действительно, световая стимуляция пресинаптических нейронов, экспрессирующих светоактивируемый возбуждающий канал (например, канальный родопсин2) позволяет осуществлять практически неинвазивную стимуляцию клеток. Еще одно преимущество, которое предоставляет оптогенетика, это быстрый поиск пресинаптических нейронов. Действительно, произвести локальную оптическую стимуляцию нескольких нейронов, экспрессирующих канальный родопсин вокруг выбранного постсинаптического нейрона, можно буквально за несколько секунд, в то время как их перебор методом пэтч-клампа является гораздо более трудоемкой процедурой.
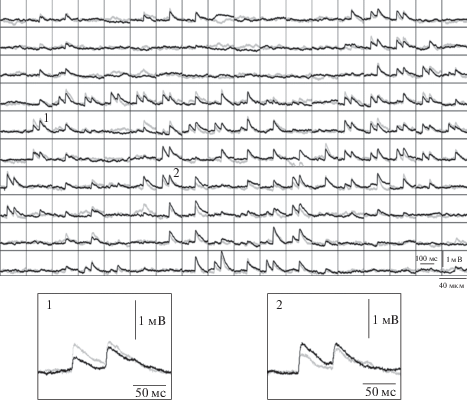
Имеющиеся в настоящее время в распоряжении исследователей специализированные оптические стимуляторы (такие, как Polygon 400), которые позволяют производить локальную оптическую стимуляцию с любым размером стимула и быстрым изменением позиции стимула, дают возможность с использованием оптогенетических подходов решить еще одну очень интересную задачу – изучить механизмы пластичности многих синаптических входов, конвергирующих на один постсинаптический нейрон. Эта задача была решена нами на модели гетеросинаптической пластичности, индуцированной несочетанной тетанизацией постсинаптического нейрона. Гетеросинаптическая пластичность – малоисследованный вид синаптической пластичности, в которой модификации подвергаются синапсы, которые не были активны непосредственно во время процесса индукции пластичности [11]. Основной методической проблемой при изучении механизмов гетеросинаптической пластичности традиционными методами является необходимость проведения большого количества экспериментов ввиду вероятностного характера развития пластических изменений синаптических входов на нейрон после его внутриклеточной тетанизации. Чтобы обойти эту проблему мы использовали оптическую стимуляцию множества пресинаптических нейронов, которую можно осуществить в рамках одного эксперимента. Для этого мы экспрессировали канальный родопсин2 в пирамидных нейронах 2–3 слоя неокортекса крыс методом in utero электропорации. Метод заключается в том, что в желудочек мозга эмбриона крысы на 17-й день внутриутробного развития в ходе проведения полостной операции на беременной самке, вводится плазмида, содержащая “ген интереса” под сильным неспецифическим промотором (чаще всего CAG). После этого на голову эмбриона прямо через стенки матки накладываются электроды и пропускается электрический ток, в результате чего плазмида входит в момент проведения операции в нейроны, которые выстилают стенки желудочка. На 17-й день в стенке желудочка находятся клетки-предшественники, которые затем мигрируют и становятся пирамидными нейронами 2–3 слоя. Если же провести электропорацию на более ранних сроках внутриутробного развития, то можно трансфицировать пирамидные нейроны 5-го слоя [12]. Одно из достоинств этого метода состоит в том, что он обеспечивает селективность экспрессии целевого гена исключительно в пирамидных нейронах даже без использования специфического промотора. Ни тормозные интернейроны, ни глия при таком методе трансфекции не заражаются, поскольку их предшественники располагаются в других отделах мозга эмбриона или закладываются в другие сроки. Известно, что пирамидные клетки 2–3 слоя образуют синаптические связи с низлежащими пирамидами 5-го слоя. На переживающих срезах мозга электропорированных in utero крыс мы регистрировали внутриклеточно пирамидный нейрон 5-го слоя методом пэтч-кламп. При этом мы проводили стимуляцию вышележащих пирамидных нейронов 2–3 слоя, экспрессирующих канальный родопсин2, при помощи картирующей стимуляции, похожей на ту, которая использовалась нами при изучении светоиндуцированной генерации потенциалов действия в GtACR2-экспрессирующих нейронах (см. выше). Каждый световой стимул представлял собой квадрат размером 40 × 40 мкм, вспыхивающий два раза с интервалом 50 мс, при этом длительность одного светового стимула составляла 1–2 мс. Было показано, что подобная стимуляция нейронов 2–3 слоя вызывает ВПСП при предъявлении оптических стимулов во многих квадратах стимуляционной матрицы (рис. 3). После проведения 10–15 сессий оптической стимуляции (то есть получения 10–15 ВПСП от каждого входа), тестирование синаптических входов прекращалось и проводилась внутриклеточная тетанизация постсинаптического нейрона. Подробный анализ изменений, происходящих одновременно во многих синаптических входах на одну клетку, показал, что практически в каждом эксперименте удается зарегистрировать входы, подвергшиеся как потенциации, так и депрессии. Оказалось, что применение подобной методики стимуляции позволяет получить в одном эксперименте достаточное количество данных для статистической оценки корреляции между индексом парного взаимодействия и амплитудой изменений ВПСП после внутриклеточной тетанизации [13]. Интересно, что ни в одном из экспериментов не было зафиксировано появления синаптических ответов после внутриклеточной тетанизации в квадратах стимуляции, в которых ответов не было до тетанизации. Таким образом, с большой долей вероятности можно утверждать, что при развитии долговременной потенциации после несочетанной тетанизации постсинаптического нейрона не происходит активации т. н. “молчащих” синапсов.
Рис. 3.
Синаптические ответы пирамидного нейрона 5-го слоя коры в ответ на парную оптическую стимуляцию каналородопсин2-экспрессирующих нейронов 2–3 слоя до и после внутриклеточной тетанизации постсинаптического нейрона. Показана стимуляционная матрица, в каждой ячейке которой приведен ответ постсинаптического нейрона, вызванный оптической стимуляцией данного квадрата матрицы световым стимулом, представляющим собой квадрат размером 40 × 40 мкм и вспыхивающий два раза на 1 мс с интервалом 50 мс. Серым цветом показаны ВПСП, усредненные за весь период регистрации до внутриклеточной тетанизации, черным цветом – усредненные ВПСП после тетанизации. Приведены результаты одного репрезентативного эксперимента. Внизу представлены увеличенные ответы на стимуляцию квадратов 1 и 2, продемонстрировавших депрессию (1) и потенциацию (2) после внутриклеточной тетанизации.
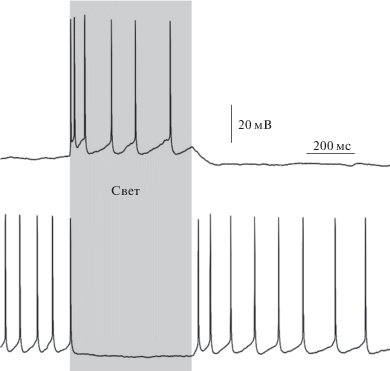
Одним из перспективных направлений клинического применения оптогенетики является использование ее для протезирования дегенеративной сетчатки [14]. Идея этого подхода заключается в наделении световой чувствительностью сохранившихся в ходе дегенеративного процесса нервных элементов сетчатки (например, ганглиозных клеток) путем гетерологической экспрессии в них светоактивируемых белков в условиях дегенерации фоторецепторов. Однако недостатком такого подхода является то, что в случае протезирования ганглиозных клеток теряется обработка зрительной информации, происходящая на всех вышележащих уровнях внутрисетчаточных сетей. Чтобы обойти, хотя бы частично, это ограничение был предложен подход, заключающийся в воссоздании ON–OFF рецептивного поля ганглиозной клетки сетчатки путем субклеточного таргетирования возбуждающего светоактивируемого белка в центральной (сома и проксимальные дендриты нейрона) и тормозного в периферической части клетки. Всего в мире существует две работы, в которых была продемонстрирована работоспособность этого подхода на препаратах изолированной сетчатки [15, 16]. Очевидно, что для создания полноценного ON–OFF рецепторного поля необходимо соблюсти четкий баланс между уровнями экспрессии возбуждающего и тормозного опсинов. Все предыдущие подходы к оптогенетическому воссозданию ON–OFF взаимодействий в рецептивном поле ганглиозных клеток, известные в мировой литературе, заключались в использовании двух экспрессионных векторов (двух плазмид или двух вирусов), один из которых нёс ген возбуждающего, а другой ген тормозного опсинов [15, 16]. При таких способах соотношение уровней экспрессии каждого гена будет сильно варьировать от клетки к клетке в зависимости от того, сколько копий ДНК первого и второго вектора попадет внутрь клетки в ходе трансфекции (трансдукции). Мы разработали подход, который заключается в том, чтобы поместить оба гена (возбуждающего и тормозного опсинов) внутрь одной конструкции, разделив их специальной вставкой, позволяющей контролировать уровень экспрессии второго гена относительно первого. В качестве такой вставки нами была использован участок внутренней посадки рибосомы (IRES) вируса энцефаломиокардита. В литературе известна библиотека из 24 мутантных IRES последовательностей, позволяющих ослабить экспрессию второго гена от 0.5 до 90% по сравнению с уровнем экспрессии первого гена в бицистронной конструкции [17]. В нашей работе мы опытным путем подобрали один из IRES мутантов, обеспечивающих требуемое соотношение уровней экспрессии возбуждающего и тормозного опсинов. Нами была создана бицистронная генетическая конструкция pCAG-CHR2-Venus-Kv2.1-IRES_10-GtACR2-FLAG, обеспечивающая соматическую локализацию возбуждающего опсина при помощи мотива калиевого канал Kv2.1, при этом экспрессия тормозного опсина никак пространственно не ограничивается [18]. При этом уровень экспрессии тормозного опсина значительно понижен таким образом, чтобы в центральной части возбуждающий опсин функционально “перевешивал” бы тормозный. В таком случае в результате суммарной реакции на свет было бы возбуждение в центральной (сома и проксимальные дендриты) части нейрона, а на периферии, где будет представлен исключительно анионный опсин, будет наблюдаться торможение. В качестве возбуждающего опсина нами был выбран канальный родопсин2, а в качестве тормозного – анионный канальный родопсин GtACR2, который, как мы показали ранее, является эффективным оптогенетическим инструментом для торможения активности нейронов [19]. В качестве модельной системы нами были использованы нейроны первичной культуры гиппокампа и пирамидные нейроны 2–3 слоя коры крыс, трансфицированные методом in utero электропорации. Мы показали, что экспрессия данной конструкции в нейронах приводит к воссозданию пространственного ON–OFF антагонизма: при освещении центральной части нейронов происходит генерация потенциалов действия, в то время как освещение периферии клетки вызывает торможение активности, вызванной внутриклеточной деполяризацией нейрона (рис. 4) [18]. Таким образом, в результате проведенной работы нами была создана и испытана бицистронная генетическая конструкция, несущая в себе гены катионного и анионного канальных родопсинов и обеспечивающая воссоздание ON-OFF взаимодействий рецептивного поля ганглиозной клетки сетчатки. Данная конструкция теоретически может быть использована для протезирования дегенеративной сетчатки (пигментного ретинита) в случае ее доставки к ганглиозным нейронам сетчатки при помощи вирусных векторов большой емкости, например, лентивирусов.
Рис. 4.
Световая стимуляция центральной части пирамидного нейрона, экспрессирующего бицистронную конструкцию pCAG-CHR2-Venus-Kv2.1-IRESv10-GtACR2-FLAG, вызывает активацию клетки (вверху), в то время как стимуляция периферии вызывает торможение (внизу). Время световой стимуляции показано серым прямоугольником.
Резюмируя, можно сказать, что оптогенетика – это сравнительно молодой, но бурно развивающийся методический подход в нейронауках, который находит свое всё более широкое применение в самых различных областях биологии и медицины: от исследования механизмов синаптической пластичности до клинического применения в целях оптогенетического протезирования дегенеративной сетчатки.
Список литературы
Boyden E.S., Zhang F., Bamberg E., Nagel G., Deisseroth K. Millisecond-timescale, genetically targeted optical control of neural activity. Nat. Neurosci. 8(9): 1263–1268. 2005.
Lin J.Y. A user’s guide to channelrhodopsin variants: Features, limitations and future developments. Exp. Physiol. 96(1): 19–25. 2011.
Nagel G., Szellas T., Huhn W., Kateriya S., Adeishvili N., Berthold P., Ollig D., Hegemann P., Bamberg E. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proc. Natl. Acad. Sci. U. S. A. 100(24): 13940–13945. 2003.
Bernstein J.G., Boyden E.S. Optogenetic tools for analyzing the neural circuits of behavior. Trends Cogn. Sci. 15(12): 592–600. 2011.
Berndt A., Lee S.Y., Ramakrishnan C., Deisseroth K. Structure-guided transformation of channelrhodopsin into a light-activated chloride channel. Science. 344: 420–424. 2014.
Wietek J., Wiegert J.S., Adeishvili N., Schneider F., Watanabe H., Tsunoda S.P., Vogt A, Elstner M., Oertner T.G., Hegemann P. Conversion of channelrhodopsin into a light-gated chloride channel. Science. 344: 409–412. 2014.
Govorunova E.G., Sineshchekov O.A., Janz R., Liu X., Spudich J.L. Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349: 647–650. 2015.
Dolgikh D.A., Malyshev A.Y., Roshchin M.V., Smirnova G.R., Nekrasova O.V., Petrovskaya L.E., Feldman T.B., Balaban P.M., Kirpichnikov M.P., Ostrovsky M.A. Comparative characteristics of two anion-channel rhodopsins and prospects of their use in optogenetics. Dokl. Biochem. Biophys. 471: 440–442. 2016.
Malyshev A.Y., Roshchin M.V., Smirnova G.R., Dolgikh D.A., Balaban P.M., Ostrovsky M.A. Chloride conducting light activated channel GtACR2 can produce both cessation of firing and generation of action potentials in cortical neurons in response to light. Neurosci. Lett. 640: 76–80. 2017.
Mahn M., Gibor L., Patil P., Cohen-Kashi Malina K., Oring S., Printz Y., Levy R., Lampl I., Yizhar O. High-efficiency optogenetic silencing with soma-targeted anion-conducting channelrhodopsins. Nat. Commun. 9: 4125. 2018.
Chistiakova M., Bannon N.M., Bazhenov M., Volgushev M. Heterosynaptic plasticity: Multiple mechanisms and multiple roles. Neuroscientist. 20: 483–98. 2014.
Langevin L.M., Mattar P., Scardigli R., Roussigné M., Logan C., Blader P., Schuurmans C. Validating in utero electroporation for the rapid analysis of gene regulatory elements in the murine telencephalon. Dev. Dyn. 236(5): 1273–1286. 2007.
Симонова Н.А., Баль Н.В., Балабан П.М., Волгушев М.А., Малышев А.Ю. Оптогенетический подход к изучению механизмов гетеросинаптической пластичности в нейронах неокортекса. Журн. высш. нервн. деят. 67: 75–85. 2017. [Simonova N.A., Bal N.V., Balaban P.M., Volgushev M.A.1, Malyshev A.Y. Optogenetic approach to study mechanisms of heterosynaptic plasticity in cortical neurons. Zh. Vyssh. Nerv. Deiat. Im. I. P. Pavlova. 67: 75–85. 2017. (In Russ.)].
Ostrovsky M.A., Kirpichnikov M.P. Prospects of Optogenetic Prosthesis of the Degenerative Retina of the Eye. Biochemistry (Mosc). 84(5): 479–490. 2019.
Greenberg K.P., Pham A., Werblin F.S. Differential targeting of optical neuromodulators to ganglion cell soma and dendrites allows dynamic control of center-surround antagonism. Neuron. 69: 713–720. 2011.
Wu C., Ivanova E., Zhang Y., Pan Z.H. rAAV-mediated subcellular targeting of optogenetic tools in retinal ganglion cells in vivo. PLoS One. 8: e66332. 2013.
Koh E.Y., Ho S.C., Mariati, Song Z., Bi X., Bardor M., Yang Y. An internal ribosome entry site (IRES) mutant library for tuning expression level of multiple genes in mammalian cells. PLoS One. 8: e82100. 2013.
Петровская Л.Е., Рощин М.В., Смирнова Г.Р., Колотова Д.Е., Балабан П.М., Островский М.А., Малышев А.Ю. Бицистронная генетическая конструкция для оптогенетического протезирования рецептивного поля ганглиозной клетки дегенеративной сетчатки. Докл. А. Н. 486: 258–261. 2019 [Petrovskaya L.E., Roshchin M.V., Smirnova G.R., Kolotova D.E. Balaban P.M., Ostrovsky M.A., Malyshev A.Y. Bicycronic construct for optogenetic prosthesis of ganglion cell receptive field of degenerated retina. Dokl. Acad. Nauk. 486: 258–261. 2019 (In Russ.)].
Dolgikh D.A., Malyshev A.Y., Salozhin S.V., Nekrasova O.V., Petrovskaya L.E., Roshchin M.V., Borodinova A.A., Feldman T.B., Balaban P.M., Kirpichnikov M.P., Ostrovsky M.A. Anion-selective channelrhodopsin expressed in neuronal cell culture and in vivo in murine brain: Light-induced inhibition of generation of action potentials. Dokl Biochem Biophys. 465: 424–427. 2015.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


