Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 2, стр. 258-266
Влияние степени гипоксии, пола животного и 17β-эстрадиола на проявления гипоксической формы легочной гипертензии
Н. В. Панькова 1, *, М. М. Артемьева 1, А. С. Попова 2, А. А. Андреев-Андреевский 1, 2, Н. А. Медведева 1
1 Биологический факультет МГУ им. М.В. Ломоносова
Москва, Россия
2 Институт медико-биологических проблем РАН
Москва, Россия
* E-mail: nadezhda.pankova.nnov@gmail.com
Поступила в редакцию 04.12.2018
После доработки 08.02.2019
Принята к публикации 08.02.2019
Аннотация
В работе изучали действие хронического введения женского полового гормона –17β эстрадиола (Е2) в дозе 15 мкг/кг/сут на развитие легочной гипертензии (ЛГ), вызываемой действием прерывистой гипоксии с содержанием О2 13, 10 и 8% в течение 2-х недель. Исследование проводили на гонадоэктомированных крысах популяции Вистар обоего пола. Степень развития ЛГ оценивали по величине систолического давления в правом желудочке сердца (СПЖД) и его гипертрофии. Показано, что у всех животных, подвергавшихся гипоксии, развивалась ЛГ, степень которой зависела от содержания О2 во вдыхаемом воздухе. При гипоксии 10% О2, у самцов СПЖД было на 19% меньше, чем у самок (p < 0.05). Хроническое введение Е2 вызывало гендер-зависимые изменения ЛГ только при 10% О2. Так, у самцов введение Е2 увеличивало СПЖД на 31% (р < 0.05), а у самок – уменьшало гипертрофию на 10%. Кроме того, Е2 увеличивал выживаемость самок при 8% О2 в 2.5 раза, но не самцов. Увеличение гематокрита при гипоксии 10% О2 у самок происходило за счет увеличения количества эритроцитов, а у самцов – за счет возрастания их объема. Таким образом, степень развития гипоксической формы легочной гипертонии зависит от содержания О2 во вдыхаемом воздухе и имеет гендерные различия. E2 влияет на развитие этого заболевания.
Хроническое уменьшение кислорода во вдыхаемом воздухе менее 15% вызывает сужение сосудов малого круга кровообращения, утолщение их стенки и гипертрофию правого желудочка сердца, что приводит к повышению артериального давления в легких или к легочной гипертензии (ЛГ). Данной патологией чаще страдают женщины (от 1.4 до 4х раз) [1], однако продолжительность жизни с ЛГ у женщин выше, чем у мужчин.
Гендерные различия объясняют влиянием половых гормонов [2]. Известно, что 17β-эстрадиол оказывает протективное действие на сердечно-сосудистую систему (ССС), расширяя кровеносные сосуды путем увеличения синтеза оксида азота и других сосудорасширительных факторов в эндотелии сосудистой стенки [3]. Считается, что за счет данного механизма женская заболеваемость сердечно-сосудистыми заболеваниями (ССЗ) в репродуктивном возрасте меньше, чем у мужчин. Однако ЛГ является исключением из этого правила. В литературе много противоречивых данных о влиянии 17β-эстрадиола – женского полового гормона на процесс развития ЛГ. В частности, это связано с тем, что 17β-эстрадиол может оказывать как про- так и противовоспалительное действие [4], а гормонзаместительная терапия не всегда приводит к ожидаемому положительному эффекту [2]. Показано, что гормон-заместительная терапия, как и оральные контрацептивы, могут усугубить протекание ЛГ [5, 6], а у мужчин с ЛГ показан значительно более высокий уровень циркулирующего эстрадиола (Е2) и отношения E2/тестостерон [7].
К развитию легочной гипертензии приводит кислородная недостаточность различного генеза, которую у животных модулируют помещением животных в камеру с разным содержанием кислорода (от 2 до 16%) [8]. В реакции на гипоксию существует как межвидовая, так и индивидуальная изменчивость [9]. Так, у 25% людей гипоксическая вазоконстрикция не развивается, а у 1–2%, напротив, она выражена очень сильно [10]. Раннее было показано, что в норме величина систолического давления в правом желудочке сердца (СПЖД) у самцов выше, чем у самок. Хроническая гипоксия, вызывающая развитие ЛГ, у самок сопровождается увеличением СПЖД в большей степени по сравнению с самцами, то есть легочная гипертензия у них более выражена. [11].
Учитывая все вышеизложенное, целью нашего исследования явилось сравнительное изучение влияния разной степени гипоксии и экзогенного 17β-эстрадиола на развитие легочной гипертензии у гонадэктомированных самцов и самок крыс популяции Вистар.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проводили на половозрелых крысах популяции Вистар массой 190–220 г. (Москва, виварий НИИ общей патологии и патофизиологии). Животных содержали в условиях 12-ти часового светового дня со свободным доступом к воде и пище. В гипоксической части эксперимента свободный доступ к еде и воде у животных был только в ночное время суток (12 ч). Работу с животными проводили согласно требованиям Европейской конвенции по защите позвоночных животных, используемых для экспериментов или в других научных целях 1986 г. Исследование начинали через 3 недели после транспортировки, в течение которых животных приучали к рукам.
Для минимизации влияния на эксперимент эндогенных половых гормонов, животных обоих полов в возрасте 2х месяцев повергали билатеральной гонадоэктомии. Через 2 недели после операции начинали ежедневное подкожное введение веществ. Однако группа животных получала 17β-эстрадиол (Е2) в дозе 15 мкг/кг (Sigma, Китай), другая группа – растворитель эстрадиола – 1,2-пропиленгликоль (ПГ) (Sigma, Китай). Подбор дозы 17β-эстрадиола описан в предыдущих экспериментах [11]. Спустя 2 недели от начала введения веществ всех животных вне зависимости от пола и вводимого вещества делили на 4 группы. Первую группу животных на протяжении 14 последующих дней содержали в условиях вивария (содержание кислорода при давлении 1 атм 21%). Остальных самок (Ск) и самцов (Сц) крыс в течение 2х недель ежедневно по 10 ч в сутки подвергали действию хронической прерывистой гипобарической гипоксии при содержании кислорода во вдыхаемом воздухе равном 13% (0.65 атм), 10% (0.55 атм) или 8% (0.47 атм). Таким образом, всего было сформировано 16 экспериментальных групп животных (по 4–9 особей в каждой).
На 14-е сутки от начала гипоксического воздействия у животных из хвостовой вены брали кровь для гематологического исследования (анализатор Гемалайт 1280, Диксион, Россия). На следующий день под уретановым наркозом (1.2 г/кг, 0.6 г/мл) животным через яремную вену вводили катетер (РЕ-50) в правый желудочек сердца для прямого измерения систолического давление в правом желудочке сердца (СПЖД). По величине СПЖД судили о степени развития ЛГ. Через катетер (РЕ-10), введенный в брюшную аорту, проводили измерение АД и ЧСС с использованием датчиков STATHAM (США) и регистрацией на компьютере (модифицированная программа DAQ_2013). Далее наркотизированных животных декапитировали, вырезали сердце и определяли массу целого органа и его отделов. Массу правого желудочка (ПЖ) выражали в процентах к массе всего сердца. Увеличение относительной массы правого желудочка использовали как второй показатель развития ЛГ.
Статистический анализ данных проводили с использованием трехфакторного анализа ANOVA и критерию Краскала–Уоллиса для независимых переменных из пакета программы Statistica 8.0 (Statistica Inc США). Различия считали значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
1. Влияние гипоксии (13, 10, 8% О2) на величину систолического давления в правом желудочка сердца всех экспериментальных групп
Величина СПЖД в норме у людей не превышает 25 мм рт. ст, а увеличение этого показателя свидетельствует о развитии легочной гипертензии. У бодрствующих животных эта величина колеблется в пределах 21–38 мм рт. ст. [12]. В нашем исследовании СПЖД (рис. 1) в норме (21% О2) составляло около 40 мм рт. ст., что, вероятно, связано с использованием в качестве наркоза уретана, который повышает венозный возврат и артериальное давление. У нормоксических животных (О2 = 21%) различий между самцами и самками и между группами ПГ и Е2 не наблюдалось.
Рис. 1.
Систолическое давление в правом желудочке сердца у гонадоэктомированных самцов и самок крыс, подвергавшихся гипоксии разной степени и хроническому введению эстрадиола. ПГ – животные, получающие 1,2-пропиленгликоль; Е2 – животные, получающие 17β-эстрадиол. По горизонтали – группы животных. По вертикали – систолическое давление в правом желудочке сердца в мм рт. ст. * – Достоверное увеличение СПЖД (p < 0.05, здесь и далее ANOVA, непараметрический критерий Краскела–Уоллиса) по сравнению с соответствующей негипоксической группой; γ – достоверное (p < 0.05) уменьшение СПЖД у группы самцов по сравнению с соответствующей группой самок; € – достоверное (p < 0.05) увеличение СПЖД группы с введением 17β-эстрадиола по сравнению с группой без введения 17β-эстрадиола; # – достоверное (p < 0.05) увеличение СПЖД по сравнению с соответствующей группой с 13% О2. В кружках показано количество животных в группе.
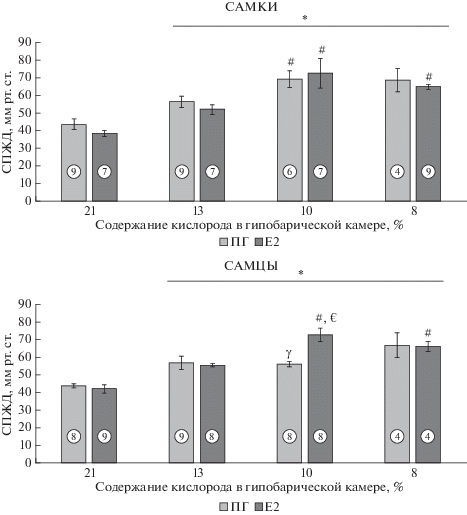
Как показано на рис. 1, хроническая прерывистая гипоксия любой степени (13, 10 и 8%) приводит к достоверному (p < 0.05) увеличению СПЖД, что свидетельствует о развитии легочной гипертензии как у самок, так и у самцов крыс. Гипоксия 13% О2 вызывает увеличение СПЖД в среднем на 31%. Хроническое введение 17β-эстрадиола не влияет на эти показатели и гендерных различий в этом случае не наблюдается. СПЖД статистически значимо увеличивается на 23-38% при уменьшении содержания кислорода во вдыхаемом воздухе до 10% О2 у самок, при этом влияния 17β-эстрадиола на этот показатель не было выявлено. При уменьшении концентрации кислорода с 13 до 10% О2 у самцов наблюдается увеличение СПЖД на 31% только в группе с хроническим введением 17β-эстрадиола.
Уменьшение содержания кислорода с 10 до 8% достоверно не изменяет СПЖД ни у самок, ни у самцов. Возможно, что это связано с большой гибелью животных (см. раздел 3 настоящей статьи) при такой степени гипоксии.
2. Влияние гипоксии (13, 10, 8% О2) на гипертрофию правого желудочка сердца животных всех экспериментальных групп
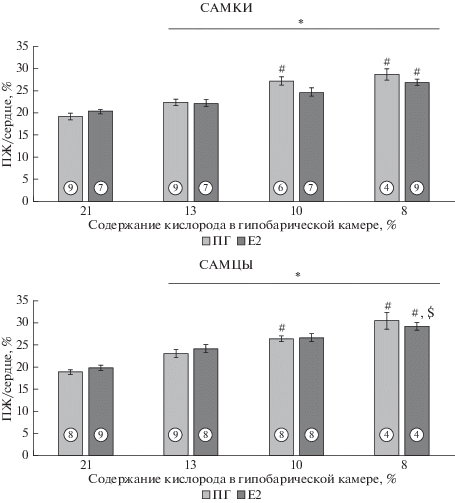
Вторым симптомом развития ЛГ является увеличение массы (гипертрофия) правого желудочка сердца. Как и в случае СПЖД, гипертрофию ПЖ (отношения ПЖ/сердце) наблюдали у всех гипоксических групп (рис. 2). При возрастании степени гипоксии с 13 до 10% достоверное увеличение данного показателя выявили у самцов и самок ПГ (на 21.5 и 14.8% соответственно), но не у животных, получавших E2, что свидетельствует о защитном действии 17β-эстрадиола в отношении гипертрофии правого желудочка. При дальнейшем уменьшении парциального давления кислорода во вдыхаемом воздухе (8% О2) протективное действие 17β-эстрадиола нивелировалось.
Рис. 2.
Относительная масса правого желудочка сердца у гонадоэктомированных самцов и самок крыс, подвергавшихся гипоксии разной степени. ПГ – животные, получающие 1,2-пропиленгликоль; Е2 – животные, получающие 17β-эстрадиол. По горизонтали – группы животных. По вертикали – масса правого желудочка сердца, нормированная на массу сердца (%); * – достоверное различие (p < 0.05, здесь и далее ANOVA, непараметрический критерий Краскела–Уоллиса) по сравнению с соответствующей негипоксической группой; # – достоверное (p < 0.05) различие по сравнению с соответствующей группой с 13% О2; $ – достоверное (p < 0.05) различие по сравнению с соответствующей группой с 10% О2. В кружках показано количество животных в группе.
3. Влияние разной степени гипоксии и хронического введения 17β-эстрадиола на выживаемость животных в гипоксический период эксперимента
При хроническом воздействии гипобарической гипоксии наблюдается гибель животных, частота которой зависит от тяжести гипоксического воздействия. При содержании кислорода в гипобарической камере равном 13 или 10% погибает до 10% животных. Однако при уменьшении доступного кислорода до 8% смертность животных резко возрастает. В табл. 1 показано количество животных до и в конце эксперимента с гипоксией 8% О2. Видно, что хроническое введение 17β-эстрадиола овариэктомированным самкам увеличивает их выживаемость в 2 раза, по-видимому, увеличивая их способность адаптироваться к гипоксии. На самцах подобного эффекта не наблюдалось. Таким образом, хроническое применение 17β-эстрадиола улучшает адаптивные свойства организма самок крыс с тяжелой степенью гипоксического воздействия.
Таблица 1.
Количество выживших животных при действии прерывистой двухнедельной гипоксии 8% О2
| Группа | Количество животных в группах до гипоксии | Количество животных после 2-х недель гипоксии |
|---|---|---|
| Самки ПГ | 13 | 4 |
| Самки Е2 | 13 | 10*, # |
| Самцы ПГ | 13 | 5 |
| Самцы Е2 | 14 | 4 |
Таким образом, протективное действие Е2 при высокой степени гипоксии в экспериментах in vivo (8% О2) проявляется только у самок крыс в виде увеличения их выживаемости.
4. Влияние разной степени гипоксии и хронического введения 17β-эстрадиола на гематологические показатели в зависимости от пола животного
Одной из адаптивных реакций организма на гипоксию является увеличение гематокрита, что может повлиять на степень развития заболевания. В табл. 2 приведены гематологические показатели крови крыс на 14-й день прерывистой гипоксии.
Таблица 2.
Гематологические показатели гонадоэктомированных крыс, подвергавшихся гипоксии разной степени (M ± SEM)
| Кислород | 21% | 13% | 10% | 8% | |||||
|---|---|---|---|---|---|---|---|---|---|
| параметр | группа | самки | самцы | самки | самцы | самки | самцы | самки | самцы |
| HCT, % | ПГ | 36.5 ± 1.7 | 39.5 ± 2.1 | 42.1 ± 2.4 | 40.1 ± 2.2 | 56.7 ± 2.8*, # | 49.6 ± 1.7*, # | 65.6 ± 0.5*, #, $ | 63.3 ± 2.7*, #, $ |
| Е2 | 36.5 ± 2.8 | 42.2 ± 2.1 | 40.1 ± 2.3 | 41.5 ± 2.3 | 51.6 ± 1.9*, # | 48.7 ± 1.8*, # | 61.7 ± 1.1*, #, $, € | 63.4 ± 1.7*, #, $ | |
| RBC, ×1012/л | ПГ | 5.7 ± 0.2 | 7.6 ± 0.3γ | 7.1 ± 0.4* | 7.9 ± 0.5 | 9.4 ± 0.5*, # | 7.9 ± 0.1 | 9.4 ± 0.3*, # | 10.1 ± 0.3*, #, $ |
| Е2 | 5.8 ± 0.3 | 7.7 ± 0.2γ | 6.9 ± 0.4 | 7.7 ± 0.3 | 8.4 ± 0.3*, # | 7.8 ± 0.2 | 9.1 ± 0.1*, #, $ | 9.7 ± 0.3*, #, $ | |
| MCV, фл | ПГ | 64.1 ± 3.4 | 51.8 ± 1.2γ | 58.9 ± 1.7 | 50.8 ± 0.9γ | 60.2 ± 0.5 | 62.8 ± 1.4*, # | 69.7 ± 1.7#, $, γ | 62.6 ± 1.1*, # |
| Е2 | 63.2 ± 3.0 | 54.6 ± 1.6γ | 58.2 ± 2.5 | 53.9 ± 1.4 | 61.7 ± 0.6 | 62.8 ± 0.8*, # | 68.1 ± 1.0#, $ | 65.6 ± 1.3*, # | |
ПГ – животные, получающие 1,2 -пропиленгликоль; Е2 – животные, получающие 17β-эстрадиол. HCT – гематокрит, RBC – количество эритроцитов, MCV – средний объем эритроцита. * – достоверное различие (p < 0.05, здесь и далее ANOVA, непараметрический критерий Краскела–Уоллиса) по сравнению с соответствующей негипоксической группой; # – достоверное (p < 0.05) различие по сравнению с соответствующей группой с 13% О2; $ – достоверное (p < 0.05) по сравнению с соответствующей группой с 10% О2; γ – достоверное (p < 0.05) различие у группы самцов по сравнению с соответствующей группой самок; € – достоверное (p < 0.05) различие группы с введением 17β-эстрадиола по сравнению с группой без введения 17β-эстрадиола.
Как видно из табл. 2, в нормоксических условиях гематокрит у животных не различается. Уменьшение содержания кислорода во вдыхаемом воздухе до 13% не приводит к увеличению гематокрита ни у самок, ни у самцов животных. Однако, дальнейшее увеличение степени гипоксии сопровождается увеличением гематокрита у всех групп животных. Таким образом, уменьшения кислорода во вдыхаемом воздухе до менее 13% запускает механизмы, увеличивающие кислородную емкость крови. Эффект не зависит от пола животных и присутствия женского полового гормона.
Гематокрит определяется количеством эритроцитов (RBC) и их объемом (MCV). У нормоксических гонадоэктомированных самцов крыс количество эритроцитов достоверно (p < 0.05) на 32% выше, чем у самок, а их объем на 20% меньше. У самок группы с гипоксией в 13% О2 происходит рост количества эритроцитов до уровня самцов. Усиление гипоксии с 13 до 10% О2 сопровождается ростом количества эритроцитов у самок, а у самцов наблюдается увеличение их объема. Дальнейшее увеличение степени гипоксии до 8% приводит к увеличению количества эритроцитов у самцов крыс, а у самок их объема.
Таким образом, существуют гендерные различия в механизмах адаптивного увеличения гематокрита при развитии гипоксической формы легочной гипертензии. Хроническое введение 17β-эстрадиола гонадоэктомированным животным не влияет на способ поддержания кислородной емкости крови. Увеличение гематокрита в условиях 10%-ного содержания кислорода во вдыхаемом воздухе у самок достигается путем увеличения количества эритроцитов, а у самцов их объема. Вероятно, это связано с тем, что в нормоксических условиях количество эритроцитов у самцов крыс больше, а их объем больше у самок. В условиях более жесткой гипоксии для достижения необходимого уровня гематокрита и у самок, и у самцов происходит увеличение объема и количества эритроцитов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Гипоксия с содержанием кислорода 13, 10, 8% О2 вызывает развитие ЛГ как у самок, так и самцов гонадоэктомированных крыс, о чем свидетельствует увеличение СПЖД и гипертрофия правого желудочка сердца всех экспериментальных животных. При 10% О2 увеличение СПЖД у самцов достоверно меньше, чем у самок при этой же степени гипоксии. Хроническое введение 17β-эстрадиола не приводило к уменьшению СПЖД, как это было показано на другой гипоксической модели ЛГ, где использовался блокатор рецептора VEGF-Sugen/SU5416-SuHx, модели, которая характеризуется ремоделированием легочных сосудов, их окклюзией, правожелудочковой недостаточностью и смертельным исходом [13, 14]. По-видимому, это связано с разной степенью развития ЛГ и высокой, не физиологической, дозой вводимого 17β-эстрадиола (75 мкг/кг) в этих экспериментах. Увеличение СПЖД у самцов с хроническим введением 17β-эстрадиола при гипоксии 10% О2, полученное в данной работе, можно связать с изменением соотношения женских и мужских половых гормонов в организме животных [7]. Интересно отметить, что при прерывистой гипоксии существует предел увеличения СПЖД (65–70 мм рт. ст.) как у самок, так и у самцов крыс, который проявляется при гипоксии 10% О2. Дальнейшее уменьшение кислорода не отражается на величине СПЖД.
Хроническое введение 17β-эстрадиола, не влияя на величину СПЖД, предупреждает увеличение гипертрофии правого желудочка сердца у самок при гипоксии 10% О2 по сравнению с группой животных с 13% О2. Таким образом, по второму показателю развития ЛГ, 17β-эстрадиол оказывал протекторное действие на развитие ЛГ, но только у самок крыс. Дальнейшее увеличение степени гипоксии нивелировало этот эффект. Эффект уменьшения гипертрофии ПЖ в ответ на 17β-эстрадиол за счет стимулирования сократительной активности ПЖ ранее был показан на самках мышей с SuHx моделью ЛГ [15]. Известно, что 17β-эстрадиол способен ограничивать и структурное ремоделирование правого желудочка сердца и легочных сосудов [16]. Существует ряд данных о том, что подобный эффект может оказывать как сам гормон, так и его метаболиты, например, 2-метоксиэстрадиол [17].
Интересным фактом, показанным впервые в нашей работе, было увеличение выживаемости овариоэктомированных самок крыс, подвергшихся гипоксии с 8% О2 на фоне хронического введения17β-эстрадиола. Влияния на смертность самцов выявлено не было. Это соотносится с данными о том, что патологические изменения в легочных сосудах, индуцированные гипоксическим воздействием, меньше у самок крыс с сохраненными яичниками, чем у овариоэктомированных животных. У последних ремоделирование легочных сосудов соответствовало уровню самцов. Так же было показано, что легочные артерии у самок крыс с высоким уровнем 17β-эстрадиола в крови демонстрируют меньшую суживающую реакцию в ответ на гипоксию [18]. Вероятно, именно эти особенности регуляции сосудистого тонуса легочных сосудов позволили самкам, получавшим 17β-эстрадиол и подвергавшихся гипоксии 8% О2, выжить в первый день гипоксии, тогда как овариоэктомированные самки и самцы гибли вдвое чаще.
Хорошо известно, что развитие гипоксической формы легочной гипертензии сопровождается увеличением гематокрита как одного из факторов, адаптирующего организм к уменьшению кислорода во вдыхаемом воздухе. Однако вопрос о гендерных различиях в развитии этого процесса мало изучен. Мы показали, что у самок сначала увеличивается количество эритроцитов, и лишь высокая степень гипоксии приводит к увеличению их объема, а у самцов наоборот. Гендерные стратегии адаптивного увеличения гематокрита не зависят от хронического введения эстрадиола гонадоэктомированным животным. Полученные данные свидетельствуют о том, что механизм изменения кислородной емкости крови при разной степени гипоксии имеет гендер-зависимый характер, но, по-видимому, не связан с действием экзогенного 17β-эстрадиола на основные показатели развития гипоксической формы легочной гипертензии. Таким образом, в данной работе впервые показано, что имеется гендерная зависимость в проявлении ЛГ в зависимости от степени гипоксии и содержания женского полового гормона, что необходимо учитывать как в исследованиях на людях, так и в экспериментах на животных.
Список литературы
Lahm T., Tuder R.M., Petrache I. Progress in solving the sex hormone paradox in pulmonary hypertension. Am. J. Physiol. Lung Cell Mol. Physiol. 307(1): 7–26. 2014.
Assaggaf H., Felty Q. Gender, estrogen, and obliterative lesions in the lung. Int. J. Endocrinol. 2017: 1–13. 2017.
Sherman T.S., Chambliss K.L., Gibson L.L., Pace M.C., Mendelsohn M.E., Pfister S.L., Shaul P.W. Estrogen acutely activates prostacyclin synthesis in ovine fetal pulmonary artery endothelium. Am. J. Respir. Cell Mol. Biol. 26: 610–616. 2002.
Roy D., Morgan M., Yoo C., Deoraj A., Roy S., Yadav V. K., Garoub M., Assaggaf H., Doke M. Integrated bioinformatics, environmental epidemiologic and genomic approaches to identify environmental and molecular links between endometriosis and breast cancer. Int. J. Mol. Sci. 16(10): 25285–25322. 2015.
Morse J.H., Horn E.M., Barst R.J. Hormone replacement therapy: a possible risk factor in carriers of familial primary pulmonary hypertension. Chest. 116(3): 847. 1999.
Sweeney L., Voelkel N.F. Estrogen exposure, obesity and thyroid disease in women with severe pulmonary hypertension. Eur. J. Med. Res. 14(10): 433–442. 2009.
Ventetuolo C.E., Baird G.L., Barr R.G., Bluemke D.A., Fritz J.S., Hill N.S., Klinger J.R., Lima J.A., Ouyang P., Palevsky H.I., Palmisciano A.J., Krishnan I., Pinder D., Preston I.R., Roberts K.E., Kawut S.M. Higher estradiol and lower dehydroepiandrosterone-sulfate levels are associated with pulmonary arterial hypertension in men. Am. J. Respir. Crit. Care Med. 193(10): 1168–1175. 2016.
Navarrete-Opazo A., Mitchell G.S. Therapeutic potential of intermittent hypoxia: a matter of dose. Am. J. Physiol. Regul. Integr. Comp. Physiol. 307(10): 1181–1197. 2014.
Naeije R., Dedobbeleer C. Pulmonary hypertension and the right ventricle in hypoxia. Exp. Physiol. 98(8): 1247–12456. 2013.
Bartsch P., Gibbs S. Effect of altitude on the heart and the lungs. Circulation. 116: 2191–2202. 2007.
Панькова Н.В., Артемьева М.М., Медведева Н.А. Влияние эстрадиола 17-бета на степень проявления гипоксической формы легочной гипертонии у самцов и самок крыс Вистар. Эксп. клин. фармакол. 80(1): 9–13. 2017. [Pankova N.V., Medvedeva N.A., Artemieva M.M. Influence of the female sex hormone 17-beta-estradiol on the degree of hypoxic pulmonary hypertension in male and female Wistar rats. Eksp. Klin. Farmakol. 80(1): 9–13. 2017. (In Russ.)].
Ou L.C., Sardella G.L., Leiter J.C., Brinck-Johnsen T., Smith R. P. Role of sex hormones in development of chronic mountain sickness in rats. J. Appl. Physiol. 77(1): 427–433. 1994.
Медведева Н.А., Панькова Н.В., Артемьева М.М. Гендерные различия в проявлении легочной гипертонии. Влияние женского полового гормона эстрадиола. Артериальная гипертензия. 23(5): 421–433. 2017. [Medvedeva N.A., Pankova N.V., Artemieva M.M. Gender differences in the development of pulmonary hypertension: Effects of sex hormone estradiol. A-rterial Hypertension. 23(5): 421–433. 2017. (In Russ.)].
Frump A.L., Goss K.N., Vayl A., Albrecht M., Fisher A., Tursunova R., Fierst J., Whitson J., Cucci A.R., Brown M.B., Lahm T. Estradiol improves right ventricular function in rats with severe angioproliferative pulmonary hypertension: effects of endogenous and exogenous sex hormones. Am. J. Physiol. Lung Cell Mol. Physiol. 308(9): 873–890. 2015.
Nadadur R.D., Umar S., Wong G., Eghbali M., Iorga A., Matori H. Reverse right ventricular structural and extracellular matrix remodeling by estrogen in severe pulmonary hypertension. J. Appl. Physiol. 113: 149–158. 2012.
Liu A., Schreier D., Tian L., Eickhoff J.C., Wang Z., Hacker T.A., Chesler N.C. Direct and indirect protection of right ventricular function by estrogen in an experimental model of pulmonary arterial hypertension. Am. J. Physiol. Heart Circ. Physiol. 307(3): 273–283. 2014.
Tofovic S.P., Zhang X., Jackson E.K., Dacic S., Petrusevska G. 2-Methoxyestradiol mediates the protective effects of estradiol in monocrotaline-induced pulmonary hypertension. Vascul. Pharmacol. 45(6): 358–367. 2006.
Dunquan Xu, Wen Niu, Ying Luo, Bo Zhang, Manling Liu, Haiying Dong, Yi Liu, Zhichao Li. Endogenous estrogen attenuates hypoxia-induced pulmonary hypertension by inhibiting pulmonary arterial vasoconstriction and pulmonary arterial smooth muscle cells proliferation. Int. J. Med. Sci. 10(6): 771–781. 2013.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


