Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 3, стр. 327-338
Роль редокс-статуса и окислительной модификации белков в реализации апоптоза лимфоцитов крови человека в норме и при экспериментальном окислительном стрессе
О. Л. Носарева 1, *, Е. А. Степовая 1, Е. В. Шахристова 1, О. Н. Алексеева 1, Д. И. Кузьменко 1, А. А. Садыкова 1, В. В. Новицкий 1
1 Сибирский государственный медицинский университет
Томск, Россия
* E-mail: olnosareva@yandex.ru
Поступила в редакцию 12.09.2018
После доработки 29.12.2018
Принята к публикации 29.12.2018
Аннотация
В статье представлены данные, характеризующие уровень активных форм кислорода, необратимой и обратимой окислительной модификации белков, состояние компонентов системы глутатиона и активность каталазы, реализацию апоптоза в интактных лимфоцитах крови. Методом моделирования окислительного стресса in vitro исследовано влияние пероксида водорода в конечной концентрации 0.5 мМ на реализацию апоптоза; проведена оценка вклада компонентов системы глутатиона, необратимой и обратимой окислительной модификации белков в молекулярные механизмы клеточной гибели лимфоцитов крови. Показано, что апоптотический тип гибели лимфоцитов крови при экспериментальном окислительном стрессе характеризовался активированием глутатионилирования и карбонилирования протеинов. Представленные данные доказывают, что молекулы белков являются потенциальными редокс-зависимыми мишенями для регуляции клеточного метаболизма лимфоцитов крови.
В норме метаболизм клеток во многом зависит от редокс-баланса, который в свою очередь определяется соотношением и активностью компонентов про- и антиоксидантной систем.
Неотъемлемой частью патогенеза многих заболеваний, таких как нейродегенеративные, онкологические, воспалительные, аутоиммунные, сердечно-сосудистые и др., являются процессы свободно-радикального окисления. Они лежат в основе внутриклеточного метаболизма и оказывают влияние на функцию клеток организма, в том числе лимфоцитов крови [1, 2]. Лимфоциты, являясь компонентами иммунной системы, участвуют в регуляции обмена веществ целостного организма. От метаболического состояния этих клеток зависит специфическая иммунореактивность, естественная резистентность и координированное взаимодействие клеточных элементов сложноорганизованной иерархической системы организма. Лимфоциты крови находятся в постоянном контакте с другими клетками и тканями, занимают ведущую позицию в защите организма от различных агрессивных факторов и одними из первых взаимодействуют с чужеродными агентами, в результате чего может происходить активация свободно-радикальных процессов. Однако продукция активных форм кислорода стимулируется не только в ответ на внешнее воздействие, но и является частью механизма внутриклеточной сигнализации [3, 4]. Необходимо учитывать, что активные кислородные метаболиты с одной стороны обладают высокой цитотоксичностью, с другой – могут выступать регуляторами активности биомолекул в клетках [5–7]. Наиболее чувствительными к усилению процессов свободно-радикального окисления и основными акцепторами активных форм кислорода являются белки [8]. В результате взаимодействия активных форм кислорода с протеинами возникает как обратимая, так и необратимая окислительная модификация этих молекул [9–11]. Конформационные изменения белков являются основополагающими в функционировании рецепторов, мембранных транспортных систем, изменении скорости биохимических реакций, регуляции фаз клеточного цикла, транскрипции, репликации, гибели клеток и других процессах.
В поддержании уровня активных форм кислорода в клетке и снижении их деструктивного действия на макромолекулы участвует антиоксидантная система, состоящая из неферментативного и ферментативного звена [5, 12]. Поэтому актуальным является установление роли компонентов антиоксидантной системы и редокс-чувствительных белков в регуляции пролиферации и апоптоза при развитии свободно-радикальных патологических процессов с участием иммунокомпетентных клеток.
Цель работы – установить роль окислительной модификации белков и изменения редокс-статуса в реализации апоптоза лимфоцитов крови человека в норме и при экспериментальном окислительном стрессе.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования явились лимфоциты, выделенные из фракции мононуклеарных лейкоцитов у здоровых лиц (21 мужчины и 19 женщин в возрасте от 20 до 45 лет, протокол заседания этического комитета ФГБОУ ВО СибГМУ Минздрава России № 4267 от 21.09.2015 г.) – интактные клетки, которые получали из венозной крови при катетеризации локтевой вены утром натощак с использованием вакутейнеров “Becton Dickinson Vacutainer™” (США), содержащих антикоагулянт – гепарин натрия (25 Ед/мл).
Выделение мононуклеарных лейкоцитов из венозной крови проводили в стерильных условиях методом градиентного центрифугирования с помощью Ficoll-Paque (“Sigma-Aldrich”, США) (ρ = 1.077 г/см3) [13], а затем лимфоцитов – на градиенте Перколла (“Sigma-Aldrich”, США) (ρ = 1.130 г/см3) [14]. Жизнеспособность лимфоцитов крови оценивали микроскопически с помощью 0.4%-ного раствора трипанового синего (“Serva”, США). Для постановки эксперимента была использована культура клеток, содержащая более 95% живых клеток.
Для моделирования окислительного стресса, выделенные лимфоциты крови (клеточная суспензия в концентрации до 4 × 106 клеток на 1 мл) инкубировали в питательной среде, состоящей из 90% RPMI-1640 (“Вектор-Бест”, Россия), 10% эмбриональной телячьей сыворотки (“Invitrogen”, США), подвергнутой инактивации в течение 30 мин при температуре 56°С, 2 мМ Hepes (“Flow”, Великобритания), гентамицина (100 мкг/мл) (“KRKA”, Словения), L-глутамина (0.3 мг/мл) (“Вектор-Бест”, Россия) и пероксида водорода в конечной концентрации 0.5 мМ, в полуоткрытой системе при температуре 37°С и 5% СО2 в течение 18 ч, соблюдая стерильные условия.
После инкубации лимфоциты крови трижды отмывали 0.01 М натрий-фосфатным буфером (рН = 7.4) (“Amresco”, США) и использовали для определения содержания активных форм кислорода, в том числе и гидроксильного радикала, числа аннексин V-положительных клеток, либо ресуспендировали в буфере с добавлением 1% тритона X-100 (“Panreac”, Испания) при 0°С и готовили лизат с сохранением стандартной концентрации клеток для определения уровня общего белка, SH-групп протеинов, карбонильных производных белков и активности каспазы-3, глутатионредуктазы, каталазы, глутатионпероксидазы. Для определения содержания восстановленного, окисленного и связанного с белками глутатиона лизат лимфоцитов крови депротеинизировали с помощью 5%-ного раствора сульфосалициловой кислоты.
Концентрацию внутриклеточных активных форм кислорода определяли методом проточной цитометрии по уровню свечения 2,7-дихлорфлюоресцеина на клетку, который образовался после взаимодействия полярного производного 2,7-дихлорфлюоресцеин-диацетата (“Sigma-Aldrich”, США) с липидными пероксидами и Н2О2 [15]. Результаты представляли в усл. ед.
Содержание гидроксильного радикала внутри клетки определяли спектрофотометрически по способности этого радикала (после предварительной опсонизации клеток зимозаном (“Sigma-Aldrich”, США)) разрушать модельный субстрат – 2-дезокси-D-рибозу (“Sigma-Aldrich”, США) с образованием продукта реакции, имеющего максимум поглощения при 532 нм [16]. Результаты выражали в нмоль/мг белка в пробе.
Количество апоптозных клеток оценивали методом проточной цитометрии с использованием FITC-меченного аннексина V, специфически взаимодействующего с фосфатидилсерином, и с применением пропидия йодида (РI), способного интеркалировать с молекулой ДНК, согласно протоколу фирмы производителя (“ANNEXIN V FITC Kit” “TREVIGEN”, США). Количество FITC-положительных/PI-отрицательных- и FITC-положительных/PI-положительных-меченных клеток оценивали к общему числу изучаемых клеток и выражали в процентах.
Активность каспазы-3 (КФ 3.4.22.56) определяли спектрофлуориметрическим методом путем гидролиза N-ацетил-(Асп-Глу-Вал-Асп)-7-амино-4-метилкумарина (“Sigma-Aldrich”, США) с образованием флуоресцирующего продукта – амино-4-метилкумарина, обладающего флюоресценцией при 430–460 нм (максимум возбуждения флуоресценции = 380 нм). Активность фермента выражали в пмоль/мин мг белка в пробе [17, 18].
Внутриклеточную концентрацию восстановленного и окисленного глутатиона определяли спектрофотометрически – методом каталитической рециркуляции и блокирования SH-групп трипептида 2-винилпиридином (“Wako”, Япония) с дальнейшим взаимодействием глутатиона с 5,5'-дитио-бис(2-нитробензойной) кислотой (“Sigma-Aldrich”, США) и образованием продукта реакции с характерным максимумом поглощения при 412 нм [19]. Полученные результаты выражали в нмоль/мг белка, дополнительно вычисляя показатель редокс-статуса клетки – величину соотношения восстановленного к окисленному глутатиону.
Спектрофотометрическим методом, описанным выше, оценивали внутриклеточное содержание уровня связанного с белками глутатиона, предварительно высвобождая его из связи с белками с помощью 1%-ного раствора боргидрида натрия (“Sigma-Aldrich”, США) [20]. Концентрацию SH-групп протеинов определяли по способности реагирования тиоловых соединений с 5,5'-дитио-бис(2-нитробензойной) кислотой спектрофотометрическим методом, описанным ранее [20]. Результаты представляли в нмоль/мг белка в пробе.
Активность глутатионредуктазы (КФ 1.6.4.2) определяли спектрофотометрическим методом, описанным ранее, по НАДФН-зависимому восстановлению окисленной формы глутатиона (“Sigma-Aldrich”, США) и последующем ее взаимодействии с 5,5'-дитио-бис(2-нитробензойной) кислотой [21]. Полученные результаты активности энзима выражали в нмоль/мин мг белка в пробе.
Активность глутатионпероксидазы (КФ 1.11.1.9) оценивали спектрофотометрическим методом по способности катализа реакции восстановленного глутатиона (“Sigma-Aldrich”, США) с гидроперекисью трет-бутила (“Sigma-Aldrich”, США) [22]. Активность фермента представляли в мкмоль/мин мг белка в пробе.
Активность каталазы (КФ 1.11.1.6) определяли спектрофотометрическим методом по способности, не разрушенной в ходе реакции Н2О2, образовывать с молибдатом аммония стойкий окрашенный комплекс, имеющий максимум поглощения при 410 нм [23]. Активность фермента выражали в нкат/мг белка в пробе.
Содержание карбонильных производных белков оценивали по реакции взаимодействия с 2,4-динитрофенилгидразином методом иммуноферментного анализа, с использованием набора “Carbonyl Proteine ELISA Kit” (“Immundiagnostik AG”, Германия) согласно инструкции фирмы-производителя. Результаты представляли в нмоль/мг белка в пробе.
Внутриклеточную концентрацию белка оценивали спектрофотометрически с помощью метода, основанного на взаимодействии аминокислотных остатков лизина и аргинина с красителем – бриллиантовым голубым G-250 (“Sigma-Aldrich”, США) (максимум поглощения при 595 нм) [24].
Полученные результаты подвергали статистической обработке с помощью программы Statistica 6.0. Используя критерий Шапиро–Уилки, проверяли нормальность распределения количественных показателей. Для оценки достоверности различий независимых выборок использовали непараметрический критерий Манна–Уитни. Полученные данные выражали в виде медианы (Ме), верхнего и нижнего квартилей (Q1–Q3). Методом корреляционного анализа определяли наличие связи между количественными показателями, исчисляя коэффициент ранговой корреляции Спирмена. Статистически значимыми считались различия при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ полученных данных в интактных лимфоцитах крови позволил установить участие окислительной модификации белков и изменения редокс-статуса в реализации апоптоза.
При анализе и сопоставлении полученных данных в интактных лимфоцитах крови нами были установлены корреляции между содержанием активных форм кислорода и восстановленным глутатионом (r = –0.57; р < 0.05), концентрацией карбонильных производных протеинов и числом аннексин V-положительных клеток (r = +0.61; р < 0.05).
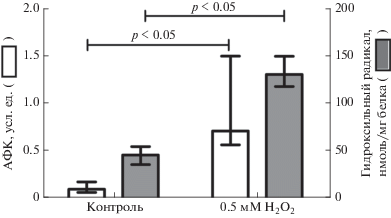
При инкубации лимфоцитов крови с добавлением пероксида водорода в конечной концентрации 0.5 мМ было получено статистически значимое увеличение концентрации активных форм кислорода, определяемых с помощью 2,7-дихлорфлуоресцеина, в 6.8 раза (р < 0.05), а гидроксильного радикала в 2.8 раза (р < 0.05) по сравнению с интактными клетками (рис. 1).
Рис. 1.
Содержание активных форм кислорода (n = 6) методом проточной цитометрии и гидроксильного радикала (n = 10) в интактных лимфоцитах крови (контроль) и при окислительном стрессе in vitro (0.5 мМ Н2О2), Mе (Q1–Q3). р – уровень значимости различий по сравнению с интактными лимфоцитами крови.
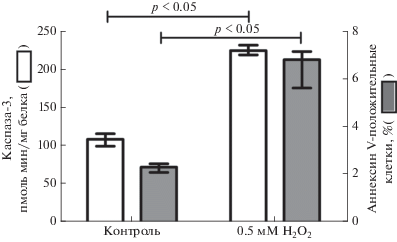
При оценке показателей, характеризующих степень выраженности и завершенности апоптоза, нами было установлено увеличение числа аннексин V-положительных лимфоцитов крови в 2.9 раза (р <0.05) и активности каспазы-3 в 2.1 раза (р < 0.05) по сравнению с аналогичными результатами в интактных клетках (рис. 2).
Рис. 2.
Активность каспазы-3 (n = 6) и количество аннексин V-положительных (n = 6) интактных лимфоцитов крови (контроль) и при окислительном стрессе in vitro (0.5 мМ Н2О2), Mе (Q1–Q3). р – уровень значимости различий по сравнению с интактными лимфоцитами крови.
Величина соотношения восстановленного к окисленному глутатиону, характеризующая редокс-статус лимфоцитов крови в условиях моделирования окислительного стресса in vitro, была выше в 1.7 раза (р < 0.05) по сравнению с интактными клетками. Возрастание этого показателя было обусловлено увеличением содержания восстановленной формы тиола в 2.8 раза (р < 0.05), а окисленной формы всего в 1.5 раза (р < 0.05) по сравнению с изучаемыми показателями в интактных клетках (табл. 1).
Таблица 1.
Содержание восстановленного, окисленного глутатиона, величина их соотношения, активность глутатионредуктазы и глутатионпероксидазы в интактных лимфоцитах крови и в условиях окислительного стресса in vitro, Mе (Q1–Q3)
| Группы | Показатель | ||||
|---|---|---|---|---|---|
| восстановленный глутатион, нмоль/мг белка | окисленный
глутатион, нмоль/мг белка |
восстановленный глутатион/окисленный глутатион |
глутатионредуктаза, нмоль/мин мг белка |
глутатионпероксидаза, мкмоль/мин мг белка | |
| Лимфоциты | n = 6 | n = 6 | n = 6 | n = 10 | n = 10 |
| 0.75 | 0.11 | 7.17 | 312.80 | 5.68 | |
| (0.74–0.88) | (0.10–0.11) | (6.52–8.00) | (287.08–321.70) | (5.06–7.00) | |
| Лимфоциты + 0.5 мМ Н2О2 | n = 6 | n = 6 | n = 6 | n = 10 | n = 10 |
| 2.08 | 0.17 | 12.42 | 277.56 | 9.28 | |
| (1.52–2.16) | (0.15–0.17) | (10.71–12.78) | (213.36–353.95) | (7.95–10.22) | |
| р < 0.05 | р < 0.05 | р < 0.05 | р > 0.05 | р < 0.05 | |
Наряду с этим отмечено увеличение активности глутатионпероксидазы на фоне сопоставимой активности глутатионредуктазы в лимфоцитах крови при моделировании окислительного стресса. Так, при внесении Н2О2 в конечной концентрации 0.5 мМ в среду инкубации лимфоцитов крови возрастание активности глутатионпероксидазы составило в 1.6 раза (р < 0.05) относительно значений активности фермента в интактных лимфоцитах крови (табл. 1). При изучении каталазной активности было установлено, что индукция окислительного стресса in vitro в лимфоцитах крови характеризовалась увеличением активности фермента в 4.8 раза (р < 0.05) по сравнению с показателем в интактных лимфоцитах крови (табл. 2).
Таблица 2.
Содержание SH-групп, карбонильных производных протеинов, связанного с белками глутатиона и активность каталазы в интактных лимфоцитах крови и в условиях окислительного стресса in vitro, Mе (Q1–Q3)
| Группы | Показатель | |||
|---|---|---|---|---|
| белок-SH, нмоль/мг белка |
связанный
с белками
глутатион, нмоль/мг белка |
карбонильные производные
белков, нмоль/мг белка |
каталаза, нкат/мг белка |
|
| Лимфоциты | n = 6 | n = 6 | n = 6 | n = 10 |
| 2.84 (1.79–2.94) | 0.05 (0.04–0.06) | 0.149 (0.142–0.151) | 6.76 (6.44–9.90) | |
| Лимфоциты + + 0.5 мМ Н2О2 |
n = 6 | n = 6 | n = 6 | n = 10 |
| 0.33 (0.28–0.38) | 0.14 (0.13–0.15) | 0.359 (0.354–0.362) | 32.55 (22.10–35.02) | |
| р < 0.05 | р < 0.05 | р < 0.05 | р < 0.05 | |
Формирование окислительного стресса в лимфоцитах крови сопровождалось снижением концентрации SH-групп протеинов в 8.6 раза (р < 0.05) по сравнению с результатом в интактных клетках (табл. 2).
Влияние пероксида водорода в конечной концентрации 0.5 мМ в лимфоцитах крови характеризовалось возрастанием содержания обратимо и необратимо модифицированных производных протеинов. Так, в лимфоцитах крови при моделировании окислительного стресса in vitro концентрация связанного с белками глутатиона была увеличена в 2.8 раза (р < 0.05), а содержание карбонильных производных белков в 2.4 раза (р < 0.05) было выше относительно показателей, полученных в интактных лимфоцитах крови (табл. 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Свободно-радикальные реакции являются активными участниками физиологических процессов во всех клетках организма. C позиции протекания этих процессов особый интерес представляют эффекторные клетки крови, а именно лимфоциты. От редокс-статуса лимфоцитов крови зависит не только их функциональная активность, участие в межклеточных взаимодействиях, регулирующих гомеостаз организма, но и протекание внутриклеточных процессов, определяющих реализацию и регуляцию клеточной гибели. Поэтому выяснение молекулярных механизмов участия активных форм кислорода и окислительно-модифицированных молекул в нарушении регуляции апоптоза лимфоцитов крови является актуальным с позиции уточнения патогенеза опухолевого роста, аутоиммунных реакций, воспалительных процессов и т.д., протекающих с участием этих клеток.
Добавление Н2О2 в конечной концентрации 0.5 мМ в среду инкубации лимфоцитов крови вызывает окислительный стресс, сопровождающийся преимущественно апоптотическим типом гибели клеток, что позволило использовать эту модель для достижения цели исследования. Проводимые исследования на клеточных моделях, имеют неоспоримую ценность, так как позволяют установить взаимосвязи между теорией и практикой в медицинской науке, способствуют выявлению молекулярных механизмов участия внутриклеточных систем в формировании различных патологий и исключить многие неспецифические факторы, сопровождающие редокс-модуляцию in vivo. Апоптотический тип гибели является физиологическим механизмом элиминации клеток, имеющих нарушенную функцию и дефектные рецепторы. Однако при срыве регуляторных механизмов наблюдается патологическое стимулирование или ингибирование этого процесса.
Активация окислительных процессов в лимфоцитах крови с помощью добавления 0.5 мМ пероксида водорода сопровождалась изменением редокс-статуса, модификацией и повреждением белков, участвующих в регуляции метаболизма этих клеток, на фоне запуска апоптотической гибели, выражающейся в увеличении числа аннексин V-положительных клеток и активности каспазы-3.
Одной из самых мощных систем, поддерживающих редокс-статус клетки является система глутатиона. Восстановленный глутатион является участником внутриклеточной сигнальной трансдукции, редокс-регулятором активности транскрипционных факторов и экспрессии генов, а также сильным акцептором синглетного кислорода и гидроксильного радикала, тем самым, снижая цитотоксическое и повреждающее действие активных форм кислорода [25–28]. Участие глутатиона в редокс-регулировании опосредовано через образование дисульфидных связей между окисленной формой трипептида и SH-групп белков [29].
При инкубации с 0.5 мМ пероксидом водорода отмечено изменение редокс-статуса лимфоцитов крови за счет увеличения восстановленной фракции глутатиона. В указанных условиях инкубации, вероятнее всего, это связано с увеличением скорости цитозольного синтеза тиола de novo с участием γ-глутамилцистеинсинтетазы. Глутатион является низкомолекулярным тиолом и представляет собой важный компонент неферментативной, легко мобилизуемой системы удаления активных форм кислорода в качестве донора протонов, в результате чего образуется окисленный глутатион. Окисленный глутатион, как известно, для клетки является токсичным, высокореакционным соединением и активно конвертируется обратно в восстановленную форму ферментом глутатионредуктазой. Для обеспечения внутриклеточного окислительно-восстановительного баланса и восстановления дисульфидных связей в протеинах необходима постоянная редукция окисленных компонентов системы глутатиона [30]. В лимфоцитах крови действие Н2О2 в конечной концентрации 0.5 мМ характеризовалось повышением содержания окисленной формы трипептида, что, вероятнее всего, есть следствие не только воздействия агрессивного для клетки агента, но и активации глутатионпероксидазы, использующей восстановленный глутатион в качестве субстрата реакции. Активность глутатионредуктазы, превращающей окисленный глутатион в восстановленный, не различалась достоверно при сравнении результатов, полученных в лимфоцитах крови при индукции пероксидом водорода окислительного стресса и в интактных клетках. Кроме этого, при моделировании окислительного стресса нами была отмечена тенденция к снижению активности фермента. Можно предположить повышенную чувствительность глутатионредуктазы по сравнению с глутатионпероксидазой к повреждающему действию пероксида водорода. Также необходимо учитывать, что для реализации катализа глутатионредуктазной реакции требуется достаточное количество НАДФН [31], который поставляется в основном за счет реакций пентозофосфатного пути окисления глюкозо-6-фосфата.
Зафиксированное нами снижение концентрации SH-групп протеинов на фоне высокого содержания активных форм кислорода при индукции окислительного стресса в лимфоцитах крови свидетельствует об участии белковых молекул в качестве акцепторов пероксида водорода и гидроксильного радикала. Подвергаясь окислительному воздействию, SH-группы цистеиновых радикалов белковых молекул способны обратимо переходить в дисульфидное состояние и активно вступать во взаимодействие с окисленным глутатионом. Это подтверждалось увеличением содержания связанного с белками глутатиона на фоне возрастания концентрации окисленного глутатиона при индукции окислительного стресса в изучаемых клетках. Известно, что гидроксильный радикал обладает высокой реакционной способностью и вызывает повреждение не только белковых молекул, но и липидов и нуклеиновых кислот, вызывая при этом образование органических радикалов [1]. Внутриклеточная продукция ОН• происходит с участием ионов переменной валентности (Fe2+, Cu+) в реакциях Фентона. Гидроксильный радикал имеет малое время жизни и радиус диффузии, поэтому в биологических системах не существуют специализированных протективных систем, защищающих клетки от ОН•. Ведущая роль в его инактивации принадлежит соединениям, содержащим SH-группы [32].
Добавление Н2О2 в конечной концентрации 0.5 мМ в среду инкубирования лимфоцитов крови способствовало не только обратимой окислительной модификации белков, но и накоплению их карбонильных производных. Эти производные протеинов образуются путем ковалентной модификации аминокислотных радикалов треонина, аргинина, пролина, гистидина, цистеина, лизина и являются стабильными продуктами [33].
Проведенный нами корреляционный анализ полученных результатов в лимфоцитах крови в условиях окислительного стресса позволил установить положительные взаимосвязи между количеством аннексин V-положительных клеток и концентрацией гидроксильного радикала (r = +0.71; р < 0.05), содержанием карбонильных производных белков и активностью каспазы-3 (r = +0.65; р < 0.05). Это указывает на участие активных форм кислорода и окислительно-модифицированных белков в реализации апоптотического типа гибели лимфоцитов крови в условиях экспериментального окислительного стресса.
В настоящее время известно, что продукты неполного восстановления молекулярного кислорода помимо повреждающего действия выполняют регуляторные функции. По физико-химическим свойствам в качестве вторичного посредника для активации лимфоцитов выступает молекула Н2О2. В сравнении с гидроксильным радикалом, H2O2 менее агрессивна, но при этом способна окислять цистеин в составе белков и пептидов, превращая его цистеинтиолат-анион (–СН2–S¯). В случае снижения редокс-статуса клетки при формировании окислительного стресса цистеин способен легко окисляться пероксидом водорода до сульфеновой кислоты, с последующим образованием дисульфидных или сульфенамидных связей. Наличие остатков цистеина в регуляторных белках, таких как факторы транскрипции, рецепторы, протеинкиназы, циклин-зависимые киназы, позволяет считать их редокс-зависимыми протеинам, а молекулы активных форм кислорода – модуляторами функционального статуса лимфоцитов крови, меняющих активность этих клеток в иммуногенезе [32, 34].
В связи с этим чрезмерная активация или угнетение гибели эффекторных клеток крови может обуславливать нарушение регуляции межклеточной кооперации, являющуюся причиной возникновения патологических процессов. Поэтому исследование участия активных форм кислорода в молекулярных механизмах, составляющих основу внутриклеточного функционирования лимфоцитов крови, как в норме, так и при патологии является актуальным и перспективным с позиции разработки технологий для профилактики и коррекции патологических состояний, характеризующихся развитием окислительного стресса.
Формирование иммунного ответа влечет за собой активацию всех участников иммунной защиты. Компоненты иммунной системы, в том числе лимфоциты крови, способны очень быстро и активно взаимодействовать между собой. С помощью лимфоцитов происходит формирование специфического иммунитета, реализация и координация иммунного ответа путем синтеза воспалительных цитокинов и антиген-специфических связывающих рецепторов, обеспечивающих постоянство внутренней среды организма и защиту от чужеродных агентов [4]. Процесс образования активных форм кислорода при функционировании клеток лимфоидной природы неизбежен. Но редокс-статус этих клеток должен находиться под строгим контролем. Важно отметить, что усиление свободно-радикальных процессов и нарушение физиологического баланса между про- и антиоксидантными системами с привлечением в качестве эффекторной клетки лимфоцита крови может быть причиной аутоиммунных и аллергических патологий, опухолевого роста различной локализации, неинфекционного и инфекционного воспаления и др. [2, 12].
Таким образом, сочетание антиоксидантных и свободно-радикальных процессов влияет на окислительную модификацию протеинов и является основой редокс-зависимых путей реализации и активации апоптотической гибели в интактных лимфоцитах крови. Исследование, проведенное нами на модели окислительного стресса в лимфоцитах крови, позволило установить молекулярные механизмы влияния пероксида водорода в конечной концентрации 0.5 мМ на процесс окислительной модификации белков и состояние компонентов системы глутатиона в лимфоцитах крови. При изменении соотношения в содержании про- и антиоксидантов в лимфоцитах крови в условиях моделирования окислительного стресса нами было выявлено, что потенциальными редокс-зависимыми молекулярными мишенями для коррекции нарушений метаболизма и ключевыми молекулами в регуляции клеточного ответа на окислительный стресс являются белки. Управление редокс-зависимыми процессами карбонилирования и глутатионилирования протеинов является перспективным с позиции модуляции функциональных свойств лимфоцитов крови.
Список литературы
Меньщикова Е.Б., Зенков Н.К., Ланкин В.З., Бондарь И.А., Труфакин В.А. Окислительный стресс. Патологические состояния и заболевания. Новосибирск. Сибирск. универ. изд-во. 2017. [Men’shhikova E.B., Zenkov N.K., Lankin V.Z., Bondar’ I.A., Trufakin V.A. Okislitel’nyj stress. Patologicheskie sostoyaniya i zabolevaniya [Oxidative stress: Pathological states and diseases]. Novosibirsk. Sibirskoe Universitetskoe Izdatelstvo. 2017.].
Belikov A.V., Schraven B., Simeoni L. T cells and reactive oxygen species. J. Biomed. Sci. 22: 85–92. 2015.
Gostner J.M., Becker K., Fuchs D., Sucher R. Redox regulation of the immune response. Redox. Rep. 18(3): 88–94. 2013.
Kesarwani P., Murali A.K., Al-Khami A.A., Mehrotra S. Redox regulation of T-cell function: From molecular mechanisms to significance in human health and disease. Antioxid. Redox. Signal. 18(12): 1497–1534. 2013.
Меньщикова Е.Б., Ланкин В.З., Зенков Н.К., Бондарь И.А., Круговых Н.Ф., Труфакин В.А. Окислительный стресс. Прооксиданты и антиоксиданты. М. Фирма “Слово”. 2006. [Men’shhikova E.B., Lankin V.Z., Zenkov N.K., Bondar’ I.A., Kruguvyh N.F., Trufakin V.A. Okislitel’nyj stress. Prooksidanty i antioksidanty [Oxidative stress: Prooxidant and antioxidant]. Moscow. Firma “Word”. 2006.].
Thannickal V.J., Fanburg B.L. Reactive oxygen species in cell signaling. J. Physiol. 279(6): L1005–L1028. 2000.
Ullrich V., Kissner R. Redox signaling: Bioinorganic chemistry at its best. J. Inorg. Biochem. 100(12): 2079–2086. 2006.
Dubinina E.E., Dadali V.A. Role of 4-hydroxy-trans-2-nonenal in cell functions. Biochemistry (Mosc). 75(9): 1069–1087. 2010.
Степовая Е.А., Рязанцева Н.В., Носарева О.Л., Закирова Е.В., Наумова А.И., Веснина О.Н., Орлов Д.С., Шахристова Е.В., Иванов В.В., Новицкий В.В. Роль окислительной модификации белков в редокс-зависимой регуляции апоптоза опухолевых клеток. Молекулярная медицина. (4): 60–64. 2015. [Stepovaya E.A., Ryazantseva N.V., Nosareva O.L., Zakirova E.V., Naumova A.I., Vesnina O.N., Orlov D.S., Shakhristova E.V., Ivanov V.V., Novitsky V.V. The role of oxidative protein modification in redox-dependent regulation of tumor cell apoptosis. Molecular medicine. (4): 60–64. 2015. (in Russ.)].
Chondrogianni N., Petropoulos I., Grimm S., Georgila K., Catalgol B., Friguet B., Grune T., Gonos E.S. Protein damage, repair and proteolysis. Mol. Aspects Med. 35: 1–71. 2014.
Popov D. Protein S-glutathionylation: From current basics to targeted modifications. Arch. Physiol. Biochem. 120(4): 123–130. 2014.
Nosareva O.L., Stepovaya E.A., Ryazantseva N.V., Shakhristova E.V., Egorova M.Y., Novitsky V.V. The role of the glutathione system in oxidative modification of proteins and dysregulation of apoptosis in Jurkat tumor cells. Bull. Exp. Biol. Med. 164(2): 199–202. 2017.
Bignold L.P., Ferrante A. Mechanism of separation of polymorphonuclear leukocytes from whole blood by the one-step Hypaque-Ficoll method. J. Immunol. Methods. 96(1): 29–33. 1987.
Ulmer A.J., Flad H.D. Discontinuous density gradient separation in human mononuclear leucocytes using percoll as gradient medium. J. Immun. Methods. 30(1): 1–10. 1979.
Halliwell B., Whiteman M. Measuring reactive species and oxidative damage in vivo and in cell culture: How should you do it and what do the results mean? Br. J. Pharmacol. 142(2): 231–255. 2004.
Thom S.R., Elbuken M.E. Oxygen-dependent antagonism of lipid peroxidation. Free Radic. Biol. Med. 10(6): 413–426. 1991.
Cohen G.M. Caspases: The executioners of apoptosis. Biochem. J. 326: 1–16. 1997.
Nicholson D.W. Caspase structure, proteolytic substrates, and function during apoptotic cell death. Cell Death and Differentiation. 6: 1028–1042. 1999.
Kojima S., Nakayama K., Ishida H. Low dose gamma-rays activate immune functions via induction of glutathione and delay tumor growth. J. Radiat. Res. 45(1): 33–39. 2004.
Burchill B.R., Oliver J.M., Pearson C.B., Leinbach E.D., Berlin R.D. Microtubule dynamics and glutathione metabolism in phagocytizing human polymorphonuclear leukocytes. J. Cell Biol. 76(2): 439–447. 1978.
Worthington D.J., Rosemeyer M.A. Glutathione reductase from human erythrocytes. Catalytic properties and aggregation. Eur. J. Biochem. 67(1): 231–238. 1976.
Карпищенко А.И. Медицинские лабораторные технологии. CПб. Интермедика. 1998. [Karpishchenko A.I. Medicinskie laboratornye tekhnologii [Medical laboratory techniques]. Saint Petersburg. Intermedika. 1998.].
Королюк М.А., Иванова Л.Н., Майорова И.Г., Токарев В.Е. Метод определения активности каталазы. Лаб. дело. 1: 16–19. 1988. [Korolyuk M.A., Ivanova L.N., Majorova I.G., Tokarev V.E. Method for determination of catalase activity. Laboratornoe delo. 1: 16–19. 1988. (in Russ.)].
Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72: 248–254. 1976.
Кулинский В.И., Колесниченко Л.С. Глутатион ядра клетки и его функции. Биомедицинская химия. 56(6): 657–662. 2010. [Kulinskiĩ V.I., Kolesnichenko L.S. Nuclear glutathione and its functions. Russ. Biomeditsinskaya Khimiya. 56(6): 657–662. 2010. (in Russ.)]
Dannenmann B., Lehle S., Hildebrand D.G., Kübler A., Grondona P., Schmid V., Holzer K., Fröschl M., Essmann F., Rothfuss O., Schulze-Osthoff K. High glutathione and glutathione peroxidase-2 levels mediate cell-type-specific DNA damage protection in human induced pluripotent stem cells. Stem Cell Reports. 4(5): 886–898. 2015.
Harris I.S., Treloar A.E., Inoue S., Sasaki M., Gorrini C., Lee K.C., Yung K.Y., Brenner D., Knobbe-Thomsen C.B., Cox M.A., Elia A., Berger T., Cescon D.W., Adeoye A., Brüstle A., Molyneux S.D., Mason J.M., Li W.Y., Yamamoto K., Wakeham A., Berman H.K., Khokha R., Done S.J., Kavanagh T.J., Lam C.W., Mak T.W. Glutathione and thioredoxin antioxidant pathways synergize to drive cancer initiation and progression. Cancer Cell. 27(2): 211–222. 2015.
Pastore A., Piemonte F. S-glutathionylation signaling in cell biology: Progress and prospects. Eur. J. Pharm. Sci. 46(5): 279–292. 2012.
Hill B.G., Bhatnagar A. Protein S-glutathiolation: Redox-sensitive regulation of protein function. J. Mol. Cell Cardiol. 52(3): 559–567. 2012.
Кулинский В.И., Колесниченко Л.С. Система глутатиона. I. Синтез, транспорт, глутатионтрансферазы, глутатионпероксидазы. Биомедицинская химия. 55(3): 255–277. 2009. [Kulinskiĩ V.I., Kolesnichenko L.S. Glutathione system. I. Synthesis, transport, glutathione transferases, glutathione peroxidases. Russ. Biomeditsinskaya Khimiya. 55(3): 255–277. 2009. (in Russ.)].
Son A., Yodoi J., Nakamura H. Thioredoxin. Nippon Rinsho. 62(11): 537–540. 2004.
Зенков Н.К., Меньщикова Е.Б., Ткачев В.О. Некоторые принципы и механизмы редокс-регуляции. Кислород и антиоксиданты. 1: 3–64. 2009. [Zenkov N.K., Men’shhikova E.B., Tkachev V.O. Some principles and mechanisms of redox-regulation. Oxygen and antioxidants. 1: 3–64. 2009. (in Russ.)].
Grimsrud P.A., Xie H., Griffin T.J., Bernlohr D.A. Oxidative stress and covalent modification of protein with bioactive aldehydes. J. Biol. Chem. 283(32): 21837–21841. 2008.
Kalinina E.V., Chernov N.N., Novichkova M.D. Role of glutathione, glutathione transferase, and glutaredoxin in regulation of redox-dependent processes. Biochemistry. (Mosc). 79(13): 1562–1583. 2014.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


