Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 3, стр. 386-398
Изучение эффективности и безопасности магнитоуправляемой доставки магнитных наночастиц на модели изолированного сердца крысы
Я. Г. Торопова 1, *, В. Д. Богушевская 1, В. И. Мишанин 1, Д. В. Королев 1, 2, К. Г. Гареев 3
1 Национальный медицинский исследовательский центр им. В.А. Алмазова
Санкт-Петербург, Россия
2 Первый Санкт-Петербургский государственный медицинский университет
имени академика И.П. Павлова
Санкт-Петербург, Россия
3 Санкт-Петербургский государственный электротехнический университет “ЛЭТИ”
им. В.И. Ульянова (Ленина)
Санкт-Петербург, Россия
* E-mail: yana.toropova@mail.ru
Поступила в редакцию 03.09.2018
После доработки 28.02.2019
Принята к публикации 02.03.2019
Аннотация
В данной работе на модели изолированного сердца крысы по методу Langendorff была произведена оценка эффективности магнитоуправляемой доставки наночастиц, синтезированных различными способами, в условиях наличия/отсутствия внешнего магнитного поля, изучено их влияние на параметры сократительной функции миокарда. В работе установлено, что наночастицы магнетита и композитные наночастицы магнетита–кремнезема в равной степени накапливаются в миокарде независимо от условий их введения, что может быть обусловлено недостаточным по силе воздействия влиянием магнитного поля. В условиях острого эксперимента накопление наночастиц в миокарде приводило к изменению параметров его сократительной активности; в зависимости от вида наночастиц и условий их введения оказанное влияние носило разнонаправленный характер. На фоне введения наночастиц наблюдалось незначительное снижение сократительной активности изолированных сердец, функционирование миокарда сохранялось до конца эксперимента.
По данным Всемирной Организации Здравоохранения [1] за 2016 г. в мире умерло 17.5 млн человек от сердечно-сосудистых заболеваний (ССЗ), что составляет 31% от всех смертельных случаев и является основной причиной смерти людей во всем мире. Из этого числа 7.4 млн человек умерли от ишемической болезни сердца и 6.7 млн человек в результате инсульта. В целях эффективного снижения указанных показателей необходимо совершенствовать методы лечения и профилактики данных заболеваний. К сожалению, на сегодняшний день “идеального” средства для предотвращения ишемических и реперфузионных повреждений миокардиальных клеток не существует. Существующие методы лечения ишемических заболеваний не всегда эффективны и имеют целый ряд недостатков, таких как большой объем распределения лекарственного вещества, побочные эффекты, вызываемые действием препарата на другие ткани, а также недостаточная стабильность препарата вследствие его быстрой инактивации и элиминации [2]. В связи с этим в последние годы исследователи большое внимание уделяют разработке способов направленной (таргетной) доставки лекарственных препаратов в поврежденную ткань [3–5]. Примером транспортеров лекарственных веществ могут служить магнитные наночастицы на основе оксида железа, которые под действием внешнего магнитного поля могут селективно накапливаться в целевой области [6, 7]. Селективность накопления при этом может реализовываться двумя путями – пассивным и активным механизмами. Пассивный направленный транспорт обеспечивается за счет структурных нарушений тканей и повышенной проницаемости капилляров в участке локализации патологического процесса. Активная адресная доставка достигается присоединением к поверхности наночастиц активных направляющих векторных молекул, в качестве которых могут выступать пептиды, лиганды к специфическим рецепторам и т.д. Также активная целевая доставка может быть обеспечена посредством управления перемещением в организме магнитных наночастиц, ассоциированных с лекарственным препаратом, с помощью применения внешнего магнитного поля. Высвобождение лекарственного препарата может также происходить различными путями: в случае, если препарат равномерно интегрирован в полимерную оболочку, покрывающую наночастицу, его постепенное высвобождение будет обусловлено биодеградацией полимера. Существует pH-зависимый механизм высвобождения препаратов с поверхности наночастиц, основанный на изменении pH тканей при различных патологических процессах. Также индуктором управляемой десорбции препарата с поверхности наночастиц может являться повышение температуры в участке накопления наночастиц, которое может быть обусловлено как самим патологическим процессом в участке патологии, так и действием внешнего магнитного поля, обеспечивающего нагрев самих наночастиц и запуск механизмов высвобождения препарата [8–10]. Ранее авторами были получены результаты естественного биораспределения наночастиц (в условиях отсутствия внешнего источника магнитного поля) [11]. Было установлено, что наночастицы магнетита и коллоидные частицы на основе оксида железа и диоксида кремния с разной динамикой накапливаются в миокарде, что, вероятно, обусловлено различной тропностью (за счет различий поверхностей) наночастиц к миокарду. Данный факт определяет актуальность дальнейших разработок наночастиц на основе оксида железа, как средства активной адресной доставки лекарственных препаратов в миокард. В качестве источника внешнего магнитного поля, позволяющего локализовать магнитные наночастицы в целевой области, могут быть использованы постоянные магниты Nd–Fe–B (системы постоянных магнитов) [12–16], электромагниты [17], ферромагнитные импланты [18] и их различные конфигурации.
Целью данной работы явилось изучение эффективности и безопасности магнитоуправляемой доставки магнитных наночастиц, синтезированных различными способами, на модели изолированного сердца крысы.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проведено на изолированных сердцах крыс стока Вистар массой 300 ± 20 г. Животные содержались в условиях вивария на полном рационе со строгим соблюдением требований Европейской конвенции (Страсбург, 1986) по содержанию, кормлению и уходу за подопытными животными, а также выводу их из эксперимента и последующей утилизации.
Для исключения влияния сезонных колебаний на устойчивость сердца к повреждающему действию ишемии, исследование проводилось в осенне–зимний период.
Исследуемые агенты
В работе использовались наночастицы магнетита (МНЧ1) и композитные частицы магнетита–кремнезема (МНЧ2). Синтез МНЧ подробно описан ранее [19]. Статические магнитные свойства МНЧ изучались с помощью вибрационного магнитометра “Lake Shore 7410” (Lake Shore Cryotronics Inc., США) в воздушной среде при стандартной температуре. Для определения размера наночастиц в приготовленных суспензиях использовали прибор Zetasizer Nano (Malvern Instruments, Великобритания) методом динамического рассеяния света (фотонная корреляционная спектроскопия) с использованием технологии неинвазивного обратного рассеяния. Определение характеристик МНЧ проводилось согласно методу, описанному ранее [20].
Краткая характеристика исследуемых видов МНЧ представлена в табл. 1.
Протокол перфузии изолированного сердца по методу Langendorff
У наркотизированных животных (хлоралгидрат в расчете 200–250мг/кг, внутрибрюшинное введение) вскрывали грудную клетку, извлекали сердца, помещая их в охлажденный раствор Кребса–Хензеляйта (4°С). Затем очищали от соединительной ткани. Изолированные сердца перфузировали оксигенированным (95% – кислород, 5% – углекислый газ) раствором Кребса–Хензеляйта (мМ): NaCl 18; KCl 4.7; MgSO4 1.2; KH2PO4 1.2; CaCl2 2.0; NaHCO3 25; глюкоза 5.5 при постоянной температуре раствора 37°С, pH ≈ 7.4 по схеме (рис. 1). Исследование проводили в двух режимах: в условиях воздействия внешнего магнитного поля и в условиях его отсутствия.
Конечная концентрация исследуемых видов наночастиц в физиологическом растворе составила 0.7 мг/мл. Коллоидный раствор МНЧ вводился в латеральную хвостовую вену крысы. Введение магнитных наночастиц и физиологического раствора производилось на этапе окончания адаптации в течение 2 мин со скоростью 1 мл/мин. Объем введения составил 1 мл. Сформированные группы представлены в табл. 2.
Таблица 2.
Характеристика экспериментальных групп
| Группа | Воздействие магнита | Вводимые агенты |
|---|---|---|
| К-БМ (n = 8) | – | 0.9%-й водный раствор хлорида натрия |
| К-М (n = 8) | + | 0.9%-й водный раствор хлорида натрия |
| МНЧ1-БМ (n = 8) | – | Наночастицы магнетита |
| МНЧ1-М (n = 8) | + | Наночастицы магнетита |
| МНЧ2-БМ (n = 8) | – | Наночастицы магнетит–кремнезем |
| МНЧ2-М (n = 8) | + | Наночастицы магнетит–кремнезем |
Источник внешнего магнитного поля
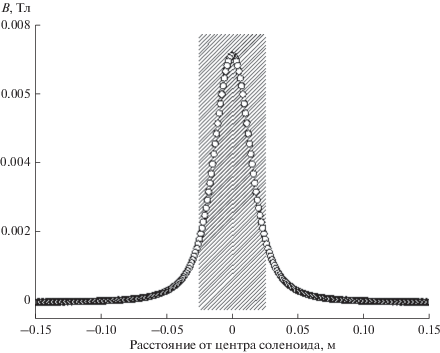
В качестве источника внешнего магнитного поля был взят соленоид со следующими характеристиками: длина соленоида L = 0.02 м; радиус R = 0.018 м; сила тока I = 0.469 А; число витков в катушке N = 500. Расчет величины проекции вектора магнитной индукции на осевую прямую, проходящую перпендикулярно через центр катушки соленоида, производили в программе MATLAB-2017 согласно формуле [21] (рис. 2). На основании расчетов была определена зависимость для индукции магнитного поля (рис. 3).
Таким образом, для проведения экспериментов в условиях воздействия магнитного поля центр катушки соленоида располагали на расстоянии 2.5 см от изолированного сердца.
Эффективность магнитоуправляемой доставки магнитных наночастиц оценивали по накоплению наночастиц в миокарде на момент окончания эксперимента, тогда как безопасность оценивали по изменению параметров функционирования изолированных сердец в ответ на введение МНЧ.
Исследование влияния магнитных наночастиц на сократительную функцию изолированного сердца
Параметры сократительной функции изолированных сердец регистрировали в изоволюмическом режиме с помощью введенного в полость левого желудочка латексного баллончика, соединенного с датчиком давления, встроенного в аппарат для физиологических исследований PhysExp. Баллончик заполняли дистиллированной водой, объем которой был достаточен для создания конечного-диастолического давления в левом желудочке на уровне 10 мм рт. ст. на этапе адаптации. Оценку сердечной деятельности проводили регистрацией кривой внутрижелудочкового давления. Дальнейший расчет параметров функционирования миокарда осуществляли с помощью программы PhysExp (Россия).
Влияние введения исследуемых видов магнитных наночастиц на состояние миокарда оценивали по следующим оценочным критериям:
• КП – количество перфузата, протекающего через коронарные сосуды изолированного сердца в единицу времени (мл/мин).
Регистрация коронарного протока производилась на момент окончания адаптации и на этапе окончания эксперимента.
• Сократительная функция миокарда – систолическое давление (СД, мм рт. ст.), конечное диастолическое давление (КДД, мм рт. ст.), давление, развиваемое левым желудочком (ДРЛЖ, мм рт. ст.) (вычисляли как разницу между систолическим и диастолическим давлениями), частота сердечных сокращений (ЧСС, уд/мин), интенсивность сократительной функции левого желудочка (характеризовали произведением ДРЛЖ на ЧСС, мм Hg/мин).
Регистрация сократительной функции миокарда производилась при помощи латексного баллончика, введенного в полость левого желудочка и соединенного с аппаратом PhysExp на этапах адаптации, окончания введения исследуемых агентов и на момент окончания эксперимента.
За критический уровень снижения параметров функционирования миокарда принимали: коронарный проток менее 6 мл/мин, ДРЛЖ менее 70 мм рт. ст.
Критерии исключения изолированных сердец из исследования:
1. Технические ошибки (неправильные катетеризация изолированного сердца или введение баллончика).
2. Коронарный проток менее 7 и более 15 мл/мин (на момент окончания адаптации).
3. Нарушения ритма сердечного сокращения (на этапе адаптации).
4. ДРЛЖ менее 80 мм рт. ст. (на момент окончания адаптации).
5.Отрицательная динамика показателей в течение 20-минутного стабилизационного периода (ДРЛЖ, КДД, ЧСС, интенсивность коронарного протока).
Оценка накопления наночастиц в миокарде
После окончания эксперимента сердца подвергались заморозке (–80°С) с последующей лиофилизацией при –50°С в VaCo 2ZiRBUS technology MITSUBISHI GOT1000 (Германия) и минерализацией для аналитического исследования накопления магнитных наночастиц в миокарде.
Определение массовой концентрации общего железа осуществляли фотометрическим методом (спектрофотометр 2802S UV/vis UNICO). Метод основан на образовании сульфосалициловой кислотой или ее натриевой солью с солями железа окрашенных комплексных соединений, причем, в слабокислой среде сульфосалициловая кислота реагирует только с солями железа (3+) (красное окрашивание), а в слабощелочной среде – с солями железа (2+) и (3+) (желтое окрашивание).
Светопоглощение окрашенных комплексных соединений железа измеряли при длине волны λ = 425–430 нм.
Предварительную калибровку проводили по навеске карбонильного железа, растворенного в смеси соляной и азотной кислот в соотношении 1 : 1. Концентрация сульфосалициловой кислоты составляла 20% от общей массы. Раствор аммиака доливали исходя из соотношения 1 : 1. Приготовленный из навески раствор (1000 мл) отбирали пипеткой (аликвотами 1, 0.8, 0.6, 0.4, 0.2 мл) в колбы по 100 мл. Затем добавляли 10 мл раствора сульфосалициловой кислоты и раствор аммиака до появления желтой окраски + избыток (всего 25 мл). Через 20 мин измеряли светопоглощение растворов. Затем приготовление растворов повторялось.
Сердца взвешивали на аналитических весах (Ohaus DV114C). Минерализация сердец проводилась в смеси равных частей концентрированной азотной кислоты и дистиллированной воды (всего 50 мл) в колбонагревателе при температуре кипения в течение 1–1.5 ч. Далее раствор охлаждали, объем доводили до 100 мл, отбирали пробу 2 мл и по методу, описанному выше, определяли общее содержание железа. Определение проводили в троекратном повторе. Полученные результаты представляли в мг/г сухой массы органа.
Статистическая обработка результатов
Проверку гипотезы о равенстве средневыборочных величин в нескольких зависимых выборках проводили методами дисперсионного анализа для повторных измерений, значения в группах – методами непараметрической статистики, указывали медиану, 25-й и 75-й процентили [Ме (25–75%)]. Проверку гипотезы о равенстве средневыборочных величин в независимых выборках проводили с использованием критерия Манна–Уитни. Статистически значимыми считали различия при уровне значимости р < 0.05. Вычисления производили по программе Statistica 10.0. Данные представлены как Ме (25–75%).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Изучение эффективности магнитоуправляемой доставки на модели изолированного сердца крысы по накоплению магнитных наночастиц
Количественный уровень железа в изолированных сердцах исследуемых групп, накопленного в ходе введения МНЧ, представлен на (рис. 4).
Рис. 4.
Содержание железа в изолированных сердцах экспериментальных групп по отношению к сухой массе органа. * – p < 0.05 относительно контроля.

В группах с введением наночастиц магнетита (МНЧ1-М и МНЧ1-БМ) содержание железа в ткани сердца относительно контроля увеличилось на 30% как в условиях включенного внешнего магнитного поля, так и при его отсутствии (p < 0.05). При введении композитных наночастиц (МНЧ2-БМ и МНЧ2-М) содержание железа в ткани сердца относительно контроля увеличилось на 40% (р < 0.05) независимо от наличия/отсутствия внешнего магнитного поля.
Таким образом, наночастицы магнетита и композитные наночастицы магнетита–кремнезема в равной степени накапливаются в миокарде вне зависимости от наличия/отсутствия внешнего магнитного поля.
Исследование влияния магнитных наночастиц на параметры функционирования миокарда
Исследуемые функциональные параметры изолированных сердец на фоне введения магнитных наночастиц в условиях наличия/отсутствия магнитного поля отражены на рис. 5–8 .
Рис. 5.
Параметры функционального состояния сократительной функции миокарда. * – p < 0.05 относительно исходного уровня; **– p < 0.05 относительно контроля. А – Коронарный проток изолированных сердец на момент окончания эксперимента (35-я минута). Б – Динамика СД изолированных сердец после введения МНЧ. В – Динамика КДД изолированных сердец после введения МНЧ. Г – Давление, развиваемое левым желудочком изолированных сердец после введения МНЧ. Д – Интенсивность сократительной функции миокарда в условиях введения МНЧ.
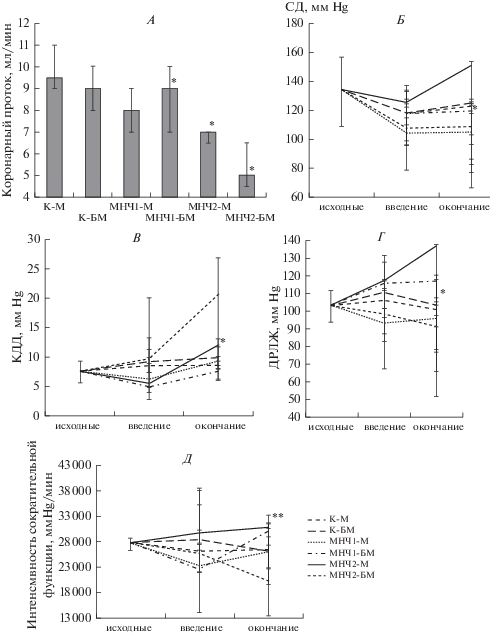
Исходные показатели были близки по значениям (p > 0.05) во всех исследуемых группах и составили: КП 10.8 (8.5; 12.0) мл/мин, СД 134.5 (109.0; 157.0) мм рт. ст., КДД 8.5 (7.6; 9.3) мм рт. ст., ДРЛЖ – 103.3 (93.7; 111.5) мм рт. ст.
В группе контроля (К-БМ) параметры функционирования миокарда оставались постоянными в ходе всего эксперимента (p > 0.05 относительно исходных значений). На момент окончания эксперимента в данной группе можно отметить: снижение КП на 17.0%, снижение СД на 7.5%, увеличение КДД на 16.4%, ДРЛЖ осталось на прежнем уровне.
Магнитное поле подключенного соленоида не обеспечивало снижения сократительной активности миокарда в группе контроля (К-М). На всех этапах эксперимента в данной группе значения параметров сократительной функции оставались на уровне исходных значений (p > 0.05), и на момент окончания эксперимента (35-я минута) были зафиксированы изменения: снижение КП на 12%, снижение СД на 18.6%, увеличение КДД на 1.1% и снижение ДРЛЖ на 2.2%.
В группе МНЧ1-БМ (введение наночастиц магнетита при отсутствии внешнего магнитного поля) на 35-й минуте эксперимента были зафиксированы следующие изменения параметров функционирования миокарда: снижение КП на 17%, снижение СД на 11.2% и увеличение ДРЛЖ на 13.5%.
На фоне введения МНЧ1 под воздействием магнитного поля (МНЧ1-М) на всем протяжении эксперимента параметры функционирования миокарда не изменялись и не отличались от таковых у контрольных групп(p > 0.05).
С учетом того, что наночастицы магнетита являются модельной системой с незащищенной поверхностью, которые в естественных условиях склонны к образованию крупных агрегатов, можно предположить, что их агрегация могла приводить к закупорке сосудов и, как следствие, вести к снижению сократительной функции. Данный вывод согласуется с результатами, представленными авторами в работе [11], где с помощью метода динамического рассеяния света показано, что МНЧ2 обладают большей агрегативной устойчивостью, чем МНЧ1. В то же время, при включении внешнего магнитного поля снижается способность к агломерации МНЧ1, что обеспечивает полную сохранность параметров сердечной функции (относительно исходных значений).
Введение наночастиц магнетита–кремнезема (МНЧ2-БМ) при отсутствии внешнего магнитного поля не приводило к изменению сократительной функции миокарда. Параметры функционирования миокарда в данной группе на всех этапах эксперимента, оставаясь на исходном уровне, не отличались от аналогичных показателей в группах с введением МНЧ1 (МНЧ1-М, МНЧ1-БМ), (p > 0.05).
При введении композитных наночастиц под воздействием магнитного поля (МНЧ2-М) к концу эксперимента были зафиксированы следующие изменения: снижение КП на 35.2%, увеличение СД на 11.7%, увеличение КДД на 41.1%, а ДРЛЖ на 13.5% относительно исходного уровня (p < 0.05).
Таким образом, введение наночастиц магнетита и композитных наночастиц магнетита–кремнезема в различных условиях (наличие/отсутствие магнитного поля) обусловливает разнонаправленное влияние на параметры сократительной активности миокарда.
Введение наночастиц магнетита в режиме отсутствия внешнего магнитного поля (МНЧ1-БМ) обусловливает незначительное изменение сократительной активности миокарда, о чем свидетельствует уровень коронарного протока и систолическое давление изолированных сердец на завершающем этапе эксперимента. В то же время, введение композитных наночастиц в аналогичных условиях не способствует снижению сократительной активности изолированных сердец. При введении композитных наночастиц в изолированные сердца в условиях воздействия магнитного поля (МНЧ2-М) отмечается снижение параметров функционирования миокарда. Описанное снижение сократительной активности сердец при введении МНЧ2-М не носило критического характера – параметры функционирования миокарда КП сохранялись на уровне, превышающем критические значения (КП – 6 мл/мин, СД – 70 мм рт. ст.).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В ходе настоящей работы была изучена эффективность и безопасность магнитоуправляемой доставки магнитных наночастиц, синтезированных различными способами, на модели изолированного сердца крысы. Было установлено, что введение наночастиц обоих видов как в условиях пассивного, так и активного транспорта, вызывало их накопление в миокарде в равной степени (о чем свидетельствует уровень железа в миокарде на момент окончании эксперимента, превышающий контрольные значения). Известно, что ключевыми факторами, определяющими возможность захвата и удержания магнитной силой МНЧ, являются параметры самих магнитных наночастиц, величины вектора магнитной индукции и градиента вектора магнитной индукции [22]. Отсутствие различий по накоплению МНЧ в миокарде может быть обусловлено недостаточным по силе воздействия влиянием магнитного поля соленоида, что не позволило обеспечить более эффективного удержания наночастиц в ткани в условиях его воздействия. Одним из способов решения данной проблемы может быть использование источников магнитного поля с величиной индукцией 200–700 мТл и градиентом в 8–100 Тл/м [23, 24]. В качестве источников внешнего магнитного поля могут быть использованы постоянные магниты NdFeB (системы постоянных магнитов) и электромагниты с подходящими характеристиками. Учитывая эффективность воздействия на магнитные наночастицы лишь на близком расстоянии от самого источника (несколько см), могут быть рассмотрены варианты имплантирования постоянных магнитов в целевую ткань.
В условиях острого (кратковременного) эксперимента вышеобозначенное накопление наночастиц в миокарде обеспечивало влияние на миокард, о чем свидетельствовали параметры сократительной активности сердец опытных групп. При этом данное влияние в зависимости от вида наночастиц и условий их введения носило разнонаправленный характер.
Так, введение наночастиц магнетита в режиме отсутствия внешнего магнитного поля вызывало незначительное снижение сократительной активности миокарда, о чем свидетельствовал уровень коронарного протока и систолическое давление изолированных сердец на этапе окончания эксперимента. Общеизвестно, что выработка свободных радикалов является классическим механизмом, лежащим в основе токсического действия всех наночастиц. В связи с данным фактом можно было бы предполагать, что одной из вероятных причин снижения параметров функционирования миокарда может являться катализ наночастицами активных форм кислорода, что, в свою очередь, может обеспечивать токсический эффект в виде описанной динамики функционирования миокарда. Однако ранее авторами был проведен ряд исследований, в которых было изучено влияние используемых в настоящей работе наночастиц на выработку свободных радикалов [25], в ходе которых было установлено, что наночастицы в установленном диапазоне доз (0.2–2 мг/мл) обеспечивают снижение образования свободных радикалов. Данный факт, а также условия эксперимента (при замене цельной крови на перфузионный раствор) позволяет не учитывать вероятность вышеописанного варианта развития событий. Между тем, описанный эффект наночастиц может быть полезен при их использовании в качестве средства адресной доставки кардиопротективных препаратов к ишемизированному и реперфузируемому миокарду с учетом значимой роли в ишемически-реперфузионном повреждении оксидативного стресса. В связи с вышесказанным можно предположить, что снижение параметров функционирования миокарда изолированных сердец на этапе окончания эксперимента обусловлены способностью наночастиц магнетита к агрегации в отсутствие магнитного поля из-за их незащищенной поверхности. Согласно собственным неопубликованным данным, формирующиеся агрегаты могут достигать размеров до нескольких микрометров и вследствие чего вести к закупорке сосудов.
В то же время, введение композитных наночастиц магнетита–кремнезема в аналогичных условиях не способствовало снижению сократительной активности изолированных сердец. Однако при введении данного вида наночастиц в изолированные сердца в условиях воздействия магнитного поля отмечается снижение параметров функционирования миокарда. Вероятно, при отсутствии внешнего магнитного поля наночастицы магнетита–кремнезема, несмотря на больший размер (не менее 100 нм), более агрегативно устойчивы из-за свойств силикатной оболочки.
Следует отметить, что параметры сократительной активности изолированных сердец на фоне введения композитных наночастиц магнетита–кремнезема оставались на уровне, превышающем критические значения, что определяет потенциальную возможность использования данных наночастиц в качестве средства адресной доставки лекарств в область миокарда.
Список литературы
World Health Organization. 2016.
Jain A., Elgendy I.Y., Al-Ani M., Agarwal N., Pepine C.J. Advancements in pharmacotherapy for angina. Expert Opinion on Pharmacotherapy. 18(5): 457–469. 2017.
de Toledo, Lucas de Alcantara Sica, Helen Cassia Rosseto,Marcos Luciano Bruschi. Iron oxide magnetic nanoparticles as antimicrobials for therapeutics. Pharmac.Development and Technol. 23(4): 316–323. 2018.
Ge J., Zhang Y., Dong Z., Jia J., Zhu J., Miao, X., Yan B. Initiation of targeted nano-drug delivery in vivo by a multifunctional magnetic implant. ACS Applied Materials & Interfaces. 9(24): 20771–20778 2017.
Qiu L., Zhu M., Gong K., Peng H., Ge L., Zhao L., Chen J. pH-triggered degradable polymeric micelles for targeted anti-tumor drug delivery. Materials Science and Engineering. 78: 912–922. 2017.
Liu D.F., Qian C., An Y.L., Chang D., Ju S.H.,Teng G.J. Magnetic resonance imaging of post-ischemic blood–brain barrier damage with PEGylated iron oxide nanoparticles. Nanoscale. 6(24): 15161–15167. 2014.
Lopez-Viota M., El-Hammadi M.M., Cabeza L., Prados J., Melguizo C., Martinez M.A.R., Delgado A.V. Development and characterization of magnetite/poly (butylcyanoacrylate) nanoparticles for magnetic targeted delivery of cancer drugs. AAPS PharmSciTech. 18(8): 3042–3052. 2017.
Michele K. Lima-Tenorio, Edgardo A. Gomez Pineda, Nasir M. Ahmad, Hatem Fessi, Abdelhamid Elaissari. Magnetic nanoparticles: In vivo cancer diagnosis and therapy. International J. Pharmac. 493: 313–327. 2015.
Gerben A. Koning, Gerard C. Krijger. Targeted multifunctional lipid-based nanocarriers for image-guided drug delivery. Anti-Cancer Agents in Medicinal Chemistry. 7: 425–440. 2007.
Gupta A.K., Naregalkar R.R., Vaidya V.D. Gupta M. Recent advances on surface engineering of magnetic iron oxide nanoparticles and their biomedical applications. Nanomedicine. 2(1): 23–39. 2007.
Королёв Д.В., Захарова Е.В., Евреинова Н.В., Торопова Я.Г., Печникова Н.А., Сергиенко Е.С., Гареев К.Г. Динамика естественного биораспределения магнитных наночастиц, полученных различными способами, при их однократном введении крысам стока Wistar. Трансляционная медицина.3(4): 56–65. 2016. [Korolev D.V., Zakharova E.V., Evreinove N.V., Toropova Y.G., Pechnikova N.A., Sergienko E.S., Gareev K.G.The Dynamics of the natural biodistribution of magnetic nanoparticles synthesized in various ways, when a single infusion to Wistar rats. Translat. Med. 3(4): 56–65. 2016. (In Russ.)].
Кириленко А.В., Чехун В.Ф., Подольцев А.Д., Кондратенко И.П., Кучерявая И.Н., Бондар В.В., Тодор И.Н. Анализ силового воздействия высокоградиентного магнитного поля на магнитные наночастицы в потоке жидкости. Биофизика. Докл. Нац. акад. наук Украины. 9: 162–172. 2010 [Kirilenko A.V., Chekchun V.F., Podolcev A.D., Kondratenko I.P., Kucheryavaya I.N., Bondar V.V., Todor I. N. Analysis of the force action of a high-gradient magnetic field on magnetic nanoparticles in a fluid flow. Biophysics. Reports Nat. Acad. Sci. of Ukraine. 9: 162–172. 2010. (In Russ.)].
Кириленко А.В., Чехун В.Ф., Подольцев А.Д., Кондратенко И.П., Кучерявая И.Н., Бондар В.В. Движение магнитных наночастиц в потоке жидкости при наложении постоянного магнитного поля. Биофизика. Докл. Нац. акад. наук Украины. 2: 186–196. 2012. (Kirilenko A.V., Chekchun V.F., Podolcev A.D., Kondratenko I.P., Kucheryavaya I.N., Bondar V.V. The motion of magnetic nanoparticles in the fluid flow by applying a constant magnetic field. Biophysics. Reports Nat. Acad. Sci. of Ukraine. 2: 186–196. 2012. (In Russ.)].
Fernandez-Pacheco R., Marquina C., Valdivia J.G., Gutierrez M., Romero M.S., Cornudella R., Jalon J.A.G. Magnetic nanoparticles for local drug delivery using magnetic implants. J. Magnetism and Magnetic Materials. 311: 318–322. 2007.
Furlani E.P., Ng K.C. Analytical model of magnetic nanoparticle transport and capture in the microvasculature. Physical Rev. 73(6): 061919. 2006.
Maciej Zborowski, Chan Bor. Fuh, Ralph. Green, Liping. Sun, Jeffrey J. Chalmers. Anal. Chem. 67(20): 3702–3712. 1995.
Alexiou C., Diehl D., Henninger P., Iro H., Rockelein R., Schmidt W., Weber H. A high field gradient magnet for magnetic drug targeting. Transactions Appl. Superconduct. 16(2): 1527–1530. 2006.
Долгополов М. А., Копытин И. В. Моделирование магнитной доставки микрочастиц в биосреду методом имплантации источников магнитного поля. Вестник Воронежского гос. универ. Серия: Физика. Математика. 2: 61–71. 2013. [Dolgopolov M.A., Kopytin I.V. Modeling of magnetic delivery of particles in the biological environment method of implantation of the sources of the magnetic field. Bull. Voronezh state Univer. Series: Physics. Mathematics. 2: 61–71. 2013. (In Russ.)].
Toropova Y.G., Golovkin A.S., Malashicheva A.B., Korolev D.V., Gorshkov A.N., Gareev K.G., Afonin M.V., Galagudza M.M. In vitro toxicity of FemOn, FemOn-SiO2 composite, and SiO2-FemOn core-shell magnetic nanoparticles. Int. J. Nanomedicine. 12: 593–603. 2017.
Королёв Д.В., Усков И.С., Сонин Д.Л., Григорова Ю.Н., Галагудза М.М., Постнов В.Н., Наумышева Е.Б. Исследование острой токсичности, биораспределения и биоэлиминации наночастиц органокремнезема. Биотехносфера. 1(25): 21–24. 2013. [Korolev D.V., Uskov I.S., Sonin D.L., Grigorova, Yu. N., Galagudza M.M., Postnov V.N., Naumychev E.B. a Study of acute toxicity, biodistribution and bioelimination nanoparticles organogenesis. Biotechnosphere. 1(25): 21–24. 2013. (In Russ.)].
Киселёв Д.Ф., Жукарев А.С., Иванов С.А., Киров С.А., Лукашева Е.В. Электричество и магнетизм. Методика решения задач. Учебное пособие. Физический факультет МГУ. 2010.[ Kiselev D.F., Gubarev A.S., Ivanov S.A., Kirov S.A., Lukasheva E.V. Electrichestvo I magnetism. Metodika Resheniya zadach. Fisicheskiy fakultet MGU. [Electricity and magnetism. Methods of solving problems. Textbook. Physical faculty of Moscow state Univer.] 2010].
Dobson J. Magnetic nanoparticles for drug delivery. Drug Development Res. 67: 55–60. 2006.
Vaněček V., Zablotskii V., Forostyak S., Růřička J., Herynek V., Babič M., Sykova E. Highly efficient magnetic targeting of mesenchymal stem cells in spinal cord injury. Internat. J. Nanomed. 7: 3719. 2012.
Voltairas P.A., Fotiadis D.I., Michalis L.K. Hydrodynamics of magnetic drug targeting. Biomech. 35: 813–821. 2002.
Торопова Я.Г., Печникова Н.А., Зелинская И.А., Королев Д.В., Гареев К.Г., Маркитантова А.С., Богушевская В.Д., Поволоцкая А.В., Маньшина А.А. Изучение гемосовместимости магнитных наночастиц магнетита и композитных частиц магнетита–кремнезема. Бюлл. сибирской медицины. 17 (№ 3): 157–167. 2018. [Toropova Y.G., Pechnikova N.A., Zelinskaya A.I., Korolev D.V., Gareev K.G., Markitantov A.S., Bogushevskaya V.D., Povolotskaya A.V., Manshina A.A. Study of hemocompatibility magnetic nanoparticles of magnetite and composite particles of magnetite–silica. Bull. Siberian medicine. 17 (3): 157–167. 2018. (In Russ.)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова