Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 4, стр. 481-491
Орексин-А и его рецепторы в гипоталамусе мышей с диета-индуцированным и меланокортиновым ожирением
И. Ю. Морина 1, Е. В. Михайлова 1, И. В. Романова 1, *, К. В. Деркач 1, А. О. Шпаков 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова, РАН
Санкт-Петербург, Россия
* E-mail: irinaromanova@mail.ru
Поступила в редакцию 29.11.2018
После доработки 16.01.2019
Принята к публикации 22.01.2019
Аннотация
Одним из регуляторов пищевого поведения и энергетического баланса является орексин-А. Этот пептид в мозге образуется в нейронах перифорникальной области гипоталамуса из препро-орексина, а его действие реализуется через два типа орексиновых рецепторов (OX1R, OX2R). В условиях диета-индуцированного ожирения (ДИО) активность гипоталамической орексиновой системы меняется, но данные об уровне орексина-А и экспрессии OX1R и OX2R немногочисленны и противоречивы. В случае меланокортинового ожирения такие данные отсутствуют. Цель работы состояла в исследовании орексиновой системы гипоталамуса у мышей с различными формами ожирения: на фоне развития ДИО, индуцированного высококалорийной диетой (8 и 16 нед.) у мышей C57Bl/6J и у мышей Agouti yellow (генотип Ay/a), генетически предрасположенных к меланокортиновому ожирению. Уровень орексина-А в нейронах гипоталамуса оценивали на срезах мозга с помощью иммуногистохимии, а экспрессию генов pOx, Ox1r и Ox2r исследовали методом количественной ПЦР. У ДИО-мышей уровень орексина-А и экспрессия генов pOx и Ox1r менялись в зависимости от продолжительности диеты – через 8 нед. повышались и через 16 нед. возвращались к контрольным значениям. При этом экспрессия гена Ox2r не менялась. У агути-мышей выявлено снижение уровня иммунопозитивного орексина-А в нейронах, но экспрессия генов pOx, Ox1r и Ox2r существенно не менялась. Полученные данные свидетельствуют о том, что уменьшение уровня орексина-А в условиях длительного, сильно выраженного ожирения может быть проявлением компенсаторной реакции, направленной на уменьшение потребления калорий, а орексиновая система гипоталамуса может рассматриваться как одна из мишеней для коррекции и предотвращения разных форм ожирения.
Одной из важнейших функций гипоталамуса является регуляция пищевого поведения и энергетического баланса. Ключевую роль в этом играют вырабатываемые гипоталамическими нейронами орексигенные и анорексигенные факторы, регулирующие аппетит, и контролируемые ими сигнальные каскады [1]. К анорексигенным факторам относят меланокортиновые пептиды, которые образуются вследствие сайт-специфичного протеолиза про-опиомеланокортина (ПОМК) в ПОМК-экспрессирующих нейронах аркуатных ядер гипоталамуса [2]. Семейство орексигенных факторов включает орексины-А и -B, продуцируемые нейронами латерального гипоталамуса, а также агути-подобный пептид (АПП) и нейропептид Y (НПY), секретируемые АПП/НПY-экспрессирующими нейронами аркуатных ядер [3–6]. Нарушение экспрессии факторов, регулирующих пищевое поведение, а также изменение активности их рецепторов рассматриваются как одни из первопричин ожирения и других метаболических расстройств.
В последние годы большое внимание уделяют функционированию гипоталамической орексиновой системы и ее роли в развитии метаболических, эндокринных и неврологических расстройств [7]. Еще в 1999 г. было установлено, что интрацеребровентрикулярное введение орексина-А приводит к сильно выраженной гиперфагии [8]. В дальнейшем было показано, что орексин и его сигнальные каскады в гипоталамических нейронах участвуют в регуляции системы подкрепления и вознаграждения [9], гомеостаза глюкозы и энергетического обмена [10]. Активаторами орексиновой сигнализации являются орексины-А и -В, которые являются продуктами посттрансляционного процессинга молекулы препро-орексина и состоят из 33 и 28 аминокислотных остатков соответственно. Орексин-А с одинаковой аффинностью связывается с орексиновыми рецепторами 1-го и 2-го типов (OX1R, OX2R), в то время как орексин-В активирует только OX2R [11]. Орексин-А является одним из ключевых регуляторов пищевого поведения и энергетического обмена. Однако данные об экспрессии орексина-А и орексиновых рецепторов в гипоталамусе при ожирении, в частности, индуцированного диетой (ДИО), в литературе немногочисленны и противоречивы [12–14], а при генетически обусловленном меланокортиновом ожирении отсутствуют. Цель исследования состояла в сравнительном изучении уровня орексина-А и экспрессии генов препро-орексина и орексиновых рецепторов OX1R и OX2R в гипоталамусе мышей с ДИО, вызванным высококалорийной диетой, и аг-ути-мышей с генетически обусловленным меланокортиновым ожирением.
МЕТОДЫ ИССЛЕДОВАНИЯ
Для экспериментов были взяты четырехмесячные самки мышей С57Bl/6J (a/a), которых получали из питомника Рапполово (Ленинградская область, Россия), а также пятимесячные самки агути-мышей C57Bl/6J (Ay/a) с мутацией в локусе Agouti, вызывающей повышенную продукцию агути-сигнального пептида, антагониста меланокортиновых рецепторов. Мыши Ay/a в полуторамесячном возрасте были доставлены из вивария Института цитологии и генетики СО РАН (Новосибирск, Россия) и в течение 3.5 мес. адаптировались к условиям вивария ИЭФБ РАН. Все эксперименты проводили в полном соответствии с требованиями Этического комитета ИЭФБ РАН, European Communities Council Directive 1986 (2010/63/EEC) и правилами, изложенными в “Guide for the Care and Use of Laboratory Animals”. Манипуляции с животными проводили в одно и то же время суток.
Для исследования влияния ДИО на орексиновую систему, мыши С57Bl/6J (a/a) были разделены на три группы – контрольные мыши, которых содержали на стандартном сухом корме (группа К1, n = 9), ДИО-мыши, которые получали высококалорийную диету в течение 8 (группа ДИО8, n = 9) или 16 нед. (группа ДИО16, n = 9). Высококалорийная диета включала 30%-ный раствор сахарозы, который животным давали вместо питьевой воды, и стандартный сухой корм с добавлением свиного сала, которое содержит большое количество насыщенных жиров. Избыток насыщенных жиров приводит к нарушению метаболизма и при длительном применении приводит к развитию метаболических расстройств – метаболическом синдрому, стеатозу печени, сахарному диабету 2-го типа. Для агути-мышей (группа Ay/a, n = 10) контролем являлись самки мышей C57Bl/6J (a/a) (К2, n = 10) того же возраста (5 мес.), что и агути-мыши. Потребление пищи животными проводили в течение 5 дней (ежедневно), заканчивая измерения за неделю до окончания эксперимента.
Уровень глюкозы в крови определяли с помощью глюкометра “Life Scan Johnson & Johnson” (Дания) и тест-полосок “One Touch Ultra” (США). У мышей, анестезированных хлоралгидратом (400 мг/кг, в/б), в конце эксперимента из сердца забирали образцы крови для определения уровней инсулина и лептина. Концентрацию инсулина определяли с помощью набора “Mouse Insulin ELISA” (Mercodia AB, Швеция), концентрацию лептина – с помощью набора “ELISA Kit for Leptin” (Cloud-Clone Corp., США) [15].
Для иммуногистохимического анализа мышей анестезировали хлоралгидратом (400 мг/кг, в/б), транскардиально перфузировали 0.1 М фосфатным буфером (PB, рН 7.4) и затем раствором 4%-ного параформальдегида в 0.2 М PB. В дальнейшем мозг дофиксировали в течение ночи в том же фиксаторе при 4°С, после чего подвергали криопротекции в 30%-ном растворе сахарозы, растворенной в 0.02 М РВ с 0.9% NaCl, и замораживали с помощью изопентана при –42°С. Для исследования использовали фронтальные срезы мозга (16 мкм) из перифорникальной области гипоталамуса, монтированные на стеклах, как описано ранее [16]. На срезах мозга мышей проводили иммуногистохимическую реакцию с использованием первичных антител кролика к орексину-А (“Sigma”, США; разведение 1 : 1000), вторичных биотинилированных антител козы против кролика (“Vector Labs”, Великобритания; 1 : 300) и комплекса стрептавидина с пероксидазой хрена (“Sigma”, США; 1 : 1000). Визуализацию реакции проводили с помощью 0.05%-ного раствора 3,3'-диаминобензидина с перекисью водорода. Реакцию останавливали дистиллированной водой. После тщательной промывки и стандартной гистологической обработки срезы заключали под покровное стекло и высушивали. Изображения структур на препаратах мозга получали c помощью микроскопа Carl Zeiss Imager A1 (“Carl Zeiss”, Германия) со встроенной телевизионной камерой и программы Axio-Vision 4.8. Делали по 10–12 снимков перифорникальной области гипоталамуса мыши у каждого животного. С помощью программы Image J на каждом из снимков была определена оптическая плотность орексина-А в нейронах.
Для оценки экспрессии генов, кодирующих препро-орексин и рецепторы OX1R и OX2R, использовали количественную ПЦР в реальном времени. Тотальную РНК выделяли из гипоталамуса мышей, используя наборы “РИБО-золь-B” (Россия). Для проведения обратной транскрипции (ОТ) использовали 1 мкг РНК и набор “RevertAid H Minus First Strand cDNA Synthesis Kit” (“Thermo Fisher Scientific Inc.”, США). Амплификацию проводили в растворе (общий объем 25 мкл), который содержал 10 нг ОТ-продукта, 0.4 мкМ прямого и обратного праймеров и реакционную смесь qPCRmix-HS SYBR+LowROX (“Евроген”, Россия), согласно инструкции производителя. Амплификационный сигнал детектировали с помощью прибора “7500 Real-Time PCR System” (“Life Technologies, Thermo Fisher Scientific Inc.”, США) в 96-луночных планшетах. ПЦР в реальном времени проводили по стандартному протоколу (Applied BioSystems, США), как описано ранее [16].
Для изучения экспрессии генов, кодирующих препро-орексин и рецепторы OX1R и OX2R, использовали следующие праймеры: pOx (NM_010410) – CGCAGAGCTAGAGCCACATC (For) и GGGTGCTAAAGCGGTGGTAG (Rev), Ox1r (NM_198959) – CCGTCTACGCCTGCTTCAC (For) и AGGGTTGGCGGCACTGT (Rev), Ox2r (NM_198962) – GACAAGCTTGCAGCACTGA (For) и AAGCAGATGACCAGTTGCGA (Rev). В качестве референсных генов использовали ген Hprt1, кодирующий гипоксантин-гуанин фосфорибозилтрансферазу-1 (KR817915) (AGCCGACCGGTTCTGTCAT, For; GGTCATAACCTGGTTCATCATCAC, Rev) и 18S рибосомальную РНК (NR_003 278) (GGGAGCCTGAGAAACGGC, For; GGGTCGGGAGTGGGTAATTT, Rev). Количественный анализ относительного уровня мРНК проводили с помощью метода delta-delta Ct.
Статистический анализ метаболических и гормональных показателей и данных ПЦР проводили с помощью программного обеспечения “GraphPad Prism 7” (“GraphPad Software”, США). Оценку нормальности распределения данных проводили с использованием теста D’Agostino–Pearson. В случае нормального распределения (α = 0.05) различия между группами оценивали с помощью непарного t-теста и рассматривали, как статистически значимые, при p < 0.05. Метаболические и гормональные показатели представлены как M ± SD, данные ПЦР – как M ± SEM. Данные иммуногистохимического анализа обрабатывали с помощью однофакторного дисперсионного анализа (ANOVA) и последующего анализа межгрупповых различий по критерию Тьюки при уровне значимости p < 0.05, используя пакет программ STATISTICA.10. Данные представлены как медиана (Ме) 50% данных с интерквартильным размахом.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Масса тела и жировой ткани у С57Bl/6J (a/a) мышей, которые в течение 8 и 16 недель потребляли высококалорийную диету, а также у агути-мышей с МО были достоверны выше, чем у контрольных животных (табл. 1). У животных с ожирением были повышены уровни глюкозы, инсулина и лептина (р < 0.05) (табл. 1). Значения индекса инсулиновой резистентности, рассчитанные как произведение концентраций глюкозы и инсулина, в группах ДИО8, ДИО16 и Ay/a были на 96, 134 и 539% выше, чем в соответствующих контрольных группах, что указывает на значительное снижение чувствительности к инсулину в условиях ДИО и меланокортинового ожирения. Суточное потребление калорий в группе ДИО8 было достоверно выше, чем в группе К1, в группе ДИО16 оно снижалось до его значения в контроле, а в случае агути-мышей было достоверно ниже, чем в группе К2 (табл. 1).
Таблица 1.
Масса тела и жировой ткани, а также уровни глюкозы, инсулина и лептина у мышей с ожирением, индуцированным высококалорийной диетой продолжительностью 8 и 16 недель, и у агути-мышей с меланокортиновым ожирением
| К1 n = 9 |
ДИО8 n = 9 |
ДИО16 n = 9 |
К2 n = 10 |
Ay/a n = 10 |
|
|---|---|---|---|---|---|
| Масса тела, г | 22.2 ± 0.5 | 25.9 ± 0.8* | 27.4 ± 1.6* | 23.4 ± 1.8 | 37.9 ± 1.7* |
| Абдоминальный жир, г | 0.37 ± 0.04 | 0.65 ± 0.09* | 0.75 ± 0.17* | 0.49 ± 0.08 | 3.87 ± 0.29* |
| Потребление пищи, ккал/мышь/день | 10.1 ± 0.7 | 12.0 ± 0.6* | 9.6 ± 0.8# | 10.2 ± 0.8 | 9.4 ± 0.6* |
| Глюкоза, мМ | 5.1 ± 0.5 | 6.6 ± 0.5* | 6.9 ± 0.6* | 5.0 ± 0.4 | 9.4 ± 0.9* |
| Инсулин, нг/мл | 0.33 ± 0.05 | 0.50 ± 0.08* | 0.57 ± 0.13* | 0.35 ± 0.12 | 1.19 ± 0.24* |
| Лептин, нг/мл | 1.14 ± 0.33 | 2.31 ± 0.34* | 2.79 ± 0.49* | 1.26 ± 0.42 | 11.99 ± 1.65* |
Иммуногистохимическое исследование оптической плотности иммунопозитивного орексина-А в перифорникальной области гипоталамуса мышей показало, что у мышей группы ДИО8 (Ме = 0.87, 0.83–0.88) по сравнению с контрольной группой (Ме = 0.61, 0.58–0.65) оптическая плотность орексина-А повышалась на 40% (р < 0.05) (рис. 1). В то же время уровень оптической плотности орексина-А у мышей группы ДИО16 (Ме = 0.66, 0.62–0.73) был снижен по сравнению с мышами группы ДИО8 (р < 0.05) и приближался к его значениям в контрольной группе (рис. 1). Таким образом, иммуногистохимический анализ выявил повышение уровня орексина-А в перифорникальной области у мышей группы ДИО8 и его снижение до контрольного уровня в группе ДИО16 (F(3.48) = 37.58, р < 0.05).
Рис. 1.
Иммуномечение орексина-А в перифорникальной области гипоталамуса у мышей С57Bl/6J (a/a) с диета-индуцированным ожирением. А–В – иммуногистохимическая реакция у мышей в группах К1 (А), ДИО8 (Б) и ДИО16 (В), масштаб 100 мкм. Г – данные оптической плотности представлены как медиана с интерквартильным размахом, х – выскакивающие значения. Различия по отношению к группам К1 (*) и ДИО8 (#) статистически значимы при р < 0.05.

Показано, что экспрессия гена, кодирующего препро-орексин, в гипоталамусе мышей группы ДИО16 была достоверно снижена по сравнению с контролем и группой ДИО8 (рис. 2А). При этом 8-ми недельная жировая диета не влияла на экспрессию гена, кодирующего препро-орексин. При анализe экспрессии орексиновых рецепторов OX1R и OX2R в гипоталамусе мышей было установлено, что уровень экспрессии гена Ox1r в группе ДИО8 был повышен на 165% по сравнению с группой К1, а в группе ДИО16 – не отличался от контроля и был достоверно ниже, чем в группе ДИО8 (рис. 2А). Экспрессия гена Ox2r в обеих группах ДИО-мышей существенно не менялась (рис. 2А).
Рис. 2.
Экспрессия генов, кодирующих препро-орексин и орексиновые рецепторы OX1R и OX2R, в гипоталамусе ДИО-мышей (А) и агути мышей (Б) по сравнению с контрольной группой. Значения экспрессии мРНК (RQ, у. ед.) представлены как M ± SEM. Различия по отношению к группам К1 (*) и ДИО8 (#) статистически значимы при р < 0.05.
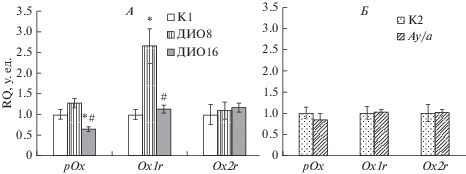
Анализ оптической плотности орексина-А у агути-мышей (Ме = 0.47, 0.41–0.55) показал ее снижение на 21% по сравнению с контрольными С57Bl/6J (a/a) мышами (Ме = 0.59, 0.55–0.62), (F(3.31) = 14.24, р < 0.05) (рис. 3). Экспрессия генов, кодирующих препро-орексин и орексиновые рецепторы в гипоталамусе агути-мышей достоверно не отличалась от соответствующего контроля (К2) (рис. 2Б). Полученные данные указывают на то, что в условиях генетически обусловленного меланокортинового ожирения в гипоталамусе агути-мышей снижается продукция орексина-А, в то время как экспрессия генов препро-орексина и орексиновых рецепторов меняется в небольшой степени.
Рис. 3.
Иммуномечение орексина-А в перифорникальной области гипоталамуса у контрольных и агути-мышей. А, Б – иммуногистохимическая реакция у контрольных (А) и агути-мышей (Б), стрелки указывают на тела нейронов с иммуноположительной реакцией к орексину-А, f – fornix; масштаб 100 мкм. В – данные оптической плотности представлены как медиана с интерквартильным размахом, х – выскакивающие значения. Различия между группами К2 и Ay/a (*) статистически значимы при р < 0.05.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные данные свидетельствуют о том, что у мышей, длительное время получавших высококалорийную диету или имеющих генетически обусловленное ингибирование меланокортинового сигналинга, развиваются ожирение, умеренно выраженная гипергликемия, гиперинсулинемия, инсулиновая резистентность, а также гиперлептинемия. Это хорошо согласуется как с результатами, полученными нами ранее, так и с данными других авторов. Так, имеются убедительные свидетельства того, что у мышей с ДИО нарушается толерантность к глюкозе, повышаются уровни инсулина и лептина, что ассоциировано с нарушением баланса орексигенных и анорексигенных влияний и значительными изменениями сигнальных каскадов в структурах гипоталамуса [16–18]. У агути-мышей с подавленной активностью гипоталамической меланокортиновой системы также нарушается энергетический обмен и отчетливо выражены признаки метаболического синдрома [16, 9–21 ]. При этом повышение уровня лептина в крови агути-мышей значительно превосходит таковое у ДИО-мышей, что может быть обусловлено накоплением у агути-мышей значительно большего количества жировой ткани, продуцирующей лептин [16].
Одним из важнейших факторов, контролирующих пищевое поведение, расход энергии, секрецию инсулина и глюкагона клетками поджелудочной железы является орексин-А и его сигнальные пути в гипоталамических нейронах [5, 22]. Вследствие этого, в условиях нарушения пищевого поведения и ожирения активность орексинергических нейронов, экспрессия основных компонентов орексиновой сигнальной системы, в первую очередь орексиновых рецепторов, может претерпевать существенные изменения [12–14]. Эти изменения зависят от природы и продолжительности действия факторов, вызывающих метаболические расстройства, а также от тяжести метаболических и гормональных нарушений [4, 5, 14]. Установлено, что у мышей, которые получали высококалорийную диету, а также имели инактивирующие мутации в гене, кодирующем лептин, у крыс, которых длительное время подвергали хроническому стрессу, а также у мышей со спонтанной гипертензией отмечали усиление орексиновой сигнализации в гипоталамических нейронах. Следствием гиперактивации орексинергических нейронов были гиперфагия, ожирение, а также быстрое развитие и прогрессирование гипертонической болезни [5]. Полученные нами данные по изменению содержания орексина-А и генной экспрессии препро-орексина и орексиновых рецепторов в гипоталамусе ДИО-мышей в значительной степени подтверждают эти данные, а также указывают на важную роль состава диеты и ее продолжительности.
Так, через 8 нед. высококалорийной диеты в нейронах перифорникальной области гипоталамуса повышался уровень иммунопозитивного орексина-А и в значительной степени в гипоталамусе возрастала экспрессия гена рецептора OX1R. В то же время через 16 нед. диеты эти показатели снижались до их контрольного уровня, а экспрессия гена pOX в гипоталамусе снижалась ниже ее уровня, как в контроле, так и в группе ДИО8. Эти изменения сопровождались снижением в группе ДИО16 потребляемых калорий, что при сохранении повышенной массы тела и жировой ткани свидетельствует о снижении расхода энергии в сравнении с группами К1 и ДИО8. Таким образом, если в группе ДИО8 отмечали изменения, свидетельствующие в пользу повышения активности орексиновой системы в гипоталамусе, что было ассоциировано с гиперфагией и развитием метаболических нарушений, то в группе ДИО16 активность этой системы нормализовалась. Это, как мы полагаем, может быть обусловлено запуском компенсаторных механизмов, которые вносят существенный вклад в снижение аппетита, и препятствуют нарастанию метаболических расстройств.
Повышение уровня орексина-А и экспрессии его основной мишени – рецептора OX1R в условиях избыточного потребления калорий на начальных стадиях ДИО может быть обусловлено двумя причинами. Во-первых, орексин-А наделен свойствами нейропротектора, предотвращающего апоптотические и воспалительные процессы в гипоталамических нейронах [23, 24]. В этой связи необходимо отметить, что в условиях гипергликемии, окислительного стресса и липотоксичности, характерных для ДИО, в гипоталамических нейронах активируются процессы, ведущие к стрессу эндоплазматического ретикулума и активации факторов апоптоза и воспаления [25]. Во-вторых, повышение активности орексиновой системы способствует усилению спонтанной двигательной активности и термогенеза, который не ассоциирован с физическими нагрузками [26, 27]. Вследствие этого повышение продукции орексина-А и экспрессии рецепторов OX1R способно обеспечивать более высокую интенсивность расхода энергии на начальных стадиях потребления высококалорийной диеты.
При повышении продолжительности диеты до 16 нед. по мере усиления метаболических нарушений возникает необходимость уменьшить потребление высококалорийной пищи, в связи с чем и происходит снижение содержания орексина-А в нейронах перифорникальной области гипоталамуса и генной экспрессии основных компонентов орексиновой системы в гипоталамусе мышей группы ДИО16 (препро-орексина и рецептора OX1R). Результатом этого является нормализация потребления калорий. Необходимо отметить, что экспрессия рецептора OX2R, который обладает сходной с OX1R аффинностью к орексину-А, при обоих сроках ДИО не менялась. Причиной этого, как можно полагать, является то, что рецепторы OX2R вовлечены в регуляцию сна и болевой чувствительности и слабо влияют на пищевое поведение и энергетический обмен [28, 29].
Наряду с продолжительностью диеты, функциональное состояние орексиновой системы определяется ее составом. Диета с высоким содержанием насыщенных жиров приводит к более выраженным метаболическим расстройствам и в большей степени повреждает нейроны в сравнении с более сбалансированной высококалорийной диетой, сочетающей потребление легких углеводов и насыщенных жиров [30]. Показано, что мыши, длительное время потреблявшие диету с высоким содержанием насыщенных жиров, имеют сниженные уровни орексина-А в гипоталамусе [12, 13]. Так, при потреблении четырехмесячными самцами C57BL/6 мышей диеты, обогащенной насыщенными жирами, в течение 10 или 17 нед. отмечали снижение в среднем на 40% экспрессии гена pOx в гипоталамусе животных [12]. В другой работе изучали влияние обогащенной жирами диеты на орексиновую систему у молодых четырехнедельных, самцов C57BL/6 мышей, причем продолжительность диеты составила 8 недель, что совпадает с продолжительностью высококалорийной диеты для исследованной нами группы ДИО8. Авторы обнаружили небольшое снижение (на 13%) уровня орексина-А в гипоталамусе мышей [13]. Как мы полагаем, при использовании высококалорийной диеты для индукции ДИО скорость “переключения” компенсаторных реакций, в которые вовлечена орексиновая система, ниже, чем при использовании высокожировой диеты, что и является причиной обнаруженного нами усиления продукции орексина-А и его рецептора OX1R на ранних стадиях ожирения у мышей группы ДИО8.
В случае агути-мышей с меланокортиновым ожирением нами выявлены снижение на 21% уровня орексина-А в нейронах перифорникальной области гипоталамуса (р < 0.05) и тенденция к снижению экспрессии гена pOx. Эти данные в целом согласуются с недавними результатами других авторов о снижении иммунореактивности к орексину-А в латеральном гипоталамусе db/db-мышей с инактивирующей мутацией в гене лептинового рецептора [14]. Интересен и тот факт, что те же авторы не выявили изменений в латеральном гипоталамусе ДИО-мышей, получавших высокожировую диету [14]. По спектру метаболических нарушений и дисфункций в гипоталамических сигнальных системах, в первую очередь в меланокортиновой, db/db-мыши имеют значительное сходство с агути-мышами, что может указывать на роль ослабления лептиновой сигнализации в развитии изменений экспрессии компонентов орексиновой системы и ее функциональной активности при генетически-обусловленном меланокортиновом ожирении.
Таким образом, нами впервые установлено, что у мышей, находящихся на высококалорийной диете, уровень орексина-А в нейронах перифорникальной области гипоталамуса и экспрессия генов препро-орексина и орексинового рецептора OX1R в гипоталамусе меняются в зависимости от выраженности метаболических нарушений, вызванных обогащенной насыщенными жирами диетой различной продолжительности. Через 8 нед. потребления мышами диеты с высоким содержанием насыщенных жиров они повышаются, через 16 нед. возвращаются к контрольным значениям. У агути-мышей с генетически обусловленным меланокортиновом ожирением отмечается снижение уровня иммунопозитивного орексина-А в нейронах перифорникальной области гипоталамуса. Это можно рассматривать как один из компонентов компенсаторной реакции, развивающейся в условиях длительного, сильно выраженного ожирения и направленной на уменьшение потребления калорий агути-мышами. Полученные данные свидетельствуют о том, что орексиновая система гипоталамуса при ДИО и МО является одной из мишеней для коррекции и предотвращения этих метаболических расстройств.
Список литературы
Ferrario C.R., Labouèbe G., Liu S., Nieh E.H., Routh V.H., Xu S., O’Connor E.C. Homeostasis meets motivation in the battle to control food intake. J. Neurosci. 36 (45): 11469–11481. 2016. https://doi.org/10.1523/JNEUROSCI.2338-16.2016
Rubinstein M., Low M.J. Molecular and functional genetics of the proopiomelanocortin gene, food intake regulation and obesity. FEBS Lett. 591(17): 2593–2606. 2017. https://doi.org/10.1002/1873-3468.12776
Shpakov A.O., Derkach K.V., Berstein L.M. Brain signaling systems in the Type 2 diabetes and metabolic syndrome: Promising target to treat and prevent these diseases. Future Sci. OA. 1(3): FSO25. 2015. https://doi.org/10.4155/fso.15.23
Chieffi S., Carotenuto M., Monda V., Valenzano A., Villano I., Precenzano F., Tafuri D., Salerno M., Filippi N., Nuccio F., Ruberto M., De Luca V., Cipolloni L., Cibelli G., Mollica M.P., Iacono D., Nigro E., Monda M., Messina G., Messina A. Orexin system: The key for a healthy life. Front. Physiol. 8: 357. 2017. https://doi.org/10.3389/fphys.2017.00357
Imperatore R., Palomba L., Cristino L. Role of orexin-A in hypertension and obesity. Curr. Hypertens. Rep. 19(4): 34. 2017. https://doi.org/10.1007/s11906-017-0729-y
Yi M., Li H., Wu Z., Yan J., Liu Q., Ou C., Chen M. A Promising therapeutic target for metabolic diseases: Neuropeptide Y receptors in humans. Cell. Physiol. Biochem. 45(1): 88–107. 2018. https://doi.org/10.1159/000486225
Wang C., Wang Q., Ji B., Pan Y., Xu C., Cheng B., Bai B., Chen J. The orexin/receptor system: Molecular mechanism and therapeutic potential for neurological diseases. Front. Mol. Neurosci. 11: 220. 2018. https://doi.org/10.3389/fnmol.2018.00220
Yamanaka A., Sakurai T., Katsumoto T., Yanagisawa M., Goto K. Chronic intracerebroventricular administration of orexin-A to rats increases food intake in daytime, but has no effect on body weight. Brain Res. 849(1–2): 248–252. 1999. https://doi.org/10.1016/s0006-8993(99)01905-8
Aston-Jones G., Smith R.J., Sartor G.C., Moorman D.E., Massi L., Tahsili-Fahadan P., Richardson K.A. Lateral hypothalamic orexin/hypocretin neurons: A role in reward-seeking and addiction. Brain Res. 1314: 74–90. 2010. https://doi.org/10.1016/j.brainres.2009.09.106
Tsuneki H., Wada T., Sasaoka T. Role of orexin in the central regulation of glucose and energy homeostasis. Endocr. J. 59(5): 365–374. 2012. https://doi.org/10.1507/endocrj.ej12-0030
Ammoun S., Holmqvist T., Shariatmadari R., Oonk H.B., Detheux M., Parmentier M., Akerman K.E., Kukkonen J.P. Distinct recognition of OX1 and OX2 receptors by orexin peptides. J. Pharmacol. Exp. Ther. 305(2): 507–514. 2003. https://doi.org/10.1124/jpet.102.048025
Tanno S., Terao A., Okamatsu-Ogura Y., Kimura K. Hypothalamic prepro-orexin mRNA level is inversely correlated to the non-rapid eye movement sleep level in high-fat diet-induced obese mice. Obes. Res. Clin. Pract. 7(4): e251–257. 2013. https://doi.org/10.1016/j.orcp.2013.01.005
Nobunaga M., Obukuro K., Kurauchi Y., Hisatsune A., Seki T., Tsutsui M., Katsuki H. High fat diet induces specific pathological changes in hypothalamic orexin neurons in mice. Neurochem. Int. 78: 61–66. 2014. https://doi.org/10.1016/j.neuint.2014.09.002
González J.A., Prehn J.H.M. Orexin-A/hypocretin-1 immunoreactivity in the lateral hypothalamus is reduced in genetically obese but not in diet-induced obese mice. Neuroscience. 369: 183–191. 2018. https://doi.org/10.1016/j.neuroscience.2017.11.009
Derkach K.V., Bogush I.V., Berstein L.M., Shpakov A.O. The influence of intranasal insulin on hypothalamic-pituitary-thyroid axis in normal and diabetic rats. Horm. Metab. Res. 47(12): 916–924. 2015. https://doi.org/10.1055/s-0035-1547236
Romanova I.V., Derkach K.V., Mikhrina A.L., Sukhov I.B., Mikhailova E.V., Shpakov A.O. The leptin, dopamine and serotonin receptors in hypothalamic POMC-neurons in normal and obese rodents. Neurochem. Res. 43(4): 821–837. 2018. https://doi.org/10.1007/s11064-018-2485-z
Sousa-Lima I., Park S.Y., Chung M., Jung H.J., Kang M.C., Gaspar J.M., Seo J.A., Macedo M.P., Park K.S., Mantzoros C., Lee S.H., Kim Y.B. Methylsulfonylmethane (MSM), an organosulfur compound, is effective against obesity-induced metabolic disorders in mice. Metabolism. 65(10): 1508–1521. 2016. https://doi.org/10.1016/j.metabol.2016.07.007
Yashiro H., Takagahara S., Tamura Y.O., Miyahisa I., Matsui J., Suzuki H., Ikeda S., Watanabe M. A novel selective inhibitor of delta-5 desaturase lowers insulin resistance and reduces body weight in diet-induced obese C57BL/6J mice. PLoS One. 11(11): e0166198. 2016. doi https://doi.org/10.1371/journal.pone.0166198
Бажан Н.М., Яковлева Т.В., Багинская Н.В., Шевченко А.Ю., Макарова Е.Н. Изменения углеводно-жирового обмена в ходе развития меланокортинового ожирения у мышей с мутацией Agouti yellow. Рос. физиол. журн. им. И.М. Сеченова. 91(12): 1445–1454. 2005. [Bazhan N.M., Iakovleva T.V., Baginskaia N.V., Shevchenko A.Y., Makarova E.N. Changes of lipid–carbohydrate metabolism during development of melanocortin obesity in the mice with the agouti yellow mutation. Ross. J. Physiol. 91(12): 1445–1453. 2005. (In Russ.)].
Makarova E.N., Chepeleva E.V., Panchenko P.E., Bazhan N.M. Influence of abnormally high leptin levels during pregnancy on metabolic phenotypes in progeny mice. Am. J. Physiol. Regul. Integr. Comp. Physiol. 305(11): R1268–R1280. 2013. https://doi.org/10.1152/ajpregu.00162.2013
Михайлова Е.В., Романова И.В., Деркач К.В., Бондарева В.М., Шпаков А.О. Количество и локализация серотониновых и дофаминовых рецепторов на гипоталамических проопиомеланокортин-иммунопозитивных нейронах мышей и их изменения при диета-индуцированном и меланокортиновом ожирении. Рос. физиол. журн. им. И.М. Сеченова. 104(6): 683–691. 2018. [Mikhailova E.V., Romanova I.V., Derkach K.V., Bondareva V.M., Shpakov A.O. The number and localization of the serotonin and dopamine receptors within the hypothalamic proopiomelanocortin-immunopositive neurons in mice and their changes in the diet-induced and melanocortin obesity. Ross. J. Physiol. 104(6): 683–691. 2018. doi 10.7868/S0869813918060114 (In Russ.)].https://doi.org/ doi 10.7868/S0869813918060114
Coborn J.E., DePorter D.P., Mavanji V., Sinton C.M., Kotz C.M., Billington C.J., Teske J.A. Role of orexin-A in the ventrolateral preoptic area on components of total energy expenditure. Int. J. Obes. (Lond). 41(8): 1256–1262. 2017. https://doi.org/10.1038/ijo.2017.92
Butterick T.A., Nixon J.P., Billington C.J., Kotz C.M. Orexin A decreases lipid peroxidation and apoptosis in a novel hypothalamic cell model. Neurosci. Lett. 524(1): 30–34. 2012. doi https://doi.org/10.1016/j.neulet.2012.07.002
Duffy C.M., Nixon J.P., Butterick T.A. Orexin A attenuates palmitic acid-induced hypothalamic cell death. Mol. Cell. Neurosci. 75: 93–100. 2016. https://doi.org/10.1016/j.mcn.2016.07.003
Marinho R., Munõz V.R., Pauli L.S.S., Ropelle E.C.C., de Moura L.P., Moraes J.C., Moura-Assis A., Cintra D.E., da Silva A.S.R., Ropelle E.R., Pauli J.R. Endurance training prevents inflammation and apoptosis in hypothalamic neurons of obese mice. J. Cell Physiol. 234(1): 880–890. 2018. https://doi.org/10.1002/jcp.26909
Butterick T.A., Billington C.J., Kotz C.M., Nixon J.P. Orexin: Pathways to obesity resistance? Rev. Endocr. Metab. Disord. 14(4): 357–64. 2013. https://doi.org/10.1007/s11154-013-9259-3
Perez-Leighton C.E., Boland K., Teske J.A., Billington C., Kotz C.M. Behavioral responses to orexin, orexin receptor gene expression, and spontaneous physical activity contribute to individual sensitivity to obesity. Am. J. Physiol. Endocrinol. Metab. 303(7): E865-E874. 2012. doi https://doi.org/10.1152/ajpendo.00119.2012
Jacobson L.H., Chen S., Mir S., Hoyer D. Orexin OX2 receptor antagonists as sleep aids. Curr. Top. Behav. Neurosci. 33: 105–136. 2017. https://doi.org/10.1007/7854_2016_47
Yazdi F., Jahangirvand M., Ezzatpanah S., Haghparast A. Role of orexin-2 receptors in the nucleus accumbens in antinociception induced by carbachol stimulation of the lateral hypothalamus in formalin test. Behav. Pharmacol. 27(5): 431–438. 2016. doi https://doi.org/10.1097/FBP.0000000000000216
Bray J.K., Chiu G.S., McNeil L.K., Moon M.L., Wall R., Towers A.E., Freund G.G. Switching from a high-fat cellulose diet to a high-fat pectin diet reverses certain obesity-related morbidities. Nutr. Metab. (Lond). 15: 55. 2018. https://doi.org/10.1186/s12986-018-0294-7
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


