Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 5, стр. 533-543
Профилактическое введение Hsp70 противодействует прогрессированию нейродегенерации в нигростриатной системе в модели болезни Паркинсона у крыс
К. В. Лапшина 1, *, И. В. Екимова 1, Ю. Ф. Пастухов 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: ksenia.lapshina@gmail.com
Поступила в редакцию 13.03.2019
После доработки 21.03.2019
Принята к публикации 21.03.2019
Аннотация
Болезнь Паркинсона (БП) является хроническим прогрессирующим нейродегенеративным заболеванием, которое до сих пор остается неизлечимым. В связи с этим огромное значение имеет разработка новых нейропротективных подходов, направленных на остановку и/или замедление нейродегенеративного процесса. Данные литературы свидетельствуют о том, что стресс-индуцибельный белок теплового шока 70 кДа (Hsp70) обладает терапевтическим потенциалом в отношении конформационных нейродегенеративных заболеваний. В проведенном исследовании изучено влияние профилактического введения Hsp70 в компактную часть черной субстанции (кчЧС) на развитие нейродегенеративного процесса в нигростриатной системе крыс в модели БП, созданной с помощью локальных микроинъекций ингибитора протеасом лактацистина в кчЧС. Данная модель воспроизводила основные признаки клинической стадии БП, вызывая гибель 61% дофаминергических нейронов в кчЧС и 65% аксонов в стриатуме, уменьшение содержания тирозингидроксилазы, везикулярного транспортера моноаминов 2 и шаперона Hsp70 в нейронах кчЧС, появление моторных симптомов (нарушения походки и тонкой моторики передних конечностей, рта и языка, развитие сенсомоторного дефицита). Впервые установлено, что профилактическое введение Hsp70 противодействовало развитию нейродегенеративного процесса в модели БП, способствуя уменьшению числа погибших дофаминергических нейронов в кчЧС (в 1.8 раза) и их аксонов в стриатуме (в 2.5 раза) по сравнению с действием лактацистина, восстановлению уровня тирозингидроксилазы и везикулярного транспортера моноаминов 2 в выживших нейронах кчЧС до контрольных значений, устранению изменений тонкой моторики и сенсомоторного дефицита и ослаблению нарушений походки. Полученные данные могут послужить обоснованием для разработки неинвазивных подходов (лечебных тепловых, мышечных нагрузок, технологий наномедицины и др.) для профилактического повышения содержания шаперонов в головном мозге с целью защиты от развития БП и других нейродегенеративных заболеваний.
Одним из наиболее распространенных нейродегенеративных заболеваний, по частоте встречаемости уступающим лишь болезни Альцгеймера, является болезнь Паркинсона (БП), затрагивающая не менее 1–2% населения земного шара старше 60 лет и 4–5% после 85 лет [1, 2]. Согласно прогнозам исследователей, увеличение продолжительности жизни в течение ближайших 20–25 лет будет сопровождаться 2-кратным увеличением числа пациентов, страдающих БП [3].
БП является хроническим прогрессирующим заболеванием, при котором нейродегенеративный процесс затрагивает различные отделы головного мозга и периферическую нервную систему, вызывая появление немоторных симптомов (депрессии, нарушений сна, ухудшения обоняния и др.), а также клинически значимых для диагностики БП двигательных нарушений – тремора покоя, постуральной неустойчивости, брадикинезии и мышечной ригидности [4–6]. Эти моторные симптомы развиваются в среднем через 10–30 лет после начала болезни, и их появление вызвано гибелью около 60–70% дофамин (ДА)-ергических нейронов в компактной части черной субстанции (кчЧС) среднего мозга и снижением содержания ДА в стриатуме на 70–80% [7]. Отсутствие нейронов-мишеней для терапии БП ставит это заболевание в ряд неизлечимых. На настоящий момент нет ни одного препарата, который бы мог замедлить или тем более остановить нейродегенеративный процесс, поэтому для облегчения имеющихся симптомов и улучшения качества жизни пациентов проводится симптоматическая терапия, а в некоторых случаях – нейрохирургическое лечение (глубокая стимуляция головного мозга).
В связи с этим огромное значение приобретают, во-первых, разработка методов доклинической диагностики, дающих возможность вовремя начать нейропротективные мероприятия, во-вторых – создание патогенетически обоснованной нейропротективной стратегии для остановки и/или замедления нейродегенеративного процесса. Решение этой задачи имеет большое значение не только для терапии БП, но и для принятия адресных профилактических мер, направленных на предотвращение болезни. БП является заболеванием преимущественно пожилых людей, поэтому в ряде лабораторий мира развернуты исследования, нацеленные на поиск препаратов, способных корректировать нарушения на молекулярном уровне при старении и нейродегенеративных заболеваниях [8–11]. Эти исследования тесно связаны с решением таких проблем, как преодоление гемато-энцефалического барьера, повышение биодоступности препаратов, уменьшение возможных побочных эффектов и вероятности повреждения самого действующего вещества.
Известно, что в патогенез БП вовлечен комплекс факторов, в частности – нарушение работы митохондрий и убиквитин-протеасомной системы, окислительный стресс, нейровоспаление [12, 13]. В механизме развития нейродегенеративного процесса при БП основное значение придается накоплению в нервных клетках белка α-синуклеина с нарушенной конформацией, способного формировать токсичные олигомерные структуры, вызывающие гибель нейронов [14]. Нарушение конформации α-синуклеина возникает в результате снижения эффективности работы убиквитин-протеасомной системы, ответственной за деградацию аномальных белков, и системы белков теплового шока HSP70 (Hsp70, Hsc70, Grp78), контролирующих фолдинг, рефолдинг и транспортировку необратимо поврежденных белков для последующей деградации [2, 10, 15–17]. Следует отметить, что эффективность работы систем поддержания протеостаза снижается с возрастом, и при БП эти изменения усугубляются [16, 18–20]. Кроме того, посмертное исследование тканей головного мозга пациентов, страдавших БП, показало, что обнаруженные в тельцах Леви представители семейства HSP70 колокализованы с агрегатами α-синуклеина [21], что подтверждает их участие в патогенезе БП.
В настоящее время накоплено достаточно фактов, полученных с применением моделей БП на клеточных культурах и на животных, указывающих на то, что стресс-индуцибельный белок теплового шока Hsp70 является первой линией защиты от фатальных последствий накопления токсичных белков с неправильной конформацией [22–24]. В модели БП у крыс, созданной на основе угнетения протеасом кчЧС, показано, что снижение уровня Hsp70 в ДА-ергических нейронах усиливает нейродегенерацию в нигростриатной системе [25, 26], а терапевтическое применение Hsp70 или его индукторов, напротив, повышает выживаемость нейронов и уменьшает количество агрегатов α-синуклеина [26, 27]. Следовательно, можно полагать, что профилактические мероприятия, направленные на повышение шаперона Hsp70 в головном мозге, будут уменьшать риск развития БП или противодействовать уже начавшейся нейродегенерации при БП.
Задача настоящего исследования – выяснить, способно ли профилактическое повышение содержания Hsp70 в кчЧС противодействовать развитию нейродегенеративного процесса в нигростриатной системе в модели БП у крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные. Исследование проведено на самцах крыс популяции Вистар (n = 15) в возрасте 4 мес. и массой тела 200–250 г. Животных содержали в виварии при температуре окружающей среды 23 ± 2°С, вода и пища были доступны без ограничений. Микроинъекции препаратов и поведенческие тесты выполняли в период с 09:00 до 10:00 ч. Все экспериментальные процедуры были выполнены с соблюдением биоэтических норм и одобрены локальным этическим комитетом ИЭФБ РАН.
Установка направляющих канюль. Хирургические операции по установке направляющих канюль выполняли под общим наркозом (золетил, 50 мг/кг внутримышечно (Virbac, Франция)). С помощью стереотаксического устройства канюли из нержавеющей стали с внутренним диаметром 0.3 мм вживляли билатерально над кчЧС по координатам: 5.0 мм каудальнее брегмы, 2.0 мм латерально слева и справа от сагиттального шва и 7.0 мм ниже поверхности черепа [28]. После установки канюли фиксировали зубным цементом. Эксперименты начинали через 7–10 дней после операции.
Препараты и схема эксперимента. Для создания модели клинической стадии БП применяли специфический ингибитор ферментативной активности протеасом лактацистин (ЛЦ) (Sigma, США). ЛЦ растворяли в апирогенном 0.1 М фосфатном буфере (pH 7.4) непосредственно перед применением. Билатеральные микроинъекции ЛЦ в кчЧС в дозе 4 мкг/мкл и со скоростью 0.1 мкл/мин выполняли двукратно (с недельным интервалом). С целью профилактического повышения содержания Hsp70 в кчЧС через направляющие канюли выполнены микроинъкции pекомбинантного белка Hsp70 человека. Препарат Hsp70, полученный в Институте цитологии РАН, вводили билатерально в кчЧС за 2 ч до введения ЛЦ в дозе 0.6 мкг/0.3 мкл. Полный протокол получения и очистки Hsp70 описан ранее [29]. Контрольным животным вводили апирогенный фосфатный буфер в объеме 0.3 мкл по той же схеме. Перед выполнением микроинъекций животных наркотизировали с помощью золетила (30 мг/кг внутримышечно). Микроинъекции всех применяемых в исследовании препаратов осуществляли с помощью шприца Hamilton (США), объем которого составлял 1 мкл. В конце опытов проводили морфологический контроль места микроиъекции с использованием красителя толуидинового синего.
Поведенческие тесты. Тесты для выявления моторных нарушений проводили через 21 день после первого введения ЛЦ.
Тест с семенами подсолнечника применяли для изучения тонкой моторики передних конечностей, рта и языка [30]. Семена подсолнечника включали в обычный рацион крыс для того, чтобы животные учились находить и открывать их. За 24 ч до эксперимента из индивидуальных клеток убирали обычную пищу. На следующий день крысе насыпали семена подсолнечника (25 шт.) и оценивали латентный период начала поедания семян и количество семян, съеденных в течение 5 мин.
Тест “Перевернутая решетка” применяли для оценки сенсомоторного дефицита конечностей [31, 32]. Крысу усаживали на решетку и давали возможность ухватиться за нее конечностями. Затем решетку аккуратно переворачивали таким образом, чтобы животное оказалось висящим под ней, и одновременно включали секундомер для регистрации времени, в течение которого крыса была способна удержаться в таком положении. Решетку располагали над мягкой поверхностью, чтобы предотвратить травмы животного при падении.
Модифицированный тест “Суок” использовали для выявления у крыс моторных дисфункций, таких как нарушение координации и походки [33, 34]. В данном тесте животное должно совершить побежку по расположенному на высоте 50 см от пола деревянному брусу (шириной 3.5 см и длиной 1.5 м) из более светлой (аверсивной) зоны в более темную (преферентную), которая оканчивалась доступом к жилой клетке. В процессе каждой побежки по балльной системе оценивали походку животных: скорость передвижения, число падений, число соскальзываний конечностей с бруса, наличие асимметричности движений конечностей. Данные всех совершенных побежек суммировались.
Иммуногистохимический метод. После выполнения моторных тестов животных наркотизировали с помощью золетила. После наркотизации животных подвергали транскардиальной перфузии 0.1 М фосфатным буфером и 4%-ным параформальдегидом. Головной мозг извлекали и инкубировали в 30%-ном растворе сахарозы при 4°С в течение 72 ч; после чего замораживали с помощью сухого льда и изопентана при температуре –42°С и хранили в морозильной камере при –80°С до дальнейшего морфологического исследования. С применением криостата (Leica, Германия) приготавливали серии чередующихся фронтальных срезов кчЧС и стриатума толщиной 10 мкм. Для определения числа выживших нейронов в кчЧС и их аксонов в дорсальном стриатуме использовали маркер ДА-ергических нейронов – скорость-лимитирующий фермент синтеза ДА тирозингидроксилазу (ТГ). После стандартной предварительной обработки, описанной ранее [35], срезы инкубировали с первичными поликлональными антителами кролика против ТГ (1 : 800; Abcam, Великобритания) и везикулярного транспортера моноаминов 2 (ВТМА2) (1 : 100; Sigma, США), с первичными моноклональными антителами мыши против индуцибельного Hsp70 (клон 2E5, получены в лаборатории защитных механизмов клетки Института цитологии РАН) в течение 24 ч при комнатной температуре. После промывки в 0.01 М фосфатном буфере срезы инкубировали в течение 1 ч с вторичными антителами против кролика или мыши (1 : 350), конъюгированными с биотином (Vector Lab., США), затем в комплексе стрептавидин–пероксидаза (1 : 350) (Vector Lab., США). Визуализацию реакции осуществляли с помощью 0.05%-ного раствора диаминобензидина. Заключение срезов под покровное стекло выполняли с помощью среды BioMount (Италия) и хранили при комнатной температуре. Для проверки специфичности иммуногистохимической реакции использовали отрицательный контроль без первичных антител.
Препараты кчЧС и стриатума анализировали с помощью микроскопа Karl Zeiss (Imager A1). После проверки правильности локализации следа от инъекционной иглы препараты фотографировали с помощью программы AxioVision (4.8) при увеличении ×10 для кчЧС и ×20 для стриатума. Количественный анализ проводили с помощью компьютерного цифрового анализатора телевизионного изображения и программного обеспечения PhotoM (Черниговский, http://t-lambda.chart.ru) на полученных от каждого животного 8–10 снимках кчЧС и стриатума. На микрофотографиях на каждом срезе обводили область кчЧС, содержащую тела ДА-ергических нейронов в соответствии с атласом [28]. После этого подсчитывали число нейронов с видимым ядром. Оценку плотности распределения ДА-ергических волокон в дорсальном стриатуме производили на основании распределения оптической плотности ТГ на параллельных срезах стриатума. На каждом срезе согласно атласу обводили центральную часть дорсального стриатума с иммунореактивными к ТГ волокнами. При помощи программы PhotoM оптическую плотность иммунореактивного вещества ТГ и ВТМА2 определяли как интенсивность серого цвета при прохождении волны света длиной 650 нм. Разница между интенсивно окрашенными нейронами кчЧС, содержащими иммунореактивное вещество, и интенсивностью окраски фона (не содержащего иммунореактивного вещества) на одном и том же срезе позволяла оценить оптическую плотность.
Статистическая обработка результатов. Результаты экспериментов обрабатывали с помощью программы Statistica 7.0 (StatSoft-Russia) с учетом характера распределения данных. Анализ результатов иммуногистохимических исследований выполняли с помощью параметрического дисперсионного анализа ANOVA. Для обработки результатов поведенческих тестов применяли непараметрический U-критерий Манна–Уитни. Различия полученных результатов считались статистически достоверными при уровне значимости p < 0.01 и p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Установлено, что введение ЛЦ приводило к гибели 61% (p < 0.01) ДА-ергических нейронов в кчЧС и уменьшению плотности распределения ДА-ергических аксонов в стриатуме на 65% (p < 0.05) (рис. 1А–1Г). При этом отмечено снижение в нейронах кчЧС уровня ТГ и ВТМА2 на 22% (p < 0.05) и 20% (p < 0.05) соответственно (рис. 2А, Б). Выяснено, что в выживших нейронах кчЧС уровень Hsp70 был снижен на 33% (p < 0.01). Развитие нейродегенеративного процесса сопровождалось нарушением моторных функций. Количество семян, съедаемых крысой в течение 5 мин, уменьшалось в 2 раза по сравнению с контролем (р < 0.05) (рис. 3А), что указывает на нарушение тонкой моторики. По сравнению с контролем выявлен сенсомоторный дефицит, проявлявшийся сокращением периода времени, в течение которого животное могло удерживаться на перевернутой решетке (с 36.2 ± 6.1 до 16 ± 2.9 с (р < 0.05)) (рис. 3Б). В тесте “Суок” обнаружено, что ЛЦ вызывал у крыс значительные нарушения координации и походки. При перемещении по узкой деревянной планке животные часто спотыкались и соскальзывали, походка становилась затрудненной и наблюдалась асимметрия в работе конечностей, в результате чего средний балл, отражающий тяжесть нарушений, возрастал в 5 раз (p < 0.01) по сравнению с контролем (рис. 3В).
Рис. 1.
Влияние профилактических микроинъекций Hsp70 в компактную часть черной субстанции (кчЧС) на изменение числа дофамин (ДА)-ергических нейронов в кчЧС (А, Б) и плотности распределения их аксонов в дорсальном стриатуме (В, Г) в модели болезни Паркинсона у крыс. Световая микроскопия. Иммунопозитивные к тирозингидроксилазе нейроны в кчЧС (масштаб 50 мкм) (Б) и аксоны в дорсальном стриатуме (масштаб 10 мкм) (В). ЛЦ – лактацистин. Здесь и на рисунках 2 и 3 данные представлены как среднее арифметическое ± ошибка среднего. * – достоверность отличия от контроля при p < 0.05, ** – достоверность отличия от контроля при p < 0.01; # – достоверность эффекта Hsp70 в модели БП при p < 0.05.
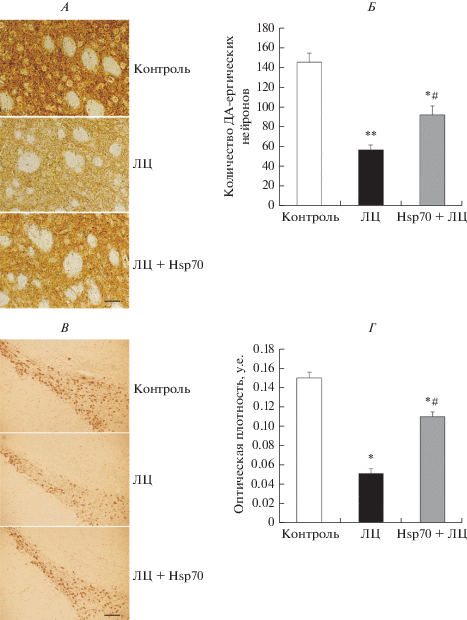
Рис. 2.
Влияние локальных микроинъекций Hsp70 в компактную часть черной субстанции (кчЧС) на изменение оптической плотности тирозингидроксилазы (ТГ) (А) и везикулярного транспортера моноаминов 2 (ВТМА2) (Б) в кчЧС в модели болезни Паркинсона у крыс.
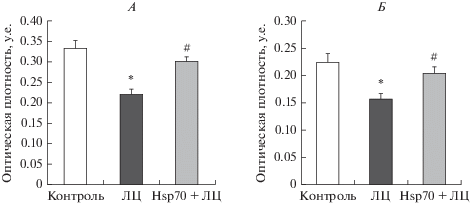
Рис. 3.
Влияние локальных микроинъекций Hsp70 в компактную часть черной субстанции (кчЧС) на тонкую моторику передних конечностей, рта и языка (А), выраженность сенсомоторного дефицита (Б) и тяжесть нарушений координации и походки (В) в модели болезни Паркинсона у крыс.

Установлено, что профилактическое введение Hsp70 противодействовало развитию нейродегенеративного процесса при моделировании БП: морфологический анализ выявил в модели БП уменьшение числа погибших ДА-ергических нейронов в кчЧС в среднем в 1.8 раза (р < 0.05) и их аксонов в стриатуме – в 2.5 раза (р < 0.05) по сравнению с контрольными условиями (рис. 1А–1Г). Обнаружено, что Hsp70 препятствовал снижению содержания ТГ и ВТМА2 в выживших нейронах кчЧС, о чем свидетельствовало повышение их уровней до контрольных значений (рис. 2А, Б). При изучении моторных показателей установлено, что микроинъекции Hsp70 предотвращали развитие характерных для модели БП у крыс нарушений в тонкой моторике передних конечностей, рта и языка (рис. 3А), устраняли проявления сенсомоторного дефицита (рис. 3Б) и уменьшали тяжесть нарушений локомоции (рис. 3В).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Применяемая в исследовании модель БП у животных характеризуется наличием основных патоморфологических признаков и специфических клинических симптомов БП: гибелью 61% ДА-ергических нейронов в кчЧС и 65% аксонов в стриатуме, уменьшением содержания скорость-лимитирующего фермента синтеза ДА ТГ и ВТМА2, укладывающего ДА в синаптические везикулы, и развитием моторного дефицита (нарушение тонкой моторики, координации движений и походки, развитие сенсомоторного дефицита). Уменьшение содержания ТГ, ВТМА2 и Hsp70 в выживших нейронах кчЧС свидетельствует о функциональной недостаточности выживших ДА-ергических нейронов и ослаблении механизмов конформационного контроля со стороны системы шаперона Hsp70, что характерно для патогенеза БП.
Ранее обнаружено, что Hsp70, введенный в ликворную систему головного мозга или интраназально крысам, способен проникать в паренхиму и интернализоваться нейронами различных отделов головного мозга, в том числе и ДА-ергическими нейронами кчЧС [26, 27, 36]. Повышение содержания экзогенного Hsp70 в головном мозге (путем его интраназального введения) в период активной гибели нервных клеток оказывало выраженный терапевтический эффект в модели БП у крыс [27]. В этих опытах показано, что Hsp70 значительно замедляет гибель нейронов и препятствует переходу патологического процесса из доклинической стадии в клиническую. Для того чтобы оценить профилактический потенциал Hsp70, мы выполнили микроинъекции этого белка за 2 ч до введения ЛЦ, т.е. до начала развития патоморфологических признаков БП. Проведенное исследование показало, что введение Hsp70 в кчЧС противодействовало прогрессированию нейродегенеративного процесса в нигростриатной системе и повышало выживаемость ДА-ергических нейронов и их аксонов. При этом отмечалось улучшение функций выживших нейронов, на что указывало повышение содержания ТГ и ВТМА2 до контрольных значений. Ослабление нейродегенеративного процесса и повышение активности ДА-ергических компенсаторных механизмов способствовали значительному улучшению моторных функций у животных в модели БП, так как были устранены проявления сенсомоторного дефицита и нарушения тонкой моторики. Однако в тесте “Суок” у модельных животных не происходило полного восстановления координации движений и нарушений походки. По-видимому, повышения содержания Hsp70 в нигральных нейронах было недостаточно для полного восстановления координации движений, поскольку наряду с кчЧС в регуляцию моторного поведения вовлечены и другие отделы головного мозга (сенсомоторная кора, красное ядро, мозжечок) [37].
Известно, что гибель нейронов вызывается олигомерами α-синуклеина и токсичными протофибриллами [38]. Ингибирование протеасом приводит к развитию α-синуклеиновой патологии и нейровоспаления при моделировании БП in vivo и in vitro [26, 39]. Шаперон Hsp70 способен связываться с α-синуклеином и другими амилоидными протеинами и подавлять образование фибрилл [40]. Кроме того, нами недавно показано, что Hsp70 способствует дезагрегации α-синуклеиновых конгломератов и уменьшению их числа в ЛЦ модели БП у животных [26]. Немаловажным фактором, противодействующим прогрессированию нейродегенерации в модели БП, является способность Hsp70 уменьшать микроглиоз в кчЧС, который вносит значительный вклад в развитие нейродегенерации [26]. По-видимому, такие же свойства Hsp70 могут лежать в основе его нейропротективного действия при профилактическом применении в условиях используемой модели БП.
Таким образом, экспериментально доказано, что профилактическое повышение уровня индуцибельного белка Hsp70 в нигростриатной системе, патогенетически значимой для БП, противодействует развитию нейродегенерации и ее прогрессированию в модели БП у крыс. Эти данные могут служить основанием для разработки неинвазивных подходов (лечебных тепловых, мышечных нагрузок, технологий, предлагаемых наномедициной и др.) для профилактического повышения содержания шаперонов в головном мозге, особенно при старении, с целью защиты уязвимых регионов головного мозга от развития БП и других нейродегенеративных заболеваний.
Список литературы
de Lau L.M., Breteler M.M. Epidemiology of Parkinson’s disease. Lancet Neurol. 6: 525–535. 2006.
Friesen E.L., De Snoo M.L., Rajendran L., Kalia L.V., Kalia S.K. Chaperone-based therapies for disease modification in Parkinson’s disease. Parkinson’s Dis. 11: 1–11. 2017.
Dorsey E.R., Bloem R. The Parkinson pandemic – a call to action. JAMA Neurol. 5(1): 9–10. 2018.
Braak H., Ghebremedhin E., Rüb U., Bratzke H., Del Tredici K. Stages in the development of Parkinson’s disease-related pathology. Cell Tissue Res. 318(1): 121–134. 2004.
Adler C.H., Dugger B.N., Hentz J.G., Hinni M.L., Lott D.G., Driver-Dunckley E., Mehta S., Serrano G., Sue L.I., Duffy A., Intorcia A., Filon J., Pullen J., Walker D.G., Beach T.G. Peripheral synucleinopathy in early Parkinson’s disease: Submandibular gland needle biopsy findings. Mov. Disord. 31(2): 250–256. 2016.
Postuma R.B., Berg D. Advances in markers of prodromal Parkinson disease. Nat. Rev. Neurol. 12(11): 622–634. 2016.
Riederer P., Wuketich S. Time course of nigrostriatal degeneration in Parkinson’s disease. J. Neural Transm. 38: 277–301. 1976.
Угрюмов М.В. Трансляционная, персонализированная и профилактическая медицина как основа для борьбы с нейродегенеративными заболеваниями. В кн.: Нейродегенеративные заболевания: от генома до целостного организма. Часть I: Моторная функция и ее регуляция в норме и при патологии. М. Научный мир. 22–44. 2014. [Ugrumov M.V. Translational, personalized and prophylactic mediсine as a background for treatment of neurodegenerative diseases. In: Neurodegenerative diseases: from genome to the whole organism. Part 1. Motor function and its regulation in normal and pathological conditions. Moscow. Scientific World. 22–44. 2014. (In Russ.)].
Sarkar S., Raymick J., Imam S. Neuroprotective and therapeutic strategies against Parkinson’s disease: Recent perspectives. Int. J. Mol. Sci. 17(6): 904. 2016.
Evgen'ev M.B., Krasnov G.S., Nesterova I.V., Garbuz D.G., Karpov V.L., Morozov A.V., Snezhkina A.V., Samokhin A.N., Sergeev A., Kulikov A.M., Bobkova N.V. Molecular mechanisms underlying neuroprotective effect of intranasal administration of human Hsp70 in mouse model of Alzheimer’s disease. J Alzheimer’s Dis. 59(4): 1415–1426. 2017.
Hernando S., Gartziandia O., Herran E., Pedraz J.L., Igartua M., Hernandez R.M. Advances in nanomedicine for the treatment of Alzheimer’s and Parkinson’s diseases. Nanomedicine (Lond). 11(10): 1267–1285. 2016.
Lim K.L., Tan J.M. Role of the ubiquitin proteasome system in Parkinson’s disease. BMC Biochem. 22(8): 13. 2007.
Blandini F. Neural and immune mechanisms in the pathogenesis of Parkinson’s disease. J. Neuroimmune Pharmacol. 8(1): 189–201. 2013.
Bridi J.C., Hirth F. Mechanisms of α-synuclein induced synaptopathy in Parkinson’s disease. Front. Neurosci. 12: 80. 2018.
Hartl F.U., Bracher A., Hayer-Hartl M. Molecular chaperones in protein folding and proteostasis. Nature. 475(7356): 324–332. 2011.
Ciechanover A., Kwon Y.T. Protein quality control by molecular chaperones in neurodegeneration. Front. Neurosci. 6(11): 185. 2017.
Morozov A.V., Astakhova T.M., Garbuz D.G., Krasnov G.S., Bobkova N.V., Zatsepina O.G., Karpov V.L., Evgen’ev M.B. Interplay between recombinant Hsp70 and proteasomes: Proteasome activity modulation and ubiquitin-independent cleavage of Hsp70. Cell Stress Chaperones. 22(5): 687–697. 2017.
López-Otín C., Blasco M.A., Partridge L., Serrano M., Kroemer G. The hallmarks of aging. Cell. 153(6): 1194–1217. 2013.
Ekimova I.V., Plaksina D.V., Kalinin R.S. Age-related features of resistance of the nigrostriatal system under proteasome dysfunction in rats. J. Evol. Biochem. Phys. 54: 487–490. 2018.
Чеснокова А.Ю., Екимова И.В., Пастухов Ю.Ф. Болезнь Паркинсона и старение. Успехи геронтологии. 37(5): 668–678. 2018. [Chesnokova A.Y., Ekimova I.V., Pastukhov Y.F. Parkinson’s disease and aging. Adv. Gerontol. 31(5): 668–678. 2018 (In Russ.)].
Leverenz J.B., Umar I., Wang Q., Montine T.J., McMillan P.J., Tsuang D.W., Jin J., Pan C., Shin J., Zhu D., Zhang J. Proteomic identification of novel proteins in cortical Lewy bodies. Brain Pathol. 17(2): 139–145. 2007.
Ebrahimi-Fakhari D., Saidi L.J., Wahlster L. Molecular chaperones and protein folding as therapeutic targets in Parkinson’s disease and other synucleinopathies. Acta Neuropathol. Commun. 1(1): 79–94. 2013.
Пастухов Ю.Ф., Екимова И.В., Чеснокова А.В. Молекулярные механизмы патогенеза болезни Паркинсона и перспективы превентивной терапии. В кн.: Нейродегенеративные заболевания – от генома до целостного организмаю Часть I. Моторная функция и ее регуляция в норме и при патологии. М. Научный мир. 316–355. 2014. [Pastukhov Yu.F., Ekimova I.V., Chesnokova A.V. Molecular mechanisms of pathogenesis of Parkinson’s disease and perspectives of the preventive therapy. In: Neurodegenerative diseases: from genome to the whole organism. Part 1. Motor function and its regulation in normal and pathological conditions. Moscow. Scientific World. 316–355. 2014. (In Russ.)].
Jones D.R., Moussaud S., McLean P. Targeting heat shock proteins to modulate α-synuclein toxicity. Ther. Ad. Neurol. Disord. 7(1): 33–51. 2014.
Екимова И.В., Плаксина Д.В., Гужова И.В., Мешалкина Д.А. Роль индуцибельного белка Hsp70 в модуляции нейродегенеративной патологии нигростриатной системы, характерной для болезни Паркинсона. Ж. эволюц. биохим. физиол. 1: 73–75. 2016. [Ekimova I.V., Plaksina D.V., Guzhova I.V., Meshalkina D.A. Role of the inducible Hsp70 protein in modulation of neurodegenerative pathology of nigrostriatal system for the Parkinson’s disease. Zh. Evol. Biokhim. Fiziol. 1: 73–75. 2016. (In Russ.)].
Ekimova I.V., Plaksina D.V., Pastukhov Y.F., Lapshina K.V., Lazarev V.F., Mikhaylova E.R., Polonik S.G., Pani B., Margulis B.A., Guzhova I.V., Nudler E. New HSF1 inducer as a therapeutic agent in a rodent model of Parkinson’s disease. Exp. Neurol. 306: 199–208. 2018.
Pastukhov Y.F., Plaksina D.V., Lapshina K.V., Guzhova I.V., Ekimova I.V. Exogenous protein HSP70 blocks neurodegeneration in the rat model of the clinical stage of Parkinson’s disease. Dokl. Biol. Sci. 457(1): 225–227. 2014.
Paxinos G., Watson C. The rat brain in stereotaxic coordinates. SDG. Acad. Press. 1998.
Shevtsov M.A., Nikolaev B.P., Yakovleva L.Y., Dobrodumov A.V., Dayneko A.S., Shmonin A.A., Vlasov T.D., Melnikova E.V., Vilisov A.D., Guzhova I.V., Ischenko A.M., Mikhrina A.L., Galibin O.V., Yakovenko I.V., Margulis B.A. Neurotherapeutic activity of the recombinant heat shock protein Hsp70 in a model of focal cerebral ischemia in rats. Drug Des. Devel. Ther. 8: 639–650. 2014.
Gomez C., Santiago-Mejia J., Ventura-Martinez R., Rodriguez R. The sunflower seed test: A simple procedure to evaluate forelimb motor dysfunction after brain ischemia. Drug Dev. Res. (67): 752–756. 2006.
Smith S.L., Thompson K.S., Sargent B.J., Heal D.J. BTS 72664 – a novel CNS drug with potential anticonvulsant, neuroprotective, and antimigraine properties. CNS Drug Rev. 7: 146–171. 2001.
Tillerson J.L., Caudle W.M., Reveron M.E., Miller G.W. Detection of behavioral impairments correlated to neurochemical deficits in mice treated with moderate doses of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. Exp. Neurol. 178: 80–90. 2002.
Kalueff A.V., Keisala T., Minasyan A., Kumar S.R., LaPorte J.L., Murphy D.L., Tuohimaa P. The regular and light–dark Suok tests of anxiety and sensorimotor integration: Utility for behavioral characterization in laboratory rodents. Nat. Protoc. 3: 129–136. 2008.
Mittoux V., Ouary S., Monville C., Lisovoski F., Poyot T., Conde F., Escartin C., Robichon R., Brouillet E., Peschanski M., Hantraye P. Corticostriatopallidal neuroprotection by adenovirus-mediated ciliary neurotrophic factor gene transfer in a rat model of progressive striatal degeneration. J. Neurosci. 22: 4478–4486. 2002.
Екимова И.В., Пази М.Б., Плаксина Д.В. Оценка нейропротективного потенциала глюкозо-регулируемого белка теплового шока в модели болезни Паркинсона у крыс. Рос. физиол. журн. им. И.М. Сеченова. 104(7): 757–768. 2018. [Ekimova I.V., Pazi M.B., Plaksina D.V. Evaluation of the neuroprotective potential of glucose-regulated heat shock protein in the model of Parkinson’s disease in rats. Russ. J. Physiol. 104(7): 757–768. 2018. (In Russ.)].
Ekimova I.V., Nitsinskaya L.E., Romanova I.V., Pastukhov Y.F., Margulis B.A., Guzhova I.V. Exogenous protein Hsp70/Hsc70 can penetrate into brain structures and attenuate the severity of chemically-induced seizures. J. Neurochem. 115(4): 1035–1044. 2010.
Базян А.С., Григорьян Г.А., Иоффе М.Е. Регуляция моторного поведения. Успехи физиол. наук. 42 (3):65–80. 2011. [Bazyan A.S., Grigoryan G.A., Ioffe M. E. Regulation of motor behaviour. Usp. Fiziol. Nauk. 42 (3): 65–80. 2011. (In Russ.)].
Roberts H.L., Brown D.R. Seeking a mechanism for the toxicity of oligomeric α-synuclein. Biomol. Ther. 5: 282–305. 2015.
Bentea E., Verbruggen L., Massie A. The proteasome inhibition model of Parkinson’s disease. J. Parkinsons Dis. 7: 31–63. 2017.
Balchin D., Hayer-Hartl M., Hartl F.U. In vivo aspects of protein folding and quality control. Science. 353(6294): aac4354. 2016.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


