Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 7, стр. 888-901
Влияние перинатального стресса и антидепрессантов на острый и тонический болевой ответ и психоэмоциональное поведение у молодых самцов крыс
В. А. Михайленко 1, *, И. П. Буткевич 1, 2, Е. А. Вершинина 1
1 Институт физиологии им. И.П. Павлова, РАН
Санкт-Петербург, Россия
2 Педиатрический медицинский университет
Санкт-Петербург, Россия
* E-mail: viktormikhailenko@yandex.ru
Поступила в редакцию 26.02.2019
После доработки 07.05.2019
Принята к публикации 14.05.2019
Аннотация
У потомства крыс, подвергнутых иммобилизационному стрессу в период беременности (пренатальный стресс), исследовали влияние периферической воспалительной боли в первые два дня жизни на болевую чувствительность, реактивность болевой системы в ответ на воспалительный агент, тревожность, депрессивноподобное поведение и когнитивные способности в препубертатном возрасте. Обнаружено, что пренатальный стресс вызывал у самцов усиление болевой чувствительности, воспалительного болевого ответа, тревожно-депрессивного поведения, ухудшение способности к пространственному обучению. Хроническое введение ингибитора обратного захвата серотонина флуоксетина или агониста 5-HT1A рецепторов буспирона беременным самкам нивелировало вредные последствия пренатального стресса. В этом случае боль у пренатально стрессированных новорожденных не приводила к нарушениям поведения ни в одном из использованных тестов. Более того, комбинация перинатальных стрессоров (пренатальный стресс и болевой стресс у новорожденных) препятствовала вредному влиянию пренатального стресса, что обнаружилось в достоверном снижении уровня болевого ответа в тесте “горячая пластина” и воспалительного болевого ответа в формалиновом тесте по сравнению с уровнем ответов у пренатально стрессированных самцов, не подвергнутых боли в новорожденном возрасте; в этих условиях действие препаратов не проявилось. Сделан вывод, что стрессовые воздействия в перинатальный период развития при определенных условиях способствуют повышению уровня стрессоустойчивости у крыс в препубертатном возрасте. Результаты обсуждаются в контексте современной гипотезы (match/mismatch stress hypothesis), согласно которой стресс в критические периоды развития может программировать адаптивное поведение организма к последующим стрессам.
Многочисленные исследования свидетельствуют о том, что стресс, которому подвергается организм в перинатальный период развития, является основным фактором риска формирования поведенческих дисфункций и психического расстройства [1–3]. Такое представление поддерживается “кумулятивной” гипотезой стресса, согласно которой стрессорные воздействия в перинатальном возрасте суммируются, что в результате ослабляет способность организма в дальнейшем сопротивляться стрессам. Хронический стресс вызывает развитие депрессии, для лечения которой используются ингибиторы обратного захвата серотонина (5-HT), среди которых флуоксетин широко применяют в период беременности [4]. Возникшая позднее концепция “прививки от стресса” (инокуляция, иммунизация стрессом) [5] предполагает, что перинатальный стресс при определенных условиях может программировать адаптацию мозговых и поведенческих функций к последующим стрессам. Доказательством этому служат результаты, полученные как в клинике, так и в экспериментах на животных [5]; наряду с этим встречаются работы, не поддерживающие эту концепцию [6]. Актуален вопрос: почему неблагоприятные события во время критических периодов развития у одних людей снижают способность сопротивляться стрессам, тогда как у других представляют собой возможный источник адаптации к стрессам в дальнейшей жизни? Существующие гипотезы дают возможность сделать предположение, что опыт относительно легких неблагоприятных ситуаций в раннем возрасте подготавливает к будущим стрессам и способствует устойчивости к стрессовым ситуациям, но если происходит несоответствие между ранним и последующим опытом, то уязвимость к стрессовым нагрузкам усиливается [7]. Привлечение многих моделей позволило выдвинуть для объяснения явлений уязвимости и устойчивости к стрессам фундаментальную концепцию трех попаданий (three hits), включающих взаимодействие генетического фактора (1), фактора окружающей среды в раннем возрасте (2) и окружающей среды в позднем возрасте (3) [5]. Практическая важность этой проблемы вызывает повышенный интерес к изучению механизмов влияния перинатального стресса [5, 6]. Несмотря на успех, вызванный привлечением современных методов исследования в этой области, остаются без ответа многие вопросы, в частности, когда именно происходит трансформация негативных явлений стресса (изменений в нейрогуморальной регуляции) в раннем возрасте в адаптивный процесс, сочетание каких типов стресса в критические периоды развития повышает устойчивость против стресса в дальнейшей жизни, как изменяются последствия стресса в процессе постнатального развития. Ответам на эти вопросы способствуют поведенческие исследования на животных. В качестве перинатальных стрессоров в лабораторных условиях на грызунах наиболее часто используют материнскую депривацию, социальный и пренатальный стресс [6, 8].
В настоящей работе мы применили в качестве перинатального стресса сочетание пренатального стресса и воспалительной боли у новорожденных крысят. Результаты исследования последствий сочетания данных факторов в критический период развития на разные типы адаптивного поведения в препубертатном возрасте представляет интерес для клиники. Во-первых, стресс во время беременности (пренатальный стресс) вызывает развитие депрессивных состояний, во-вторых, воспалительная боль часто сопутствует недоношенным новорожденным, а также в срок рожденным младенцам, требующим терапевтических или хирургических вмешательств, и, наконец, именно в препубертаный период у детей начинают проявляться симптомы депрессивного поведения [9]. В ранее опубликованных нами работах описано влияние только пренатального стресса [10] и только воспалительной боли в раннем возрасте [11] на пролонгированный двухфазный поведенческий болевой ответ в формалиновом тесте и психоэмоциональное поведение у крыс. Новизна настоящей работы состоит в исследовании влияний сочетания этих двух стрессовых ситуаций в пренатальный и ранний постнатальный период развития на болевую чувствительность, воспалительный болевой ответ, другие типы адаптивного поведения и когнитивные способности. Возраст исследованных крыс относится к препубертатному периоду развития [12], которому были посвящены предыдущие наши работы [10, 11]. Ранее мы сообщили, что повторное введение флуоксетина или агониста серотонинергических рецепторов типа 1А (5-HT1A) буспирона беременным самкам крыс, стрессированным во время беременности, нивелирует неблагоприятные последствия пренатального стресса у потомства [13]. Поскольку комбинация стрессоров может изменить активность антидепрессантов, логично было оценить действие препаратов, направленных на лечение депрессии в период беременности, с целью улучшения поведения, нарушенного пренатальным стрессом, у потомства.
Цель настоящей работы состояла в исследовании у пренатально стрессированных самцов крыс препубертатного возраста влияния воспалительной боли, которой они подвергались в новорожденном состоянии, на болевую чувствительность, пролонгированный воспалительный болевой ответ, тревожно-депрессивное поведение, когнитивные способности, а также влияния на эти типы поведения флуоксетина и буспирона, препаратов, которые повторно вводились в период беременности их матерям для нивелирования негативных последствий пренатального стресса у потомства.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проведены на самцах крыс Вистар, полученных из биоколлекции Института физиологии им. И.П. Павлова РАН (Санкт-Петербург). Все процедуры работы с животными проводились в соответствии с принципами Базельской декларации и рекомендациями руководства ARRIVE [14]. Протоколы опытов утверждены комиссией по гуманному обращению с животными Института физиологии им. И.П. Павлова РАН. В работе были использованы животные, перенесшие только пренатальный стресс (ПС) и перенесшие комбинированный стресс: ПС и ранний постнатальный (боль в новорожденном возрасте) стресс.
Модель пренатального стресса и его фармакологическая коррекция
Крыс содержали в виварии лаборатории в стандартных условиях, беременность определяли по мазку из влагалища на следующее утро после подсадки. Присутствие сперматозоидов в мазке рассматривали как нулевой день беременности. Моделирование пренатального стресса осуществляли помещением беременных самок, исключая контрольных, в пеналы с 15-го по 21-й день беременности два раза в сутки (в разные утренние (с 9 до 13), и вечерние (с 14 до 19 ч) по 60 мин в условиях сильного освещения [1]. Пенал, сделанный из органического стекла, резко ограничивал движение крысы; стенки пенала можно было раздвигать по мере увеличения размеров самки. Интенсивное развитие гипоталамо-гипофизарно-надпочечниковой системы (ГГНС) у плода происходит в последнюю пренатальную неделю, что обуславливает стрессирование самки именно в последнюю неделю беременности [15].
С 9-го дня беременности до родов некоторые самки получали ежедневно внутрибрюшинную инъекцию ингибитора обратного захвата серотонина (5-HT) антидепрессанта флуоксетина (10 мг/кг, Sigma), или агониста 5-HT1A рецепторов анксиолитика буспирона (3.5 мг/кг, Sigma), или физиологического раствора. Контрольные самки оставались без инъекций. Дозы препаратов соответствовали рекомендациям, имеющимся в литературе [16], а также были апробированы нами ранее [17]. Таким образом, в эксперименты было включено потомство: 1) контрольных самок (без иммобилизации и введения препаратов); 2) самок, подвергнутых иммобилизации и введению физиологического раствора; 3) самок, подвергнутых иммобилизации и введению флуоксетина; 4) самок, подвергнутых иммобилизации и введению буспирона.
Модель воспалительной боли
На следующие сутки после рождения потомства в помете оставляли по возможности 4 самца и 4 самки. Часть новорожденных животных из каждой группы в первый и повторно во второй день жизни подвергали воспалительной боли (подкожная инъекция 2.5%-ного раствора формалина, 0.5 мкл в подошву левой задней конечности). Сразу после инъекции новорожденные крысята были возвращены матери. Остальные животные не были подвергнуты воспалительной боли. В каждой из 8 групп было не менее 8–10 самцов.
Поведенческие тесты
Начиная с 25-дневного возраста, все самцы были исследованы в батарее тестов. В тесте “горячая пластина” для оценки базальной болевой чувствительности каждого самца по одному помещали на горячую пластину (55°С) и регистрировали трижды с перерывом в 10 мин латентный период реакции отряхивания задней конечности (с) в ответ на термический раздражитель, полученные данные усредняли. На следующие сутки в формалиновом тесте каждого самца по одному помещали в прозрачную камеру и регистрировали ответную реакцию на подкожную инъекцию формалина (2.5%, 1 мкл) в течение 60 мин: число сгибаний + встряхиваний (спинальный уровень) и продолжительность реакции вылизывания (супраспинальный уровень) (с), которые характеризуют интенсивность болевой реакции в ответ на воспалительный агент [17, 18]. Зарегистрированные показатели в тоническую фазу поведенческого ответа анализировали. Последующие тесты осуществляли с интервалом в трое суток между тестами. В приподнятом крестообразном лабиринте регистрировали в течение 5 мин время пребывания в открытых рукавах – показатель, обратно пропорциональный уровню тревожности [19]. В тесте принудительного плавания (модификация теста Порсолта) [20], который позволяет оценить влияние антидепрессантов на уровень выраженности депрессивноподобного поведения, крысу помещали в сосуд с водой (диаметр 25 см, высота 60 см, температура воды 25–27°С) и в течение 5 мин регистрировали время нахождения крысы в неподвижном состоянии (время иммобильности – показатель депрессивноподобного поведения). В водном лабиринте Морриса (диаметр бассейна 1.2 м и глубина 0.5 м) оценили способность животных к пространственному обучению. Для этого каждого самца по отдельности помещали в бассейн с водой и регистрировали латентный период, в течение которого животное находило платформу, установленную на дне бассейна на 2 см ниже уровня воды. Животному позволяли находиться на платформе в течение 15 с. Проводили четыре попытки (с промежутками в 20 с), которые повторяли два раза (две пробы) с промежутком между пробами 4 мин; все полученные данные усредняли для определения времени нахождения крысой платформы. Поведение животных в каждом тесте регистрировали с помощью видеокамеры. Все используемые нами поведенческие тесты подробно описаны в наших предыдущих статьях [11, 21].
Статистический анализ
Анализировали влияние факторов: воздействие (контроль, физиологический раствор + ПС, флуоксетин + ПС, буспирон + ПС) и экспериментальные условия (ПС, ПС + новорожденная боль) на зависимые переменные с использованием одномерного двухфакторного дисперсионного анализа ANOVA. В качестве зависимых переменных выступали: 1) латентный период в тесте горячая пластина; 2) число сгибаний и встряхиваний, а также продолжительность вылизывания в формалиновом тесте; 3) время пребывания в открытых рукавах в тесте приподнятого крестообразного лабиринта; 4) время иммобильности в тесте вынужденного плавания и 5) время нахождения платформы в водном тесте Морриса. Во множественных апостериорных сравнениях использовался тест Бонферрони. Статистические решения принимали на 5% уровне значимости при двусторонней альтернативе. Анализ данных проводился на основе программного комплекса SPSS Inc. Данные представлены средними значениями со стандартными ошибками средних.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
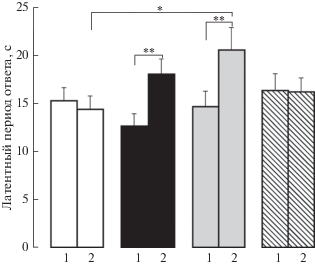
В тесте “горячая пластина” у самцов крыс препубертатного возраста обнаружено значимое влияние на латентный период экспериментальных условий F(1.85) = 5.5, p = 0.022, η2 = 0.061, кроме того, получена тенденция к значимости взаимодействия экспериментальных условий и воздействия F(3.85) = 2.6, p = 0.058, η2 = 0.084. Во множественных апостериорных сравнениях тест Бонферрони показал, что латентный период ответа у крыс с комбинацией стрессоров был больше, чем у крыс с ПС (**р < 0.01). Латентный период у крыс ПС + флуоксетин + новорожденная боль был больше, чем у крыс ПС + флуоксетин (**р < 0.01) и у крыс с новорожденной болью (*р < 0.05) (рис. 1). Таким образом, воспалительная боль у пренатально стрессированных новорожденных препятствовала проноцицептивному влиянию пренатального стресса на болевую чувствительность, антиноцицептивное действие флуоксетина на латентный период ответа в этих условиях усилилось.
Рис. 1.
Влияние пренатальных воздействий (пренатальный стресс и пренатальное введение флуоксетина и буспирона пренатально стрессированным крысам) и боли в новорожденном возрасте на латентный период болевого ответа на термический раздражитель в тесте “горячая пластина” у самцов крыс препубертатного периода развития. 1 – без боли и 2 – с болью в новорожденном возрасте. По вертикали – латентный период ответа (с). Белые столбики – пренатально не стрессированные (контроль), черные столбики – пренатальное введение физиологического раствора пренатально стрессированным крысам, серые столбики – пренатальное введение флуоксетина пренатально стрессированным крысам, заштрихованные столбики – пренатальное введение буспирона пренатально стрессированным крысам. Уровень значимости: *р < 0.05, **р < 0.01. Данные представлены в виде среднего ± стандартная ошибка.
В формалиновом тесте для сгибания + встряхивания получено значимое влияние экспериментальных условий F(1.83) = 5.1, p = 0.027, η2 = 0.058 и влияние воздействия F(3.83) = 6.9, p < 0.001, η2 = 0.200. Тест Бонферрони обнаружил, что флуоксетин (*р < 0.05) и буспирон (**р < 0.01) уменьшили число сгибаний + встряхиваний (спинальный уровень болевого ответа) у ПС крыс. Боль у ПС новорожденных крыс с флуоксетином уменьшила этот показатель по сравнению с числом сгибаний + + встряхиваний у крыс с комбинацией стрессоров (*р < 0.05) (рис. 2А).
Рис. 2.
Влияние пренатальных воздействий (пренатальный стресс и пренатальное введение флуоксетина и буспирона пренатально стрессированным крысам) и боли в новорожденном возрасте на поведенческий болевой ответ в формалиновом тесте у самцов крыс адолесцентного периода развития. 1 – без боли и 2 – с болью в новорожденном возрасте. По вертикали – число сгибаний + встряхиваний (А) и продолжительность реакции вылизывания (с) (Б). Белые столбики – пренатально не стрессированные (контроль), черные столбики – пренатальное введение физиологического раствора пренатально стрессированным крысам, серые столбики – пренатальное введение флуоксетина пренатально стрессированным крысам, заштрихованные столбики – пренатальное введение буспирона пренатально стрессированным крысам. Уровень значимости: *р < 0.05, **р < 0.01, ***р < 0.001. Данные представлены в виде среднего ± стандартная ошибка.
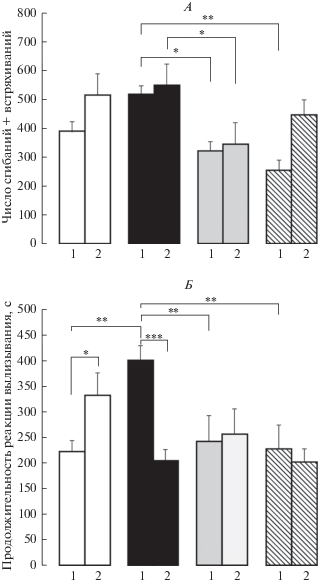
Для продолжительности вылизывания (супраспинальный уровень) получено значимое влияние воздействия F(3.83) = 2.5, p = 0.064, η2 = 0.083 и взаимодействие воздействия и экспериментальных условий F(3.83) = 6.6, p < 0.001, η2 = 0.193. Тест Бонферрони обнаружил увеличение продолжительности вылизывания у крыс с новорожденной болью (*р < 0.05) и у ПС крыс (**р < 0.01) по сравнению с этим показателем у контрольных животных (рис. 2Б). ПС + флуоксетин и ПС + буспирон уменьшили продолжительность вылизывания по сравнению с этим показателем у ПС крыс (**р < 0.01 в обоих случаях). Комбинация стрессоров (ПС + боль в период новорожденности) по сравнению с ПС уменьшила продолжительность вылизывания (***р < 0.001) и вернула уровень болевого ответа к контрольному уровню (рис. 2Б). В этих условиях флуоксетин и буспирон не проявили действие. Таким образом, ПС, как и боль у новорожденных, увеличили болевой ответ у самцов препубертатного возраста, флуоксетин и буспирон нивелировали влияние ПС. Важно, что комбинация стрессоров предотвратила влияние ПС на болевой ответ и нормализовала его, антиноцицептивное действие препаратов не проявилось.
Рис. 3.
Влияние пренатальных воздействий (пренатальный стресс и пренатальное введение флуоксетина и буспирона пренатально стрессированным крысам) и боли в новорожденном возрасте на время пребывания в открытых рукавах в тесте приподнятого крестообразного лабиринта у самцов крыс адолесцентного периода развития. 1 – без боли и 2 – с болью в новорожденном возрасте. По вертикали – время пребывания в открытых рукавах (с). Белые столбики – пренатально не стрессированные (контроль), черные столбики – пренатальное введение физиологического раствора пренатально стрессированным крысам, серые столбики – пренатальное введение флуоксетина пренатально стрессированным крысам, заштрихованные столбики – пренатальное введение буспирона пренатально стрессированным крысам.

В тесте приподнятого крестообразного лабиринта статистический анализ не обнаружил значимого влияния ни экспериментальных условий, ни воздействия на время пребывания в открытых рукавах (рис. 4).
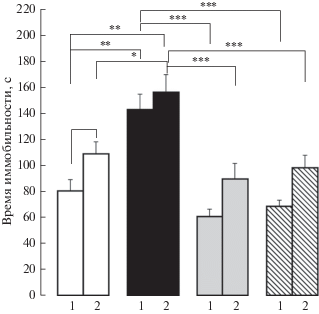
В тесте принудительного плавания обнаружен главный эффект экспериментальных условий F(1.83) = 12.1, p < 0.001, η2 = 0.127 и воздействия F(3.83) = 24.2, p < 0.001, η2 = = 0.467 на время иммобильности. Тест Бонферрони обнаружил, что воспалительная боль, ПС и комбинация стрессоров достоверно увеличили время иммобильности по сравнению с этим показателем у контроля (*р < 0.05, **р < 0.01, **р < 0.01 соответственно), флуоксетин и буспирон снизили этот показатель (***р < 0.01, в обоих случаях) (рис. 4). Комбинация стрессоров и ПС вызвали одинаковое увеличение времени иммобильности, препараты в условиях комбинированного стресса также проявили антидепрессивный эффект (***р < 0.01, в обоих случаях). Таким образом, боль в новорожденном возрасте, пренатальный стресс и комбинированный стресс усилили депрессивно-подобное поведение, влияние последних было одинаково и доминировало над влиянием боли в новорожденном возрасте (*р < 0.05) на время иммобильности. Антидепрессивное действие препаратов в условиях комбинированного стресса сохранялось.
Рис. 4.
Влияние пренатальных воздействий (пренатальный стресс и пренатальное введение флуоксетина и буспирона пренатально стрессированным крысам) и боли в новорожденном возрасте на время иммобильности в тесте принудительного плавания у самцов крыс адолесцентного периода развития. 1 – без боли и 2 – с болью в новорожденном возрасте. По вертикали – время иммобильности (с). Белые столбики – пренатально не стрессированные (контроль), черные столбики – пренатальное введение физиологического раствора пренатально стрессированным крысам, серые столбики – пренатальное введение флуоксетина пренатально стрессированным крысам, заштрихованные столбики – пренатальное введение буспирона пренатально стрессированным крысам. Уровень значимости: *р < 0.05, **р < < 0.01, ***р < 0.001. Данные представлены в виде среднего ± стандартная ошибка.
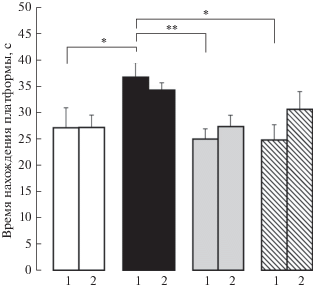
В водном лабиринте Морриса обнаружен главный эффект воздействия F(3.82) = = 6.7, p < 0.001, η2 = 0.197 на время нахождения платформы, но не выявлена зависимость когнитивного показателя от новорожденной боли. Тест Бонферрони обнаружил, что ПС увеличил время нахождения платформы по сравнению с контролем (*р < 0.05), флуоксетин и буспирон нивелировали действие ПС (**р < 0.01 и *р < 0.05 соответственно) (рис. 5). Комбинация стрессоров достоверно не изменила этот показатель. Таким образом, влияние боли в новорожденном возрасте не отразилось на способности к пространственному обучению. Действие препаратов в условиях комбинация перинатальных стрессоров не проявилось.
Рис. 5.
Влияние пренатальных воздействий (пренатальный стресс и пренатальное введение флуоксетина и буспирона пренатально стрессированным крысам) и боли в новорожденном возрасте на время нахождения платформы в тесте Морриса у крыс адолесцентного периода развития. 1 – без боли и 2 – с болью в новорожденном возрасте. По вертикали – время нахождения платформы (с). Белые столбики – пренатально не стрессированные (контроль), черные столбики – пренатальное введение физиологического раствора пренатально стрессированным крысам, серые столбики – пренатальное введение флуоксетина пренатально стрессированным крысам, заштрихованные столбики – пренатальное введение буспирона пренатально стрессированным крысам. Уровень значимости: *р < 0.05, **р < 0.01. Данные представлены в виде среднего ± стандартная ошибка.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для изучения эффекта перинатального стресса у самцов препубертатного периода развития было исследовано влияние каждого стрессора в отдельности (только пренатальный стресс, только боль в новорожденном возрасте) и впервые их сочетания на болевые ответы, тревожно-депрессивное поведение и когнитивные способности. Кроме того, важно было определить, изменит ли у самцов препубертатного периода развития воспалительная боль в новорожденном возрасте пренатальное влияние антидепрессанта флуоксетина и анксиолитика буспирона, хроническому введению которых были подвергнуты их стрессированные во время беременности матери. Принимая во внимание тесные взаимоотношения между ноцицептивной системой и гипоталамо-гипофизарно-надпочечниковой системы (ГГНС) [22], и важную роль 5-HT1A рецептора в этих взаимоотношениях [23], мы показали влияние используемых перинатальных воздействий на разные типы адаптивного поведения.
Представленные в настоящей работе результаты по влиянию пренатального стресса у самцов указывают на усиление тонического воспалительного болевого ответа, депрессивно-подобного поведения и нивелирование этих изменений, вызванное хронической инъекцией флуоксетина и буспирона их матерям, стрессированным во время беременности, что подтверждает полученные нами ранее данные [13]. Многочисленные клинические и экспериментальные исследования представляют доказательства о негативном влиянии пренатального стресса на развитие мозга [24], на тревожно-депрессивное поведение [1], серотонинергическую систему [25, 26]. Вредные для развивающегося организма влияния пренатального стресса были предотвращены у потомства введением ингибитора обратного захвата 5-HT флуоксетина самкам мышей в период беременности [27] или самкам крыс в период молочного вскармливания [28]. В настоящее время появляются работы, позволяющие рассматривать пренатальный стресс не только, как фактор риска, но и как фактор, повышающий способность организма адаптироваться к стрессу в последующем онтогенезе [8].
При исследовании влияния только боли в новорожденном возрасте на разные типы поведения мы обнаружили усиление воспалительного болевого ответа, интегрированного на супраспинальном уровне, и депрессивно-подобного поведения, что подтверждает полученные нами ранее результаты [11]. Данные литературы свидетельствуют о том, что воспалительная боль у новорожденных может иметь долговременное влияние не только на функциональную активность ноцицептивной системы, но и на адаптивное поведение [29, 30]. Сообщается, что боль у новорожденных, вызванная химическим воспалительным агентом каррагеном, модифицирует в дальнейшем не только активность ноцицептивной системы, но и ГГНС [31] и тревожное поведение [30]. Повторная боль у новорожденных, являющаяся одновременно и стрессом, представляет опасность для нормального развития ГГНС, которая влияет на перцепцию боли и связанный с ней хронический болевой синдром [32, 33]. Ноцицептивные системы и ГГНС на ранних этапах развития находятся в состоянии повышенной пластичности и работают согласованно, реагируя на вредные и полезные стимулы [34]. Боль у новорожденных нарушает нормальное протекание гипореспонсивного периода развития ГГНС, главное предназначение которого состоит в поддержании пониженного уровня глюкокортикоидов, что необходимо для протекания нормальных морфофункциональных процессов в ранний критический период формирования головного мозга [1]. Болевые воздействия в этот период также нарушают механизм регуляции обратной связи в ГГНС. Одним из нейрохимических медиаторов, участвующих в ингибирующем контроле ГГНС, является 5-HT; сообщается, что у крыс активация рецепторов 5-HT1A в дорсомедиальном гипоталамусе является одним из факторов для ингибирования индуцированной стрессом активности ГГНС [23].
В литературе нам не встретились работы, в которых в качестве стрессовых воздействий в критические периоды развития использовалась бы такая комбинация воздействий, как в нашем исследовании. Новые данные, полученные в настоящей работе, при исследовании последствий сочетания пренатального стресса и воспалительной боли в новорожденном возрасте на исследованные типы поведения указывают на то, что комбинация стрессоров ни в одном из тестов не увеличила негативное влияние пренатального стресса на поведение. Более того, комбинация стрессоров препятствовала вредному влиянию пренатального стресса, что проявилось особенно ярко в снижении уровня болевого ответа, организованного на супраспинальном уровне в формалиновом тесте. Результат взаимодействия двух типов стресса в критический период развития можно рассматривать как программирование адаптивного поведения именно к болевому стрессу в дальнейшем онтогенезе, своего рода “прививку от боли”. Важные данные, полученные в формалиновом тесте, указывают на то, что боль в период новорожденности у пренатально стрессированных самцов предотвратила проноцицептивное влияние пренатального стресса на болевой ответ, организованный на супраспинальном уровне, нормализовала его, антиноцицептивное действие флуоксетина и буспирона не проявилось. В тесте принудительного плавания боль в новорожденном возрасте увеличила показатель депрессивно-подобного поведения, пренатальный и комбинированный стресс усилили в одинаковой степени депрессивно-подобное поведение, антидепрессивное действие препаратов сохранялось. В водном лабиринте Морриса боль в новорожденном возрасте не вызвала значимое изменение во времени нахождения платформы. Пренатальный стресс ухудшил когнитивные способности, а флуоксетин и буспирон нивелировали действие пренатального стресса. Комбинация стрессоров не изменила влияние ПС, действие флуоксетина и буспирона в условиях комбинированного стресса не проявилось.
Флуоксетин и буспирон опосредуют антидепрессивный и анксиолитический эффекты через 5-HT1A рецептор [35]. Буспирон является частичным агонистом 5-HT1A ауторецепторов и полным агонистом гетерорецепторов. Продолжительное использование буспирона вызывает активацию 5-HT1A ауторецепторов и приводит к их десенситизации, и, следовательно, к увеличению секреции 5-HT в гиппоккампе и префронтальной коре. Предполагается, что антиноцицептивное влияние буспирона осуществляется через кальциевые каналы L типа [36]. Флуоксетин ингибирует транспортер серотонина, увеличивает концентрацию 5-HT в интерстициальной жидкости головного мозга, что усиливает влияние этого биогенного амина на постсинапические рецепторы и способствует ослаблению депрессивного состояния [37]. Молекулярные особенности буспирона как частичного агониста 5‑HT1A рецепторов определяют его использование в сочетании с флуоксетином для повышения эффективности последнего при лечении депрессий [38]. Данные исследования, выполненного на молекулярном уровне с использованием еще одного ингибитора обратного захвата 5-HT-пароксетина, указывают на участие глюкокортикоидных рецепторов в качестве потенциального ключевого механизма в формировании транскрипционных изменений и клинического ответа на лечение антидепрессантами [39]. Активация 5-HT1A рецепторов в дорсомедиальном гипоталамусе вносит вклад в ингибирование индуцированной стрессом активности ГГНС [22]. Существующее мнение об антиноцицептивном влиянии обоих препаратов не однозначно [40]. Полученные нами данные вносят вклад в представление о флуоксетине и буспироне не только как о препаратах, оказывающих антидепрессантное и анксиолитическое действие соответственно, но также как и о препаратах, способных проявлять и антиноцицептивный эффект.
Таким образом, полученные новые данные демонстрируют, что комбинация стрессоров в перинатальный период развития препятствует проноцицептивному влиянию пренатального стресса, что проявляется в повышении устойчивости к воспалительному болевому стрессу при достижении крысами препубертатного периода развития. В этих условиях действие флуоксетина и буспирона не проявляется. Обращает на себя внимание тот факт, что боль у пренатально стрессированных новорожденных не препятствует негативному влиянию пренатального стресса на депрессивно-подобное поведение и на способность к пространственному обучению, но и не доминирует над эффектом пренатального стресса. Полученные данные по влиянию перинатального стресса на болевую чувствительность и воспалительный болевой ответ поддерживают широко обсуждаемую в настоящее время гипотезу “соответствие/несоответствие” (match/mismatch hypothesis) [7]. Согласно этой гипотезе адаптация к стрессу формируется в том случае, если запрограммированное поведение к определенному типу стресса в критический период развития соответствует (match) стрессовым условиям в дальнейшем онтогенезе, тогда как их несоответствие (mismatch) наносит вред организму. Более глубокое понимание воздействия стресса в раннем возрасте может помочь в разработке персонализированных методов лечения пролонгированной боли в последующем онтогенезе и стратегий, направленных на предотвращение ее возникновения.
Список литературы
Weinstock M. Prenatal stressors in rodents: Effects on behavior. Neurobiology of stress. 6: 3–13. 2017.
McGowan P.O., Matthews S.G. Prenatal Stress, Glucocorticoids, and Developmental Programming of the Stress Response. Endocrinology. 159(1): 69–82. 2018.
Беляева Л.Е., Федченко А.Н., Лигецкая И.В., Ковзова Е.И., Столярова В.Н. Влияние комбинированного пренатального стресса на физическую выносливость, болевую чувствительность и поведение крыс. Вест. Витебск. гос. мед. универ. 14: 26–33. 2015. [Belyaeva L.E., Fedchenko A.N., Ligetskaya I.V., Kovzova E.I., Stolyarova V.N. The effect of combined prenatal stress on physical stamina, pain sensitivity and behavior of rats. Bull. Vitebsk. state med. univer. 14: 26–33. 2015. (In Russ.)].
Olivier J.D., Blom T., Arentsen T., Homberg J.R. The age-dependent effects of selective serotonin reuptake inhibitors in humans and rodents: A review. Prog. Neuropsychopharmacol. Biol. Psychiatry. 1;35(6): 1400–8. 2011. https://doi.org/10.1016/j.pnpbp.2010.09.013
Daskalakis N.P., Bagot R.C., Parker K.J., Vinkers C.H., Kloet E.R. The three-hit concept of vulnerability and resilience: Towards understanding adaptation to early-life adversity outcome. Psychoneuroendocrinology. 38(9): 1858–1873. 2013. https://doi.org/10.1016/j.psyneuen.2013.06.008
Genty J., Tetsi Nomigni M., Anton F., Hanesch U. The combination of postnatal separation and social stress in young adulthood does not lead to enhanced inflammatory pain and depression-related behavior in rats. PLoS One. 13(8): e0202599. 2018. https://doi.org/10.1371/journal.pone.0202599
Nederhof E., Schmidt M.V. Mismatch or cumulative stress: Toward an integrated hypothesis of programming effects. Physiol. Behav. 106: 691–700. 2012.
Hartman S., Belsky J. Prenatal programming of postnatal plasticity revisited-and extended. Dev. Psychopathol. 30(3): 825–842. 2018. https://doi.org/10.1017/S0954579418000548
Paus T., Keshavan M., Giedd J.N. Why do many psychiatric disorders emerge during adolescence? Nat. Rev. Neurosci. 9: 947–957. 2008. https://doi.org/10.1038/nrn2513
Butkevich I.P., Vershinina E.A. Prenatal stress alters time characteristics and intensity of formalin-induced pain responses in juvenile rats. Brain Res. 915: 88–93. 2001.
Butkevich I.P., Mikhailenko V.A., Lavrova Yu.A., Ulanova N.A. Repeated Inflammation-Related Pain Syndrome in Neonatal Male Rats Alters Adaptive Behavior during the Adolescent Period of Development. Neurosci. Behav. Physiol. 46(4): 461–466. 2016. https://doi.org/10.1007/s11055-016-0258-1
Tirelli E., Laviola G., Adriani W. Ontogenesis of behavioral sensitization and conditioned place preference induced by psychostimulants in laboratory rodents. Neurosci. Biobehav. Rev. 27(1–2): 163–178. 2003.
Mikhailenko V.A., Butkevich I.P. Prenatal Stimulation of 5-HT1A Receptors Improves Adaptive Behavior in Prenatally Stressed Rats. Bull. Exp. Biol. Med. 166(3): 306–309. 2019.
Kilkenny C., Browne W.J., Cuthill I.C., Emerson M., Altman D.G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. PLoS Biol. 8(6): e1000412. 2010. https://doi.org/10.1371/journal.pbio.1000412
Ward I.L., Weisz J. Differential effects of maternal stress on circulating levels of corticosterone, progesterone, and testosterone in male and female rat fetuses and their mothers. Endocrinology. 114: 1635–1644. 1984.
Glover M.E., Clinton S.M. Of rodents and humans: A comparative review of the neurobehavioral effects of early life SSRI exposure in preclinical and clinical research. Int. J. Dev. Neurosci. 51: 50–72. 2016.
Butkevich I.P., Mikhailenko V.A., Vershinina E.A., Otellin V.A., Aloisi A.M. Buspirone before prenatal stress protects against adverse effects of stress on emotional and inflammatory pain-related behaviors in infant rats: Age and sex differences. Brain Res. 1419(1): 76–84. 2011.
Dubuisson D., Dennis S.G. The formalin test: A quantitative study of the analgesic effects of morphine, meperidine, and brain stem stimulation in rats and cats. Pain. 4(2): 161—174. 1977.
Pellow S., Chopin P., File S.E., Briley M. Validation of open:closed arm entries in an elevated plus-maze as a measure of anxiety in the rat. J. Neurosci. Methods. 14(3): 149–167. 1985.
Porsolt R.D., LePichon M., Jalfre M. Depression: A new animal model sensitive to antidepressant treatments. Nature. 266: 730–732. 1977.
Butkevich I.P., Mikhailenko V.A., Vershinina E.A. Ulanova N.A. Differences in adaptive behaviors of adolescent male and female rats exposed at birth to inflammatory pain or stress. J. Evol. Biochem. Physiol. 51(4): 305–315. 2015.
Lanfumey L., Mongeau R., Cohen-Salmon C., Hamon M. Corticosteroid-serotonin interactions in the neurobiological mechanisms of stress-related disorders. Neurosci. Biobehav. Rev. 32(6): 1174–1184. 2008.
Stamper C.E., Hassell J.E.Jr., Kapitz A.J., Renner K.J., Orchinik M., Lowry C.A. Activation of 5-HT1A receptors in the rat dorsomedial hypothalamus inhibits stress-induced activation of the hypothalamic-pituitary-adrenal axis. Stress. 20(2): 223–230. 2017. https://doi.org/10.1080/10253890.2017.1301426
Van den Bergh B.R.H., Dahnke R., Mennes M. Prenatal stress and the developing brain: Risks for neurodevelopmental disorders. Dev. Psychopathol. 30(3): 743–762. 2018. https://doi.org/10.1017/S0954579418000342
Van den Hove D.L., Leibold N.K., Strackx E., Martinez-Claros M., Lesch K.P., Steinbusch H.W., Schruers K.R., Prickaerts J. Prenatal stress and subsequent exposure to chronic mild stress n rats; interdependent effects on emotional behavior and the serotonergic system. Eur. Neuropsychopharmacol. 24(4): 595–607. 2014. https://doi.org/10.1016/j.euroneuro.2013.09.006
Kiryanova V., Smith V.M., Antle M.C., Dyck R.H. Behavior of Adult 5-HT1A Receptor Knockout Mice Exposed to Stress During Prenatal Development. Neuroscience. 10(371): 16–28. 2018. https://doi.org/10.1016/j.neuroscience.2017.11.039
Avitsur R. Prenatal fluoxetine modifies the behavioral and hormonal responses to stress in male mice: Role for glucocorticoid insensitivity. Behav. Pharmacol. 28(5): 345–355. 2017.
Rayen I., van den Hove D.L., Prickaerts J., Steinbusch H.W., Pawluski J.L. Fluoxetine during development reverses the effects of prenatal stress on depressive-like behavior and hippocampal neurogenesis in adolescence. PLoS One. 6(9):e24003. 2011. https://doi.org/10.1371/journal.pone.0024003
Schwaller F., Fitzgerald M. The consequences of pain in early life: Injury-induced plasticity in developing pain pathways. Eur. J. Neurosci. 39: 344–355. 2014.
Victoria N.C., Murphy A.Z. The long-term impact of early life pain on adult responses to anxiety and stress: Historical perspectives and empirical evidence. Dev. Neurobiol. 37: 1–13. 2016.
Rincón-Cortés M., Sullivan R.M. Early life trauma and attachment: Immediate and enduring effects on neurobehavioral and stress axis development. Front. Endocrinol. 5: 33. 2014.
Anand K.J., Coskun V., Thrivikraman K.V., Nemeroff C.B., Plotsky P.M. Long-term behavioral effects of repetitive pain in neonatal rat pups. Physiol. Behav. 66(4): 627–637. 1999.
Mooney-Leber S.M., Brummelte S. Neonatal pain and reduced maternal care: Early-life stressors interacting to impact brain and behavioral development. Neuroscience. 342: 21–36. 2017. https://doi.org/10.1016/j.neuroscience.2016.05.001
Andrews M.H., Matthews S.G. Programming of the hypothalamo-pituitary-adrenal axis: Serotonergic involvement. Stress. 7(1): 15–27. 2004.
Albert P.R., Fiori L.M. Transcriptional dis-regulation in anxiety and major depression: 5-HT1A gene promoter architecture as a therapeutic opportunity. Curr. Pharm. 20: 3738–3750. 2014.
Liang J.H., Wang X.H., Liu R.K., Sun H.L., Zheng J.W. Buspirone-induced antinociception is mediated by L-type calcium channels and calcium/caffeine-sensitive pools in mice. Psychopharmacology. (Berl). 166(3): 276–283. 2003.
Hervás I., Artigas F. Effect of fluoxetine on extracellular 5-hydroxytryptemine in rat brain. Role of 5-HT autoreceptors. Eur. J. Pharmacol. 358: 9–18. 1998.
Gobert A., Rivet J.-M., Cistarelli L., Melon C., Millan M.J. Buspirone modulates basal and fluoxetine-stimulated dialysate levels – of dopamine, noradrenaline and serotonin in the frontal cortex of freely moving rats: Activation of serotoninia receptors and blockade of a2-adrenergic receptors underlie its actions. Neuroscience. 93(4): 1251–1262. 1999.
Biartmar L., Johansson I.M., Marcusson J., Ross S.B., Seckl J.R., Olsson T. Selective effects on NGFI-A, MR, GR and NGFI-B hippocampal mRNA expression after chronic treatment with different subclasses of antidepressants in the rat. Psychopharmacology. (Berl). 151(1): 7–12. 2000.
Barakat A., Hamdy M.N., Elbadr M.M. Uses of fluoxetine in nociceptive pain management: A literature overview. Eur. J. Pharmacol. 829: 12–25. 2018.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


