Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 8, стр. 966-988
Механизмы утеростимулирующего и других эффектов окситоцина
В. И. Циркин 1, 2, С. И. Трухина 1, *, А. Н. Трухин 1
1 Вятский государственный университет
Киров, Россия
2 Казанский государственный медицинский университет
Казань, Россия
* E-mail: trukhinasvetlana@yandex.ru
Поступила в редакцию 17.04.2019
После доработки 17.05.2019
Принята к публикации 22.05.2019
Аннотация
Окситоцин, активируя окситоциновые рецепторы, ассоциированные с G-белками, вызывает различные физиологические эффекты. В статье основное внимание уделено механизмам, лежащим в основе утеростимулирующего эффекта окситоцина. Рассматривается роль Gq-, Gi- и Gs-белков, ассоциированных с окситоциновыми рецепторами, фосфолипазы С, инозитолтрифосфата, диацилглицерола (DAG), саркоплазматического ретикулюма, Са2+-каналов ретикулюма и плазматической мембраны, в том числе Са2+-каналов, управляемых Са2+-депо (SOC-каналов), Са2+-насосов ретикулюма и плазматической мембраны, а также калиевых каналов и Са2+-регулируемых хлорных каналов плазматической мембраны. Сообщается о способности окситоцина вызывать феномен Са2+-сенситизации миозина, т.е. о повышении чувствительности легких цепей миозина (ЛЦМ) к ионам Са2+. Феномен заключается в индукции окситоцином кальций-независимого фосфорилирования ЛЦМ с участием неканонических протеинкиназ, включая Rho-киназу. Обсуждается вопрос о способности окситоцина ингибировать миозиновую фосфатазу (за счет активации Rho-киназы и протеинкиназы С) и о вкладе кальций-независимого фосфорилирования миозина и ингибирования миозиновой фосфатазы в обеспечении утеростимулирующего эффекта окситоцина, в том числе его тонического компонента. Приводятся сведения о роли MAPК (митоген-активируемая протеинкиназа) сигнального пути при действии окситоцина, благодаря которому возрастает синтез простагландинов, ЛЦМ, коннексина-43, Rho-киназы, а также регулируется клеточная пролиферация и процессы пренатального и постнатального созревания нейронов мозга. Обсуждаются перспективы медикаментозной коррекции дисфункции окситоцинергических процессов, например, в том числе возможность использования ингибиторов Rho-киназы, ингибиторов кальций-регулируемых хлорных каналов, активаторов Са2+-активируемых и АТФ-зависимых калиевых каналов, а также регуляторов MAPК системы для ингибирования активности матки (токолиза).
СПИСОК ОСНОВНЫХ СОКРАЩЕНИЙ
ЛЦМ – легкие цепи миозина
MAPК – митоген-активируемая протеинкиназа
Са2+-каналы L-типа – потенциалзависимые Са2+-каналы
DAG – диацилглицерол
EGFR – эпидермальный фактор роста
IP3 – инозитолтрифосфат
OТR – окситоциновые рецепторы
PG – простагландины
РКС – протеинкиназа С
PLC – фосфолипаза С
PMCA – Са2+-насос плазматической мембраны
Rho-киназа – RhoA-связанная протеинкиназа
SERCA – Са2+-насос саркоплазматического ретикулюма
SOC-каналы – Са2+-каналы, управляемые Са2+-депо
Окситоцин, активируя окситоциновые рецепторы (OТR), ассоциированные с G-белком, вызывает различные физиологические эффекты. В данном обзоре основное внимание уделено механизмам, лежащим в основе способности окситоцина повышать сократительную деятельность матки, а тем самым участвовать в индукции родовой деятельности, в плодоизгнании и рождении плаценты. Нарушения этого механизма могут приводить к преждевременным родам, к развитию слабости родовой деятельности и другим акушерским аномалиям. Поэтому усилия многих исследователей направлены на детальное изучение механизма, лежащего в основе утеростимулирующего действия окситоцина. В статье также рассмотрен феномен Са2+-сенситизации, возникающий при действии окситоцина, обсуждается роль калиевых, натриевых и хлорных каналов в утеростимулирующем эффекте окситоцина, влияние окситоцина на экспрессию коннексина-43, как основы межклеточных контактов в миометрии, роль МАРК (митоген-активируемая протеинкиназа) и других сигнальных систем в реализации физиологических эффектов окситоцина, а в заключении делается попытка суммировать данные о механизмах, лежащих в основе утеростимулирующего эффекта окситоцина.
1. G-белки (Gq-, Gs-, Gi-) и их роль в реализации эффектов окситоцина. Основные сигнальные пути. Считается, что OТR сопряжены с G-белком, в том числе с его разновидностью Gαq-, или Gαq/11-белком, от которого сигнал передается на фосфолипазу С [1–7]. Некоторые авторы называют его как Gq2a-белок [3].
Считается, что Gαq/11 нечувствителен к токсину коклюша [1, 8, 9], в то время как белки GαO/13, Galphai1/2 чувствительны к нему [1, 9]. По отсутствию влияния коклюшного токсина на эффекты окситоцина и утверждается, что сигнал от OТR в миоцитах матки идет через Gαq-белок.
Параллельно с Gαq/11-белком в передаче сигнала от OТR к PLC участвует Gi-белок [3, 4, 10, 11], а также Go-белок [3] и Gs-белок [4, 10–12]. Например, полагают, что передача сигнала через Gi- или Gs-белок приводит к ингибированию роста клеток [4, 13].
Таким образом, можно говорить о том, что OТR в миоцитах матки и в других клетках взаимодействуют с семейством G-белков (Gαq/11, Gs, Gi). Направленность передачи сигнала от OТR к внутриклеточным эффекторам определяется локализацией рецепторов [13], в частности – расположены ли они в клатриновых областях или за их пределами. Так, по данным V. Rimoldi с соавт. [13], окситоцин ингибирует клеточную пролиферацию в том случае, когда подавляющее большинство рецепторов окситоцина находится за пределами микродоменов, богатых кавеолином-1 (в этих условиях окситоцин вызывает длительную активацию рецептора эпидермального фактора роста и MAPК, а также активацию ингибитора клеточного цикла белка p21) и, напротив, активация OТR вызывает митогенный эффект, когда рецепторы находятся в микродоменах, богатых кавеолином-1 (в этом случае происходит кратковременная активация рецептора EGFR, и MAPК, но без активации белка р21). В первом случае сигнал передается через Gi-белок, а во втором – через Gs-белок. В целом, наличие нескольких видов G-белков, на которые передается сигнал от активированного окситоцином рецептора, объясняет многообразие физиологических эффектов окситоцина, несмотря на существование лишь одного вида OТR, это, в том числе, объясняет участие окситоцина в процессах торможения, внимания и переключения в ЦНС, а также в Са2+-зависимой секреции и сокращении гладкомышечных или миоэпителиальных клеток [3].
Показано [1], что миоциты матки беременных женщин содержат Gq-белок, в том числе такие его изоформы как Gq-альфа2, Gq-альфа11, а также Gi-белок (Gi-альфа1, Gi-альфа2 и Gi-альфа3). Кроме того, в миоцитах выявлена PLC, в том числе ее изоформы Сбета1, Сбета2 и Сбета3, активность которых регулируется Gq-белками, а также изоформы Сгамма1 и Сгамма2, активность которых регулируется с участием рецепторов тирозинкиназного пути, который не имеет, однако, отношения к действию окситоцина [1]. В первичных амниоцитах человека окситоцин, взаимодействуя с OТR, повышает синтез простагландинов, но это происходит не за счет активации Gαq-белка, а за счет активации Gαi2- и Gαi3-белков [14]. Характерно, что OТR первичных амниоцитов, в отличие от OТR миометрия, не блокируются атозибаном [14].
В целом, считается [4, 6, 15], что в миоцитах матки при взаимодействии окситоцина с OТR реализуется основной механизм, который осуществляется через Gq/PLC/IP3-каскад. При этом вначале активируется белок Gαq/11, затем – PLC, которая расщепляет фосфоинозитолдифосфат до инозитолтрифосфата (ИТФ3, или IP3) и диацилглицерола. При этом IP3, взаимодействуя с рецепторами IP3, находящимися на мембране саркоплазматического ретикулюма, индуцирует выход ионов Са2+ из него, а это приводит к активации киназы легких цепей миозина (киназа ЛЦМ) и тем самым вызывает сокращение миоцитов матки или миоэпителиальных клеток, а в немышечных клетках индуцирует активацию различных энзимов, таких как NO-синтаза и фосфатидилинозитол-3-киназа, т.е. включает дополнительные сигнальные пути. Этому же способствует активация протеинкиназы С, происходящая под влиянием DAG. Активированная PКС вызывает фосфорилирование ингибитора протеинфосфатазы-1, что блокирует активность миозиновой фосфатазы и тем самым повышает интенсивность сокращения, в том числе за счет механизма сенситизации миозина к ионам Са2+. Ингибированию миозиновой фосфатазы и повышению чувствительности миозина к ионам Са2+, т.е. Са2+-сенситизации способствует и активация белка Rho-A, который в свою очередь активирует RhoA-связанную протеинкиназу. Полагают, что активация Gq-белка одновременно является причиной деполяризации мембраны миоцитов (вследствие активации потенциалзависимых Са2+-каналов, т.е. Са2+-каналов L-типа), что также способствует повышению концентрации ионов Са2+ в цитозоле. Одновременно окситоцин ингибирует работу Са2+-насоса плазматической мембраны (PMCA) и, возможно, ингибирует работу Са2+-насоса саркоплазматического ретикулюма (SERCA), а вследствие снижения концентрации ионов Са2+ в саркоплазматическом ретикулюме окситоцин индуцирует открытие Са2+-каналов, управляемых Са2+-депо, например, TRPC-каналы, что увеличивает длительность утеростимулирующего эффекта окситоцина. Описанный здесь путь часто называют каноническим путем стимуляции миоцитов матки и миоэпителиальных клеток молочной железы под влиянием окситоцина [4, 6, 15].
При взаимодействии окситоцина с ОTR могут индуцироваться и другие сигнальные системы, в частности, каскад событий, реализуемый с участием MAPK и Rho-киназы [6, 14]. В основе этого механизма лежит взаимодействие ОTR с Gs- и Gi-белкам, регулирующими активность аденилатциклазы. Следствием активации MAPK и Rho-киназы является повышение транскрипции генов ферментов, участвующих в синтезе PG, в том числе, фосфолипазы A2, необходимой для образования арахидоновой кислоты, и циклооксигеназы 2, которая непосредственно преобразует арахидоновую кислоту в PG. Все это приводит к усилению синтеза PG в миоцитах матки, в плодных оболочках, в децидуальной ткани и дополнительно способствует сократительным эффектам окситоцина. Сигнальный путь, в основе которого лежит вызванная окситоцином активация Rho-киназы, индуцирует такие процессы как адгезия и миграция клеток [16–19], воспаление [16] и указанный выше феномен Са2+-сенситизации миозина, т.е. повышение чувствительности миозина к ионам Са2+ [6, 15, 16, 20–24]. Еще одним механизмом, возникающим в результате взаимодействия окситоцина с ОTR, является антипролиферативный эффект, т.е. торможение клеточного цикла, либо, наоборот, пролиферативный процесс. Этот механизм реализуется за счет активации Gi-белка и МАРK через PLC/PI3K/c-Src-зависимый каскад [12, 13, 25], а также за счет активации Rho-киназы [16, 18]. Недавно был открыт еще один механизм действия окситоцина, связанный с его способностью вызывать транслокацию транскрипционных факторов в ядро [6, 26]. Например, в миоцитах матки окситоцин дозозависимо вызывает транслокацию фактора транскрипции в ядро, в частности, ядерного фактора активированных Т-клеток и кальциневрина; этот эффект возникает при постоянном или при импульсном воздействии окситоцина, и он ингибируется блокатором ОTR [26]. Это говорит о том, что при длительном воздействии окситоцина возможно изменение синтеза белков. Очевидно, что будущие исследования уточнят, какой сигнальный каскад реализует этот эффект окситоцина.
Представляет интерес высказывание авторитетных авторов по исследованию действия окситоцина S. Arrowsmith, S. Wray [6] о том, что, хотя утеростимулирующий эффект окситоцина – это самый известный и самый изученный его эффект, но точный механизм того, как осуществляется эта стимуляция, к удивлению, еще окончательно не определен. Ниже мы рассмотрим отдельные компоненты механизма, лежащего в основе утеростимулирующего эффекта окситоцина.
2. Роль фосфолипазы С, инозитолтрифосфата, диацилглицерола и протеинкиназы С в эффектах окситоцина. Многие авторы указывают, что после активации Gαq-белка происходит активация PLС [2, 4–9, 11, 28, 29], в том числе PLСbeta1 и PLCbeta3 [9]. Под влиянием этих изоформ происходит гидролиз фосфоинозитидов, в частности, фосфатидилинозитола-4,5-бифосфата, с образованием IP3, а также с образованием DAG [2, 5–9, 11]. Так, в опытах с миометрием небеременных крыс показано [28], что ингибитор PLС препарат U-73122 блокирует утеростимулирующий эффект окситоцина.
Полагают [2, 4, 6, 7, 9, 20], что образованный под влиянием PLС IP3 активирует IP3-рецепторы саркоплазматического ретикулюма, что вызывает выход ионов Са2+ из него в цитозоль. Следствием этого является повышение уровня Са2+ в цитозоле выше порогового значения, связывание ионов Са2+ с кальмодулином и активация киназы ЛЦМ, что индуцирует фазное сокращение миоцита.
Считается [2, 11], что DAG активирует PKC и тем самым способствует индукции сокращения. Однако субстраты для PKC в миоцитах матки пока не найдены [2, 11]. Предполагается [25], что с участием PKC активируется MAPK путь и тем самым повышается синтез ЛЦМ. Однако в опытах с миоцитами матки беременных женщин показано [1], что PKC, наоборот, ингибирует утеростимулирующий эффект окситоцина, так как эффект окситоцина снижается под влиянием активаторов PKC и повышается под влиянием ее ингибиторов. Таким образом, роль PKC в эффектах окситоцина пока остается неясной.
3. Роль Са2+-каналов плазматической мембраны (VOCC, или Са2+-каналов L-типа) в утеростимулирующем эффекте окситоцина. Не вызывает сомнения, что под влиянием окситоцина возрастает концентрация ионов Са2+ в цитозоле [2, 4, 7, 15, 30–33]. Так, по данным G. Asbóth с соавт. [8], окситоцин повышает концентрацию ионов Са2+ до 800 нМ в культивируемых миоцитах матки женщин, а полумаксимальное фосфорилирование ЛЦМ достигается обычно уже при концентрации ионов Са2+, равной 300 нМ [30]. Однако за счет каких процессов при действии окситоцина происходит рост внутриклеточной концентрации ионов Са2+ – неясно. Ряд авторов полагает, что увеличение концентрации ионов Са2+ в цитозоле при действии окситоцина обусловлен преимущественно выходом ионов Са2+ из саркоплазматического ретикулюма по IP3-каналам [6, 15, 22, 28]. Вопрос о роли входящего из внеклеточной среды потока ионов Са2+ в цитозоль по потенциалчувствительным Са2+-каналам (VOCC), в том числе по Са2+-каналам L-типа – дискуссионный. По мнению одних авторов, IP3 и DAG активируют Са2+-каналы L-типа, и тем самым повышают вход ионов Са2+ в цитозоль из среды [33–36]. Полагают также, что повышение входа ионов Са2+ в цитозоль по Са2+-каналам L-типа из среды внутрь клетки индуцирует порция ионов Са2+, выходящая из саркоплазматического ретикулюма под влиянием IP3 [6, 28]. Однако высказано мнение, что порция ионов Са2+, выходящая из ретикулюма под влиянием IP3, наоборот, блокирует вход ионов Са2+ из среды по Са2+-каналам L-типа [31]. Наконец, входу ионов Са2+ из среды по Са2+-каналам L-типа может способствовать деполяризация мембраны миоцита, которая, по мнению ряда авторов [34, 37], обусловлена тем, что окситоцин активирует хлорные и неселективные катионные каналы, о чем подробнее сказано ниже.
Приведем ряд данных литературы, отражающих роль внеклеточных ионов Са2+ в эффектах окситоцина. Так, в опытах с миометрием рожающих женщин показано [32], что удаление ионов Са2+ из среды или блокада Са2+-каналов L-типа верапамилом блокирует спонтанные фазные сокращения, но не влияет существенно на сокращения, индуцируемые окситоцином. Однако другие авторы показали, что бескальциевый раствор Кребса и верапамил снижают утеростимулирующий эффект окситоцина в опытах с миометрием беременных женщин [35]. На миометрии небеременных крыс, которым вводился эстроген, показано [22], что в бескальциевом растворе гиперкалиевый (60 мМ KCl) раствор Кребса не вызывает сокращение, в то время как окситоцин повышает тонус, и это сопровождается ростом концентрации ионов Са2+ в цитозоле. Авторы объясняют этот эффект тем, что окситоцин высвобождает ионы Са2+ из внутриклеточных источников, в частности, из саркоплазматического ретикулюма. Однако другими авторами в опытах с миометрием небеременных крыс показано [28], что блокатор Са2+-каналов препарат SK & F 96.365, как и бескальциевый раствор Кребса, блокирует утеростимулирующий эффект окситоцина. Следует отметить важное наблюдение, сделанное S. Arnaudeau с соавт. [34] в опытах с миометрием небеременных крыс, согласно которому окситоцин повышает проницаемость плазмолеммы к ионам Mn2+, что отличает миоциты матки крысы от миоцитов других висцеральных органов. В связи с этим наблюдением, отметим, что ранее нами [38, 39] в опытах с миометрием небеременных крыс также была показана уникальная способность окситоцина повышать проницаемость для ионов Mn2+ (но не для ионов Cu2+, Zn2+, Co2+, Cd2+, Mg2+, La3+ и Y3+). Это проявлялось в том, что окситоцин на фоне ионов Mn2+ вызывает выраженный подъем тонуса (так называемую окситоцин-марганцевую контрактуру). Все это позволяет нам полагать, учитывая характер реакции миометрия крысы, кролика, свиньи и человека на окситоцин, серотонин, ацетилхолин, PG, брадикинин, в том числе в условиях их воздействия на фоне блокаторов Са2+-проницаемости неорганической природы, что Са2+-каналы, управляемые ОTR, существенно отличаются от других Са2+-каналов миометрия, управляемых при активации рецепторов серотонина, ацетилхолина, PG или брадикинина.
4. Вклад Са2+-насосов и Са2+-каналов в утеростимулирующий эффект окситоцина. Ряд авторов утверждает, что окситоцин ингибирует работу PMCA, в связи с чем откачка ионов Са2+ из цитозоля за пределы клетки снижается, и это способствует росту концентрации ионов Са2+ в цитозоле и тем самым дополнительно усиливает утеростимулирующий эффект окситоцина [33, 40–42]. Способность окситоцина блокировать работу PMCA показана в опытах с миометрием кролика [40, 41], кошки [41], крысы [41], небеременных [33] и беременных [33, 42] женщин. Характерно, что окситоцин ингибирует Са2+-насос плазмолеммы в миоцитах матки беременных женщин, но не влияет на работу этого насоса в эритроцитах [33, 42]. Вопрос о пути, по которому сигнал от ОTR передается на PMCA, остается открытым.
Можно предположить, что окситоцин ингибирует работу SERCA, в связи с чем откачка ионов Са2+ из цитозоля в отсеки саркоплазматического ретикулюма снижается, и это приводит к росту концентрации Са2+ в цитозоле, что повышает утеростимулирующий эффект окситоцина. Однако прямых данных, подтверждающих это предположение, мы в литературе не нашли. Отмечено [6], что влияние окситоцина на активность SERCA не изучалось, хотя такая возможность не исключается. В то же время показано, что истощение запасов ионов Са2+ в саркоплазматическом ретикулюме, например, путем ингибирования работы SERCA тапсигаргином или другими веществами, снижает стимулирующий эффект окситоцина, так как в этом случае уменьшается поток Са2+ из саркоплазматического ретикулюма в цитозоль по IP3-активируемым каналам [1, 7, 33, 36, 43–45]. Так, в опытах с изолированным миометрием крысы показано [1], что блокада работы SERCA препаратом tBHQ препятствует утеростимулирующему действию окситоцина. Аналогичные данные получены в опытах с миоцитами линии PHM1-41, т.е. с перевиваемой культурой миоцитов беременных женщин [43], в опытах с первичной культурой миоцитов матки небеременных и беременных женщин и с клетками перевиваемой культуры PHM1-41 миоцитов матки беременных и небеременных женщин [45], в опытах с миометрием небеременных и беременных буйволиц при истощении запасов ионов Са2+ с помощью ингибитора SERCA циклопиазоновой кислоты [7]. В опытах с культурой миоцитов матки женщин показано [33], что окситоцин, подобно тапсигаргину, истощает запасы ионов Са2+ в саркоплазматическом ретикулюме, что косвенно говорит о важной роли саркоплазматического ретикулюма в реализации утеростимулирующего эффекта окситоцина.
Как известно, ионы Са2+ могут выходить из саркоплазматического ретикулюма в цитозоль по двум типам Са2+-каналов, а именно, по IP3-активируемым каналам, или по IP3-каналам [1, 34, 36, 46] и по рианодиновым каналам, т.е. по каналам, активируемым рианодином [34, 45]. Доказано, что при действии окситоцина ионы Са2+, действительно, выходят в цитозоль из саркоплазматического ретикулюма по каналам, активируемым IP3 [2, 6, 7, 9, 20, 34]. Так, в опытах с миоцитами матки беременных крыс показано [34], что начальная часть сокращения, вызванного окситоцином, уменьшается под влиянием гепарина, который является блокатором IP3-каналов саркоплазматического ретикулюма.
Вопрос о роли рианодиновых каналов в действии окситоцина, вероятно, остается открытым – по одним данным, эти каналы не имеют отношения к реализации утеростимулирующего эффекта окситоцина [34, 36], так как рианодин как активатор этих каналов не влияет на эффект окситоцина в опытах с изолированными миоцитами матки небеременных женщин [46] и в опытах с изолированным миометрием беременных крыс [34], а кофеин как активатор этих каналов, не повышает спонтанную и вызванную окситоцином сократительную активность миометрия крысы, а даже снижает ее [36]. По нашим данным [39], кофеин снижает спонтанную и вызванную гиперкалиевым раствором сократительную активность изолированного миометрия крысы, кролика, свиньи и человека, независимо от этапа репродуктивного процесса. Однако по данным других исследователей, при действии окситоцина ионы Са2+ выходят из саркоплазматического ретикулюма и по рианодиновым каналам [46–48]. Об этом свидетельствует способность рутения красного как ингибитора рианодиновых каналов саркоплазматического ретикулюма снижать утеростимулирующий эффект окситоцина в опытах с миометрием небеременных крыс [47]. В другом исследовании, выполненном на миометрии беременных женщин, показано, что кофеин повышает выход ионов Са2+ из саркоплазматического ретикулюма на фоне действия окситоцина [48]. Таким образом, вопрос о вкладе рианодиновых каналов в утеростимулирующий эффект окситоцина остается открытым.
Как известно [28, 33, 45, 49, 50], SOC-каналы, в том числе TRPC1, STIM1, Orai1, Orai2 и Orai3 служат для доставки ионов Са2+ из внеклеточной среды в саркоплазматический ретикулюм и тем самым не допускают истощения запасов Са2+ в нем. Эти каналы открываются при действии окситоцина и тем самым поддерживают индуцируемое окситоцином сокращение [28, 33, 45, 49, 50]. Так, в опытах с миометрием беременных женщин показано, что при действии окситоцина возрастает вход ионов Са2+ по TRPC1-каналам [33, 45], TRPC4-каналам [50], а также по STIM1-, Orai1-, Orai2- и Orai3-каналам [45]. Считается, что при воздействии окситоцина на миоциты матки открытие ТRPC-каналов осуществляется за счет IP3 [49, 50] и/или за счет DAG [33, 49]. Не исключаем, что для одних изоформ ТRPC-каналов их активатором является IP3, а для других изоформ активатором служит DAG. Так, показано [49], что IP3 активирует ТRPC1-, ТRPC2-, ТRPC3-, ТRPC4- и ТRPC5-каналы, а DAG активирует ТRPC8-каналы. Наиболее вероятно, что SOC-каналы имеют сайты, с которыми взаимодействуют IP3 или DAG, образующиеся под влиянием PLС при действии окситоцина [45]. Установлено [45], что блокада SOC-каналов, в том числе блокада TRPC1-, STIM1-, Orai1-, Orai2- и Orai3-каналов с помощью ионов гадолиния (Gd3+) существенно снижает утеростимулирующий эффект окситоцина. В опытах с культурой миоцитов матки беременных женщин (PHM1-41), чувствительных к окситоцину, и в опытах с первичной культурой миоцитов матки беременных женщин показано [50], что при действии окситоцина повышается содержание ионов Са2+ в цитозоле, но этого не происходит, если предварительно проведен нокдаун белка TRPC4 путем введения в миоциты аденовирусов, содержащих соответствующие анти-мРНК (short hairpin RNAs, или shRNAs, или “шпильковые мРНК”).
Таким образом, окситоцин, повышая содержание в цитозоле IP3 и DAG, активирует SOC-каналы, благодаря чему в саркоплазматическом ретикулюме поддерживается высокая концентрация ионов Са2+, необходимая для реализации утеростимулирующего эффекта окситоцина.
5. Влияние окситоцина на чувствительность киназы ЛЦМ к ионам Са2+ и на активность миозиновой фосфатазы (феномен Са2+-сенситизации миозина). Известно [39, 51–54], что сокращение миоцитов матки человека и животных (как и других гладкомышечных клеток) происходит за счет взаимодействия актиновых и миозиновых нитей с использованием энергии, высвобождаемой при гидролизе АТФ. В основе процесса сокращения лежит циклическая активность миозиновых мостиков. В миоцитах матки мостиковый цикл начинается при наличии ионов Са2+ в среде выше пороговых значений. Началом этого процесса является фосфорилирование ЛЦМ (20 кДа), происходящее с участием киназы ЛЦМ, которая активируется ионами Са2+. В результате фосфорилирования ЛЦМ поперечные мостики приобретают способность взаимодействовать с актиновыми нитями за счет совершения быстрых циклов (прикрепление–открепление), т.е. за счет циклирования. Многократное повторение этого цикла приводит к укорочению миоцита или к развитию им мышечного напряжения. Мостик может подвергаться дефосфорилированию. Оно происходит под влиянием миозиновой фосфатазы (или протеинфосфатазы ЛЦМ, или фосфатазы ЛЦМ). В результате дефосфорилирования мостика его способность к взаимодействию с актиновой нитью уменьшается, что приводит к снижению силы сокращения или к полному расслаблению. Расслаблению миоцитов матки также способствует снижение концентрации ионов Са2+ в цитозоле, так как это тормозит процесс фосфорилирования ЛЦМ и способствует отсоединению дефосфорилированных мостиков. Для миоцитов матки характерна генерация не только фазных, но и тонических сокращений (тонуса), т.е. длительного сокращения, протекающего без расслабления. В основе этого процесса лежит сочетание процесса фосфорилирования ЛЦМ, которое происходит с участием киназы ЛЦМ (это Са2+-зависимый процесс) и с участием неканонических киназ (Са2+-независимый процесс). В настоящее время считается [51–53], что к числу неканонических киназ относятся Rho-киназа, взаимодействующая с молнией протеинкиназа (ZIP-киназа), интегрин-зависимая киназа, киназа, зависимая от белка р21 и малых ГТФ-аз. Так как активность неканонических киназ не зависит от концентрации ионов Са2+ в цитозоле, то процесс фосфорилирования ЛЦМ под влиянием неканонических киназ получил название Са2+-независимого фосфорилирования миозина. Неканонические киназы активируются не за счет ионов Са2+, а за счет фосфорилирования, которое осуществляется с участием ряда протеинкиназ, среди которых RhoА-белок, PKC, МАРK. Поэтому вещества, активирующие указанные протеинкиназы (за счет взаимодействия с рецепторами, ассоциированными с G-белками), например, альфа-адреномиметики, ацетилхолин, гистамин и окситоцин, повышают фазную и тоническую активность миоцитов матки. Способность неканонических киназ фосфорилировать ЛЦМ при низком уровне ионов Са2+ в среде, а тем самым индуцировать тоническое сокращение, получило название Са2+-сенситизации [51, 52, 55].
Известно [51–54], что сократимость миоцитов матки во многом зависит от состояния миозиновой фосфатазы, так как с ее участием происходит дефосфорилирование ЛЦМ и тем самым – расслабление. Поэтому вещества, повышающие активность миозиновой фосфатазы, снижают сократимость, а вещества, ингибирующие этот фермент, усиливают ее [51]. Ингибиторами миозиновой фосфатазы являются те же неканонические протеинкиназы, которые вызывают фосфорилирование миозина, т.е. Rho-киназа, ZIP-киназа, интегрин-зависимая киназа, киназа, зависимая от белка р21 и малых ГТФ-аз [51, 55]. Ингибирование миозиновой фосфатазы является компонентом феномена Са2+-сенситизации, т.е. сокращения миоцитов матки на фоне низкого содержания ионов Са2+ в цитозоле.
В целом, процесс сокращения и расслабления миоцитов матки можно представить в виде таких этапов как: связывание ионов Са2+ кальмодулином, входящим в состав киназы ЛЦМ → активация киназы ЛЦМ → фосфорилирование ЛЦМ → взаимодействие миозина с актиновыми нитями с участием миозиновых мостиков → гидролиз АТФ → высвобождение энергии → скольжение миозиновых нитей относительно актиновых нитей, т.е. акт сокращения → снижение уровня Са2+ в цитозоле → дефосфорилирование ЛЦМ с помощью миозиновой фосфатазы → расслабление (окончание фазного сокращения) или развитие тонического сокращения за счет фосфорилирования ЛЦМ с участием неканонических киназ (реализация феномена Са2+-сенситизации).
Все сказанное имеет прямое отношение к пониманию механизма утеростимулирующего действия окситоцина. Дело в том, что окситоцин рассматривается в качестве активатора Rho-киназы, в результате чего возрастает Са2+-независимое фосфорилирование ЛЦМ и одновременно ингибируется активность миозиновой фосфатазы, что в итоге формирует феномен Са2+-сенситизации миозина, проявляющийся в существенном повышении силы фазного и тонического компонентов сокращения на фоне относительно невысоких концентраций ионов Са2+ в цитозоле [6, 15, 17, 20, 21, 23, 24, 56–58].
Не вдаваясь в детали, отметим, что согласно данным литературы [51, 52], Rho-киназа представляет собой разновидность протеинкиназ. Она находится в клетке в неактивном состоянии. Ее активация происходит под влиянием RhoА-белка, находящегося в комплексе с ГТФ. Известно, что RhoА-белок входит в семейство малых ГТФ-аз (их более 200), играющих важную роль в функционировании клетки. В клетке RhoА-белок также находится в неактивном состоянии. Активация его происходит под влиянием альфа-субъединицы G-белка, которая отсоединяется от него при активации рецептора, ассоциированного с этим белком. В частности, такое происходит при взаимодействии окситоцина с OTR [6, 23, 24, 56–58]. Помимо активации Rho-киназы, окситоцин, возможно, активирует и другие неканонические протеинкиназы (ZIP-киназу, интегрин-зависимую киназу и киназу, зависимую от белка р21 и малых ГТФ-аз). Все это способствует фосфорилированию ЛЦМ даже при низких концентрациях ионов Са2+ в цитозоле, благодаря чему повышается сила сокращения миоцитов матки [6, 15, 17, 20, 21, 23, 24, 56–58]. Одновременно окситоцин, активируя Rho-киназу, повышает фосфорилирование миозиновой фосфатазы и тем самым ингибирует ее активность, что снижает скорость расслабления и приводит к длительному сохранению тонуса миоцитов, т.е. к тонической активности. Таким образом, ингибируя миозиновую фосфатазу, окситоцин повышает чувствительность ЛЦМ к ионам Са2+, т.е. способствует реализации феномена Са2+-сенситизации [6, 7, 17, 20, 23, 56, 59, 60].
Действительно, рост фосфорилирования ЛЦМ (20 кДа) при действии окситоцина, при котором повышается сила сокращения, отмечен многими авторами, в том числе в опытах с миометрием небеременных крыс [17, 20–22], беременных крыс [17], небеременных и беременных буйволиц [7], а также беременных женщин [6, 15, 21, 23]. Аналогично, многие исследователи выявили снижение активности миозиновой фосфатазы под влиянием окситоцина. Это отмечено в опытах с миометрием небеременных крыс [17, 20, 21], беременных крыс [17, 61], небеременных и беременных буйволиц [7], а также небеременных [21] и беременных [21, 23, 56, 60–62] женщин. Так, в опытах с миометрием небеременных крыс показано [20], что под влиянием окситоцина в миоцитах матки происходит транслокация RhoA-белка к плазматической мембране, где он активирует RhoA-киназу, в результате чего повышается фосфорилирование ЛЦМ и ингибируется миозиновая фосфатаза. Все это повышает чувствительность ЛЦМ к ионам Са2+ и тем самым повышает силу сокращения миометрия. Это положение доказывается тем, что утеростимулирующий эффект окситоцина блокируется селективным ингибитором RhoA-киназы препаратом Y27632 [20]. В опытах с миометрием беременных женщин показано [57], что окситоцин увеличивает чувствительность ЛЦМ к ионам Ca2+, т.е. вызывает феномен Са2+-сенситизации, и тем самым повышает вероятность фосфорилирования ЛЦМ с участием неканонических киназ. В опытах с миометрием беременных женщин отмечено [56], что окситоцин повышает активность Rho-киназы и тем самым увеличивает чувствительность ЛЦМ к ионам Са2+ (так как при одном и том же уровне Са2+ в цитозоле сила сокращения выше на фоне окситоцина) и одновременно ингибирует миозиновую фосфатазу, что в целом повышает силу сокращения. В другом исследовании, выполненном на миометрии небеременных крыс и женщин показано [21], что ингибиторы киназы ЛЦМ вортманин и препарат ML-9 полностью блокируют утеростимулирующий эффект окситоцина, но при этом они не блокируют подъем концентрации ионов Са2+ в цитозоле, индуцированный окситоцином. Косвенно это доказывает, что под влиянием окситоцина происходит активация киназы ЛЦМ и тем самым усиление фосфорилирования ЛЦМ. Способность окситоцина повышать активность Rho-киназы, а тем самым повышать силу сокращений, продемонстрирована и в опытах с миометрием небеременных крыс, которым вводился эстроген [22]. Однако не все авторы наблюдали феномен Са2+-сенситизации ЛЦМ при действии окситоцина. Так, L. Mackenzie с соавт. [30] в опытах с культурой миоцитов матки женщин показали, что под влиянием окситоцина возрастает и концентрация ионов Са2+ в цитозоле интенсивность фосфорилирования ЛЦМ, т.е. феномен Са2+-сенситизации не обнаружен.
Показано [63], что у женщин как при срочных, так и при преждевременных родах в миометрии возрастает экспрессия Rho-белков, Rho-родственных белков, а также уровень мРНК Rho-A, что создает условия для активации Rho-киназ. Кроме того, у женщин накануне родов возрастает активность Rho-киназы [61]. Это явление расценивается как одно из проявлений индукции родов [61] и как основа утеростимулируюшего эффекта окситоцина [61, 62]. С учетом положений, изложенных в этом разделе, было выдвинуто представление [61, 62], согласно которому при преждевременных родах утеростимулирующий эффект окситоцина можно уменьшить за счет ингибирования Rhо-киназы. В настоящее время фармакологами создано более 170 ингибиторов Rhо-киназы, из которых два уже разрешены для клинического применения в ряде стран. В частности, это препарат фасудил, который разрешен для применения в Японии и Китае [64], и препарат рипасудил, разрешенный к применению в Японии [64]. Возможность снижать утеростимулирующий эффект окситоцина с помощью таких ингибиторов доказана в опытах с изолированным миометрием небеременных крыс [17, 20], беременных крыс [17, 61], небеременных и беременных буйволиц [7], а также в опытах с миометрием беременных женщин [23]. В частности, способность блокировать утеростимулирующий эффект окситоцина продемонстрирована для препарата Y27632, что показано в опытах с миометрием небеременных крыс [17, 20], а также в опытах с миометрием беременных (D21) крыс [17], в которых показано, что препарат Y27632, блокируя утеростимулирующий эффект окситоцина, снижает интенсивность фосфорилирования ЛЦМ, возникающего под влиянием окситоцина, и уменьшает способность окситоцина ингибировать миозиновую фосфатазу, но не влияет на окситоцин-индуцированную мобилизацию внутриклеточного Са2+ в гладкомышечных клетках матки [17]. Блокирующий эффект в отношении вызываемых окситоцином сокращений миометрия беременных крыс проявляли такие ингибиторы Rho-киназы как фасудил гидрохлорид и препарат AS1892802 [61]. В опытах с миометрием небеременных и беременных (ранние и средние сроки) буйволиц все ингибиторы Rho-киназы, в том числе препарат Y-27632, препарат GF109203X и препарат Pyr3 снижали утеростимулирующий эффект окситоцина [7]. Все эти данные [7, 17, 20, 22, 23], с одной стороны, подтверждают представление о том, что окситоцин активирует Rho-киназу, в результате чего возрастает чувствительность миозина к ионам Са2+ и ингибируется миозиновая фосфатаза, а с другой стороны, указывают на перспективность применения ингибиторов Rho-киназы в качестве токолитиков при лечении угрозы преждевременных родов.
Не исключено, что помимо роста чувствительности ЛЦМ к ионам Са2+ под влиянием окситоцина возрастает и экспрессия гена ЛЦМ и тем самым повышается синтез ЛЦМ. Действительно, в опытах с миометрием показано [25], что окситоцин активирует PKC, с участием которой активируется MAPК сигнальный путь, направленный на повышение синтеза ЛЦМ. Попутно отметим, что ингибирование миозиновой фосфатазы при действии окситоцина, как показано в работе [6], может также происходить с участием PKC, которая после активации под влиянием DAG либо непосредственно фосфорилирует фосфатазу и тем самым ингибирует ее, либо ингибирование происходит опосредованно – за счет активации ингибитора фосфатазы, роль которого играет белок CPI-17, т.е. ингибитор протеинфосфатазы-1, активируемый PKC.
Завершая обсуждение вопроса о роли феномена Са2+-сенситизации в утеростимулирующем эффекте окситоцина, отметим, что по мнению одних исследователей [15], повышение чувствительности ЛЦМ к ионам Са2+ является наиболее значимым в действии окситоцина на миометрий женщин, но по мнению других авторов [6, 65], этот феномен не играет существенной роли в утеростимулирующем действии окситоцина. Основой для такого утверждения служат данные о том, что в опытах с изолированным миометрием беременных женщин ингибитор Rho-киназы препарат Y-27632 не влиял существенно на спонтанные сокращения и на вызываемые окситоцином сокращения, хотя значительно снижал тоническое сокращение, вызываемое гиперкалиевым (60 мМ KCl) раствором Кребса [65].
6. Роль калиевых, натриевых и хлорных каналов в утеростимулирующем действии окситоцина. Как известно, миометрий человека и животных содержит различные виды калиевых каналов. Среди них Са2+-зависимые калиевые каналы (КСа-каналы), в том числе каналы большой проводимости, или ВК-каналы [66] и каналы малой проводимости, или SK-каналы [67]. Кроме того, в миометрии небеременных крыс имеются потенциалчувствительные калиевые каналы (Кv-каналы) [68], в том числе Kv4.3-каналы [68], а также калиевые каналы аномального выпрямления, или Кir-каналы, в частности, Kir7.1, которые выявлены в миометрии небеременных мышей [69]. В миоцитах матки обнаружены также АТФ-зависимые калиевые каналы (КАТФ-каналы, или Kir6-каналы), что показано для небеременных крыс [70], небеременных мышей [71], небеременных коз [72], небеременных [73], беременных [73–77] и рожающих [74] женщин. В миоцитах матки есть также двупоровые калиевые каналы, которые обнаружены в миометрии небеременных мышей, в том числе TREK1-каналы, т.е. каналы чувствительные к растяжению [78]; TASK2-каналы –чувствительные к сдвигу рН в кислую сторону [79] и TALK1-каналы, т.е. чувствительные к сдвигу рН в щелочную сторону [79]. В литературе сообщается, что при действии окситоцина на миоциты матки проницаемость калиевых каналов снижается, что способствует деполяризации миоцитов и повышению входа ионов Са2+ по Са2+-каналам L-типа. Это установлено в отношении Са2+-чувствительных калиевых каналов большой проводимости, или ВК-каналов [36, 80, 81], в отношении каналов малой проводимости, т.е. SK-каналов [82] и КАТФ-каналов [72–77]. Доказательством роли этих каналов в реализации утеростимулирующего эффекта окситоцина является тот факт, что селективные активаторы соответствующих калиевых каналов снижали этот эффект окситоцина. Так, активатор ВК-каналов препарат NS-1619 снижал его в опытах с миометрием беременных женщин [81]. Многочисленные активаторы КАТФ-каналов снижали эффект окситоцина на различных объектах. Среди них – пинацидил – в опытах с миометрием коз [72], небеременных мышей [74], беременных женщин [75–77]; кромакалим, диазоксид и никорандил – в опытах с миометрием небеременных мышей [74]; левкромакалим – в опытах с миометрием беременных женщин [75]; априкалим (препарат BRL 38227) – в опытах с миометрием беременных и небеременных женщин [73]; гидросульфид натрия (NaHS) как донор сероводорода (H2S) – в опытах с миометрием беременных и рожающих женщин [74]. Показано, что эффект окситоцина в опытах с миометрием мышей снижается при повышении экспрессии SK-каналов [82]. Другим доказательством роли калиевых каналов в эффектах окситоцина являются данные о повышении утеростимулирующего эффекта окситоцина на фоне блокаторов этих каналов, например, при действии эндогенного блокатора ВК-каналов, который секретируется хорионом, что выявлено в опытах с миометрием беременных морских свинок [83]; на фоне неселективного блокатора ВК-каналов ибериотоксина, это выявлено в опытах с миоцитами матки женщин [80]; на фоне глибенкламида как блокатора КАТФ-каналов, что показано в опытах с миометрием беременных женщин [73–75, 77] и в опытах с миометрием коз [72].
Таким образом, можно заключить, что при действии окситоцина снижается проницаемость калиевых каналов, в частности, Са2+-зависимых калиевых каналов большой (ВК-каналы) и малой (SK-каналы) проводимости, а также КАТФ-каналов. Вопрос о том, каким образом сигнал от ОTR передается на эти каналы, остается открытым. Не исключено, что это может происходить с участием IP3, DAG или PKC. В целом, представленные в этом разделе данные указывают на перспективность применения активаторов калиевых каналов в качестве токолитиков при терапии преждевременных родов.
Как известно, в миометрии имеется один вид натриевых каналов, роль которых сводится к генерации потенциала действия (совместно с ионами Ca2+, К+ и Сl–) [39, 54, 84]. Установлено, что при действии окситоцина на миометрий беременных (18–21 день) крыс интенсивность натриевого тока не меняется [31]. Косвенно это говорит о том, что эффект окситоцина не связан с изменением состояния натриевых каналов миоцитов. Согласно данным литературы [85–89], в различных клетках организма обнаруживаются три суперсемейства хлорных каналов – лиганд-активируемые хлорные каналы, в том числе ГАМК- и глицин-активируемые хлорные каналы; Са2+-активируемые хлорные каналы (СlСа-каналы, или CaCC), среди которых выделяют два типа – макси- и мини-каналы, или ANO1 и ANO2, т.е. обладающие разной проводимостью, а также потенциал-активируемые хлорные каналы (ClC), среди которых выделяют 10 разновидностей. Все виды хлорных каналов причастны к формированию мембранного потенциала и к его изменению под влиянием различных агентов. В миометрии человека и животных выявлены Са2+-активируемые хлорные каналы, т.е. каналы, открытие которых возрастает при увеличении концентрации ионов Са2+ в среде [29, 34, 54, 68, 87, 90–95]. Эти каналы блокируются такими веществами как нифлумовая кислота [92, 93], антрацен-9-карбоновая кислота [92, 93], 5-нитро-2-(3-фенилпропиламино) бензойная кислота [92], хлоротоксин [95], а их активация происходит под влиянием H2S [94]. Полагают, что Са2+-активируемые хлорные каналы имеют прямое отношение к генерации спонтанных сокращений под влиянием возбуждения телоцитов миометрия, т.е. своеобразных пейсмекеров миометрия [87, 90–93]. Кроме того, Са2+-активируемые хлорные каналы ответственны за процессы реполяризации миометрия и за число пиков потенциала действия при генерации очередного фазного сокращения. В частности, показано, что блокада Са2+-активируемых хлорных каналов снижает частоту генерации спонтанных сокращений изолированного миометрия мышей [87, 92], беременных крыс [65, 96] и беременных женщин [87], а также снижает силу фазных сокращений [96]. У крыс при беременности возрастает экспрессия Са2+-активируемых хлорных каналов, которая достигает максимума при родах [68]. Косвенно это говорит о возможном участии этих каналов в индукции родовой деятельности. Полагают, что блокада Са2+-активируемых хлорных каналов может быть использована для торможения маточной активности у женщин с преждевременными родами [87, 96].
Сообщается [29, 34, 87, 93], что под влиянием окситоцина увеличивается проницаемость Са2+-активируемых хлорных каналов. Это вызывает выход ионов хлора из клетки, т.е. деполяризацию миоцитов, что, в свою очередь, вызывает открытие Са2+-каналов L-типа, повышение входа ионов Са2+ внутрь клетки и, как следствие, повышение фазной и тонической активности миоцитов матки. Блокада Са2+-активируемых хлорных каналов снижает утеростимулирующий эффект окситоцина. Это отмечено при использовании нифлумовой кислоты [93] и других блокаторов хлорных каналов [29, 87]. Так, в опытах с одиночными клетками миометрия беременных крыс показано [34], что окситоцин преимущественно активирует хлорную и катионную проводимости. Хлорные и катионные токи вызывали увеличение внутриклеточной концентрации кальция в зависимости от высвобождения кальция из гепарин-чувствительных внутриклеточных запасов, т.е. из саркоплазматического ретикулюма. Авторы заключают, что стимуляция рецепторов окситоцина вызывает открытие хлорных и катионных каналов, активируемых кальцием, что приводит к деполяризации клеток миометрия. Эта деполяризация открывает, в свою очередь, потенциалзависимые Са2+-каналы. В опытах с миометрием беременных крыс показано [93], что утеростимулирующий эффект окситоцина, в том числе повышение концентрации ионов Са2+ в цитозоле снижается под влиянием нифлумовой кислоты как блокатора Са2+-активируемых хлорных каналов. В опытах с миометрием мышей и женщин показано [87], что утеростимулирующий эффект окситоцина снижается при блокаде Са2+-активируемых хлорных каналов типа ANO1 и ANO2; это означает, что указанные каналы причастны к эффектам окситоцина. В опытах с миометрием крыс и женщин показано [29], что утеростимулирующий эффект окситоцина снижается под влиянием блокатора Са2+-активируемых хлорных каналов; это указывает на значение хлорных каналов в реализации эффекта окситоцина.
Таким образом, утеростимулирующий эффект окситоцина может быть связан с повышением под его влиянием активности Са2+-активируемых хлорных каналов. Поэтому применение блокаторов этих каналов, типа нифлумовой кислоты в качестве токолитиков может иметь перспективу.
7. Значение экспрессии щелевых контактов (нексусов) для утеростимулирующего эффекта окситоцина. Согласно данным литературы [97–99], щелевые контакты между миоцитами матки, функцию которых выполняет белок коннексин-43, принадлежащий к семейству коннексинов, формируются к доношенному сроку беременности; их количество увеличивается при родах, но уже в течение 24 ч после родов они исчезают. Проводящая система щелевых контактов обеспечивает синхронизацию и координацию сокращений миометрия в активной фазе родов. Считают [97], что коннексины также способствуют наступлению лактации после родов, так как с их помощью происходит острая реорганизация ткани молочной железы, ведущая к лактации и к способности миоэпителиальных клеток к выдавливанию молока, в связи с чем недостаточная экспрессия коннексина у матери может привести к отсутствию лактации. Полагают [58, 100], что синтез коннексина во время беременности тормозится под влиянием прогестерона за счет его воздействия на ядерные рецепторы типа PR-B, чему противодействует ядерный транскрипционный фактор NF-kappaB, появляющийся при воспалении. Тем самым воспаление способствует подготовке миометрия к родам, в том числе и к преждевременным родам. Отдельные авторы полагают, что окситоцин может усиливать синтез коннексина-43, т.е. число щелевых контактов, и тем самым повысить взаимодействие между миоцитами матки, т.е. проводимость [6, 101–104]. Такой эффект окситоцина был продемонстрирован в опытах с изолированным миометрием беременных (37–40 недель) женщин [104]. В этих опытах миометрий выдерживали в течение 180 мин в буфере со стандартной концентрацией глюкозы и отдельных гормонов, после чего иммуноцитохимически (антиконнексин-43) и элекронно-микроскопически выявляли щелевые контакты. Авторы установили, что инкубация в буфере приводит к значительному уменьшению количества нексусов в миометрии. Эстрадиол и окситоцин по отдельности или в комбинации не задерживают это снижение, в то время как прогестерон в комбинации с окситоцином (независимо от наличия в среде эстрадиола) задерживает уменьшение числа нексусов. Эти результаты согласуются с данными о низком количестве нексусов в миометрии при беременности и резком увеличении числа этих контактов при начале активной родовой деятельности. Таким образом, эти данные свидетельствуют о том, что окситоцин на фоне высокого уровня прогестерона индуцирует синтез нексусов в миометрии женщин, что, вероятно, и происходит накануне родов. Показано, что у морской свинки, у которой уровень прогестерона перед родами не снижается (как и у женщин), окситоцин способствует образованию нексусов в миометрии [101]. Однако другие авторы полагают, что, окситоцин, действительно, индуцирует образование нексусов в миометрии, но опосредовано, а именно – за счет повышения в миометрии и плодных оболочках синтеза PG, которые непосредственно индуцируют экспрессию коннексина в миометрии [102]. При исследовании желтого тела бабуина (Papio hamadryus anubis) показано [103], что окситоцин, подобно хорионическому гонадотропину, индуцирует образование нексусов, т.е. повышает экспрессию коннексина-43 между стероидопродуцирующими клеткам, а прогестерон блокирует этот эффект окситоцина. На основании этих данных авторы не исключают, что и в миометрии окситоцин также индуцирует образование нексусов [103]. Обобщая эти данные, S. Arrowsmith и S. Wray [6] заключают, что необходимы более веские доказательства способности окситоцина повышать экспрессию нексусов в миометрии, а также важно понять механизм, лежащий в основе этого важного эффекта окситоцина.
8. МАРK путь и другие сигнальные пути при действии окситоцина. Помимо пути, идущего через Gq-белок к PLС, обнаружены и другие сигнальные пути, которые активируются при воздействии окситоцина на OTR [4, 5, 13, 14, 25, 27, 29]. Среди них важное значение имеет МАРK путь, который начинается с активации внеклеточно регулируемой киназы ERK1/2 или других МАРK. Этот путь может индуцироваться различными факторами. В частности, он может индуцироваться под влиянием PKC, которая активируется DAG, образующимся при активации Gq-белка [25], или он может индуцироваться с участием Gi- и Gs-белков [6, 14], а также, вероятно, с участием бета-аррестина, который способен образовывать комплексы с сигнальными молекулами, в том числе с МАРK. Активация МАРK пути может вызывать различные эффекты. Среди них – повышение синтеза PG [4, 6, 14], продукции ЛЦМ [25], синтеза коннексина-43, т.е. щелевых контактов [102], сократимости миоцитов матки, в том числе, за счет активации Rho-киназы [5], индукция процесса регенерации и пролиферации скелетных мышечных волокон [105], регулирование процессов пролиферации различных клеток [13, 27], активация созревания нейронов мозга в антенатальный и постнатальный периоды [106].
9. Заключение (основные механизмы, лежащие в основе утеростимулирующего действия окситоцина). Окситоцин, активируя ОTR, которые ассоциированы с G-белком, вызывает различные физиологические эффекты. В данной статье основное внимание уделено механизмам, лежащим в основе способности окситоцина повышать сократительную деятельность матки, а тем самым участвовать в индукции родовой деятельности и в рождении плода и плаценты. Нарушение этого механизма может приводить к преждевременным родам или к развитию слабости родовой деятельности, дискоординированной родовой деятельности и к другим аномалиям сократительной деятельности матки. Поэтому так много внимания уделяется изучению механизмов, лежащих в основе утеростимулирующего действия окситоцина.
Общепризнанно (рис. 1), что при взаимодействии окситоцина с ОTR происходит активация одного из многочисленных G-белков. При утеростимулирующем эффекте окситоцина им является Gq-белок, который, распадаясь на альфа-, бета- и гамма-субъединицы, активирует PLС. Под влиянием PLС происходит распад фосфоинозитолдифосфата до IP3 и DAG. В свою очередь, IP3 активирует IP3-рецепторы саркоплазматического ретикулюма, т.е. Са2+-каналы, что вызывает выход ионов Са2+ из саркоплазматического ретикулюма в цитозоль. Это повышает в цитозоле концентрацию Са2+ до уровня, необходимого для фосфорилирования ЛЦМ, которое осуществляется с участием киназы ЛЦМ, т.е. для индукции фазного сокращения. Вопрос о других источниках ионов Са2+, необходимых для активации киназы ЛЦМ, продолжает обсуждаться в литературе. По одной версии, порция ионов Са2+, вышедшая из саркоплазматического ретикулюма, повышает вход Са2+ в цитозоль из среды по Са2+-каналам L-типа. По другой версии, наоборот, эта порция блокирует каналы. По третьей версии, ионы Са2+ поступают в цитозоль из среды по Са2+-каналам L-типа вследствие того, что их проницаемость возрастает в результате деполяризации миоцитов, которая происходит: 1) за счет снижения проницаемости калиевых каналов, которые в миоцитах матки представлены такими каналами как Са2+-зависимые калиевые каналы большой проводимости (ВК-каналы), Са2+-зависимые калиевые каналы малой проводимости (SK-каналы) и АТФ-зависимые калиевые каналы (КАТФ-каналы); 2) за счет повышения активности хлорных каналов, которые в миоцитах матки представлены в виде Са2+-активируемых хлорных каналов. Одновременно окситоцин снижает интенсивность работы PMCA, что также способствует повышению концентрации ионов Са2+ в цитозоле. Вследствие того, что окситоцин уменьшает запасы Са2+ в саркоплазматическом ретикулюме, то с участием IP3 и/или DAG активируются SOC-каналы, которые в миометрии представлены такими изоформами как TRPC1-, TRPC3-, TRPC4-, STIM1-, Orai1-, Orai2- и Orai3-каналами. В результате этой активации ионы Са2+ из внеклеточного пространства входят в саркоплазматический ретикулюм, пополняя его запасы и создавая условия для длительного утеростимулирующего эффекта окситоцина. Пока нет данных о способности окситоцина блокировать работу SERCA, что могло бы способствовать повышению [Са2+] в цитозоле. В то же время важным для проявления утеростимулирующего эффекта окситоцина является его способность вызывать феномен Са2+-сенситизации миозина, т.е. повышение чувствительности ЛЦМ к ионам Са2+. Этот феномен заключается в том, что окситоцин вызывает Са2+-независимое фосфорилирование ЛЦМ с участием активируемых им неканонических протеинкиназ, включая Rho-киназу, а также, возможно, ZIP-киназу, интегрин-зависимую киназу, киназу, зависимую от белка р21 и малых ГТФ-аз, а также за счет ингибирования миозиновой фосфатазы, которое происходит с участием активируемой окситоцином Rho-киназы. Получены убедительные данные, подтверждающие способность окситоцина повышать активность Rho-киназы (за счет активации малых ГТФ-аз, в том числе RhA-белка). Ингибирование миозиновой фосфатазы происходит также за счет того, что DAG, активируя PKC, повышает активность 17-kDa-ингибитора протеин-фосфатазы-1, т.е. миозиновой фосфатазы. В целом, Са2+-независимое фосфорилирование миозина и ингибирование миозиновой фосфатазы обеспечивают тонический компонент утеростимулирующего эффекта окситоцина.
Рис. 1.
Механизм утеростимулирующего действия окситоцина. ОТ – окситоцин, OTR – окситоциновый рецептор, MLCK – киназа легких цепей миозина (киназа ЛЦМ), PLC – фосфолипаза С, PIP2 – фосфоинозитолдифосфат, IP3 – инозитолтрифосфат, DAG – диацилглицерол, CPI-17 – протеин-фосфатаза-1, MLCP – миозиновая фосфатаза, Rho-A – белок Rho-A, ROCK – RhoA-связанная протеинкиназа, PLA2 – фосфолипаза A2, COX-2 – циклооксигеназа 2, TRP, SOCE – SOC-каналы, т.е. Ca-каналы, управляемые Са-депо, МАРК – митоген-активируемая протеинкиназа, PGF2α – простагландин F2α, PGЕ2 – простагландин Е2 (по [6] в нашей модификации).
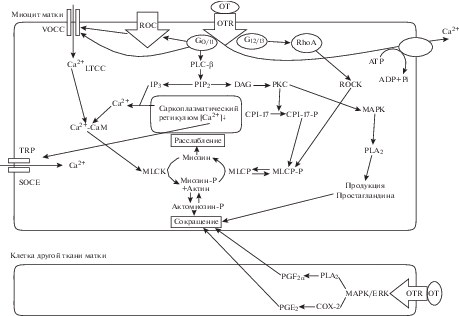
Кроме того, активация PKC, как и активация Gi- и Gs-белков, вызывает активацию MAPK пути, в частности, активацию внеклеточно регулируемой сигнальной протеинкиназы (ERK1/2), либо р38-МАР-киназы, в результате чего повышается синтез PG, ЛЦМ, коннексина-43, участвующего в образовании нексусов, активируется Rho-киназа, что в итоге способствует росту силы сокращения миоцитов матки, а также изменению интенсивности процессов клеточной пролиферации и процессов созревания нейронов мозга. Наличие МАРK пути в действии окситоцина свидетельствует о том, что сигнал от ОTR может передаваться не только на Gq-белок, но и на другие G-белки (в частности, на Gi-, Gs-, Go-белки), а тем самым могут индуцироваться другие сигнальные пути. Этим объясняется известный факт, что свои многочисленные физиологические эффекты окситоцин реализует, активируя ОTR, которые, как это неудивительно, представлены лишь одним видом [6, 95]. Действительно, согласно данным литературы [4, 6, 11, 39, 106], окситоцин, помимо повышения фазной и тонической активности миоцитов матки, обеспечивающей рождение плода и плаценты, и помимо повышения активности миоэпителиальных клеток молочной железы, обеспечивающей лактацию, также способен повышать синтез PG в миометрии и плодных оболочках, усиливать, или наоборот, тормозить пролиферативные процессы, повышать регенерацию миоцитов матки, повышать синтез коннексина-43, т.е. повышать образование межклеточных контактов. Кроме того, окситоцин способствует созреванию нейронов мозга в период внутриутробного развития и в раннем постнатальном периоде; участвует в регуляции продукции гипофизарных, надпочечниковых и яичниковых гормонов; причастен к регуляции эстрального цикла и фолликулогенеза; участвует в регуляции сексуальной активности мужчин (эрекция, эякуляция) и женщин; участвует в регуляции просоциального поведения (аффилированного, сексуального, родительского). Окситоцин также участвует в регуляции метаболизма, деятельности прооксидантной и антиоксидантной систем, влияет на состояние системы гемостаза, иммунитета, системы выделения, участвует в регуляции сердечно-сосудистой и дыхательной систем, в регуляции пищевого поведения, в реализации стресс-реакций, будучи компонентом антиноцицептивной системы, участвует в формировании эмоций и в реализации таких когнитивных процессов как память, внимание, мышление и речь. Будущие исследования должны уточнить сигнальные пути, реализующие каждый физиологический эффект окситоцина, а также механизмы, регулирующие запуск соответствующего сигнального пути. Вероятно, это определяется изоформой G-белка, с которой ассоциирован ОTR [107], локализацией этого рецептора в мембране клетки, т.е. в зависимости от содержания кавеолина и холестерина в местах нахождения ОTR [6, 36, 108], а также видом адаптерного белка бета-аррестина, который, как полагают, выполняет функцию переключателя сигнальных путей, активируемых окситоцином. Способность окситоцина индуцировать разные сигнальные пути (даже в одной и той же клетке), называется “расщеплением” рецептора и G-белка (receptor-G protein promiscuity) [107]. Она, являясь уникальной для окситоцина, позволяет окситоцину вызывать разнообразные физиологические эффекты.
При анализе механизмов действия окситоцина следует также иметь ввиду возможность окситоцина оказывать свои эффекты, в том числе, утеростимулирующий, за счет взаимодействия с вазопрессиновыми рецепторами типа V1A и V2, которые, как известно [6, 109], имеются в миоцитах матки, и которые (в частности, вазопрессиновые рецепторы типа V1A) могут блокироваться атозибаном – относительно селективным блокатором ОTR [57, 110]. Однако вопрос о роли вазопрессиновых рецепторов в эффектах окситоцина пока не решен, причиной чему, по мнению ряда авторов [6], является отсутствие селективных агонистов и антагонистов окситоциновых и вазопрессиновых рецепторов. Будущие исследования должны также раскрыть механизмы, лежащие в основе патогенеза таких нейропсихических состояний как расстройства аутистического спектра (аутизм), шизофрения, просоциальная тревожность, депрессивные состояния, агрессивность, которые, согласно данным литературы [4, 106, 111–115], обусловлены дефицитом окситоцина. Все это позволит глубже понять физиологическую роль окситоцина и создавать новые технологии, направленные на коррекцию тех физиологических процессов, которые реализуются с участием окситоцина.
Список литературы
Phaneuf S., Europe-Finner G.N., Carrasco M.P., Hamilton C.H., López Bernal A. Oxytocin signalling in human myometrium. Adv. Exp. Med. Biol. 395: 453–467. 1995.
Arthur P., Taggart M.J., Mitchell B.F. Oxytocin and parturition: A role for increased myometrial calcium and calcium sensitization? Front. Biosci. 12: 619–633. 2007.
Чернышева М.П., Ноздрачев А.Д. Нонапептид окситоцин: соматические и висцеральные функции при некоторых психопатологиях. Психофармакол. биол. наркол. 9 (3–4): 2574–2590. 2009. [Chernysheva M.P., Nozdrachev A.D. [Nonapeptide oxytocin: Somatic and visceral functions in certain psychopathologies]. Psihofarmakol. Biol. Narkol. 9(3–4): 2574–2590. 2009. (In Russ.)].
Vrachnis N., Malamas F.M., Sifakis S., Deligeoroglou E., Iliodromiti Z. The oxytocin-oxytocin receptor system and its antagonists as tocolytic agents. Int. J. Endocrinol. 2011. art. 350546. 2011.
Wrzal P.K., Goupil E., Laporte S.A., Hébert T.E., Zingg H.H. Functional interactions between the oxytocin receptor and the β2-adrenergic receptor: Implications for ERK1/2 activation in human myometrial cells. Cell Signal. 24(1): 333–341. 2012.
Arrowsmith S., Wray S. Oxytocin: its mechanism of action and receptor signalling in the myometrium. J. Neuroendocrinol. 26(6): 356–369. 2014.
Sharma A., Nakade U.P., Choudhury S., Garg S.K. Functional involvement of protein kinase C, Rho-kinase and TRPC3 decreases while PLC increases with advancement of pregnancy in mediating oxytocin-induced myometrial contractions in water buffaloes (Bubalus bubalis). Theriogenology. 92: 176–189. 2017.
Asbóth G., Phaneuf S., Europe-Finner G.N., Tóth M., Bernal A.L. Prostaglandin E2 activates phospholipase C and elevates intracellular calcium in cultured myometrial cells: Involvement of EP1 and EP3 receptor subtypes. Endocrinology. 37(6): 2572–2579. 1996.
Mhaouty-Kodja S., Houdeau E., Cohen-Tannoudji J., Legrand C. Catecholamines are not linked to myometrial phospholipase C and uterine contraction in late pregnant and parturient mouse. J. Physiol. 536 (Pt 1): 123–131. 2001.
Koehbach J., Stockner T., Bergmayr C., Muttenthaler M., Gruber C. W. Insights into the molecular evolution of oxytocin receptor ligand binding. Biochem. Soc. Trans. 41(1): 197–204. 2013.
Szukiewicz D., Bilska A., Mittal T. K., Stangret A., Wejman J., Szewczyk G., Pyzlak M., Zamlynski J. Myometrial contractility influences oxytocin receptor (OXTR) expression in term trophoblast cells obtained from the maternal surface of the human placenta. BMC Pregnancy Childbirth. 15: art. 220. 2015.
Viero C., Shibuya I., Kitamura N., Verkhratsky A., Fujihara H., Katoh A., Ueta Y., Zingg H. H., Chvatal A., Sykova E., Dayanithi G. Review: Oxytocin: Crossing the bidge between basic science and pharmacotherapy. CNS Neurosci. Ther. 16(5): e138–e156. 2010.
Rimoldi V., Reversi A., Taverna E., Rosa P., Francolini M., Cassoni P., Parenti M., Chini B. Oxytocin receptor elicits different EGFR/MAPK activation patterns depending on its localization in caveolin-1 enriched domains. Oncogene. 22(38): 6054–6060. 2003.
Kim S.H., MacIntyre D.A., Hanyaloglu A.C., Blanks A.M., Thornton S., Bennett P.R., Terzidou V. The oxytocin receptor antagonist, Atosiban, activates pro-inflammatory pathways in human amnion via Gαi signalling. Mol. Cell Endocrinol. 420: 11–23. 2016.
Shmygol A., Gullam J., Blanks A., Thornton S. Multiple mechanisms involved in oxytocin-induced modulation of myometrial contractility. Acta Pharmacol. Sin. 27(7): 827–832. 2006.
Loirand G. Rho kinases in health and disease: From basic science to translational research. Pharmacol. Rev. 67(4): 1074–1095. 2015.
Tahara M., Morishige K., Sawada K., Ikebuchi Y., Kawagishi R., Tasaka K., Murata Y. RhoA/Rho-kinase cascade is involved in oxytocin-induced rat uterine contraction. Endocrinology. 143(3): 920–929. 2002.
Struckhoff A.P., Rana M.K., Worthylake R.A. RhoA can lead the way in tumor cell invasion and metastasis. Front. Biosci. (Landmark Ed). 16: 1915–1926. 2011.
Matsuoka T., Yashiro M. Rho/ROCK signaling in motility and metastasis of gastric cancer. World J. Gastroenterol. 20(38): 13756–13766. 2014.
Somlyo A.P., Somlyo A.V. From pharmacomechanical coupling to G-proteins and myosin phosphatase. Acta Physiol. Scand. 164(4): 437–448. 1998.
Longbottom E.R., Luckas M.J., Kupittayanant S., Badrick E., Shmigol T., Wray S. The effects of inhibiting myosin light chain kinase on contraction and calcium signalling in human and rat myometrium. Pflugers Arch. 440(2): 315–321. 2000.
Trujillo M.M., Ausina P., Savineau J.P., Marthan R., Strippoli G., Advenier C., Pinto F.M., Candenas M.L. Cellular mechanisms involved in iso-osmotic high K+ solutions-induced contraction of the estrogen-primed rat myometrium. Life Sci. 66(25): 2441–2453. 2000.
Hudson C.A., Heesom K. J., López Bernal A. Phasic contractions of isolated human myometrium are associated with Rho-kinase (ROCK)-dependent phosphorylation of myosin phosphatase-targeting subunit (MYPT1). Mol. Hum. Reprod. 18(5): 265–279. 2012.
Hudson C.A., Bernal A.L. The regulation of myosin phosphatase in pregnant human myometrium. Biochem. Soc. Trans. 40(1): 262–267. 2012.
Devost D., Wrzal P., Zingg H.H. Oxytocin receptor signalling. Prog. Brain Res. 170: 167–176. 2008.
Pont J.N., McArdle C.A., López Bernal A. Oxytocin-stimulated NFAT transcriptional activation in human myometrial cells. Mol. Endocrinol. 26(10): 1743–1756. 2012.
Klenerová V., Hynie S. Some newer findings concerning oxytocin receptor signaling. Cesk. F-ysiol. 57(2–3): 76–82. 2008.
Wassdal I., Nicolaysen G., Iversen J.G. Bradykinin causes contraction in rat uterus through the same signal pathway as oxytocin. Acta Physiol. Scand. 164(1): 47–52. 1998.
Alotaibi M.F. The response of rat and human uterus to oxytocin from different gestational stages in vitro. Gen. Physiol. Biophys. 36(1): 75–82. 2017.
Mackenzie L.W., Word R.A., Casey M.L., Stull J.T. Myosin light chain phosphorylation in human myometrial smooth muscle cells. Am. J. Physiol. 258 (1, Pt 1): C92–C98. 1990.
Inoue Y., Shimamura K., Sperelakis N. Oxytocin actions on voltage-dependent ionic channels in pregnant rat uterine smooth muscle cells. Can. J. Physiol. Pharmacol. 70(12): 1597–1603. 1992.
Fu X., Moberg C., Bäckström T., Ulmsten U., Gylfe E. Anisomycin and verapamil influence the action of progesterone on regulation of term human myometrial contractile activity. Clin. E-ndocrinol. (Oxf.). 47(3): 349–355. 1997.
Шлыков С.Х. Окситоцин и его роль в контроле внутриклеточного уровня ионов кальция в миометрии. Укр. биохим. журн. 82(2): 5–14. 2010. [Shlykov S.H. Oxytocin and its role in controlling the intracellular level of calcium ions in the myometrium. Ukr. Biohim. zhurn. 82(2): 5–14. 2010. (In Russ.)].
Arnaudeau S., Leprêtre N., Mironneau J. Oxytocin mobilizes calcium from a unique heparin-sensitive and thapsigargin-sensitive store in single myometrial cells from pregnant rats. Pflugers Arch. 428(1): 515–519. 1994.
Абрамченко В.В., Щербина Л.А., Кузьминых Т.У. Роль оксида азота и его донаторов в регуляции сократительной деятельности матки. Журн. акушерства и женских болезней. (1): 58–63. 1998. [Abramchenko V.V., Shherbina L.A., Kuz’minyh T.U. The role of nitric oxide and its donators in the regulation of uterine contractile activity. J. Obstetrics Womans Diseas. (1): 58–63. 1998. (In Russ.)].
Noble K., Matthew A., Burdyga T., Wray S. A review of recent insights into the role of the sarcoplasmic reticulum and Ca entry in uterine smooth muscle. Eur. J. Obstet. Gynecol. Reprod. Biol. 144 (Suppl 1): S11–S19. 2009.
Тепляшина Е.А., Лопатина О.Л., Екимова М.В., Пожиленкова Е.А., Салмина А.Б. Роль окситоцина и окситоциновых рецепторов в регуляции репродуктивных функций и фолликулогенеза. Сибирск. мед. журн. (8): 21–26. 2013. [Tepljashina E.A., Lopatina O.L., Ekimova M.V., Pozhilenkova E.A., Salmina A.B. The role of oxytocin and oxytocin receptors in the regulation of reproductive functions and folliculogenesis. Sibirsk. Med. zhurn. (8): 21–26. 2013. (In Russ.)].
Циркин В.И., Бордуновская В.П., Пешиков В.Л. Влияние веществ-стимуляторов на сократительную активность изолированного миометрия крыс на фоне различных блокаторов кальциевой проницаемости. Физиол. журн. СССР им. И.М. Сеченова. 66(2): 279–287. 1980. [Cirkin V.I., Bordunovskaja V.P., Peshikov V.L. The effect of stimulating substances on the contractile activity of isolated rat myometrium against the background of various calcium permeability blockers. Fiziol. Zhurn. SSSR im. I.M. Sechenova. 66(2): 279–287. 1980. (In Russ.)].
Циркин В.И., Дворянский С.А. Сократительная активность матки (механизмы регуляции). Киров. КГМИ. 1997. [Cirkin V.I., Dvorjanskij S.A. Sokratitel’naja aktivnost' matki (mehanizmy reguljacii). [Contractile activity of the uterus (regulation mechanisms)]. Kirov. KGMI. 1997. (In Russ.)].
Akerman K.E., Wikström M.K. Ca2+. Mg2+-stimulated ATPase activity of rabbit myometrium plasma membrane is blocked by oxytocin. FEBS Lett. 97(2): 283–287. 1979.
Костерин С.А., Курский М.Д. Механизмы регуляции концентрации Са2+ в клетках миометрия. Укр. биохим. журн. 57(5): 100–116. 1985. [Kosterin S.A., Kurskij M.D. Mechanisms of regulation of Ca2+ concentration in myometrium cells. Ukr. biohim. zhurn. 57(5): 100–116. 1985. (In Russ.)].
Popescu L.M., Nutu O., Panoiu C. Oxytocin contracts the human uterus at term by inhibiting the myometrial Ca2+-extrusion pump. Biosci. Rep. 5(1): 21–28. 1985.
Monga M., Campbell D.F., Sanborn B.M. Oxytocin-stimulated capacitative calcium entry in human myometrial cells. Am. J. Obstet. Gynecol. 181(2): 424–429. 1999.
Chung D., Kim Y.S., Phillips J.N., Ulloa A., Ku C.Y., Galan H.L., Sanborn B.M. Attenuation of canonical transient receptor potential-like channel 6 expression specifically reduces the diacylglycerol-mediated increase in intracellular calcium in human myometrial cells. Endocrinology.151(1): 406–416. 2010.
Murtazina D.A., Chung D., Ulloa A., Bryan E., Galan H.L., Sanborn B.M. TRPC1, STIM1, and ORAI influence signal-regulated intracellular and endoplasmic reticulum calcium dynamics in human myometrial cells. Biol. Reprod. 85(2): 315–326. 2011.
Young R.C. Sarcoplasmic reticulum, calcium waves and myometrial signalling. Novartis Found. Symp. 246: 174–182. 2002.
Phillippe M., Basa A. Effects of sodium and calcium channel blockade on cytosolic calcium oscillations and phasic contractions of myometrial tissue. J. Soc. Gynecol. Investig. 4(2): 72–77. 1997.
Awad S.S., Lamb H.K., Morgan J.M., Dunlop W., Gillespie J.I. Differential expression of ryanodine receptor RyR2 mRNA in the non-pregnant and pregnant human myometrium. Biochem. J. 322 (Pt 3): 777–783. 1997.
Hofmann T., Obukhov A.G., Schaefer M., Harteneck C., Gudermann T., Schultz G. Direct activation of human TRPC6 and TRPC3 channels by diacylglycerol. Nature. 397(6716): 259–263. 1999.
Ulloa A., Gonzales A.L., Zhong M., Kim Y.S., Cantlon J., Clay C., Ku C.Y., Earley S., Sanborn B.M. Reduction in TRPC4 expression specifically attenuates G-protein coupled receptor-stimulated increases in intracellular calcium in human myometrial cells. Cell Calcium. 46(1): 73–84. 2009.
Воротников А.В., Щербакова О.В., Кудряшова Т.В., Тарасова О.С., Ширинский В.П., Пфитцер Г., Ткачук В.А. Фосфорилирование миозина как основной путь регуляции сокращения гладких мышц. Рос. физиол. журн. им. И.М. Сеченова. 95(10): 1058–1073. 2009. [Vorotnikov A.V., Shherbakova O.V., Kudrjashova T.V., Tarasova O.S., Shirinskij V.P., Pfitcer G., Tkachuk V.A. Myosin phosphorylation as the main pathway for the regulation of smooth muscle contraction. Russ. J. Physiol. 95(10): 1058–1073. 2009. (In Russ.)].
Воротников А.В. Хемотаксис: движение, направление, управление. Успехи биол. химии. 51(8): 335–400. 2011. [Vorotnikov A.V. Chemotaxis: movement, direction, control. Uspehi biol. himii. 51(8): 335–400. 2011. (In Russ.)].
Morgan K.G. The importance of the smooth muscle cytoskeleton to preterm labour. Exp. Physiol. 99(3): 525–529. 2014.
Sanborn B.M., Ku C.Y., Shlykov S., Babich L. Molecular signaling through G-protein-coupled receptors and the control of intracellular calcium in myometrium. J. Soc. Gynecol. Investig. 12(7): 479–487. 2005.
Ihara E., MacDonald J.A. The regulation of smooth muscle contractility by zipper-interacting protein kinase. Can. J. Physiol. Pharmacol. 85(1): 79–87. 2007.
McKillen K., Thornton S., Taylor C.W. Oxytocin increases the [Ca2+]i sensitivity of human myometrium during the falling phase of phasic contractions. Am. J. Physiol. 276 (2, Pt 1): E345–E351. 1999.
Thornton S., McKillen H.-C., Taylor C. W. Oxytocin increases the sensitivity in vitro of the contractile apparatus to Ca2+ in human pregnant myometrium. J. Physiol. Proc. 506: 144. 1998.
Thota C., Farmer T., Garfield R., Menon R., Al-Hendy A. Vitamin D elicits anti-inflammatory response, inhibits contractile-associated proteins, and modulates Toll-like receptors in human myometrial cells. Reprod. Sci. 20(4): 463–475. 2013.
Aguilar H.N., Tracey C.N., Tsang S.C., McGinnis J.M., Mitchell B.F. Phos-tag-based analysis of myosin regulatory light chain phosphorylation in human uterine myocytes. PLoS One. 6(6): art. e20903. 2011.
Lartey J., López Bernal A. RHO protein regulation of contraction in the human uterus. Reproduction. 138(3): 407–424. 2009.
Ergul M., Turgut N.H., Sarac B., Altun A., Yildirim Ş., Bagcivan I. Investigating the effects of the Rho-kinase enzyme inhibitors AS1892802 and fasudil hydrochloride on the contractions of isolated pregnant rat myometrium. Eur. J. Obstet. Gynecol. Reprod. Biol. 202: 45–50. 2016.
Hutchinson J.L., Rajagopal S.P., Yuan M., Norman J.E. Lipopolysaccharide promotes contraction of uterine myocytes via activation of Rho/ROCK signaling pathways. FASEB J. 28(1): 94–105. 2014.
Lartey J., Smith M., Pawade J., Strachan B., Mellor H., López Bernal A. Up-regulation of myometrial RHO effector proteins (PKN1 and DIAPH1) and CPI-17 (PPP1R14A) phosphorylation in human pregnancy is associated with increased GTP-RHOA in spontaneous preterm labor. Biol. Reprod. 76(6): 971–982. 2007.
Feng Y., LoGrasso P.V., Defert O., Li R. Rho kinase (ROCK) inhibitors and their therapeutic potential. J. Med. Chem. 59(6): 2269–2300. 2016.
Kupittayanant S., Burdyga T., Wray S. The effects of inhibiting Rho-associated kinase with Y‑27632 on force and intracellular calcium in human myometrium. Pflugers Arch. 443(1): 112–114. 2001.
Steffens F., Zhou X.B., Sausbier U., Sailer C., Motejlek K., Ruth P., Olcese J., Korth M., Wieland T. Melatonin receptor signaling in pregnant and nonpregnant rat uterine myocytes as probed by large conductance Ca2+-activated K+ channel activity. Mol. Endocrinol. 17(10): 2103–2115. 2003.
Rahbek M., Nazemi S., Odum L., Gupta S., Poulsen S.S., Hay-Schmidt A., Klaerke D.A. Expression of the small conductance Ca2+-activated potassium channel subtype 3 (SK3) in rat uterus after stimulation with 17β-estradiol. PLoS One. 9(2): art e87652. 2014.
Song J., Zhang X., Qi Z., Sun G., Chi S., Zhu Z., Ren J., Qiu Z., Liu K., Myatt L., Ma R. Z. Cloning and characterization of a calcium-activated chloride channel in rat uterus. Biol. Reprod. 80(4): 788–794. 2009.
McCloskey C., Rada C., Bailey E., McCavera S., van den Berg H. A., Atia J., Rand D.A., Shmygol A., Chan Y.W., Quenby S., Brosens J.J., Vatish M., Zhang J., Denton J.S., Taggart M.J., Kettleborough C., Tickle D., Jerman J., Wright P., Dale T., Kanumilli S., Trezise D.J., Thornton S., Brown P., Catalano R., Lin N., England S. K., Blanks A. M. The inwardly rectifying K+ channel KIR7.1 controls uterine excitability throughout pregnancy. EMBO Mol. Med. 6(9): 1161–1174. 2014.
Robinson H., Wray S. A new slow releasing, H2S generating compound, GYY4137 relaxes spontaneous and oxytocin-stimulated contractions of human and rat pregnant myometrium. PLoS One. 7(9): art e46278. 2012.
Hong S.H., Kyeong K.S., Kim C.H., Kim Y.C., Choi W., Yoo R.Y., Kim H.S., Park Y.J., Ji I.W., Jeong E.H., Kim H.S., Xu W.X., Lee S.J. Regulation of myometrial contraction by ATP-sensitive potassium (KATP) channel via activation of SUR2B and Kir 6.2 in mouse. J. Vet. Med. Sci. 78(7): 1153–1159. 2016.
Mandi G., Sarkar S.N., Mishra S.K., Raviprakash V. Effects of calcium channel blocker, mibefradil, and potassium channel opener, pinacidil, on the contractile response of mid-pregnant goat myometrium. Indian J. Exp. Biol. 43(9): 795–801. 2005.
Cheuk J.M., Hollingsworth M., Hughes S.J., Piper I.T., Maresh M.J. Inhibition of contractions of the isolated human myometrium bypotassium channel openers. Am. J. Obstet. Gynecol. 168 (3, Pt 1): 953–960. 1993.
Hu R., Lu J., You X., Zhu X., Hui N., Ni X. Hydrogen sulfide inhibits the spontaneous and oxytocin-induced contractility of human pregnant myometrium. Gynecol. Endocrinol. 27(11): 900–904. 2011.
Morrison J. J., Ashford M. L., Khan R. N., Smith S. K. The effects of potassium channel openers on isolated pregnant human myometrium before. Am. J. Obstet. Gynecol. 169(5): 1277–1285. 1993.
Novaković R., Radunović N., Marković-Lipkovski J., Ćirović S., Beleslin-Čokić B., Ilić B., Ivković B., Heinle H., Živanović V., Gojković-Bukarica L. J. Effects of the polyphenol resveratrol on contractility of human term pregnant myometrium. Mol. Hum. Reprod. 21(6): 545–551. 2015.
Sadlonova V., Franova S., Dokus K., Janicek F., Visnovsky J., Sadlonova J. Participation of BKCa2+ and KATP potassium ion channels in the contractility of human term pregnant myometrium in in vitro conditions. J. Obstet. Gynaecol. Res. 37(3): 215–221. 2011.
Monaghan K., Baker S.A., Dwyer L., Hatton W.C., Sik Park K., Sanders K.M., Koh S.D. The stretch-dependent potassium channel TREK-1 and its function in murine myometrium. J. Physiol. 589 (Pt 5): 1221–1233. 2011.
Kyeong K.S., Hong S.H., Kim Y.C., Cho W., Myung S.C., Lee M.Y., You R.Y., Kim C.H., Kwon S.Y., Suzuki H., Park Y.J., Jeong E.H., Kim H.S., Kim H., Lim S.W., Xu W.X., Lee S.J., Ji I.W. Myometrial relaxation of mice via expression of two pore domain acid sensitive K+TASK-2 channels. Korean J. Physiol. Pharmacol. 20(5): 547–556. 2016.
Anwer K., Oberti C., Perez G. J., Perez-Reyes N., McDougall J.K., Monga M., Sanborn B.M., Stefani E., Toro L. Calcium-activated K+ channels as modulators of human myometrial contractile activity. Am. J. Physiol. 265 (46, Pt 1): C976–C985. 1993.
Carvajal J.A., Zambrano M.J., Theodor N.M., Moreno L.E., Olguín T.R., Vanhauwaert P.S., Rojas N.B., Delpiano A.M. The synergic in vitro tocolytic effect of nifedipine plus ritodrine on human myometrial contractility. Reprod. Sci. 24(4): 635–640. 2017.
Brown A., Cornwell T., Korniyenko I., Solodushko V., Bond C.T., Adelman J.P., Taylor M.S. Myometrial expression of small conductance Ca2+-activated K+ channels depresses phasic uterine contraction. Am. J. Physiol. Cell Physiol. 292(2): C832–C840. 2007.
Carvajal J.A., Thompson L.P., Weiner C.P. Chorion-induced myometrial relaxation is mediated by large-conductance Ca2+-activated K+ channel opening in the guinea pig. Am. J. Obstet. Gynecol. 188(1): 84–91. 2003.
Reinl E.L., Cabeza R., Gregory I.A., Cahill A.G., England S.K. Sodium leak channel, non-selective contributes to the leak current in human myometrial smooth muscle cells from pregnant women. Mol. Hum. Reprod. 21(10): 816–824. 2015.
Зефиров А.Л., Ситдикова Г.Ф. Ионные каналы возбудимой клетки (структура, функция, патология). Казань. Арт-кафе. 2010. [Zefirov A.L., Sitdikova G.F. Ion channels of an excitable cell (structure, function, pathology). Kazan’. Art-kafe. 2010. (In Russ.)].
Abeyrathne P.D., Chami M., Stahlberg H. Biochemical and biophysical approaches to study the structure and function of the chloride channel (ClC) family of proteins. Biochimie. 128–129: 154–162. 2016.
Bernstein K., Vink J.Y., Fu X.W., Wakita H., Danielsson J., Wapner R., Gallos G. Calcium-activated chloride channels anoctamin 1 and 2 promote murine uterine smooth muscle contractility. Am. J. Obstet. Gynecol. 211(6): 688.e1–688.e10. 2014.
Kamaleddin M. A. Molecular, biophysical, and pharmacological properties of calcium-activated chloride channels. J. Cell Physiol. 233(2): 787–798. 2018.
Sabirov R.Z., Merzlyak P.G., Islam M.R., Okada T., Okada Y. The properties, functions, and pathophysiology of maxi-anion channels. Pflugers Arch. 468(3): 405–420. 2016.
Atia J., McCloskey C., Shmygol A.S., Rand D.A., van den Berg H.A., Blanks A.M. Reconstruction of cell surface densities of ion pumps, exchangers, and channels from MRNA expression, conductance kinetics, whole-cell calcium, and current-clamp voltage recordings, with an application to human uterine smooth muscle cells. PLoS Comput. Biol. 12(4): art e1004828. 2016.
Cretoiu S.M., Cretoiu D., Marin A., Radu B.M., Popescu L.M. Telocytes: Ultrastructural, immunohistochemical and electrophysiological characteristics in human myometrium. Reproduction. 145(4): 357–370. 2013.
Dodds K.N., Staikopoulos V., Beckett E.A. Uterine contractility in the nonpregnant mouse: Changes during the estrous cycle and effects of chloride channel blockade. Biol. Reprod. 92(6): art. 141. 2015.
Jones K., Shmygol A., Kupittayanant S., Wray S. Electrophysiological characterization and functional importance of calcium-activated chloride channel in rat uterine myocytes. Pflugers Arch. 448(1): 36–43. 2004.
Mijušković A., Kokić A.N., Dušić Z.O., Slavić M., Spasić M.B., Blagojević D. Chloride channels mediate sodium sulphide-induced relaxation in rat uteri. Br. J. Pharmacol. 172(14): 3671–3686. 2015.
Zingg H.H. Vasopressin and oxytocin receptors. Baillieres Clin. Endocrinol. Metab. 10(1): 75–96. 1996.
Yarar Y., Cetin A., Kaya T. Chloride channel blockers 5-nitro-2-(3-phenylpropylamino) benzoic acid and anthracene-9-carboxylic acid inhibit contractions of pregnant rat myometrium in vitro. Soc. Gynecol. Investig. 8(4): 206–209. 2001.
M Kidder G., Winterhager E. Physiological roles of connexins in labour and lactation. Reproduction. 150(4): R129–R136. 2015.
Rabotti C., Mischi M. Propagation of electrical activity in uterine muscle during pregnancy: A review. Acta Physiol. (Oxf.). 213(2): 406–416. 2015.
Smith R., Imtiaz M., Banney D., Paul J.W., Young R.C. Why the heart is like an orchestra and the uterus is like a soccer crowd. Am. J. Obstet. Gynecol. 213(2): 181–185. 2015.
Mendelson C. R. Minireview: Fetal-maternal hormonal signaling in pregnancy and labor. Mol. Endocrinol. 23(7): 947–954. 2009.
Chwalisz K. The use of progesterone antagonists for cervical ripening and as an adjunct to labour and delivery. Hum. Reprod. 9 (Suppl 1): 131–161. 1994.
Ivanisević M., Djelmis J., Buković D. Review on prostaglandin and oxytocin activity in preterm labor. Coll. Antropol. 25(2): 687–694. 2001.
Khan-Dawood F.S., Yang J., Dawood M.Y. Hormonal regulation of connexin-43 in baboon corpora lutea. J. Endocrinol. 157(3): 405–414. 1998.
Kilarski W.M., Fu X., Bäckström T., Roomans G.M., Ulmsten U. Progesterone, oestradiol and oxytocin and the in vitro effect on maintaining the number of gap junction plaques in human myometrium at term. Acta Physiol. Scand. 157(4): 461–469. 1996.
Elabd C., Cousin W., Upadhyayula P., Chen R. Y., Chooljian M.S., Li J., Kung S., Jiang K.P., Conboy I.M. Oxytocin is an age-specific circulating hormone that is necessary for muscle maintenance and regeneration. Nat. Commun. 5: art. 4082. 2014.
Lopatina O., Inzhutova A., Salmina A.B., Higashida H. The roles of oxytocin and CD38 in social or parental behaviors. Front. Neurosci. 6: art. 182. 2013.
Strunecká A., Hynie S., Klenerová V. Role of oxytocin/oxytocin receptor system in regulation of cell growth and neoplastic processes. Folia Biol. (Praha). 55(5): 159–165. 2009.
Sladek C.D., Song Z. Diverse roles of G-protein coupled receptors in the regulation of neurohypophyseal hormone secretion. J. Neuroendocrinol. 24(4): 554–565. 2012.
Yamashita K., Kitano T. Molecular evolution of the oxytocin-oxytocin receptor system in eutherians. Mol. Phylogenet. Evol. 67(2): 520–528. 2013.
Pierzynski P. Oxytocin and vasopressin V1A receptors as new therapeutic targets in assisted reproduction. Reprod. Biomed. Online. 22(1): 9–16. 2011.
Cardoso C., Kingdon D., Ellenbogen M. A. A meta-analytic review of the impact of intranasal oxytocin administration on cortisol concentrations during laboratory tasks: Moderation by method and mental health. Psychoneuroendocrinology. 49: 161–170. 2014.
Higashida H. Somato-axodendritic release of oxytocin into the brain due to calcium amplification is essential for social memory. Physiol. Sci. 66(4): 275–282. 2016.
Hoge E.A., Lawson E.A., Metcalf C.A., Keshaviah A., Zak P.J., Pollack M.H., Simon N.M. Plasma oxytocin immunoreactive products and response to trust in patients with social anxiety disorder. Depress. Anxiety. 29(11): 924–930. 2012.
MacDonald K., Feifel D. Oxytocin’s role in anxiety: A critical appraisal. Brain Res. 1580: 22–56. 2014.
Munesue T., Nakamura H., Kikuchi M., Miura Y., Takeuchi N., Anme T., Nanba E., Adachi K., Tsubouchi K., Sai Y., Miyamoto K., Horike S., Yokoyama S., Nakatani H., Niida Y., Kosaka H., Minabe Y., Higashida H. Oxytocin for male subjects with autism spectrum disorder and comorbid intellectual disabilities: A randomized pilot study. Front. Psychiatry. 7: art. 2. 2016.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


