Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 9, стр. 1142-1153
Слабая ирритация слизистой оболочки желудка потенцирует секрецию, вызванную раздражением вагуса
В. А. Золотарев 1, *, Ю. В. Андреева 1, Р. П. Хропычева 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: zolotarevva@infran.ru
Поступила в редакцию 26.06.2019
После доработки 03.07.2019
Принята к публикации 03.07.2019
Аннотация
Целью работы было изучение роли оксида азота (NO) и простагландинов (ПГ) в модулирующем действии слабой ирритации слизистой оболочки желудка (СОЖ) на желудочную секрецию, вызванную раздражением блуждающего нерва. У наркотизированных крыс в условиях полостной перфузии желудка секрецию кислоты и бикарбонатов рассчитывали на основе измеренных в перфузате значений pH/PCO2. Концентрация пепсиногена определялась по деградации гемоглобинового стандарта. Полостная перфузия желудка раствором слабых ирритантов (500 мM NaCl, pH 3.0) в сравнении с перфузией контрольным изотоническим раствором (154 мM NaCl, pH 4.0) усиливала секрецию H+ и ${\text{HCO}}_{3}^{ - },$ вызванную электрическим раздражением периферического отрезка субдиафрагмального вагуса. Селективная блокада нейрональной синтазы оксида азота (nNOS) с помощью 7-нитроиндазола, а также неселективная блокада нейрональной и эндотелиальной NOS с помощью Nω-нитро-L-аргинина в равной мере подавляли потенцирующий эффект ирритации. Блокада циклооксигеназы индометацином не влияла на потенцирующий эффект ирритации, но усиливала вагусную секрецию H+ и ${\text{HCO}}_{3}^{ - }$ на фоне перфузии желудка контрольным изотоническим раствором. Вагусная продукция пепсиногена ослабевала в присутствии блокаторов NOS независимо от ирритации. Сделан вывод о том, что потенцирующий эффект ирритации СОЖ по отношению к вагусной секреции кислоты и бикарбонатов опосредуется локальной активацией nNOS, но не зависит от продукции ПГ.
Физиологической нормой, в условиях которой поддерживается структурная и функциональная целостность слизистой оболочки желудка (СОЖ), является кислая реакция химуса (до 0.15 М HCl), протеолитическая активность пепсина, повышенное осмотическое давление, действие желчных кислот, высокая температура и т.д. [1]. Действие этих относительно слабых поражающих факторов (слабых ирритантов) на эпителий и клетки подслизистого слоя запускает реакции адаптивной гастропротекции, в результате которых повышается устойчивость СОЖ к последующим сильным ульцерогенным воздействиям, что достигается через увеличение кровотока в подслизистом слое, усиление за счет секреции ионов бикарбоната слизисто-щелочного барьера на поверхности желудочного эпителия, уменьшение агрегации тромбоцитов и лейкоцитов, продукцию эпидермального фактора роста [2].
Помимо локальных реакций принципиальное значение для сохранения целостности СОЖ имеет парасимпатическая иннервация. С одной стороны, повышенная активность блуждающего нерва приводит к образованию геморрагических язв, а ваготомия уменьшает повреждения. С другой стороны, ваго-вагальные рефлексы вовлечены во многие защитные реакции, вызванные слабой ирритацией, посредством которых локальный протективный эффект распространяется на участки СОЖ, не вступавшие в контакт с ирритантом. Обеспечивающие подобные реакции ваго-вагальные рефлекторные дуги в качестве сенсорного звена имеют капсаицин-чувствительные нервные окончания. Эфферентным звеном реакции являются преганглионарные холинергические волокна [3]. Холинергические механизмы адаптивной гастропротекции реализуются через те же физиологические процессы, что и локальные реакции на слабую ирритацию СОЖ, а именно, через усиление продукции простагландинов (ПГЕ2 и ПГI2), оксида азота (NO) и выделение из периферических окончаний первичных афферентов кальцитонин-ген-родственного пептида (КГРП) [4–6].
В то же время не до конца понятно, насколько локальное усиление продукции NO и ПГ, спровоцированное слабой ирритацией СОЖ, влияют на реакции, вызванные активацией блуждающего нерва. Задачей данной работы была оценка изменений в желудочной секреции кислоты, бикарбонатов и пепсиногена, вызванной стимуляцией блуждающего нерва, на фоне раздражения СОЖ слабыми ирритантами. В качестве слабого ирританта был использован гипертонический раствор сравнительно небольшой кислотности (500 мM NaCl, pH 3.0), который отчасти моделировал физико-химические показатели в полости желудка при пищеварении. Интересно заметить, что в базовых исследованиях адаптивной гастропротекции использовались краткие аппликации гораздо больших нефизиологических концентраций некротизирующих агентов [7, 8].
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проведено в соответствии с принципами Базельской декларации под контролем Комиссии по биоэтике Института физиологии им. И.П. Павлова РАН. В работе использованы крысы самцы линии Спрег–Доули массой 300–350 г, выращенные в виварии ИФ РАН (ЦКП “Биоколлекция ИФ РАН”, Программа по сохранению и развитию биоресурсных коллекций ФАНО России). После 18–20 часового голодания при свободном доступе к воде в клетках с приподнятым решетчатым дном животные наркотизировались уретаном (1.2 г/кг, внутрибрюшинно). Брюшную полость вскрывали по средней линии и производили зондирование пищевода и безжелезистого преджелудка, а двенадцатиперстную кишку перевязывали выше луковицы. Внутривенные (в.в.) инъекции производили через катетер, введенный в бедренную вену. Оба ствола блуждающего нерва, вентральный и дорзальный, перевязывались под диафрагмой. Участок вентрального (левого) вагуса дистальнее места перевязки очищали от соединительной ткани, помещали на биполярные Ag/AgCl электроды и защищали от высыхания каплей вазелинового масла. На время опыта брюшная полость закрывалась, и температура тела поддерживалась обогревательным столиком и лампой.
Полость желудка, предварительно промытую физиологическим раствором, перфузировали либо изотоническим раствором относительно низкой кислотности (154 мМ NaCl, pH 4.0), либо гипертоническим раствором повышенной кислотности (500 мМ NaCl, pH 3.0). Перфузионные растворы не содержали буфера. Раствор подавался через пищеводный зонд со скоростью 1 мл/мин при 37°C. Из желудка перфузат свободно оттекал через канюлю, введенную в преджелудок и расположенную таким образом, чтобы давление в полости органа оставалось близким к нулю.
Оттекающий из желудка перфузат проходил через термостабилизированную камеру объемом 200 мкл, снабженную pH-электродом и датчиком парциального давления диоксида углерода (PCO2). Концентрацию H+ и ${\text{HCO}}_{3}^{ - }$ в потоке вычисляли по уравнению Гендерсона–Хассельбаха, используя значения pH и PCO2, усредненные за 30-секундные интервалы [9]. Секрецию H+ и ${\text{HCO}}_{3}^{ - }$ рассчитывали, вычитая из величин, измеренных на “выходе” из желудка, “входные” значения H+ и ${\text{HCO}}_{3}^{ - }$ в свежеприготовленных растворах. Прошедший через измерительную камеру перфузат собирали в течение 15-минутных интервалов для дальнейшего спектрофотометрического определения концентрации пепсиногена по деградации гемоглобинового стандарта [10].
За 15 мин до начала стимуляции нерва производили в.в. инъекцию следующих препаратов, приобретенных в Sigma-Aldrich, Inc. (США): 7-нитроиндазола (7-NI, 10 мг/кг), Nω-нитро-L-аргинина (L-NNA, 10 мг/кг), либо индометацина (ИНД, 5 мг/кг). Интактные группы животных получали внутривенно равный объем растворителя, 0.1%-ного раствора диметилсульфоксида (DMSO, Вектон), эмульгированного в физиологическом растворе.
Омепразол (Astra, Швеция) в дозе 10 мг/кг инъецировали подкожно за сутки до эксперимента и в.в. за 50 мин до стимуляции секреции. Перфузия тестовым раствором начиналась за 30 мин до и продолжалась в течение 40 мин после начала стимуляции нерва. Дистальный отрезок левого субдиафрагмального ствола вагуса раздражали в течение 10 мин электрическими стимулами с напряжением 10 В, длительностью 2 мс и частотой 10 Гц.
Результаты экспериментов представлены как скорость секреции и удельная продукция, нормированные на сырой вес желудка. Базальная секреция рассчитывалась путем усреднения измерений в течение 5 мин перед началом раздражения СОЖ. Удельную продукцию вычисляли методом трапеций, как суммарную секрецию в течение заданного времени после начала раздражения за вычетом базального уровня. Все данные представлены в виде средних арифметических и стандартных ошибок (М ± m). Чтобы избежать наложения друг на друга планок погрешностей, на кривых стандартная ошибка показана только для каждого 10-го значения.
Величина выборки (n) соответствует числу экспериментальных животных, поскольку каждое животное получало только одно воздействие. Статистические сравнения эффектов блокаторов NOS проведены с помощью многофакторного дисперсионного анализа, результаты которого даны в подписи к рис. 1. Зависимой переменной в 3-х факторном анализе была скорость секреции при перфузии желудка контрольным раствором либо слабыми ирритантами (эффект ирритации), а в 2-х факторном – продукция бикарбонатов на фоне блокаторов NOS. Последующие множественные сравнения производили, используя тест Фишера LSD. Для анализа результатов опытов, представленных на рис. 2 и 3, использовался тест Манна–Уитни. Для всех расчетов применялся пакет программ Statistica 7.0. Различия признавались значимыми при p < 0.05.
Рис. 1.
Влияние слабой ирритации СОЖ на желудочную секрецию кислоты, бикарбонатов и пепсиногена, вызванную электрическим раздражением блуждающего нерва. Эффект блокаторов NOS Nω-нитро-L-аргинина (L-NNA) и 7-нитроиндазола (7-NI). На графиках А, В, Д – скорость секреции, Б, Г, Е – удельная продукция. Контроль (КОНТР): полостная перфузия желудка изотоническим раствором (154 мM NaCl, pH 4.0). Ирритация (ИРРИТ): перфузия гипертоническим раствором (500 мM NaCl, pH 3.0). Период стимуляции дистального отрезка децентрализованного левого субдиафрагмального вагуса (10 В, 2 мс, 10 Гц, 5 мин) отмечен полосой на графиках А, В, Д. Блокаторы NOS (оба 10 мг/кг, в.в.) инъецированы за 15 мин до начала раздражения нерва. Интактным животным (ИНТАКТ) вводили равный объем 0.1%-ного DMSO. Статистические сравнения проведены с помощью многофакторного дисперсионного анализа: А) эффект ирритации – F(1, 33) = 5.12, p < 0.05; эффект блокады NOS – F(2, 33) = 3.54, p < 0.05; эффект раздражения вагуса F(79, 2607) = 79.81, p < 0.01; взаимодействие эффектов ирритации и вагуса – F(79, 2607) = 1.78, p < 0.01; раздражение вагуса × блокада NOS – F(158, 2076) = 3.22, p < 0.01; раздражение вагуса × ирритация × блокада NOS – F(158, 2076) = 2.22, p < 0.01. Б) эффект блокады NOS – F(2, 20) = 4.59, p < 0.05; блокада NOS × ирритация – F(2, 20) = 4.78, p < 0.05. B) эффект ирритации – F(1, 33) = 14.82, p < 0.01; эффект блокады NOS – F(2, 33) = 6.84, p < 0.01; ирритация × блокада NOS – F(2, 33) = 8.02; p < 0.01; эффект раздражения вагуса F(79, 2607) = 20.71, p < 0.01; ирритации × раздражение вагуса – F(79, 2607) = 7.96, p < 0.01; раздражение вагуса × блокада NOS – F(158, 2076) = 6.33, p < 0.01; раздражение вагуса × ирритация × блокада NOS – F(158, 2076) = 5.14, p < 0.01. Г) эффект ирритации – F(1, 10) = 9.43, p < 0.05; эффект блокады NOS – F(2, 20) = 6.03, p < 0.01; блокада NOS × ирритация – F(2, 20) = 4.25, p < 0.05. Д) эффект раздражения вагуса F(3, 105) = 49.29, p < 0.01; раздражение вагуса × блокада NOS – F(6, 105) = 2.94, p < 0.05; раздражение вагуса × ирритация × блокада NOS – F(6, 105) = 2.31, p < 0.05. Е) эффект блокады NOS – F(2, 22) = 4.46, p < 0.05. Все не указанные эффекты и взаимодействия не имеют статистической значимости. Множественные сравнения произведены с помощью теста Фишера LSD: * – p < 0.05, ** – p < 0.01. Размер выборок указан на столбцах гистограммы Б.

Рис. 2.
Влияние слабой ирритации СОЖ на желудочную секрецию кислоты, бикарбонатов и пепсиногена, вызванную электрическим раздражением блуждающего нерва. Эффект омепразола. А, В, Д – скорость секреции, Б, Г, Е – удельная продукция. Контроль (КОНТР): полостная перфузия желудка изотоническим раствором (154 мM NaCl, pH 4.0). Ирритация (ИРРИТ): перфузия гипертоническим раствором (500 мM NaCl, pH 3.0). Период стимуляции дистального отрезка децентрализованного левого субдиафрагмального вагуса (10 В, 2 мс, 10 Гц, 5 мин) отмечен полосой на графиках А, В, Д. Омепразол инъецировали дважды в дозе 10 мг/кг: за 18 ч до эксперимента подкожно и за 50 мин до стимуляции нерва (в.в.). Статистические сравнения проведены с помощью критерия Манна–Уитни: * – p < 0.05, ** – p < 0.01. Размер выборок указан на столбцах гистограммы Б.
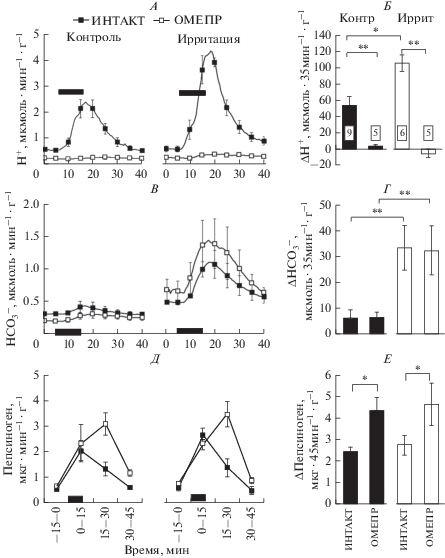
Рис. 3.
Влияние слабой ирритации СОЖ на желудочную секрецию кислоты, бикарбонатов и пепсиногена, вызванную электрическим раздражением блуждающего нерва. Эффект индометацина (ИНД). На графиках А, В, Д – скорость секреции, Б, Г, Е – удельная продукция. Контроль (КОНТР): полостная перфузия желудка изотоническим раствором (154 мM NaCl, pH 4.0). Ирритация (ИРРИТ): перфузия гипертоническим раствором (500 мM NaCl, pH 3.0). Период стимуляции дистального отрезка децентрализованного левого субдиафрагмального вагуса (10 В, 2 мс, 10 Гц, 5 мин) отмечен полосой на графиках А, В, Д. ИНД (5 мг/кг, в.в.) инъецировали за 15 мин до начала раздражения нерва. Интактным животным (ИНТАКТ) вводили равный объем 0.1%-ного DMSO. Статистические сравнения проведены с помощью критерия Манна–Уитни: * – p < 0.05. Размер выборок указан на столбцах гистограммы Б.

РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Непродолжительное электрическое раздражение дистальной части децентрализованного левого субдиафрагмального ствола блуждающего нерва вызывало быстрый рост желудочной секреции кислоты, бикарбонатов и пепсиногена, достигавший пиковых значений через 15 мин после начала стимуляции. Затем скорость секреции H+ и ${\text{HCO}}_{3}^{ - }$ возвращалась к исходному уровню в течение 25 мин, а восстановление скорости секреции пепсиногена наблюдали через 30 мин (рис. 1А, В, Д). Увеличение осмотического давления и кислотности в полости желудка при перфузии гипертоническим раствором повышенной кислотности (500 мM NaCl, pH 3.0) по сравнению с контрольными опытами (перфузия изотоническим раствором) приводило к усилению базальной секреции ${\text{HCO}}_{3}^{ - }$ с 0.31 ± 0.03 до 0.51 ± 0.03 мкмоль мин–1 г–1 (p < 0.05, n = 9 ~ 6, тест Фишера LSD). В то же время слабая ирритация не влияла на базальную секрецию кислоты и пепсиногена.
На фоне орошения СОЖ гипертоническим подкисленным раствором отмечено почти 2-х кратное увеличение удельной продукции кислоты (рис. 1Б; p < 0.05, n = 9 ~ 6; тест Фишера LSD), вызванной раздражением вагуса, и примерно 5-ти кратный рост продукции бикарбонатов (рис. 1Г; p < 0.01, n = 9 ~ 6; тест Фишера LSD). Изменений вагусной продукции пепсиногена при этом не наблюдали (рис. 1Е).
Блокада изоформ конститутивной синтазы оксида азота (cNOS) с помощью L-NNA или 7-NI не влияла на базальную секрецию H+. В то же время на фоне слабой ирритации L-NNA (p < 0.05, n = 6), а также 7-NI (p < 0.01, n = 6, тест Фишера LSD) в равной степени угнетали базальную секрецию ${\text{HCO}}_{3}^{ - }.$ Базальный уровень пепсиногена под действием блокаторов NOS, напротив, увеличивался. Статистическая значимость увеличения базальной секреции пепсиногена выявлена в присутствии 7-NI как в контроле (p < 0.01, n = 9 ~ 6), так и на фоне ирритации (p < 0.05, n = 6).
Инъекция блокаторов cNOS привела к ослаблению вызванной раздражением блуждающего нерва секреции кислоты, бикарбонатов и пепсиногена, причем эффект зависел от ирритации СОЖ (см. результаты ANOVA в подписи к рис. 1). На фоне ирритации L-NNA и 7-NI практически в равной мере снижали вагусную продукцию H+ и ${\text{HCO}}_{3}^{ - },$ хотя в контрольных опытах блокаторы cNOS подобного эффекта не производили (рис. 1А–Г). Удельная продукция пепсиногена, вызванная стимуляцией вагуса, существенно снижалась в присутствии L-NNA либо 7-NI как в контрольных опытах, так и при слабой ирритации СОЖ (рис. 1Д, Е).
Раздражение блуждающего нерва вызывает кратковременное увеличение кислотности в полости желудка до pH ≤ 2.0, что может быть дополнительным стимулом продукции NO и ПГ в слизистой оболочке. Чтобы оценить влияние эндогенной кислоты на вагусную секрецию бикарбонатов и пепсиногена, были проведены эксперименты с блокадой H+, K+-АТФазы омепразолом. Устранение секреции кислоты не повлияло на вагусную продукцию ${\text{HCO}}_{3}^{ - }$ (рис. 2А–Г), но привело к значительному увеличению продукции пепсиногена как в контроле, так и на фоне ирритации (рис. 2Д, Е).
Влияние неселективного блокатора циклооксигеназ индометацина (ИНД) на анализируемые показатели желудочной секреции проявилось, в основном, в контрольных опытах при перфузии полости желудка изотоническим раствором pH 4.0. В частности, после инъекции ИНД наблюдали достоверное увеличение вагусной продукции H+, ${\text{HCO}}_{3}^{ - }$ и пепсиногена. На фоне слабой ирритации ИНД не действовал на продукцию H+, ${\text{HCO}}_{3}^{ - }$ (рис. 3А–Г). В то же время ИНД сохранял влияние на вагусную продукцию пепсиногена и на фоне ирритации СОЖ, хотя в этих условиях под действием ИНД происходило ослабление его продукции (рис. 3Д, Е).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенное исследование впервые показало, что изменение в физиологическом диапазоне кислотности и осмотического давления в полости желудка является эффективным периферическим модулятором секреции H+ и ${\text{HCO}}_{3}^{ - },$ вызванной раздражением периферического отрезка блуждающего нерва. При этом вагусная продукция пепсиногена оказалась нечувствительной к слабой ирритации СОЖ (рис. 1). Электрическая стимуляция блуждающего нерва закономерно вызывала непродолжительное, но резкое увеличение кислотности в полости желудка, которое само по себе может быть раздражающим фактором. Тем не менее, опыты с омепразолом показали, что эндогенная кислота не участвовала в потенциации вагусной секреции ${\text{HCO}}_{3}^{ - }$ (рис. 2В, Г). В то же время вызванная стимуляцией вагуса секреция пепсиногена после инъекций омепразола увеличивалась независимо от ирритации (рис. 2Д, Е), что известно как следствие гипергастринемии [11].
Описанное выше усиление вагусной секреции Н+ и ${\text{HCO}}_{3}^{ - },$ связанное с действием слабых ирритантов на СОЖ, осуществлялось преимущественно за счет периферической продукции NO. Поскольку вагусные воздействия на желудочную секрецию кислоты, пепсиногена и бикарбонатов, в том числе вызванные электрической стимуляцией нерва, целиком опосредуются М-холинергической передачей [12], эндогенный NO скорее потенцирует эффект М-холинергической трансмиссии, чем действует аддитивно.
Парасимпатические нервные окончания в стенке желудка находятся в тесном контакте с эндотелиальными, секреторными и эндокринными клетками, экспрессирующими эндотелиальную (eNOS) и нейрональную (nNOS) синтазы оксида азота [13–18], кроме того, значительная доля пре- и постганглионарных парасимпатических волокон в сплетении желудка сама содержит nNOS [19, 20]. Оксид азота, синтезированный в различных тканях желудка, участвует в разнонаправленных изменениях желудочной секреции. Например, в желудке наркотизированных крыс вызванная ирритацией слизистой оболочки активность eNOS приводит к ослаблению, а стимуляция nNOS, напротив, к усилению секреции H+ и ${\text{HCO}}_{3}^{ - }$ [21].
Сопоставление эффектов блокаторов cNOS позволяет сделать вывод о ведущей роли nNOS в потенциации вагусной секреции H+ и ${\text{HCO}}_{3}^{ - }.$ Вследствие активности nNOS, в том числе и в отсутствие ирритации, происходило также усиление вагусной продукцию пепсиногена. Оба примененных на фоне ирритации блокатора, L-NNA и 7-NI, в равной мере снижали секрецию H+ и HCO3- до контрольного уровня (рис. 1А–Г). Учитывая, что L-NNA имеет практически одинаковое сродство с nNOS и eNOS, а 7-NI – в основном с nNOS in vivo, а также, что примененная доза блокаторов была близка к EC50 каждого из них [22–26], путем алгебраического сложения эффектов этих двух блокаторов можно, по крайней мере качественно, оценить вклад eNOS в нитрергическую потенциацию вагусной секреции в желудке как незначительный.
Единого механизма, потенцирующего действия NO по отношению к вызванной раздражением блуждающего нерва секреции H+, ${\text{HCO}}_{3}^{ - }$ и пепсиногена, вероятно, не существует. Например, в изолированном желудке мыши NO усиливает желудочную секрецию H+, вызванную стимуляцией блуждающего нерва либо M1-холиномимтетиками, опосредованно, через цАМФ зависимую стимуляцию продукции гистамина [27]. С другой стороны, модулирующее действие NO по отношению к вагусной продукции ${\text{HCO}}_{3}^{ - }$ связано в основном с действием на ткани желудка КГРП, который выделяется при деполяризации капсаицин-чувствительных первичных афферентных окончаний [28–30]. Кроме того, NO в физиологической концентрации может выделяться самими капсаицин-чувствительными нервными окончаниями, содержащими nNOS [31]. Десенситизация афферентных окончаний с помощью алкалоида капсаицина полностью устраняла секрецию ${\text{HCO}}_{3}^{ - },$ вызванную аппликацией ирритантов на СОЖ, а также реакции адаптивной гастропротекци [32, 33]. В проведенных экспериментах неизбежно происходило антидромное раздражение капсаицин-чувствительных афферентов вагуса, которое может вызвать усиление продукции бикарбонатов в желудке [34]. Тем не менее, наблюдавшаяся NO-зависимая потенциация вагусной продукции бикарбонатов, скорее всего, мало зависела от антидромной стимуляции афферентов, поскольку эффект блокаторов NOS проявлялся только на фоне ирритации, но не в контрольных экспериментах. Кроме того, в желудке доля КГРП-содержащих волокон в афферентах вагуса невелика по сравнению с афферентными волокнами спинального происхождения [35]. Известно также, что NO потенцирует продукцию пепсиногена, вызванную введением карбохолина [36]. Участвующий в этой реакции NO синтезируется в самих главных клетках, где его продукция усиливается под действием кальций-мобилизующих агентов, таких как карбохол, холецистокинин и гастрин, которые сами способны вызвать секрецию пепсиногена [37].
Известно также, что в ответ на аппликацию кислоты на СОЖ оксид азота синтезируется в части нейронов миэнтерального сплетения [38]. Однако эти клетки были идентифицированы как мотонейроны, обеспечивающие адаптивную релаксацию и, по-видимому, не имеющие отношения к секреторной активности [39, 40]. Наконец, эндогенный NO потенциально способен усиливать холинергическую передачу, действуя пресинаптически через цГМФ – фосфодиестераза 3 – зависимый каскад и фосфорилирование Ca2+ каналов типа N, как это было показано в опытах на изолированном предсердии [41].
Аппликация ирритантов на СОЖ, а также М-холинергические воздействия усиливают в желудке локальный синтез важнейших эйкозаноидов, обеспечивающих реакции адаптивной гастропротекции, – простагландинов (в основном ПГЕ2 и ПГI2) [3, 42, 43,]. При этом ПГЕ2 стимулирует реакции адаптивной гастропротекции, включая секрецию бикарбонатов, относительно независимо от активности капсаицин-чувствительных первичных афферентов и КГРП [33]. В то же время, эндогенные ПГ (вероятно, ПГI2) потенцируют гастропротективное действие капсаицина [44]. В желудке NOS и COX часто экспрессируются в одних и тех же клетках, влияя друг на друга. В литературе описано, в основном, потенцирующее действие NO/цГМФ на продукцию ПГ. В частности, нитрергическая стимуляция продукции ${\text{HCO}}_{3}^{ - }$ в СОЖ полностью зависит от цГМФ-опосредованного синтеза ПГЕ2, который, в свою очередь, через рецептор EP1 стимулирует рост внутриклеточной концентрации ${\text{Ca}}_{2}^{ + }$ [45].
Наши эксперименты, в которых использовался неселективный блокатор циклооксигеназ индометацин, в целом, подтвердили, что роль ПГ в модуляции вагусной секреции не тождественна вкладу NO. Угнетающее влияние ПГ по отношению к вагусной продукции H+ и ${\text{HCO}}_{3}^{ - }$ выявлялось только в отсутствие химического раздражения СОЖ, когда полость желудка перфузировали изотоническим раствором низкой кислотности. На фоне слабой ирритации СОЖ влияние ПГ на секрекцию H+ и ${\text{HCO}}_{3}^{ - }$ прекращалось (рис. 3А–Г). При этом продукцию пепсиногена эндогенные ПГ тормозили независимо от химических воздействий на желудочный эпителий. Полученные результаты отчасти совпадают с данными литературы о том, что ПГ снижают кислотность и протеолитическую активность желудочного секрета [36]. Механизм, за счет которого ПГ ослабляют секрецию HCO3, неочевиден. Хорошо известно, что ПГ усиливают секрецию муцина и бикарбонатов эпителиоцитами СОЖ, что опосредуется EP4 и EP1 рецепторами соответственно [46]. В то же время опосредованное простагландинами ослабление желудочной секреции бикарбонатов также представляется возможным. Оно может быть связано с их сосудорасширяющим эффектом [47], либо пресинаптическим угнетением ПГ релизинга ацетилхолина [48].
Можно заключить, что изменение в физиологических пределах кислотности и осмотического давления желудочного химуса эффективно модулирует желудочную секрецию кислоты и бикарбонатов, вызванную раздражением блуждающего нерва, но не влияет на вагусную продукцию пепсиногена. Выявленная потенциация вагусной продукции ${\text{HCO}}_{3}^{ - }$ не зависела от продукции эндогенной кислоты. В основном потенциация вагусной секреции H+ и ${\text{HCO}}_{3}^{ - }$ была связана с локальной активацией nNOS, не относящейся к пресинаптическим нервным окончаниям и нейронам миэнтерального сплетения. Эндогенные ПГ тормозят вагусную секрецию в отсутствие химического раздражения СОЖ, но при слабой ирритации теряют свою эффективность.
Список литературы
Tarnawski A.S., Ahluwalia A., Jones M.K. The mechanisms of gastric mucosal injury: Focus on microvascular endothelium as a key target. Curr. Med. Chem. 19(1): 4–15. 2012.
Laine L., Takeuchi K., Tarnawski A. Gastric mucosal defense and cytoprotection: Bench to bedside. Gastroenterology. 135: 41–60. 2008.
Ko J.K., Cho C.H. Adaptive cytoprotection and the brain-gut axis. Digestion. 83 Suppl 1: 19–24. 2011.
Takeeda M., Hayashi Y., Yamato M., Murakami M., Takeuchi K. Roles of endogenous prostaglandins and cyclooxygenase izoenzymes in mucosal defense of inflamed rat stomach. J. Physiol. Pharmacol. 55(1 Pt 2): 193–205. 2004.
Evangelista S. Role of calcitonin gene-related Peptide in gastric mucosal defence and healing. Curr. Pharm. 15(30): 3571–3576. 2009.
Magierowski M., Magierowska K., Kwiecien S., Brzozowski T. Gaseous mediators nitric oxide and hydrogen sulfide in the mechanism of gastrointestinal integrity, protection and ulcer healing. Molecules. 20(5): 9099–9123. 2015.
Robert A., Nezamis J.E., Lancaster C., Davis J.P., Field S.O., Hanchar A.J. Mild irritants prevent gastric necrosis through “adaptive cytoprotection” mediated by prostaglandins. Am. J. Physiol. 245(1): G113–G121. 1983.
Takeuchi K., Araki H., Umeda M., Komoike Y., Suzuki K. Adaptive gastric cytoprotection is mediated by prostaglandin EP1 receptors: A study using rats and knockout mice. J. Pharmacol. Exp. Ther. 297(3): 1160–1165. 2001.
Золотарев В.А., Поленов С.А., Лепнев Г.П., Разумова Н.А. Метод непрерывного количественного определения секреции кислоты и бикарбонатов в желудке наркотизированных крыс. Рос. физиол. журн. им. И.М. Сеченова. 82(7): 111–116. 1996. [Zolotarev V.A., Polenov S.A., Lepnev G.P., Razumova N.A. A method for the continuous quantitative estimation of acid and bicarbonate secretion in the stomach of narcotized rats. Russ. J. Physiol. 82(7): 111–116. 1996. (In Russ.)].
Гинодман Л.В., Соловьева Т.А. Определение пепсина и гастриксина в желудочном соке у человека. Вопр. мед. химии. 11: 87–89. 1965. [Ginodman L.V., Solovjeva T.A. Measurement of pepsin and gastricsin in the gastric juice of humans. Probl. Med. Chem. 11: 87–89, 1965. (In Russ.)].
Thomson A.B., Sauve M.D., Kassam N., Kamitakahara H. Safety of the long-term use of proton pump inhibitors. World. J. Gastroenterol. 16(19): 2323–2330. 2010.
Хропычева Р.П., Золотарев В.А., Поленов С.А. Количественная оценка роли холинергических, гастриновых и гистаминовых механизмов в регуляции продукции пепсиногена в желудке наркотизированных крыс. Бюлл. экспер. биол. и мед. 129(1): 12–15. 2000. [Khropycheva R.P., Zolotarev V.A., Polenov S.A. Quantitative evaluation of the role of cholinergic, gastrin, and histamine regulation of pepsinogen production in the stomach of anesthesized rats. Bull. Exp. Biol. Med. 129(1): 12–15. 2000. (In Russ.)].
Brown J.F., Tepperman B.L., Hanson P.J., Whittle B.J., Moncada S. Differential distribution of nitric oxide synthase between cell fractions isolated from the rat gastric mucosa. Biochem. Biophys. Res. Commun. 184: 680–685. 1992.
Byrne C.R., Price K.J., Williams J.M., Brown J.F., Hanson P.J., Whittle B.J. Nitric oxide synthase and arginase in cells isolated from the rat gastric mucosa. Biochim. Biophys. Acta. 1356: 131–139. 1997.
Ichikawa T., Ishihara K., Kusakabe T., Kurihara M., Kawakami T., Takenaka T., Saigenji K., Hotta K. Distinct effects of tetragastrin, histamine, and CCh on rat gastric mucin synthesis and contribution of NO. Am. J. Physiol. 274: G138–G146. 1998.
Price K., Hanson P. Constitutive nitric oxide synthases in rat gastric mucosa: Subcellular distribution, relative activity and different carboxylterminal antigenicity of the neuronal form compared with cerebellum. Digestion. 59: 308–313. 1998.
Fiorucci S., Distrutti E., Santucci L., Morelli A. Leukotrienes stimulate pepsinogen secretion from guinea pig gastric chief cells by a nitric oxidedependent pathway. Gastroenterology. 108: 1709–1719. 1995.
Burrell M.A., Montuenga L.M., García M., Villaro A.C. Detection of nitric oxide synthase (NOS) in somatostatin-producing cells of human and murine stomach and pancreas. J. Histochem. Cytochem. 44: 339–346. 1996.
Bredt D.S., Hwang P.M., Snyder S.H. Localization of nitric oxide synthase indicating a neural role for nitric oxide. Nature. 347: 768–770. 1990.
García-Vitoria M., García-Corchon C., Rodríguez J.A., García-Amigot F., Burrell M.A. Expression of neuronal nitric oxide synthase in several cell types of the rat gastric epithelium. J. Histochem. Cytochem. 48: 1111–1120. 2000.
Золотарев В.А., Андреева Ю.В., Вершинина Е.А., Хропычева Р.П. Роль конститутивных синтаз оксида азота в регуляции желудочной секреции бикарбонатов на фоне слабой ирритации слизистой оболочки. Рос. физиол. журн. им. И.М. Сеченова. 101(4): 415–432. 2015. [Zolotarev V.A., Andreeva Y.V., Vershinina E.A., Kropycheva R.P. Roles of constitutive synthases of nitric oxide in the regulation of gastric bicarbonate secretion induced by mild irritation of mucosa. Russ. J. Physiol. 101(4): 415–432. 2015. (In Russ.)].
Babbedge R.C., Bland-Ward P.A., Hart S.L., Moore P.K. Inhibition of rat cerebellar nitric oxide synthase by 7-nitro indazole and related substituted indazoles. Br. J. Pharmacol. 110(1): 225–228. 1993.
Moore P.K., Babbedge R.C., Wallace P., Gaffen Z.A., Hart S.L. 7-Nitro indazole, an inhibitor of nitric oxide synthase, exhibits anti-nociceptive activity in the mouse without increasing blood pressure. Br. J. Pharmacol. 108(2): 296–297. 1993.
Southan G.J., Szabó C. Selective pharmacological inhibition of distinct nitric oxide synthase isoforms. Biochem. Pharmacol. 51(4): 383–394. 1996.
Bush M.A., Pollack G.M. Pharmacokinetics and pharmacodynamics of 7-nitroindazole, a selective nitric oxide synthase inhibitor, in the rat hippocampus. Pharm. Res. 18(11): 1607–1612. 2001.
Víteček J., Lojek A., Valacchi G., Kubala L. Arginine-based inhibitors of nitric oxide synthase: Therapeutic potential and challenges. Mediators Inflamm. 2012: 318087. https://doi.org/10.1155/2012/31.8087
Hasebe K., Horie S., Noji T., Watanabe K., Yano S. Stimulatory effects of endogenous and exogenous nitric oxide on gastric acid secretion in anesthetized rats. Nitric Oxide. 13(4): 264–271. 2005.
Aihara E., Hayashi M., Sasaki Y., Kobata A., Takeuchi K. Mechanisms underlying capsaicin-stimulated secretion in the stomach: Comparison with mucosal acidification. J. Pharmacol. Exp. Ther. 315: 423–432. 2005.
Takeuchi K., Matsumoto J., Ueshima K., Okabe S. Role of capsaicin-sensitive afferent neurons in alkaline secretory response to luminal acid in the rat duodenum. Gastroenterology. 101: 954–961. 1991.
Takeuchi K., Ueshima K., Matsumoto J., Okabe S. Role of capsaicin-sensitive sensory nerves in acid-induced bicarbonate secretion in rat stomach. Dig. Dig. Sci. 37: 737–743. 1992.
Raimura M., Tashima K., Matsumoto K., Tobe S., Chino A., Namiki T., Terasawa K., Horie S. Neuronal nitric oxide synthase-derived nitric oxide is involved in gastric mucosal hyperemic response to capsaicin in rats. Pharmacology. 92(1–2): 60–70. 2013.
Zolotarev V.A., Andreeva Y.V., Khropycheva R.P. Effect of TRPV1 on activity of isoforms of constitutive nitric oxide synthase during regulation of bicarbonate secretion in the stomach. Bull. Exp. Biol. Med. 166(3): 310–312. 2019.
Takeuchi K., Aihara E. Mechanism of capsaicin-stimulated gastric HCO3-secretion – comparison with mucosal acidification. In: Capsaicin – sensitive neural afferentation and the gastrointestinal tract: from bench to bedside. Eds. Mozsik G., Abdel-Salam O.M.E., Takeuchi K. Publ. July 16, 2014 under CC BY 3.0 license.
Zolotarev V.A., Khropycheva R.P., Polenov S.A. Selective regulation of acid, pepsinogen, and bicarbonate secretion in the stomach by different C-fiber populations of vagus nerve. Bull. Exp. Biol. Med. 133(3): 210–213. 2002.
Tan L.L., Bornstein J.C., Anderson C.R. Neurochemical and morphological phenotypes of vagal afferent neurons innervating the adult mouse jejunum. Neurogastroenterol. Motil. 9: 994–1001. 2009.
Fiorucci S., Santucci L., Gresele P., Luinetti O., Morelli A. Effect of NSAIDs on pepsinogen secretion and calcium mobilization in isolated chief cells. Am. J. Physiol. 268(6 Pt 1): G968–78. 1995.
Raufman J.P. Gastric chief cells: Receptors and signal-transduction mechanisms. Gastroenterology. 102(2): 699–710. 1992.
Schicho R., Schemann M., Holzer P., Lippe I.T. Mucosal acid challenge activates nitrergic neurons in myenteric plexus of rat stomach. Am. J. Physiol. Gastrointest. Liver Physiol. 281: G1316–1321. 2001.
Ekblad E., Ekelund M., Graffner H., Hakanson R., Sundler F. Peptide-containing nerve fibers in the stomach wall of rat and mouse. Gastroenterology. 89: 73–85. 1985.
Berthoud H.R. Morphological analysis of vagal input to gastrin releasing peptide and vasoactive intestinal peptide containing neurons in the rat glandular stomach. J. Comp. Neurol. 370: 61–70. 1996.
Herring N., Paterson D.J. Nitric oxide-cGMP pathway facilitates acetylcholine release and bradycardia during vagal nerve stimulation in the guinea-pig in vitro. J. Physiol. 535(Pt 2): 507–518. 2001.
Coceani F., Pace-Asciak C., Volta F., Wolfe L.S. Effect of nerve stimulation on prostaglandin formation and release from the rat stomach. Am. J. Physiol. 213: 1056–1064. 1967.
Bennett A., Friedmann C.A., Vane J.R. Release of prostaglandin E-1 from the rat stomach. Nature. 216: 873–876. 1967.
Tashima K., Nakashima M., Kagawa S., Kato S., Takeuchi K. Gastric hyperemic response induced by acid back-diffusion in rat stomachs following barrier disruption – relation to vanilloid type-1 receptors. Med. Sci. Monit. 8(5): BR157–63. 2002.
Kita K., Takahashi K., Ohashi Y., Takasuka H., Aihara E., Takeuchi K. Phosphodiesterase isozymes involved in regulation of formula secretion in isolated mouse stomach in vitro. J. Pharmacol. Exp. Ther. 326(3): 889–896. 2008.
Takeuchi K., Koyama M., Hayashi S., Aihara E. Prostaglandin EP receptor subtypes involved in regulating HCO(3)(–) secretion from gastroduodenal mucosa. Curr. Pharm. Des. 16(10): 1241–1251. 2010.
Funatsu T., Chono K., Hirata T., Keto Y., Kimota A., Sasamata M. Mucosal acid causes gastric mucosal microcirculatory disturbance in nonsteroidal anti-inflammatory drug-treated rats. Eur. J. Pharmacol. 554: 53–59. 2007.
Spicuzza L., Barnes P.J., Di Maria G.U., Belvisi M.G. Effect of 8-iso-prostaglandin F(2 alpha) on acetylcholine release from parasympathetic nerves in guinea pig airways. Eur. J. Pharmacol. 416(3): 231–234. 2001.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


