Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 9, стр. 1179-1188
Стероидогенез и сперматогенез у самцов мышей со стрептозотоциновым сахарным диабетом
К. В. Деркач 1, А. А. Бахтюков 1, Л. В. Баюнова 1, И. И. Зорина 1, Викас Рой 2, А. Ю. Грязнов 1, 3, А. О. Шпаков 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
2 Университет Мизорама
Аиджал, Мизорам, Индия
3 Центр планирования семьи и репродукции
Пушкин, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 29.07.2019
После доработки 31.07.2019
Принята к публикации 31.07.2019
Аннотация
Сахарный диабет 1-го типа (СД1) приводит к нарушениям функций мужской репродуктивной системы, включая андрогенный дефицит и нарушенный сперматогенез. Однако в условиях СД1 активность системы стероидогенеза в семенниках и взаимосвязи между нарушениями стероидогенеза и сперматогенеза и выраженностью метаболических и гормональных изменений остаются малоизученными. Целью работы было изучить стероидогенез и сперматогенез у самцов мышей с сильно выраженной (свД) и умеренно выраженной (увД) формами СД1, индуцированными последовательными инъекциями стрептозотоцина. Уровни тощаковой глюкозы и инсулина в крови мышей групп свД и увД составили 11.6 ± 1.5 и 8.5 ± 1.0 мМ и 0.13 ± 0.04 и 0.21 ± 0.06 нг/мл, и статистически значимо отличались от таковых в контроле (5.1 ± 0.4 мМ и 0.43 ± 0.08 нг/мл, P < 0.05). В группе свД в сравнении с контролем достоверно снижались уровни лептина и тестостерона в крови, в семенниках в среднем на 30–40% снижалась экспрессия генов, кодирующих транспортный белок StAR и ферменты стероидогенеза цитохромы Р450scc и Р450-17α и дегидрогеназы 3β-HSD и 17β-HSD. Анализ спермограмм показал снижение количества сперматозоидов с поступательным прямолинейным движением и повышение морфологически дефектных форм в группе свД. У мышей группы увД эти изменения были выражены в меньшей степени. Парадоксально, что в группе увД интратестикулярные уровни прогестерона и тестостерона были снижены, в то время как в группе свД, несмотря на андрогенный дефицит, они не отличались от таковых в контроле, что может быть связано с нарушением транспорта тестостерона в кровоток при более тяжелой форме СД1. Таким образом, выявлены специфичные изменения стероидогенеза и сперматогенеза у самцов мышей с СД1 различной степени тяжести, что необходимо учитывать при лечении репродуктивных дисфункций, ассоциированных с диабетической патологией.
Сахарный диабет 1-го типа (СД1), характерными чертами которого являются сильно выраженная гипергликемия и острый дефицит инсулина, сопровождается рядом тяжелых осложнений, среди которых важное место занимают дисфункции репродуктивной системы. У мужчин, страдающих СД1, выявлено снижение уровня половых стероидных гормонов, нарушение сперматогенеза и, как следствие, сниженная фертильность, что часто приводит к бесплодию [1–3]. Показано, что у мышей с СД1 существенно снижен уровень тестостерона в крови, концентрация лютеинизирующего и фолликулостимулирующего гормонов и их соотношение, а также количество и подвижность сперматозоидов, причем выраженность этих изменений зависит от модели СД1, тяжести и продолжительности заболевания [4–7]. Наряду с гипергликемией, важную роль в нарушении функций семенников могут играть недостаток инсулина и лептина, которые прямо или опосредованно влияют на процессы стероидогенеза и сперматогенеза у человека и экспериментальных животных [8–11]. При этом исследования системы стероидогенеза, в которых оцениваются экспрессия генов, кодирующих ключевые стероидогенные ферменты, а также уровни стероидных гормонов в семенниках грызунов с различными по степени тяжести формами СД1 в настоящее время отсутствуют. Не изучены взаимосвязи между показателями стероидогенеза и сперматогенеза и изменениями концентраций инсулина и лептина в крови диабетических животных. В этой связи необходимо отметить, что расшифровка и изучение молекулярных механизмов индукции и развития нарушений стероидогенеза и сперматогенеза в условиях диабетической патологии имеет большое значение для разработки подходов, направленных на предупреждение и коррекцию репродуктивных дисфункций, характерных для СД1.
Цель работы состояла в изучении стероидогенеза и сперматогенеза у самцов мышей с СД1 различной степени тяжести, индуцированным последовательными инъекциями стрептозотоцина. Интенсивность стероидогенеза оценивали по уровню тестостерона в крови, по уровням тестостерона и его предшественников (прогестерона, 17-гидроксипрогестерона) в семенниках, а также по интратестикулярной экспрессии генов, кодирующих белок StAR, осуществляющий транспорт холестерина в митохондрии, и основные ферменты стероидогенеза. Изучали экспрессию генов цитохрома Р450scc (Cyp11a1), осуществляющего превращение холестерина в прегненолон, 3β-гидроксистероиддегидрогеназы (Hsd3b), катализирующей конверсию прегненолона в прогестерон, цитохрома Р450-17α (Cyp17a1), осуществляющего превращение прогестерона сначала в 17-гидроксипрогестерон и затем в андростендион, и 17β-гидроксистероиддегидрогеназы (Hsd17b), катализирующей заключительную стадию синтеза тестостерона. Для оценки сперматогенеза сперматозоиды извлекали из каудального отдела эпидидимиса, определяли общее количество сперматозоидов, количество неподвижных и дегенеративных форм, а также сперматозоидов с поступательным прямолинейным движением.
МАТЕРИАЛ И МЕТОДИКА
Для экспериментов использовали самцов белых беспородных мышей (возраст 4 месяца, масса тела 32–35 г), которые содержались в пластиковых садках, в условиях нормального суточного цикла и температуры (12 ч день/12 ч ночь, 24 ± 3°C), со свободным доступом к стандартному корму (Ассортимент-Агро, Московская область, Тураково, Россия) и питьевой воде. Все экспериментальные процедуры проводили в строгом соответствии с требованиями Комитета по биоэтике ИЭФБ РАН и European Communities Council Directive 1986 (86/609/EEC).
Случайным образом были сформированы две группы мышей – контрольная (К, n = 6) и диабетическая (Д, n = 20). Животных из группы Д четырежды с интервалами в 3 дня обрабатывали стрептозотоцином (Sigma, США). Препарат вводили внутрибрюшинно, в виде раствора в 0.1 М Na+-цитратном буфере (pH 4.5), в разовой дозе 75 мг/кг (суммарная доза в течение десятидневного периода введения препарата составила 300 мг/кг). Контрольным животным в те же сроки вводили цитратный буфер без стрептозотоцина. Через 10 дней после последней инъекции по результатам измерения мониторинга уровня постпрандиальной глюкозы диабетических мышей разделили на две группы – с сильно выраженным (свД, n = 6) и умеренно выраженным СД1 (увД, n = 6), которые имели средние значения уровня глюкозы в крови 21.9 ± 1.6 и 14.6 ± 2.1 мМ, соответственно, превышающие таковые в группе К (6.3 ± ± 0.5 мМ, p < 0.05). Часть мышей (n = 8) со слабо выраженным СД1 или с очень тяжелой его формой была выведена из эксперимента. Уровень глюкозы в крови, получаемой из хвостовой вены, определяли с помощью тест-полосок One Touch Ultra (США) и глюкометра Life Scan Johnson & Johnson (Дания). Через 30 дней после первой инъекции стрептозотоцина животных декапитировали под наркозом, забирая у них образцы крови, ткани семенников и каудальную часть эпидидимиса. В крови мышей определяли уровни инсулина и лептина с помощью наборов Mouse Insulin ELISA kit (Mercodia AB, Швеция) и ELISA kit for Leptin (Cloud-Clone Corp., США). Концентрацию тестостерона в крови и семенниках определяли с помощью набора Тестостерон-ИФА (Алкор-Био, Россия), содержание 17-гидроксипрогестерона и прогестерона в семенниках мышей – с помощью наборов Прогестерон-ИФА и 17-OH-Прогестерон-ИФА (ООО Хема Медика, Россия).
Экспрессию генов в семенниках мышей оценивали, используя количественную ПЦР с обратной транскрипцией, для чего из тестикулярной ткани с помощью TRIzol Reagent (Thermo Fisher Scientific Inc., США) выделяли общую РНК. В дальнейшем с использованием набора MMLV RT Kit (Евроген, Россия) с помощью обратной транскрипции получали кодирующую ДНК. Амплификацию проводили в среде qPCRmix-HS SYBR+LowROX (Евроген, Россия), содержащей 10 нг ПЦР-продукта и по 0.4 мкМ прямого и обратного праймеров, как описано ранее [12]. Амплификационный сигнал детектировали с помощью прибора 7500 Real-Time PCR System (Thermo Fisher Scientific Inc., США). Экспрессию генов, кодирующих StAR-белок (Star), цитохромы Р450scc (Cyp11a1) и Р450-17α (Cyp17a1), гидроксистероиддегидрогеназы 3β-HSD (Hsd3B) и 17β-HSD (Hsd17B), определяли с помощью следующих праймеров: Star – AAGGCTGGAAGAAGGAAAGC (For) и CACCTGGCACCACCTTACTT (Rev); Cyp11a1 – TATTCCGCTTTGCCTTTGAG (For) и CACGATCTCCTCCAACATCC (Rev); Hsd3B – AGGCCTGTGTCCAAGCTAGTGT (For) и CTCGGCCATCTTTTTGCTGTAT (Rev); Cyp17a1– CATCCCCCACAAGGCTAAC (For) и TGTGTCCTTGGGGACAGTAAA (Rev); Hsd17B – CCTTTGGCTTTGCCATGAGA (For) и CAATCCATCCTGCTCCAACCT (Rev). В качестве референсных использовали гены для β-актина (Actb) и глицеральдегидфосфатдегидрогеназы (Gapdh). Анализ результатов проводили с использованием порогового метода ΔΔСt с помощью программного обеспечения 7500 Software v2.0.6 и Expression Suite Software v1.0.3. Значения RQ в диабетических группах мышей рассчитывали по отношению к контрольной группе животных.
Для оценки показателей спермограммы каудальную часть эпидидимиса мышей массой 18–25 мг иссекали ножницами, измельчали в 250 мкл среды фертилизации Quinn’s AdvantageTM Medium With HEPES (In Vitro Fertilization Inc., Cooper Surgical Company, США), затем инкубировали в течение 15 мин при 37°C. Для изучения морфологии сперматозоидов готовили мазок на предметном стекле с последующей окраской азуром и эозином с использованием набора реагентов Спермо-Дифф-200 (ООО Синтакон, Россия). Осуществляли подсчет морфологически дефектных форм, включающих сперматозоиды с извитым хвостом или дефектами головки, из расчета на 100 сперматозоидов в каждом препарате. Фотографии препаратов получали с использованием микроскопа Axio Lab.A1 MAT (Carl Zeiss, Германия) со встроенной телевизионной камерой и программы Axio-Vision 4.8 при увеличении ×1000.
Статистический анализ экспериментальных данных проводили с помощью программы Microsoft Office Excel 2007 (надстройки AtteStat 12.5 и Daniel’s XL Toolbox 6.52). Данные представляли как M ± SD. Нормальность распределения проверяли с помощью критерия Шапиро–Уилка. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента, для сравнения трех групп – дисперсионный анализ с поправкой Бонферрони. Статистически значимыми считали отличия при уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Масса тела и яичек у мышей с сильно и умеренно выраженным СД1 была достоверно снижена в сравнении с контрольными животными. В группах свД и увД в значительной степени были повышены уровни тощаковой и постпрандиальной глюкозы и снижен уровень инсулина в крови (табл. 1). При этом в группе увД уровни глюкозы были ниже, чем в группе свД. Статистически значимое снижение уровней лептина и тестостерона в крови диабетических мышей отмечали только в группе свД. Соответствующие показатели в группе увД не отличались от таковых в группе К и были достоверно выше, чем у мышей группы свД (табл. 1). Эти данные свидетельствуют о том, что мыши групп свД и увД имеют характерные для СД1 гипергликемию и инсулиновый дефицит, причем мыши с более тяжелой формой заболевания характеризуются не только более выраженной гипергликемией, но и отчетливо выраженными гиполептинемией и андрогенным дефицитом.
Таблица 1.
Масса тела и яичек, метаболические и гормональные показатели у самцов мышей со стрептозотоциновой моделью СД1
| Показатель | Контроль n = 6 | свД, n = 6 | увД, n = 6 |
| Масса тела, г | 34.7 ± 2.5 | 26.2 ± 2.4a | 27.8 ± 2.2a |
| Масса яичек, мг | 226 ± 15 | 158 ± 19a | 176 ± 25a |
| Тощаковая глюкоза в крови, мМ | 5.1 ± 0.4 | 11.6 ± 1.5a | 8.5 ± 1.0a, b |
| Постпрандиальная глюкоза в крови, мМ | 6.6 ± 0.8 | 23.7 ± 4.5a | 15.7 ± 2.1a, b |
| Инсулин в крови, нг/мл | 0.43 ± 0.08 | 0.13 ± 0.04a | 0.21 ± 0.06a |
| Лептин в крови, нг/мл | 1.83 ± 0.29 | 1.10 ± 0.26a | 1.59 ± 0.33b |
| Тестостерон в крови, нМ | 5.2 ± 1.0 | 3.2 ± 0.8a | 4.4 ± 0.6b |
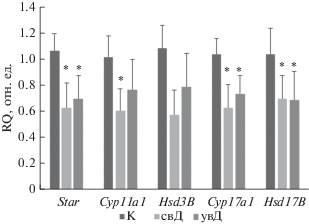
С целью изучения взаимосвязи андрогенного дефицита и интенсивности стероидогенеза у мышей с СД1 оценивали содержание стероидных гормонов и экспрессию генов стероидогенеза в семенниках диабетических животных. Показано, что у мышей с свД экспрессия генов, кодирующих транспортный белок StAR и стероидогенные ферменты, снижена в среднем на 30–40%, причем различия между группами К и свД во всех случаях были статистически значимыми (p < 0.05) (рис. 1). В группе увД также отмечали сходное по величине снижение экспрессии стероидогенных генов, но статистически значимые различия между группами К и увД отмечали только для генов Star, Cyp17a1 и Hsd17b (p < 0.05) (рис. 1). Эти данные свидетельствуют о том, что экспрессия генов белка StAR и стероидогенных ферментов у мышей как с умеренно выраженной, так и сильно выраженной формой СД1 снижается примерно в одинаковой степени. Можно лишь обратить внимание на менее выраженную тенденцию к снижению экспрессии генов Cyp11a1 и Hsd3b в группе увД.
Рис. 1.
Уровень экспрессии генов Star, Cyp11a1, Cyp17a1, Hsd3B и Hsd17B, кодирующих стероидогенные белки, в семенниках самцов мышей с сильно и умеренно выраженным СД1 в сравнении с контрольными животными. Уровень экспрессии генов нормирован по уровню экспрессии референсных генов Gapdh и Actb. Группы: К – контроль; свД – мыши с сильно выраженным СД1; увД – мыши с умеренно выраженным СД1. Значения RQ рассчитаны по отношению к контрольной группе животных. * – Различия между контролем и группами свД и увД статистически значимы при p < 0.05. Данные представлены в виде M ± SD. n = 6.
Несколько неожиданным было отсутствие на фоне выраженной андрогеной недостаточности значимых различий между интратестикулярными уровнями стероидных гормонов – тестостерона и его прекурсоров прогестерона и 17-гидроксипрогестерона, в группах К и свД. В то же время у мышей группы увД, без выраженного андрогенного дефицита, отмечали снижение уровней прогестерона и тестостерона в семенниках на 33 и 31% (p < 0.05) (рис. 2).
Рис. 2.
Уровни тестостерона и его предшественников, прогестерона и 17-гидроксипрогестерона, в семенниках самцов мышей с СД1 в сравнении с контрольными животными. Группы: К – контроль; свД – мыши с сильно выраженным СД1; увД – мыши с умеренно выраженным СД1. * – Различия между контролем и группами свД и увД статистически значимы при p < 0.05. Данные представлены в виде M ± SD. n = 6.

Несмотря на то, что взаимосвязи между экспрессией стероидогенных генов и интратестикулярными уровнями стероидных гормонов в семенниках мышей с СД1 до нас не были изучены, имеются исследования, в которых оценивали некоторые показатели стероидогенеза у крыс со стрептозотоциновой моделью СД1 [17]. Показано, что у крыс с СД1, индуцированным обработкой стрептозотоцином в дозе 50 мг/кг, снижалась экспрессия белка StAR и дегидрогеназы 3β-HSD, в то время как экспрессия дегидрогеназы 17β-HSD менялась слабо. Как и в нашем случае, в условиях выраженного системного андрогенного дефицита концентрация тестостерона в семенниках крыс при СД1 практически не менялась. В то же время у диабетических крыс в два раза снижалось количество синтезируемого в семенниках андроген-связывающего белка (Androgen-binding protein, ABP), который является одной из изоформ секс-гормон-связывающего глобулина (Sex hormone-binding globulin, SHBG) [13]. Установлено, что позитивными регуляторами экспрессии ABP в семенниках являются тестостерон и гонадотропины, а также повышенная активность внутриклеточных цАМФ-зависимых сигнальных каскадов и активируемых через них транскрипционных факторов CREB и CREM [14–17]. Поскольку в условиях СД1, как и при длительном голодании, наряду со снижением в крови уровней тестостерона и гонадотропинов, в семенниках крыс ослабляется активность чувствительной к гонадотропинам аденилатциклазной сигнальной системы, катализирующей синтез цАМФ и ответственной за стероидогенез в клетках Лейдига [18, 19], все эти факторы в совокупности способны снижать интратестикулярную продукцию ABP. Результатом этого является нарушение переноса тестостерона в виде комплексов с ABP в кровоток, что приводит к накоплению тестостерона в семенниках и снижению его уровня в крови, а также снижение внутритестикулярного транспорта тестостерона к незрелым сперматозоидам, что препятствует их созреванию и снижает количество их высокоподвижных форм [20]. Соотношение уровней тестостерона в крови и семенниках в контрольной группе в 1.6 раза выше, чем в группе свД. При этом в группе увД, при менее выраженной форме СД1, несмотря на некоторое снижение интратестикулярного уровня тестостерона, его соотношение в семенниках и крови соответствует таковому в контроле. Это позволяет сделать вывод о том, что транспорт тестостерона из интратестикулярного пространства в кровоток в полной мере сохраняется. Нельзя исключить того факта, что снижение уровня тестостерона в семенниках мышей группы увД может быть обусловлено, по крайней мере, частично, интенсификацией его переноса в кровоток.
Анализ спермограмм мышей групп К и свД показал, что у диабетических животных отмечается тенденция к снижению общего числа сперматозоидов и статистически значимое увеличение доли дефектных форм сперматозоидов и доли сперматозоидов с поступательным прямолинейным движением (табл. 2). При этом среди морфологически дефектных форм сперматозоидов превалировали сперматозоиды с извитым хвостом (рис. 3).
Рис. 3.
Микрофотографии сперматозоидов мыши с сильно выраженной формой СД1. А – морфологически нормальные сперматозоиды, Б – сперматозоиды с извитым хвостом, В – сперматозоиды с дефектом головки. Окраска произведена с помощью азура и эозина (увеличение ×1000).

Таблица 2.
Показатели спермограммы у самцов мышей с СД1 в сравнении с таковыми у контрольных мышей
| Показатель | Контроль, n = 6 | свД, n = 6 | увД, n = 6 |
| Количество сперматозоидов, ×106/мг эпидидимиса | 1.62 ± 0.46 | 1.29 ± 0.39 | 1.52 ± 0.52 |
| Доля сперматозоидов с морфологическими дефектами хвоста и головки, % | 24 ± 6 | 59 ± 18 a | 32 ± 11 b |
| Доля сперматозоидов с поступательным прямолинейным движением, % | 26 ± 7 | 13 ± 5 a | 22 ± 5 b |
Учитывая тот факт, что интратестикулярный уровень тестостерона в группе свД не отличался от такового в контроле, основными факторами, которые могли привести к значительным нарушениям сперматогенеза у мышей с сильно выраженной формой диабетической патологии может быть нарушение транспорта тестостерона в придатки яичка, где происходит процесс созревания сперматозоидов, а также снижение уровней лептина и гонадотропинов в крови, также контролирующих этот процесс. Установлено, что лептиновая сигнализация в семенниках может быть ослаблена как в условиях лептинового дефицита, который показан нами у мышей с сильно выраженным формой СД1, так и лептиновой резистентностью, развивающейся при СД2 и тяжелых формах ожирения. Независимо от первопричины, снижение активности лептиновых сигнальных путей в семенниках нарушает процесс созревания сперматозоидов, непосредственно воздействуя на незрелые сперматиды [21]. Показано также, что нарушение лептинового сигналинга может привести к развитию варикоцеле, представляющему собой расширение вен гроздьевидного сплетения семенного канатика, и, тем самым, активировать процессы воспаления, окислительного стресса и апоптоза в созревающих сперматозоидах [22]. Необходимо отметить, что в группе увД изменения сперматогенной функции были выражены в меньшей степени, и уровень лептина в крови статистически значимо не отличался от такового в контроле (табл. 2).
Таким образом, нами впервые показано, что у мышей с сильно выраженным стрептозотоциновым СД1, на фоне гипергликемии и острого инсулинового дефицита, снижаются уровни тестостерона и лептина в крови, ослабляется экспрессия генов, кодирующих стероидогенные белки, а также нарушается сперматогенез, о чем свидетельствует повышение доли дефектных сперматозоидов и снижение доли их подвижных форм. У мышей с умеренно выраженным СД1 эти нарушения выражены в меньшей степени, что указывает на прямую взаимосвязь между тестикулярными дисфункциями и тяжестью метаболических и гормональных нарушений при СД1, в том числе снижением уровня лептина в крови. Впервые обнаружено, что уровень тестостерона в семенниках мышей с сильно выраженным СД1 не отличается от такового в контроле, в то время как в группе мышей с умеренно выраженным СД1 он был снижен. Высокий уровень тестостерона при сильно выраженном СД1 может быть обусловлен снижением транспорта тестостерона из семенников в кровоток, о чем свидетельствует снижение соотношения уровней тестостерона в крови и семенниках. Важно отметить, что в группе с умеренно выраженным СД1 такой транспорт сохранялся. Полученные данные свидетельствуют о том, что одним из путей коррекции репродуктивных дисфункций при СД1 может являться предотвращение дефицита уровня циркулирующего в крови лептина и нормализация активности систем, ответственных за продукцию стероидных гормонов в семенниках и их транспорт в кровоток и придатки яичка.
Список литературы
Шпаков А.О. Функциональное состояние гипоталамо-гипофизарно-гонадной системы при сахарном диабете. Проблемы эндокринологии. 56(5): 23–29. 2010. [Shpakov A.O. Functional state of the hypothalamic-pituitary-gonadal axis in diabetes mellitus. Probl. Endokrinol. (Mosk.) 56(5): 23–29. 2010. (In Russ.)]
Jangir R.N., Jain G.C. Diabetes mellitus induced impairment of male reproductive functions: A review. Curr. Diabetes Rev. 10(3): 147–157. 2014.
Shi G.J., Li Z.M., Zheng J., Chen J., Han X.X., Wu J., Li G.Y., Chang Q., Li Y.X., Yu J.Q. Diabetes associated with male reproductive system damages: Onset of presentation, pathophysiological mechanisms and drug intervention. Biomed. Pharmacother. 90: 562–574. 2017. https://doi.org/10.1016/j.biopha.2017.03.074
Ahangarpour A., Oroojan A.A., Heidari H., Ehsan G., Rashidi Nooshabadi M.R. Effects of Hydro-Alcoholic Extract of Rhus coriaria (Sumac) Seeds on Reproductive Complications of Nicotinamide-Streptozotocin Induced Type-2 Diabetes in Male Mice. World J. Mens Health. 32(3): 151–158. 2014. https://doi.org/10.5534/wjmh.2014.32.3.151
Feyli S.A., Ghanbari A., Keshtmand Z. Therapeutic effect of pentoxifylline on reproductive parameters in diabetic male mice. Andrologia. 49(1): 12604. 2017. https://doi.org/10.1111/and.12604
Korejo N.A., Wei Q.W., Shah A.H., Shi F.X. Effects of concomitant diabetes mellitus and hyperthyroidism on testicular and epididymal histoarchitecture and steroidogenesis in male animals. J. Zhejiang Univ. Sci. B. 17(11): 850–863. 2016.
Sampannang A., Arun S., Burawat J., Sukhorum W., Iamsaard S. Testicular histopathology and phosphorylated protein changes in mice with diabetes induced by multiple-low doses of streptozotocin: An experimental study. Int. J. Reprod. Biomed. (Yazd). 16(4): 235–246. 2018.
Ahn S.W., Gang G.T., Kim Y.D., Ahn R.S., Harris R.A., Lee C.H., Choi H.S. Insulin directly regulates steroidogenesis via induction of the orphan nuclear receptor DAX-1 in testicular Leydig cells. J. Biol. Chem. 288(22): 15937–15946. 2013. https://doi.org/10.1074/jbc.M113.451773
Chou S.H., Mantzoros C. 20 years of leptin: Role of leptin in human reproductive disorders. J. Endocrinol. 223(1): T49–T62. 2014. https://doi.org/10.1530/JOE-14-0245
Leisegang K., Henkel R. The in vitro modulation of steroidogenesis by inflammatory cytokines and insulin in TM3 Leydig cells. Reprod. Biol. Endocrinol. 16(1): 26. 2018. https://doi.org/10.1186/s12958-018-0341-2
Shpakov A.O., Ryzhov Ju.R., Bakhtyukov A.A., Derkach K.V. The regulation of the male hypothalamic-pituitary-gonadal axis and testosterone production by adipokines (Chapter 2). Advances in Testosterone Action. Rijeka. Croatia. Intech Open Access Publisher: 25–57. 2018. ISBN 978-953-51-6241-4. https://doi.org/10.5772/intechopen.76321.
Бахтюков А.А., Деркач К.В., Шпаков А.О. Взаимосвязь между андрогенным дефицитом и ослаблением чувствительности аденилатциклазы к гонадотропинам в семенниках крыс со стрептозотоциновым диабетом различной степени тяжести. Рос. физиол. журн. им. И.М. Сеченова. 105(1): 100–110. 2019. [Bakhtyukov A.A., Derkach K.V., Shpakov A.O. The relationship between an androgen deficiency and a decrease of the sensitivity of testicular adenylyl cyclase to gonadotropines in rats with streptozotocin diabetes of varying severity. Russ. J. Physiol. 105(1): 100–110. 2019. (in Russ.)] https://doi.org/10.1134/S0869813919010011
Premalatha R., Jubendradass R., Rani S.J., Srikumar K., Mathur P.P. A phytooxysterol, 28-homobrassinolide modulates rat testicular steroidogenesis in normal and diabetic rats. Reprod. Sci. 20(5): 589–596. 2013. https://doi.org/10.1177/1933719112459241
Danzo B.J., Pavlou S.N., Anthony H.L. Hormonal regulation of androgen binding protein in the rat. Endocrinology. 127(6): 2829–2838. 1990.
Dimitriadis F., Tsampalas S., Tsounapi P., Giannakis D., Chaliasos N., Baltogiannis D., Miyagawa I., Saito M., Takenaka A., Sofikitis N. Effects of phosphodiesterase-5 inhibitor vardenafil on testicular androgen-binding protein secretion, the maintenance of foci of advanced spermatogenesis and the sperm fertilising capacity in azoospermic men. Andrologia. 44. Suppl. 1: 144–153. 2012. https://doi.org/10.1111/j.1439-0272.2010.01153.x
Ma Y., Yang H.Z., Xu L.M., Huang Y.R., Dai H.L., Kang X.N. Testosterone regulates the autophagic clearance of androgen binding protein in rat Sertoli cells. Sci. Rep. 5: 8894. 2015. https://doi.org/10.1038/srep08894
Selva D.M., Hammond G.L. Human sex hormone-binding globulin is expressed in testicular germ cells and not in Sertoli cells. Horm. Metab. Res. 38(4): 230–235. 2006. https://doi.org/10.1055/s-2006-925336
Деркач К.В., Мойсеюк И.В., Чистякова О.В., Бондарева В.М. Шпаков А.О. Активность аденилатциклазной системы в миокарде и семенниках крыс с острой и пролонгированной стрептозотоциновыми моделями сахарного диабета. Технологии живых систем. 10(9): 3–12. 2013. [Derkach K.V., Moyseyuk I.V., Chistyakova O.V., Bondareva V.M., Shpakov A.O. Activity of adenylyl cyclase system in the myocardium and testes of rats with acute and long-term streptozotocin models of diabetes mellitus. Tekhnologii Zhivykx Syst. 10(9): 3–12. 2013. (in Russ.)]
Shpakov A.O., Derkach K.V., Chistyakova O.V., Bondareva V.M. Functional state of adenylyl cyclase signaling system in rat testis and ovary under conditions of fasting. J. Evol. Biochem. Physiol. 47(1): 43–52. 2011. https://doi.org/10.1134/S0022093011010063]
Hermo L., Barin K., Oko R. Androgen binding protein secretion and endocytosis by principal cells in the adult rat epididymis and during postnatal development. J. Androl. 19(5): 527–541. 1998.
Elfassy Y., Bastard J.P., McAvoy C., Fellahi S., Dupont J., Levy R. Adipokines in Semen: Physiopathology and Effects on Spermatozoas. Int. J. Endocrinol. 2018: 3906490. 2018. https://doi.org/10.1155/2018/3906490
Zhang J., Jin P.P., Gong M., Yi Q.T., Zhu R.J. Role of leptin and the leptin receptor in the pathogenesis of varicocele-induced testicular dysfunction. Mol. Med. Rep. 17(5): 7065–7072. 2018. https://doi.org/10.3892/mmr.2018.8753
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


