Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 10, стр. 1312-1320
Особенности распределения различных изоформ гемоглобина в эритроцитах крыс
Б. Г. Юшков 1, 2, 3, С. А. Бриллиант 1, 3, *
1 Институт иммунологии и физиологии Уральского отделения РАН
Екатеринбург, Россия
2 Уральский федеральный университет им. первого Президента России Б.Н. Ельцина,
Институт естественных наук и математики
Екатеринбург, Россия
3 Институт медицинских клеточных технологий
Екатеринбург, Россия
* E-mail: svetlana.brilliant@bk.ru
Поступила в редакцию 14.05.2020
После доработки 05.07.2020
Принята к публикации 18.08.2020
Аннотация
С помощью фракционного центрифугирования эритроцитов периферической крови интактных крыс удается выделить шесть фракций клеток, отличающихся содержанием и соотношением разных изоформ гемоглобина. Распределение гемоглобина в эритроцитах характеризуется тем, что если в цельной крови определяется шесть изоформ белка, то в клетках каждой отдельной фракции только две. Эритроциты с изоформами меньшей молекулярной массы содержат меньший процент гемоглобинов с кислото- и щелочеустойчивыми свойствами.
На данный момент описаны первичные структуры более 600 вариантов гемоглобинов различных животных [1–4]. Довольно часто в крови одного организма определяется несколько гемоглобинов, которые принято называть изоформами, иногда близких по свойствам, а иногда значительно различающихся. Так, в крови взрослого человека циркулирует три изоформы гемоглобина, у птиц – две [5, 6], у крысы – шесть [5, 7, 8], а по некоторым данным девять [9].
Вместе с тем, возникает вопрос о количестве видов гемоглобина в одном эритроците: содержит ли он одну или несколько изоформ, каких и сколько. В работе Betke и Kleihauer утверждается, что у взрослого человека фетальный гемоглобин содержится лишь в небольшом числе красных клеток [10]. Сходные данные получены Стародубом и Назаренко относительно гемоглобинов крыс: фракции, обозначенные авторами как пятая и шестая также обнаружены лишь в некоторых эритроцитах [11]. Ряд авторов допускает, что один эритроцит может содержать несколько типов гемоглобина, в частности, в клетках с фетальным гемоглобином имеется определенное количество гемоглобина A [12]. Однако вопрос о распределении разных изоформ гемоглобина в эритроцитах остается не решенным.
Цель исследования – оценить распределение изоформ гемоглобина с разной молекулярной массой в эритроцитах крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проводили на 18 крысах-самцах линии Вистар массой 250–300 г. Условия содержания и обращение с используемыми в эксперименте животными соответствовали рекомендациям международных этических комитетов (Директива Совета ЕС2010/63/EU), а также Этического комитета ИИФ УрО РАН.
Кровь в объеме 6 мл забирали из хвостовой вены животных, наркотизированных с помощью диэтилового эфира. Животные после забора крови оставались живыми. 1 мл цельной крови использовали для проведения общего анализа и определения фракций гемоглобина. Оставшуюся кровь использовали для разделения эритроцитов на фракции. Для этого 5 мл цельной крови разводили физиологическим раствором для внутривенных инъекций (производство Solopharm ООО Гротекс, Россия) в соотношении 1 : 1 и центрифугировали на центрифуге Sigma 3R30 (Россия) в течение 5 мин (1-я проба) при 500 об/мин (RCF = 19.56 g). Полученный осадок разводили физиологическим раствором до объема 0.5 мл и прогоняли через геманализатор. Надосадочную жидкость доводили до 10 мл и повторно центрифугировали при 500 об/мин (RCF = 19.56 g), и так же, как и осадок, проводили измерения на геманализаторе Celly 70 фирмы Biocode-Hycel (Франция) в каждой пробе. Процедуру повторяли 6 раз, увеличивая время центрифугирования для каждой последующей пробы: 2-я проба – 10, 3-я проба – 15, 4-я – 20, 5-я – 25 и 6-я проба – 30 мин (рис. 1). После шестого центрифугирования эритроциты в надосадочной жидкости не выявлялись.
Рис. 1.
Схема разделения эритроцитов на фракции. Fig. 1. Scheme of separation the erythrocytes on fractions.

Таким образом, удавалось разделить эритроциты на 6 фракций. На гематологическом анализаторе Celly 70 фирмы Biocode-Hycel (Франция) оценивали качественные характеристики эритроцитов как в цельной крови, так и в каждой отдельной фракции, включая средний объем эритроцитов, среднее содержание гемоглобина в эритроците, среднюю концентрацию гемоглобина в эритроците и индекс анизоцитоза эритроцитов.
Для выявления эритроцитов, содержащих фетальные формы гемоглобина – ФК, мазки крови выдерживали в цитратно-фосфатном буфере (pH 4.5), затем в 1%-ном растворе эозина (метод Betke–Kleihauer) [10]. Подсчет ретикулоцитов осуществляли в мазках крови, окрашенных бриллиантовым крезиловым синим. Ретикулоциты и клетки с фетальным гемоглобином считали в мазках крови на 1000 эритроцитов, при увеличении 100× на световом микроскопе Leica DM 2500 (Германия).
Для определения изоформ гемоглобина приготовляли гемолизат из периферической крови по стандартной методике [13, 14]. Для приготовления образца к 0.5 мл цельной крови или взвеси эритроцитов (после центрифугирования) добавляли 0.5 мл физиологического раствора (соотношение 1 : 1) и центрифугировали при 3000 оборотах (RCF = 704.34 g) в течение 15 мин. Затем надосадочную жидкость сливали, осадок вновь разводили в 1 мл физиологического раствора и вновь центрифугировали при тех же условиях. Процедуру повторяли трижды. Гемолиз эритроцитов проводили осмотическим способом путем смешивания эритромассы с тремя объемами дистиллированной воды. Выбор осмотического гемолиза был обусловлен требованием сведения до минимума воздействия на структуру гемоглобина. После добавления дистиллированной воды смесь оставляли на 10 мин с целью выжидания полного разрушения эритроцитов. Затем добавляли 1 объем хлороформа. Встряхивали в течение 1 мин и центрифугировали 5 мин при 3000 оборотах (RCF = 704.34 g). В результате центрифугирования смесь распределялась на три слоя: нижний слой – хлороформ, средний – клеточный детрит, верхний – раствор гемоглобина (гемолизат). К гемолизату добавляли равный объем 50%-ного раствора глицерина и содержали в холодильной камере при температуре 3–5°С. Данные образцы могли храниться в течение 2 недель.
Для определения соотношения между белковыми фракциями гемоглобина использовали метод электрофореза в полиакриламидном геле по Мауреру [14]. Электрофорез осуществлялся в ПААГ 10%-ной концентрации с помощью оборудования фирмы Bio-Rad (США). В лунки геля вносились образцы в количестве 200 мкл на 1 лунку. Для точного определения молекулярных масс в первую лунку вносился белковый стандарт Precision Plus Protein Standards Dual Color фирмы Bio-Rad (США). Диапазон молекулярных масс составлял от 10 до 250 кДа. С 2-й по 10-ю лунки геля вносили образцы гемолизата.
Электроды устанавливались таким образом, чтобы в верхнем электродном буфере располагался катод, а в нижнем – анод, поскольку гемоглобин по своей природе является полианионом. Это обеспечивало движение образца от катода к аноду. Электрофорез проводили в одной гелевой ячейке (конструкцией прибора предусмотрено использование двух ячеек). После полной подготовки системы к работе устанавливали силу тока 10 мА на время вхождения образца в концентрирующий гель, а затем 50 мА в течение 1 ч. После отключения источника питания электродные буферы сливали в сосуды, извлекали гелевую ячейку и отслаивали от геля переднюю стенку. Для лучшей диагностики проводили окрашивание полос бензидиновым раствором (смешивали 0.025 г основного бензидина и 0.1 г перекиси бария, перед исследованием добавляли 5 мл 50%-ного раствора уксусной кислоты и взбалтывали до полного растворения бензидина). Далее электрофореграмму подвергали моментальному сканированию и денситометрической обработке с помощью программы Image Lab 6.0.1. фирмы Bio-Rad (США), определяющей как соотношение отдельных изоформ гемоглобина, так и его молекулярную массу (рис. 2) [5, 13, 14].
Рис. 2.
Разгонка белковых фракций гемоглобина в норме и после фракционного центрифугирования. Fig. 2. Acceleration of protein fractions of hemoglobin normal and after fractional centrifugation.

Статистическую обработку полученных результатов проводили в программном пакете Statistica 8.0. Данные представлены в виде среднего арифметического и его стандартной ошибки (M ± m). Сравнение групп выполняли с использованием критерия Манна–Уитни (U). Различия считали статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Полученные данные свидетельствуют, что в эритроцитах цельной крови определяются 6 изоформ гемоглобина, отличающиеся по электрофоретической подвижности (рис. 3), что соответствует данным других авторов [5, 7, 8]. В зависимости от молекулярной массы они были обозначены как: F1 – 52.27 ± 1.33 kDa, F2 – 56.9 ± 1.21 kDa, F3 – 63.0 ± 1.43 kDa, F4 – 70.71 ± 0.31 kDa, F5 – 81.67 ± 0.97 kDa и F6 – 86.86 ± 0.54 kDa.
Рис. 3.
Эритрофореграмма крыс без фракционного центрифугирования. Fig. 3. Erythrophoregram of rats without fractional centrifugation.

Следует отметить, что только две фракции F3 и F4 соответствуют наиболее часто приводимой в литературе расчетной величине молекулярной массы гемоглобина 65–68 kDa, в то время, как F1 и F2 – меньше, а F5 и F6 – больше указанной величины.
Увеличение молекулярной массы может быть обусловлено полимеризацией. Феномен полимеризации гемоглобина показан, в частности, у рыб [15] и рептилий – черепах [16]. При удалении гемоглобина из цитозоля эритроцитов с помощью катионообменной хроматографии в последнем удается обнаружить более 600 разных белков [17], с которыми гемоглобин может образовывать комплексы. Отдельно следует выделить мембраносвязанную форму гемоглобина [2, 18]. Полимеризация гемоглобина происходит одинаково в растворах и клетках [19].
Феномен полимеризации используется при получении кислородоносителей на основе гемоглобина. В частности, при молекулярной массе тетрамера 64 кДа получают монодисперсные рекомбинантные полимеры человеческого гемоглобина 130 и 260 кДа, а также и пен-тетрамер с молекулярной массой 320 кДа [20, 21], отличающиеся по способности переносить кислород и вазоактивному действию.
Образование изоформ с меньшей молекулярной массой может быть связано с тем, что среди различных функций гемоглобина особое место занимает его роль в образовании биоактивных сигнальных молекул. Показано, что внутри эритроцитов человека происходит интенсивный протеолиз гемоглобина, приводящий к образованию и выделению пептидных соединений, обладающих регуляторными свойствами [22]. В супернатанте эритроцитов идентифицировано более 37 пептидов, которые стимулируют пролиферацию и гемопоэз, подавляют пролиферацию, обладают бактерицидным эффектом и др., что указывает на физиологическую значимость высвобождения пептидов эритроцитами [23].
С помощью использованного метода можно разделить эритроциты крысы на 6 фракций, отличающихся по своим морфологическим характеристикам (табл. 1)
Таблица 1.
Морфологические характеристики различных фракций эритроцитов Table 1. Morphological characteristics of various fractions of red blood cells
| Фракции гемоглобина Fraction of hemoglobin | MCV, фл (средний объем эритроцитов) (red blood cell volume) |
MCH, пг (среднее содержание гемоглобина в отдельном эритроците) (hemoglobin content in red blood cell) |
MCHC, г/л (средняя концентрация гемоглобина в отдельном эритроците) (hemoglobin concentration in red blood cell) |
RDW, % (показатель анизоцитоза) (anisocytosis rate ) |
Rt, % (ретикулоциты) (reticulocytes) |
HbF, % (клетки с фетальным гемоглобином) (cells with fetal hemoglobin) |
|---|---|---|---|---|---|---|
| Контроль без разделения на фракции Сontrol without dividing into fractions (n=18) |
55.54 ± 0.32 | 17.7 ± 0.51 | 32.83 ± 1.08 | 14.12 ± 0.31 | 1.23 ± 0.06 | 1.32 ± 0.09 |
| 1 фракция 1 fraction (n =18) |
54.95 ± 0.17 | 19.26 ± 0.11 | 35.05 ± 0.26 | 14.68 ± 0.15 | 4.4 ± 0.88* | 2.27 ± 0.06* |
| 2 фракция 2 fraction (n =18) |
54.09 ± 0.08* | 18.81 ± 0.14* | 34.5 ± 0.44 | 14.51 ± 0.24 | 2.98 ± 0.22* | 2.47 ± 0.1* |
| 3 фракция 3 fraction (n =18) |
53.6 ± 0.1* | 18.32 ± 0.08 | 34.19 ± 0.22 | 14.85 ± 0.17* | 1.32 ± 0.05 | 2.67 ± 0.11* |
| 4 фракция 4 fraction (n =18) |
53.31 ± 0.08* | 18.52 ± 0.13 | 35.7 ± 0.16* | 13.9 ± 0.21 | 1.14 ± 0.4 | 2.62 ± 0.09* |
| 5 фракция 5 fraction (n =18) |
49.61 ± 2.06 | 19.07 ± 0.16* | 37.27 ± 0.47* | 13.98 ± 0.2 | 0.67 ± 0.07* | 0.7 ± 0.06* |
| 6 фракция 6 fraction (n =18) |
52.42 ± 0.19* | 17.78 ± 0.11 | 34.13 ± 0.42 | 14.9 ± 0.21* | 0.01 ± 0.008* | 0.02 ± 0.001* |
Если в цельной крови выявляется 6 изоформ гемоглобина, то после фракционирования в клетках каждой из фракций только 2 (рис. 4).
Рис. 4.
Белковые фореграммы эритроцитов после фракционного центрифугирования при 500 об/мин: (А) 5 мин; (B) 10 мин; (C) 15 мин; (D) 20 мин; (E) 25 мин; (F) 30 мин. Fig. 4. Erythrocyte protein foregramms after fractional centrifugation at 500 rpm: (A) 5 min; (B) 10 min; (C) 15 min; (D) 20 min; (E) 25 min; (F) 30 min.

Рис. 4.
Окончание
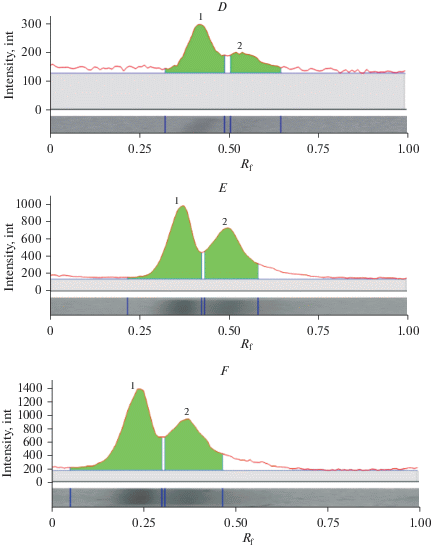
Первую фракцию составляют эритроциты, содержащие наиболее тяжелые изоформы гемоглобина – F4 и F6 (в соотношении – 54.0% и 46.0%, в 1-й пробе соответственно), вторую – эритроциты с гемоглобинами F3 и F5 (в соотношении – 60% и 40% во 2-й пробе). Третья и четвертая содержат одинаковые изоформы F3 и F4, но отличаются по соотношению последних (третья – соотношение 33.3% и 66.7% в 3-й пробе, четвертая – соотношение 43.1% и 56.9% в 4-й пробе). Пятая фракция представлена эритроцитами с F2 и F3 изоформами (в соотношении – 37.1% и 62.9% в 5-й пробе), а шестая содержит самые легкие F1 и F2 гемоглобины (в соотношении 32.5% и 67.1% в 6-й пробе) (рис. 4 ).
Эритроциты фракций 1-4 содержат одинаковый процент фетальных клеток (ФК), превышающий показатель в цельной крови, в то время как во фракциях 5 и 6 содержание этих клеток минимальное. Количество ретикулоцитов во фракциях 1 и 2 выше, в 3-й и 4-й – соответствует, а в 5-й и 6-й меньше, чем в цельной крови.
Полученные данные о наличии в эритроците двух изоформ гемоглобина вполне согласуются с выявленным ранее фактом содержания двух форм гемоглобина в ФК: HbF и HbА, при этом на долю первого приходится до 25% общего Hb в эритроците [12].
Изменения соотношения между эритроцитами с различными изоформами гемоглобина могут играть существенную роль в механизмах адаптации организма к действию экстремальных факторов и при патологии.
ЗАКЛЮЧЕНИЕ
С помощью фракционного центрифугирования эритроцитов периферической крови крыс удается выделить шесть фракций клеток, различающихся по гемоглобиновому профилю. Распределение гемоглобина в эритроцитах интактных крыс имеет ряд особенностей:
1. Определяемые в периферической крови крыс 6 изоформ гемоглобина распределяются между эритроцитами неравномерно.
2. Каждый эритроцит крысы содержит две изоформы гемоглобина.
3. Эритроциты отличаются как по видам изоформ гемоглобина, так и по соотношению между ними
4. Эритроциты, содержащие изоформы с меньшей молекулярной массой содержат меньший процент гемоглобинов с кислото- и щелочеустойчивыми свойствами.
Список литературы
Gell D. A. Structure and function of haemoglobins. Blood cells, molecules and diseases. 70: 13–42. 2018. https://doi.org/10.1016/j.bcmd.2017.10.006
Топунов А.Ф., Космачевская О.В. Множественные функциональные формы гемоглобина в организме человека: современный взгляд и практическое использование. Биомика. 10(3): 251–267. 2018. [Topunov A.F., Kosmachevskaya O.V. The multiplicity of hemoglobin functional forms in human organism: the modern view and practical applications. Biomics. 10(3):251–267. 2018. (In Russ)]. https://doi.org/10.31301/2221-6197.bmcs.2018-34
Ванин А.Ф. Динитрозильные комплексы железа с тиолсодержащими лигандами: физикохимия, биология, медицина. М. Институт комплексных исследований. 2015. [Vanin A.F. Dinitrosyl complexes of iron with thiol-containing ligands: physicochemistry, biology, medicine. M. Inst. Res. 2015. (In Russ)].
Космачевская О.В., Топунов А.Ф. Гемоглобины – разнообразие структур и функций. Приклад. биохим. и микробиол. 45(6): 627–653. 2009. [Kosmachevskaya O.V., Topunov A.F. Hemoglobins - variety of structures and functions. Appl. Biochem. and Microbiol. 45(6): 627–653. 2009. (In Russ)].
Сумин М.Н., Резайкин А.В., Юшков Б.Г. Гетерогенность гемоглобина в условиях измененного эритропоэза. Бюлл. эксперим. биол. и мед. 135 (6): 660–663. 2003. [Sumin M.N., Rezaykin A.V., Yushkov B.G. Heterogeneity of hemoglobin in conditions of altered erythropoiesis. Bull. Experim. Biol. and Med. 135 (6): 660–663. 2003. (In Russ)].
Storz J.F. Hemoglobin–oxygen affinity in high-altitude vertebrates: is there evidence for an adaptive trend? J. Experim. Biol. 219: 3190–3203. 2016. https://doi.org/10.1242/jeb.127134
Stein S., Cherian M.G., Mazur A. Preparation and properties of six rat hemoglobin’s. J. Biol. Chem. 246 (7): 5287–5293. 1971.
Проскурина И.К., Титовский А.В. Фракционный состав гемоглобина крысы при экспериментальной дегидратации. Ярославск. педагог. вестник. 3(21): 83–85. 1999. [Proskurina I.K., Titovsky A.V. The fractional composition of rat hemoglobin during experimental dehydration. Yaroslavl. Pedagog. Bull. 3(21): 83–85. 1999. (In Russ)].
Datta M.C., Gilman J.G. Rat hemoglobin heterogeneity: postnatal changes in proportions of multiple components and effects of erythropoietin on marrow cell cultures. Hemoglobin. 5(7–8): 701–14. 1981.
Betke K., Kleihauer E. Felaler and bleibender blutfarbstoff in erythrozyten und erythroblasten von menschlichen feten und neugeborene. Blut. 4: 241–250. 1958.
Стародуб Н.Ф., Назаренко В.И. Гетерогенная система гемоглобина: структура, свойства, синтез, биологическая роль. Киев. Наукова Думка. 1987. [Starodub N.F., Nazarenko V.I. Heterogeneous hemoglobin system: structure, properties, synthesis, biological role. Kiev. Scien. Dumka. 1987. (In Russ)].
Dover G.J. Quantitation of hemoglobins within individual red cells: asynchronous biosynthesis of fetal and adult hemoglobin during erythroid maturation in normal subjects. Blood. 56(6): 1082–1091. 1980.
Остерман Л.А. Методы исследования белков и нуклеиновых кислот. Электрофорез и ультрацентрифугирование. М. Наука. 1981. [Osterman L.A. Research methods for proteins and nucleic acids. Electrophoresis and ultracentrifugation. M.: Science. 1981. (In Russ)].
Maurer G. Disc-electrophoresis. Theoria et praxis polyacrylamide gel electrophoresis. M. Mir. 1971.
Hunt von Herbing I., Schroeder-Spain K. Hemoglobin Polymerization in Red Blood Cells of Marine Fishes: A Case of Adaptive Phenotypic Plasticity? Biol. Bull. 236(1): 29–42. 2019. https://doi.org/10.1086/700832
Petersen A.G., Petersen S.V., Frische S., Drakulic S., Golas M.M., Sander B., Fago A. Hemoglobin polymerization via disulfide bond formation in the hypoxia-tolerant turtle Trachemys scripta: implications for antioxidant defense and O2 transport. Am. J. Physiol. Regul. Integr. Comp. Physiol. 314: 84–93. 2018.
Bhattacharya D., Mukhopadhyay D., Chakrabarti A. Hemoglobin depletion from red blood cell cytosol reveals new proteins in 2-D gel-based proteomics study. Proteomics. Clin. Appl. 1(6): 561–564. 2007. https://doi.org/10.1002/prca.200700178
Топунов А.Ф., Петрова Н. Э. Гемоглобины: эволюция, распространение и гетерогенность. Успехи биол. хим. 1: 199–228. 2001. [Topunov A.F., Petrova N.E. Hemoglobins: evolution, distribution and heterogeneity. Advances in Biol. Chem. 1: 199–228. 2001. (In Russ)].
Сергунова В.А., Манченко Е.А., Гудкова О.Е. Гемоглобин: модификации, кристаллизация, полимеризация (обзор). Общая реаниматол. 12(6): 49–63. 2016. [Sergunova V.A., Manchenko E.A., Gudkova O.E. Hemoglobin: modifications, crystallization, polymerization (review). Gen. Resuscit. 12(6): 49–63. 2016. (In Russ)]. D0I: https://doi.org/10.15360/1813-9779-2016-6-49-63
Marquardt D.A., Doyle M.P., Davidson J.S., Epp J.K., Aitken J.F., Lemon D.D., Anthony-Cahil S.J. Monodisperse 130 and 260 kDa Recombinant Human Hemoglobin Polymers as Scaffolds for Protein Engineering of Hemoglobin-Based Oxygen Carriers. J. Funct. Biomater. 3(1): 61–78. 2012. https://doi.org/10.3390/jfb3010061
Abassi Z., Kotob S., Pieruzzi F., Abouassali M., Keiser H.R., Fratantoni J.C., Alayash A.I. Effects of polymerization on the hypertensive action of diaspirin cross-linked hemoglobin in rats. J. Lab. Clin. Med. 129(6): 603–610. 1997.
Говорун В.М., Иванов В.Т. Протеомика и пептидомика в фундаментальных и прикладных медицинских исследованиях. Биоорган. химия. 37(2): 199–215. 2011. [Govorun V.M., Ivanov V.T. Proteomics and peptidomics in fundamental and applied medical research. Bioorgan. Chem. 37(2): 199–215. 2011. (In Russ)].
Филиппова М.М., Хачин Д.П., Сазонова О.В. Блищенко Е.Ю., Яцкин О.Н., Назимов И.В., Карелин А.А., Иванов В.Т., Расстригин Н.А., Пивник А.В. Фрагменты функциональных белков в приживающей культуре эритроцитов человека. Биоорган. химия 34(2):160-170. 2008. [Filippova M.M., Khachin D.P., Sazonova O.V., Blishchenko E.Yu., Yatskin O.N., Nazimov I.V., Karelin A.A., Ivanov V.T., Rasstrigin N.A., Pivnik A.V. Fragments of functional proteins in the surviving culture of human red blood cells. Bioorgan. Chem. 34(2): 160–170. 2008 (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


