Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 11, стр. 1385-1399
Участие гормонов гипоталамо-гипофизарно-адренокортикальной системы крыс в гастропротекции при сенситизации и десенситизации капсаицин-чувствительных афферентных нейронов
Т. Т. Подвигина 1, *, О. Ю. Морозова 1, О. П. Комкова 1, Л. П. Филаретова 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: tpodvigina@yandex.ru
Поступила в редакцию 22.07.2020
После доработки 08.09.2020
Принята к публикации 08.09.2020
Аннотация
Задачей настоящей работы явилось: а) изучение вклада глюкокортикоидных гормонов в гастропротекцию, индуцированную сенситизацией капсаицин-чувствительных афферентных нейронов (КЧН), б) исследование гастропротективного эффекта кортикотропин-рилизинг-фактора (КРФ) в условиях десенситизации КЧН и возможного участия кортикостерона в этом эффекте. Эксперименты проведены на крысах-самцах линии Спрейг–Доули массой 260–300 г. В качестве ульцерогенных стимулов использовали иммобилизацию при температуре 10°С (3 ч) или введение индометацина в дозе 35 мг/кг. Сенситизацию КЧН индуцировали введением капсаицина в дозах 1 и 10 мг/кг за 1 ч до предъявления ульцерогенных стимулов, десенситизацию – введением капсаицина в суммарной нейротоксической дозе 100 мг/кг (20 + 30 + 50) в течение 3-х последовательных дней за 2 недели до начала экспериментов. КРФ вводили внутрибрюшинно в дозе 2.5 мг/кг за 30 мин до введения индометацина крысам с десенситизацией КЧН. Для изучения вовлечения кортикостерона в изучаемые гастропротективные эффекты использовали ингибитор его синтеза метирапон в дозе 30 мг/кг. Капсаицин, введенный в дозах 1 и 10 мг/кг, вызывал гастропротективный эффект в обеих ульцерогенных моделях. Введение метирапона за 30 мин до капсаицина устраняло гастропротективный эффект сенситизации КЧН, вызванной введением капсаицина в дозе 1 мг/кг, но не влияло на гастропротективный эффект капсаицина при его введении в дозе 10 мг/кг. Введение КРФ индуцировало гастропротективный эффект не только у контрольных крыс, но и у животных с десенситизацией КЧН. Результаты экспериментов с метирапоном свидетельствуют о том, что обнаруженный гастропротективный эффект КРФ у крыс с десенситизацией КЧН, по крайней мере, частично опосредуется кортикостероном.
Известно, что сенситизация капсаицин-чувствительных афферентных нейронов (КЧН) оказывает защитное действие на слизистую оболочку желудка [1–5], а десенситизация КЧН, напротив, усугубляет ульцерогенное действие на желудок различных факторов [6–9]. Влияние капсаицина опосредуется ваниллоидными рецепторами (TRPV1) [9–11]. Реализация гастропротективного эффекта КЧН происходит с участием кальцитонин-ген-связанного пептида, который выделяется из нервных окончаний при стимуляции КЧН [9, 12, 13]. Показано участие простагландинов и оксида азота в опосредовании гастропротективного эффекта капсаицина [9, 12–14].
Взаимодействие глюкокортикоидных гормонов и КЧН в гастропротекции до исследований нашей лаборатории не изучалось, что может быть связано с укоренившейся в литературе точкой зрения о глюкокортикоидных гормонах как ульцерогенных факторах [15, 16]. Исследования, проведенные в нашей лаборатории, доказали гастропротективную роль глюкокортикоидных гормонов, выделяющихся при стрессе [17–20], а также при действии других ульцерогенных факторов, в том числе и индометацина [21]. Кроме того, при определенных условиях мы продемонстрировали гастропротективное влияние и экзогенных глюкокортикоидов [21]. Изучение механизмов гастропротективного действия глюкокортикоидных гормонов выявило наличие общих мишеней с КЧН в гастропротекции [2, 17, 22, 23], что привело к предположению о возможном их взаимодействии. Это предположение подтвердилось в исследованиях лаборатории, продемонстрировавших компенсаторную гастропротективную роль эндогенных глюкокортикоидных гормонов в поддержании целостности слизистой оболочки желудка при десенситизации КЧН [8].
Вопрос об участии глюкокортикоидных гормонов в опосредовании гастропротективного действия сенситизации КЧН в литературе не освещен. В нашей предыдущей работе [24] было показано дозозависимое уменьшение площади индометацин-индуцированных эрозий желудка при введении капсаицина в малых дозах, а также параллельное повышение уровня кортикостерона и глюкозы в крови. Введение метирапона (ингибитора синтеза кортикостерона) предотвращало повышение уровня кортикостерона в ответ на введение капсаицина и устраняло гастропротективный эффект капсаицина, введенного в дозе 1 мг/кг [24]. Полученные результаты свидетельствуют об участии глюкокортикоидных гормонов в опосредовании гастропротективного эффекта капсаицина в указанных условиях. Настоящая работа является продолжением этих исследований.
Предположение о возможной гастропротективной роли кортикотропин-рилизинг-фактора (КРФ) у крыс с десенситизацией КЧН также основано на результатах наших предыдущих исследований, в которых был подтвержден гастропротективный эффект КРФ при действии различных ульцерогенных стимулов и впервые показано вовлечение глюкокортикоидных гормонов в реализацию этого эффекта [19, 25–27]. Вопрос о возможности гастропротективного действия КРФ в условиях десенситизации КЧН ранее не изучался.
Таким образом, задачей настоящей работы явилось: а) изучение вклада глюкокортикоидных гормонов в гастропротекцию, индуцированную сенситизацией КЧН, б) исследование гастропротективного эффекта КРФ в условиях десенситизации КЧН и возможного участия кортикостерона в этом эффекте.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на животных из биоколлекции “Коллекция лабораторных млекопитающих разной таксономической принадлежности” Института физиологии им. И.П. Павлова РАН. Эксперименты проводили на крысах-самцах линии Спрейг–Доули массой около 260–300 г. Количество крыс в экспериментальных группах варьировало от 8 до 12. За неделю до начала экспериментов крыс акклиматизировали к стандартным условиям лабораторного вивария: температура 20–22°С, световой режим 12 ч: 12 ч (включение света в 8 ч, выключение в 20 ч), свободный доступ к воде и пище. Сенситизацию КЧН индуцировали однократным введением капсаицина в дозах 1 и 10 мг/кг. Капсаицин (Sigma-Aldrich, Германия) для этой цели вводили подкожно в объеме 5 мл/кг за 1 ч до применения ульцерогенного стимула. Выбор этих доз капсаицина был сделан на основании полученных в предыдущей работе результатов о дозозависимом гастропротективном эффекте капсаицина [24]. Контрольным крысам вводили растворитель капсаицина – спирт : твин 80 : физиологический раствор в объемном соотношении 5 : 5 : 90 соответственно.
Для десенситизации КЧН капсаицин вводили крысам под эфирным наркозом в нейротоксической дозе 100 мг/кг в течение 3-х последовательных дней (20, 30, 50 мг/кг) подкожно, в объеме 5 мл/кг. В этом случае использовали растворитель капсаицина с другим соотношением компонентов – спирт : твин : физиологический раствор соответственно – 10 : 10 : 80. Десенситизацию КЧН производили за 2 нед. до ульцерогенного стимула.
Эффекты сенситизации КЧН на слизистую оболочку желудка крыс изучали в условиях действия двух ульцерогенных стимулов: иммобилизации в пеналах при температуре 10°С в течение 3-х ч или индометацина (подкожное введение в дозе 35 мг/кг в объеме 5 мл/кг за 4 ч до декапитации). Влияние десенситизации КЧН на изучаемые показатели исследовали только в индометациновой ульцерогенной модели. Ульцерогенные стимулы применялись после 24-часового голодания животных.
Для изучения роли кортикостерона в гастропротекции, вызванной сенситизацией КЧН, использовали ингибитор его синтеза метирапон (Sigma-Aldrich, Германия). Метирапон вводили внутрибрюшинно в дозе 30 мг/кг за 30 мин до введения капсаицина. Контрольным крысам вводили растворитель метирапона: 0.9%-ный раствор NaCl с каплей твина 80.
Схема экспериментов: голод 24 ч, введение метирапона (ингибитора синтеза кортикостерона), через 30 мин введение капсаицина в дозе 1 или 10 мг/кг (сенситизация КЧН), через 1 ч применение ульцерогенного стимула (иммобилизация при 10°С или введение индометацина), декапитация через 3 ч после начала иммобилизации или через 4 ч после введения индометацина. Эксперименты без метирапона начинались соответственно с введения капсаицина.
Возможность проявления гастропротективного эффекта КРФ у крыс с десенситизацией КЧН оценивали после внутрибрюшинного введения КРФ (Sigma-Aldrich, Германия) в дозе 2.5 мкг/кг за 30 мин до применения индометацина. Чтобы проверить, влияет ли десенситизация КЧН на чувствительность гипофизарно-адренокортикального звена гипоталамо-гипофизарно-адренокортикальной системы (ГГАКС) к КРФ, сравнивали влияние введения КРФ у контрольных и десенситизированных крыс на уровень кортикостерона в крови через 30 мин после его введения (без ульцерогенных факторов). В опытах с изучением роли кортикостерона в гастропротекции КРФ у крыс с десенситизацией КЧН также использовали метирапон, который вводили за 30 мин до введения КРФ.
Схема экспериментов: введение капсаицина в течение 3-х последовательных дней в дозах 20, 30 и 50 мг/кг соответственно; в течение 13 дней развитие десенситизации КЧН, голод 24 ч, 14-й день – введение метирапона, через 30 мин – введение КРФ, еще через 30 мин – введение индометацина в ульцерогенной дозе, через 4 ч – декапитация животных. Эксперименты без метирапона начинались с введения КРФ.
При декапитации брали пробы крови для определения уровней кортикостерона и глюкозы. Наш интерес к определению глюкозы связан с имеющимися данными о том, что поддержание глюкокортикоидными гормонами уровня глюкозы в крови может быть одним из механизмов их гастропротективного действия [17, 21]. Площадь эрозий оценивали на основании фотографий желудков с помощью модифицированной компьютерной программы Image J [28]. Содержание глюкозы определяли в капле крови крыс с помощью тест-полосок системы One Touch Ultra, США. Уровень кортикостерона в плазме крови определяли иммуноферментным методом с использованием набора реагентов “Кортикостерон крыса/мышь-ИФА” (ХЕМА). Все данные обрабатывали статистически. Непараметрический метод Манна–Уитни использовали для сравнения площадей эрозий слизистой оболочки желудка и уровней кортикостерона в крови, для анализа изменений уровня глюкозы использовали t-критерий Стьюдента.
Исследования проводились в соответствии с принципами Базельской декларации и рекомендациями Комиссии по содержанию и использованию животных Института физиологии им. И.П. Павлова РАН.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Стимуляция КЧН при введении капсаицина в дозах 1 и 10 мг/кг приводила к дозозависимому гастропротективному эффекту в обеих ульцерогенных моделях (рис. 1). Выбранные модели существенно различались между собой по изменениям исследуемых физиологических параметров у контрольных животных (с введением растворителя капсаицина) и этим были интересны для сопоставления. Например, у контрольных крыс иммобилизация при холоде вызывала значительно большее повреждение слизистой оболочки желудка по сравнению с таковым после введения индометацина в ульцерогенной дозе. При стрессе наблюдался очень высокий подъем кортикостерона в крови и достаточно высокий уровень глюкозы, несмотря на предварительное голодание. В индометациновой модели уровень глюкозы после голода был низким, уровень кортикостерона значительно ниже, чем в группе контрольных крыс после стресса (рис. 1).
Рис. 1.
Влияние сенситизации КЧН (введение капсаицина в дозе 1 и 10 мг/кг за 1 ч до ульцерогенного стимула) на площадь эрозий желудка, уровень кортикостерона и глюкозы в крови крыс через 3 ч после начала иммобилизации при 10°С (А) или через 4 ч после введения индометацина (B). Veh – растворитель капсаицина, Caps 1 или Caps 10 – капсаицин в дозе 1 или 10 мг/кг. p < 0.05: * от Veh, + от Caps 1. Число крыс в группе 10–12. Fig. 1. The effect of CSN sensitization (administration of capsaicin at the dose of 1 mg/kg or 10 mg kg 1 h before ulcerogenic stimuli) on the gastric erosions, blood corticosterone and glucose level in rats 3 h after the onset of immobilization (A) or 4 h after indomethacin administration (B). Veh – capsaicin vehicle, Caps 1 or Caps 10 – capsaicin at the dose of 1 or 10 mg/kg p < 0.05: * from Veh, + from Caps 1 mg/kg. n = 10–12.

Тем не менее, в обеих ульцерогенных моделях наблюдался защитный эффект сенситизации КЧН на слизистую оболочку желудка, наиболее ярко выраженный в стрессорной модели после введения капсаицина в дозе 10 мг/кг: в этом случае происходило снижение площади эрозий с очень высоких значений у контрольных крыс до очень низких при введении капсаицина (рис. 1А). Несмотря на высокий уровень глюкозы и кортикостерона в крови контрольных крыс через 3 ч после начала иммобилизации, предварительное введение капсаицина в дозе 10 мг/кг (но не в дозе 1 мг/кг) приводило к дальнейшему росту этих показателей (рис. 1А). В индометациновой ульцерогенной модели введение капсаицина в дозе 10 мг/кг также оказало более выраженный гастропротективный эффект по сравнению с таковым при дозе 1 мг/кг (рис. 1B). При введении капсаицина (1 и 10 мг/кг) в индометациновой модели наблюдалось дозозависимое увеличение уровня глюкозы и кортикостерона в крови. Следует обратить внимание на то, что в индометациновой модели увеличение уровней кортикостерона и глюкозы после введения капсаицина в дозе 1 мг/кг происходило на фоне невысоких уровней этих показателей у контрольных животных (через 4 ч после введения индометацина) (рис. 2B).
Рис. 2.
Эффект метирапона (введение в дозе 30 мг/кг за 30 мин до капсаицина) на площадь эрозий желудка, уровень кортикостерона и глюкозы в крови крыс с сенситизацией КЧН через 3 ч после начала иммобилизации при 10°С. Veh – растворитель метирапона (0.9%-ный раствор NaC)l, Met – метирапон, Vehicle – растворитель капсаицина. p < 0.05: * от Veh – Vehicle, # от Veh – Capsaicin 1 мг/кг, + – от соответствующей группы в Capsaicin 1 мг/кг. Число крыс в группе 9–10. Fig. 2. The effect of metyrapone administration at the dose of 30 mg/kg (i.p., 30 min before capsaicin injection) on the gastric erosions, blood corticosterone and glucose level in rats with sensitization of CSN 3 h after the onset of immobilization. Met – metyrapone, Veh – metyrapone vehicle – 0.9% NaCl, Vehicle – capsaicin vehicle. p < 0.05: * from Veh in Vehicle, # from Veh in Capsaicin 1 mg/kg, + from the appropriate group in Capsaicin 1 mg/kg. n = 9–10.

Введение метирапона, ингибитора синтеза кортикостерона, как в стрессорной, так и в индометациновой ульцерогенной модели приводило к устранению гастропротективного эффекта капсаицина, введенного в дозе 1 мг/кг, о чем свидетельствует повышение площади эрозий до уровня контрольных значений у крыс без введения капсаицина (рис. 2, 3). При этом в стрессорной ульцерогенной модели не наблюдалось достоверных изменений в уровне кортикостерона и глюкозы в крови, тестируемом через 3 ч после начала действия стрессорного стимула (рис. 2), в индометациновой модели введение метирапона приводило к снижению уровня кортикостерона через 4 ч после введения индометацина (рис. 3).
Рис. 3.
Эффект метирапона (введение в дозе 30 мг/кг за 30 мин до капсаицина) на площадь эрозий, уровень кортикостерона и глюкозы в крови крыс с сенситизацией КЧН через 4 ч после введения индометацина в ульцерогенной дозе. Veh – растворитель метирапона, Met – metyrapone, Vehicle – растворитель капсаицина. p < 0.05: * от Veh – Vehicle, # от Veh – Capsaicin 1мг/кг, + от cоответствующей группы в Capsaicin 1 мг/кг. Число крыс в группе 10–12. Fig. 3. The effect of metyrapone administration at the dose of 30 mg/kg (i.p., 30 min before capsaicin injection) on the gastric erosion, blood corticosterone and glucose level in the blood of rats with CSN sensitization 4 h after indomethacin administration (35 mg/kg). Met – metyrapone, Veh – metyrapone vehicle , Vehicle – capsaicin vehicle. p < 0.05: * from Veh in Vehicle, # from Veh in Capsaicin 1 mg/kg, + from the appropriate group in Capsaicin 1 mg/kg. n = 10–12.

В условиях введения капсаицина в дозе 10 мг/кг метирапон не вызывал достоверных изменений в гастропротективном эффекте сенситизации КЧН в обеих ульцерогенных моделях (рис. 2, 3). При этой дозе капсаицина не было найдено достоверных различий и в уровне кортикостерона в крови крыс после введения метирапона.
При десенситизации КЧН чувствительность гипофизарно-адренокортикального звена ГГАКС к экзогенному КРФ, определяемая по уровню кортикостерона в крови, не изменялась по сравнению с таковой у контрольных животных: уровень кортикостерона в крови через 30 мин после введения КРФ был одинаково повышен у обеих групп крыс по сравнению с контрольными значениями (рис. 4). Не наблюдалось каких-либо изменений в уровне глюкозы.
Рис. 4.
Влияние КРФ (2.5 мг/кг, внутрибрюшинно) на уровень кортикостерона и глюкозы через 30 мин после его введения крысам с десенситизацией КЧН (введение капсаицина в общей дозе 100 мг/кг за 14 дней до эксперимента). Veh – растворитель КРФ, Vehicle - растворитель капсаицина. p < 0.05: * – от Veh. Число крыс в группе 6. Fig. 4. The effect of CRF (2,5 mg/kg, i.p.) on blood corticosterone and glucose level 30 min after its administration in rats with CSN desensitization (the administration of capsaicin in the total dose of 100 mg/kg) 14 day before experiment. p < 0.05 * from Veh (0.9% NaCl). n = 6.

Десенситизация КЧН, как и следовало ожидать, приводила к увеличению чувствительности слизистой оболочки желудка к ульцерогенному действию индометацина. Внутрибрюшинное введение КРФ за 30 мин до введения индометацина оказывало гастропротективный эффект как у контрольных крыс, так и у крыс с десенситизацией КЧН, при этом снижение площади эрозий у десенситизированных крыс в процентном отношении оказалось даже более выраженным по сравнению с контрольными животными (рис. 5). Так, у контрольных крыс площадь эрозий под влиянием КРФ снизилась на 50%, у десенситизированных крыс – на 70%.
Рис. 5.
Влияние метирапона (введение в дозе 30 мг/кг за 30 мин до КРФ) на гастропротективный эффект КРФ, уровень кортикостерона и глюкозы у крыс с десенситизацией КЧН и у контрольных крыс (введение растворителя капсаицина) через 4 ч после введения индометацина. Veh Veh – растворители метирапона и КРФ, Veh CRF – растворитель метирапона + КРФ, Мet CRF – метирапон + КРФ, Vehicle – растворитель капсаицина. p < 0.05: * от Veh Veh - Vehicle, # от Veh CRF – Vehicle и Capsaicin, + – от Veh Veh – Capsaicin. Число крыс в группе 10–12. Fig. 5. The effect of metyrapone administration at the dose of 30 mg/kg (30 min before CRF administration) on the gastroprotective effect of CRF, blood corticosterone and glucose level in rats with desensitization of CSN and in control rats (the administration capsaicin vehicle) 4 h after indomethacin. Veh Veh – metyrapone and CRF vehicle, Veh CRF – metyrapone vehicle + CRF, Met CRF – metyrapone + CRF. p < 0.05: * from Veh Veh in Vehicle, # from Veh CRF in Vehicle and Capsaicin groups, + from Veh Veh in Capsaicin. n = 10–12.
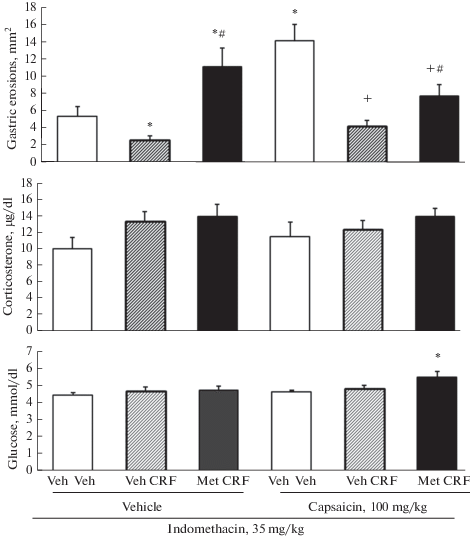
Для выяснения вопроса о роли кортикостерона в наблюдаемом гастропротективном эффекте КРФ также был использован метирапон, который вводили до введения КРФ. Введение метирапона контрольным крысам не просто устраняло защитный эффект КРФ, а приводило к увеличению площади эрозий по сравнению с таковой у контрольных крыс. У крыс с десенситизацией КЧН введение метирапона приводило к повышению площади эрозий по сравнению с таковой у крыс с введением КРФ без метирапона, однако, наблюдаемая площадь эрозий оставалась ниже значений контрольных крыс с десенситизацией КЧН (без КРФ), т.е. защитный эффект КРФ все же частично сохранялся (рис. 5). Уровни кортикостерона и глюкозы в крови практически не изменялись после введения метирапона у крыс с десенситизацией КЧН по сравнению с таковыми у контрольных крыс (без метирапона) за исключением небольшого, но достоверного подъема глюкозы после введения метирапона крысам с десенситизацией КЧН (рис. 5). Отсутствие изменений может быть связано с тем, что тестирование кортикостерона и глюкозы происходило отставлено по времени после введения метирапона, действие которого является кратковременным.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Введение капсаицина в дозах 1 и 10 мг/кг оказывало дозозависимый гастропротективный эффект в обеих ульцерогенных моделях (иммобилизационный стресс при холоде или введение индометацина), что, исходя из данных литературы [4, 5, 24], было ожидаемым. Особенно впечатляющим гастропротективное действие капсаицина было при его введении в дозе 10 мг/кг в стрессорной ульцерогенной модели.
Участие кортикостерона в гастропротективном эффекте сенситизации КЧН, исследованное путем кратковременного ингибирования его синтеза метирапоном, проявилось при введении капсаицина в дозе 1 мг/кг в обеих ульцерогенных моделях. Этот факт, обнаруженный нами ранее в индометациновой ульцерогенной модели [24], подтвердился и в настоящей работе. Мы посчитали необходимым повторить эти опыты для более корректного сравнения эффекта двух доз капсаицина в двух ульцерогенных моделях. Как показали результаты настоящей работы, при использовании стрессорной модели также было обнаружено участие кортикостерона в защитном влиянии сенситизации КЧН на желудок, если она была вызвана введением капсаицина в дозе 1мг/кг. Вместе с тем, в обеих ульцерогенных моделях введение метирапона не повлияло на гастропротективный эффект капсаицина при его введении в дозе 10 мг/кг. В чем причина таких различий, пока не ясно. Можно предположить, что при применении более высокой дозы капсаицина подключаются другие механизмы его гастропротективного действия, не связанные с действием кортикостерона. Кроме того, представляется вероятным, что влияние метирапона, кратковременного ингибитора синтеза кортикостерона [19, 29], оказывается недостаточным для того, чтобы повлиять на высокий уровень кортикостерона, вызванный применением ульцерогенных факторов, да еще усиленный действием капсаицина в дозе 10 мг/кг. Тот факт, что не всегда проявляется ожидаемое изменение уровня кортикостерона при введении капсаицина или метирапона, можно еще объяснить кратковременностью этих изменений и длительностью эксперимента, связанную с применением ульцерогенных факторов. Это можно продемонстрировать на примере введения КРФ: к концу эксперимента через 4 ч после введения индометацина уровень кортикостерона в крови крыс с введением КРФ не отличался от контрольных значений. Однако через 30 мин после введения КРФ, как было показано в отдельном опыте, наблюдалось достоверное повышение уровня кортикостерона в крови.
В работе получены данные о стимулирующем влиянии капсаицина на активность ГГАКС. Об этом свидетельствует дальнейшее увеличение стрессорного уровня кортикостерона после введения капсаицина в дозе 1 мг/кг в индометациновой модели и в обеих ульцерогенных моделях – после введения капсаицина в дозе 10 мг/кг. Имеющиеся немногочисленные данные литературы подтверждают этот вывод [30, 31]. Механизм этой стимуляции не ясен и практически не изучался. В одной из упомянутых выше работ показано, что при гипофизэктомии введение кальцитонин-ген-связанного пептида, одного из главных пептидов, опосредующих гастропротективное действие КЧН, активирует выброс кортизола в кровь у телят [30]. Однако другими авторами было обнаружено снижение высокого уровня кортикостерона в крови, вызванного введением липополисахарида, после введения капсаицина в дозе 2 мг/кг [32]. Возможно, изменение стрессорного уровня кортикостерона под влиянием низких доз капсаицина зависит от вида и силы стрессорного фактора. Если работ о влиянии активации КЧН на ГГАКС недостаточно, чтобы сделать окончательный вывод о характере этого влияния, то исследования об участии глюкокортикоидов в гастропротективном эффекте сенситизации КЧН вообще нам не известны, что не позволяет сравнить полученные нами результаты с данными литературы.
Десенситизация КЧН – один из подходов для изучения роли этих нейронов в гастропротекции. При десенситизации КЧН происходит усугубление язвообразования в желудке при действии различных ульцерогенных факторов, в том числе и индометацина [6, 8, 9, 24]. Известно, что КРФ оказывает гастропротективный эффект у крыс при действии ульцерогенных стимулов [19, 25, 26]. В настоящей работе выясняли вопрос о том, сохранится ли защитный эффект КРФ на желудок при десенситизации КЧН. Результаты работы показали, что гастропротективный эффект КРФ у крыс с десенситизацией КЧН не только сохранился, но оказался даже более выраженным по сравнению с таковым у контрольных животных. В этой связи следует обратить внимание на удивительную устойчивость гастропротективного действия КРФ, которое было обнаружено нами в различных ульцерогенных моделях у интактных крыс [19, 25, 26], у крыс со стрептозотоцин-индуцированным диабетом [27] и, наконец, у крыс с десенситизацией КЧН. Этот факт устойчивости гастропротективного эффекта КРФ сам по себе интересен и требует дальнейшего изучения.
Уровни кортикостерона и глюкозы у крыс с введением КРФ не изменились по сравнению с контролем в исследованной временной точке (через 4.5 ч после введения КРФ). В предварительных опытах было показано, что через 30 мин после введения КРФ уровень кортикостерона в крови в одинаковой степени повышается у контрольных крыс и у крыс с десенситизацией КЧН. Таким образом, десенситизация КЧН не влияла на реактивность нижних звеньев ГГАКС к КРФ, а также на уровень кортикостерона у контрольных крыс (без КРФ). Следует сказать, что данные литературы о влиянии десенситизации КЧН на активность гормонов ГГАКС очень немногочисленны и противоречивы [6, 33, 34]. Полученные нами результаты совпадают с некоторыми данными литературы [33, 34], в которых показано, что у крыс с десенситизацией КЧН и у контрольных животных не отличался ответ на внутривенное введение АКТГ или КРФ по уровню кортикостерона или АКТГ соответственно. В одной из работ у крыс с десенситизацией КЧН обнаружено снижение ответа ГГАКС на введение интерлейкина-1-бета или простагландина Е2 по уровню АКТГ [34]. Однако имеются данные и о стимулирующем эффекте десенситизации КЧН на ГГАКС [6].
Защитный эффект КРФ на желудок у контрольных крыс (с введением растворителя капсаицина) полностью устранялся введением метирапона. Эти результаты указывают на то, что гастропротективный эффект КРФ у контрольных крыс опосредуется кортикостероном и хорошо подтверждают полученные нами ранее данные [19, 25, 26]. У крыс с десенситизацией КЧН частично сохранялся гастропротективный эффект КРФ при введении метирапона, однако, этот эффект был значительно менее выраженным по сравнению с эффектом КРФ без метирапона. Представленные данные полностью совпадают с полученными ранее результатами исследования гастропротективного влияния КРФ при введении метирапона интактным крысам в стрессорной ульцерогенной модели [19]. Как и в указанной выше работе, мы делаем похожий вывод о том, что гастропротективный эффект КРФ у крыс с десенситизацией КЧН только частично обусловлен повышением уровня кортикостерона в крови. Возможно, изучение роли рецепторов КРФ в гастропротекции поможет лучше понять механизм защитного эффекта КРФ на желудок при десенситизации КЧН.
Таким образом, капсаицин, введенный в дозах 1 и 10 мг/кг, индуцировал гастропротективный эффект в обеих ульцерогенных моделях. Введение метирапона устраняло гастропротективный эффект сенситизации КЧН, вызванной введением капсаицина в дозе 1 мг/кг и не повлияло на гастропротективный эффект капсаицина при его введении в дозе 10 мг/кг. Введение КРФ крысам с десенситизацией КЧН оказывало гастропротективный эффект, который частично опосредовался кортикостероном.
Список литературы
Szolcsanyi J., Bartho L. Capsaicin-sensitive afferents and their role in gastroprotection: an update. J. Physiol. (Paris). 95(1–6): 181–188. 2001.
Holzer P. Efferent-like roles of afferent neurons in the gut: blood flow regulation and tissue protection. Auton. Neurosci. 125(1–2): 70–75. 2006.
Harada N., Okajima K. Inhibition of neutrophil activation by lafutidine, an H2-receptor antagonist, through enhancement of sensory neuron activation contributes to the reduction of stress-induced gastric mucosal injury in rats. Dig. Dis. Sci. 52(2): 469–477. 2007.
Kwiecien S., Magierowska K., Magierowski M., Surmiak M., Hubalewska-Mazgaj M., Pajdo R., Sliwowski Z., Chmura A., Wojcik D., Brzozowski T. Role of sensory afferent nerve.s, lipid peroxidation and antioxidative enzymes in the carbon monoxide-induced gastroprotection against stress ulcerogenesis. J. Physiol. Pharmacol. 67(5): 717–729. 2016.
Mózsik G. Capsaicin as new orally applicable gastroprotective and therapeutic drug alone or in combination with nonsteroidal anti-inflammatory drugs in healthy human subjects and in patients. Prog. Drug Res. 68: 209–258. 2014.
Бобрышев П.Ю., Подвигина Т.Т., Багаева Т.Р., Филаретова Л.П. Компенсаторное гастропротективное действие глюкокортикоидных гормонов в условиях выключения функции капсаицин-чувствительных нейронов у крыс. Рос. физиол. журн. им. И.М. Сеченова. 92(8): 1006–1015. 2006. [Bobryshev P.YU., Podvigina T.T., Bagaeva T.R., Filaretova L.P. Compensatory gastroprotective action of glucocorticoid hormones in the rats with ablation of capsaicin-sensitive neurons. Russ. J. Physiol. 92(8): 1006–1015. 2006. (In Russ)].
Mózsik G., Vincze A., Szolcsányi J. Four response stages of capsaicin-sensitive primary afferent neurons to capsaicin and its analog: gastric acid secretion, gastric mucosal damage and protection. J. Gastroenterol. Hepatol. 16(10): 1093–1097. 2001.
Filaretova L., Bobryshev P., Bagaeva T., Podvigina T., Takeuchi K. Compensatory gastroprotective role of glucocorticoid hormones during inhibition of prostaglandin and nitric oxide production and desensitization of capsaicin-sensitive neurons. Inflammopharmacology. 15(4): 146–153. 2007.
Филаретова Л.П., Ярушкина Н.И. Капсаицин-чувствительные нейроны: роль в гастропротекции и регуляции болевой чувствительности. Успехи физиол. наук. 50(1): 3–16. 2019. [Filaretova L.P., Yarushkina N.I. Capsaicin sensitive neurons: role in gastroprotection and regulation of pain sensitivity. Usp. Fisiol. Nauk. 50(1): 3–16. 2019. (In Russ)].
Holzer P. Transient receptor potential (TRP) channels as drug targets for diseases of the digestive system. Pharmacol. Ther. 131(1): 142–170. 2011.
Kunde D.A., Yingchoncharoen J., Jurković S., Geraghty D.P. TRPV1 mediates capsaicin-stimulated metabolic activity but not cell death or inhibition of interleukin-1β release in human THP-1 monocytes. Toxicol. Appl. Pharmacol. 360: 9–17. 2018. https://doi.org/10.1016/j.taap.2018
Konturek P.C., Brzozowski T., Walter B., Burnat G., Hess T., Hahn E.G., Konturek S.J. Ghrelin-induced Gastroprotection Against Ischemia-Reperfusion Injury Involves an Activation of Sensory Afferent Nerves and Hyperemia Mediated by Nitric Oxide. Eur. J. Pharmacol. 536(1–2): 171–181. 2006.
Sun F., Xiong S., Zhu Z. Dietary capsaicin protects cardio metabolic organs from dysfunction. Nutrients. 8 (5): E174. 2016. https://doi.org/10.3390/nu8050174
Takeuchi K., Kato S., Takeeda M., Ogawa Y., Nakashima M., Matsumoto M. Facilitation by endogenous prostaglandins of capsaicin-induced protection in rodent through EP2 and IP receptors. J. Pharmacol. Exp. Ther. 304(3): 1055–1062. 2003.
Garabadu D., Shah A., Ahmad A., Joshi V.B., Saxena B., Palit G., Krishnamurthy S. Eugenol as an anti-stress agent: modulation of hypothalamic-pituitary-adrenal axis and brain monoaminergic systems in a rat model of stress. Stress. 14(2): 145–155. 2011.
Martínek J., Hlavova K., Zavada F., Seifert B., Rejchrt S., Urban O., Zavoral M. “A surviving myth” – corticosteroids are still considered ulcerogenic by a majority of physicians. Scand. J. Gastroenterol. 45(10): 1156–1161. 2010.
Filaretova L.P., Filaretov A.A., Makara G.B. Corticosterone increase inhibits stress-induced gastric erosions in rats. Am. J. Physiol. 274(6): G1024–G1030. 1998.
Филаретова Л.П. Вклад глюкокортикоидных гормонов в гастропротекцию. Успехи физиол. наук. 45(1): 43–55. 2014. [Filaretova L.P. Contribution of glucocorticoid hormones to gastroprotection. Usp. Fisiol. Nauk. 45(1): 43–55. 2014. (In Russ)].
Filaretova L., Bagaeva T., Morozova O. Stress and stomach: corticotropin-releasing factor may protect the gastric mucosa through involvement of glucocorticoids. Cell. Mol. Neurobiol. 32(5): 829–836. 2012.
Filaretova L., Podvigina T., Yaryshkina N. Physiological and pharmacological effects of glucocorticoids on the gastrointestinal tract. Curr. Pharm. Des. V. 26. 2020. doi: . 2020https://doi.org/10.2174/1381612826666200521142746
Filaretova L., Podvigina T., Bagaeva T., Morozova O. From gastroprotective to ulcerogenic effects of glucocorticoids: role of long-term glucocorticoid action. Curr. Pharm. Des. 20(7): 1045–1050. 2014.
Podvigina T.T., Bobryshev P.Y., Bagaeva T.R., Mal’tsev N.A., Levkovich Y.I., Filaretova L.P. The effects of desensitization of capsaicin-sensitive afferent neurons on the microcirculation in the stomach in rats depend on the blood glucocorticoid hormone level. Neurosci. Behav. Physiol. 39(6): 559–564. 2009.
Morgan A.E., Lang C.H. Involvement of capsaicin-sensitive nerves in regulating the hormone and glucose metabolic response to endotoxin. Am. J. Physiol. 273(2, Pt 1): E328–E335. 1997.
Подвигина Т.Т., Морозова О.Ю., Солнушкин С.Д., Чихман В.Н., Филаретова Л.П. Влияние сенситизации и десенситизации капсаицин-чувствительных нейронов на образование эрозий в слизистой оболочке желудка, индуцированных индометацином, у крыс: роль глюкокортикоидных гормонов. Рос. физиол. журн. им. И.М. Сеченова.105(2): 225–237. 2019. [Podvigina T.T., Morozova O.Yu., Solnushkin S.D., Chykhman V.N., Filaretova L.P. Effect of sensitization and desensitization of capsaicin-sensitive neurons on the formation of gastric erosions induced by indomethacin in rats: the role of glucocorticoids. Russ. J. Physiol. 105(2): 225–237. 2019. (In Russ)].
Filaretova L., Bagaeva T. The realization of the brain-gut interactions with corticotropin releasing factor and glucocorticoids. Curr. Neuropharmacol. 14(8): 876–881. 2016.
Филаретова Л.П. Вклад кортикотропин-рилизинг фактора в гастропротекцию. Нейрохимия. 35(2): 122–125. 2018. [Filaretova L.P. Contribution of corticotropin releasing factor on gastroprotection. Neurochemistry. 35(2): 122–125. 2018. (In Russ)].
Подвигина Т.Т., Морозова О.Ю., Багаева Т.Р., Филаретова Л.П. Гастропротективный эффект кортикотропин-рилизинг фактора у крыс со стрептозотоцин-индуцированным диабетом. Рос. физиол. журн. им. И.М. Сеченова. 102(11): 1352–1362. 2016. [Podvigina T.T., Bagaeva T.P., Filaretova L.P. Gastroprotective effect of corticotropin-releasing factor in streptozotocin-induced diabetic rats. Russ. J. Physiol. 102(11): 1352–1362. 2016. (In Russ)].
Солнушкин С.Д., Чихман В.Н. Компьютерная обработка биологических изображений. Биомед. радиоэлектроника. 2: 35–40. 2018. [Solnushkin S.D., Chikhman V.N. Experience of biological images processing. Biomed. radioengineering. 2: 35–40. 2018. (In Russ.)]
Cordero M.I., Kruyt N.D., Merino J.J., Sandi C. Glucocorticoid involvement in memory formation in a rat model for traumatic memory. Stress. 5(1): 73–79. 2002.
Bloom S.R., Edwards A.V., Jones C.T. Adrenal responses to calcitonin gene-related peptide in conscious hypophysectomized calves. J. Physiol. 409: 29–41. 1989.
Choi Y.J., Kim J.Y., Yoo S.B., Lee J.H., Jahng J.W. Repeated oral administration of capsaicin increases anxiety-like behaviors with prolonged stress-response in rats. J. Biosci. 38(3): 561–571. 2013.
Ferreira L.G., Prevatto J.P., Freitas H.R., Reis R.A.M., Silva P.M., Martins M.A., Faria R.X., Carvalho V.F. Capsaicin inhibits lipopolysaccharide-induced adrenal steroidogenesis by raising intracellular calcium levels. Endocrine. 64(1): 169–175. 2019.
Donnerer J., Lembeck F. Different control of the adrenocorticotropin-corticosterone response and of prolactin secretion during cold stress, anesthesia, surgery, and nicotine injection in the rat: involvement of capsaicin-sensitive sensory neurons. Endocrinology. 126(2): 921–926. 1990.
Watanabe T., Morimoto A., Tan N., Makisumi T., Shimada S.G., Nakamori T., Murakami N. ACTH response induced in capsaicin-desensitized rats by intravenous injection of interleukin-1 or prostaglandin. Eur. J. Physiol. 475(1): 139–145. 1994.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


