Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 3, стр. 267-282
Сочетание стрессовых воздействий в критические периоды развития повышает устойчивость к стрессу воспалительной боли у взрослых крыс
И. П. Буткевич 1, 2, *, В. А. Михайленко 1, Е. А. Вершинина 1
1 Институт физиологии им. И.П. Павлова, РАН
Cанкт-Петербург, Россия
2 Педиатрический медицинский университет
Санкт-Петербург, Россия
* E-mail: irinabutkevich@yandex.ru
Поступила в редакцию 26.11.2019
После доработки 24.12.2019
Принята к публикации 25.12.2019
Аннотация
Исследовали долговременное влияние сочетания стресса в пренатальный и препубертатный периоды развития на показатели тонической воспалительной боли в формалиновом тесте и уровня выраженности депрессивноподобного поведения, а также на стрессовую реактивность гормонального ответа у взрослых крыс. Кроме того, у крыс обоего пола было оценено влияние ингибитора обратного захвата серотонина (5-HT) флуоксетина и агониста 5-HT1A-рецептора буспирона, хронически вводимых их стрессированным матерям в период беременности, на исследованные типы адаптивного поведения, нарушенного пренатальным стрессом. Обнаружено, что у крыс обоего пола пренатальный стресс усилил болевой ответ, организованный на спинальном и супраспинальном уровнях центральной нервной системы, флуоксетин и буспирон нормализовали их. Стресс в препубертатный период развития нивелировал у взрослых крыс влияние пренатального стресса на воспалительный болевой ответ, интегрированный на супраспинальном уровне; в этих условиях флуоксетин и буспирон не действовали в отличие от их антиноцицептивного влияния на болевой ответ, интегрированный на спинальном уровне. Стресс в препубертатном возрасте нивелировал половые различия, обнаруженные при депрессивно-подобном поведении у пренатально не стрессированных и пренатально стрессированных с введением физиологического раствора крыс. У контрольных взрослых самок и взрослых самок с пренатальными воздействиями стресс в препубертатном возрасте повысил уровень кортикостерона в плазме крови после принудительное плавания по сравнению с базальным уровнем гормона, но достоверных различий в уровне стрессовой реактивности гормонального ответа после принудительного плавания обнаружено не было. Таким образом, идентифицированы условия стрессовых воздействий, которые повышают устойчивость к стрессу у взрослых крыс. Стресс в критические периоды развития формирует фенотип с повышенной стрессоустойчивостью к воспалительному болевому воздействию, что обнаружено в ответе, организованном на супраспинальном уровне у взрослых особей.
Стрессовые события в ранние периоды индивидуального развития нарушают функциональную активность гипоталамо-гипофизарно-надпочечниковой системы (ГГНС), морфофункциональное развитие головного мозга и, как следствие, изменяют формирование поведения [1, 2]. Подтверждением этому являются многочисленные данные, полученные как на человеке [3, 4], так и в экспериментах на животных [1, 2] при исследовании краткосрочных и долговременных влияний стресса в перинатальный период развития на психоэмоциональное поведение. Стресс в препубертатный период развития, характерной особенностью которого является высокая пластичность, обуславливающая повышенную чувствительность к внешним и внутренним раздражителям [5], рассматривают, наряду со стрессом в перинатальном возрасте, как фактор риска для развития тревожных и депрессивных состояний и отклонений в функциональной активности ГГНС [6–8]. Уделяется внимание половым различиям у взрослых животных во влиянии стресса в препубертатном возрасте [9] на поведение. При исследовании на животных в качестве стресса наиболее часто применяют пренатальный стресс (стресс матери во время гестации), стресс изоляции новорожденных от матери, хронический умеренный стресс и неблагоприятные условия жизни [7, 10, 11]. Влияние стресса в раннем возрасте изучают преимущественно на стрессоустойчивость к эмоциональному и социальному типам стресса [11]. Доминирующее число работ было посвящено негативным последствиям стресса в критические периоды развития, к которым относятся и пренатальный и препубертатный периоды [8, 9, 12]. Одной из самых важных мишеней пренатального стресса является 5-HT1A-рецептор [13]. Ранее нами было показано, что повторные инъекции ингибитора обратного захвата серотонина (5-HT) флуоксетина и агониста 5-HT1A-рецептора буспирона беременным самкам крыс, стрессированным в период беременности, нормализовали адаптивное поведение, нарушенное пренатальным стрессом, у молодого потомства [14]. Оба препарата действуют через 5-HT1A-рецептор, вовлеченный в психоэмоциональное поведение и ноцицепцию и влияют на уровень 5-HT в головном мозге [15]. Серотонин в пренатальный период онтогенеза выполняет роль развивающего сигнала и ответственен, при тесном взаимоотношении с ГГНС, за высокую нейропластичность, которая позволяет клеткам мозга в ответ на изменения окружающей среды корректировать развитие центральной нервной системы и адаптироваться к ним [16]. Перечисленные факты привлекли наше внимание к серотонинергической системе при исследовании влияния сочетания стрессовых воздействий в пре- и постнатальном развитии на адаптивное поведение крыс в разные возрастные периоды.
В последние годы все чаще появляются данные о возможном благоприятном влиянии повторного стресса во время критических периодов развития на чувствительность к стрессу во взрослом возрасте [17, 18], притом большое внимание обращается на половые различия. Неоднородность результатов, полученных в разных экспериментальных условиях, включая тип и последовательность стрессовых воздействий, их интенсивность и длительность, а также пол животных и возраст в период воздействия стрессом и во время оценки его последствий, сдерживает исследование механизмов этого феномена. В настоящее время актуальным является идентификация разнообразных стрессовых условий, сочетание которых в критические периоды развития повышает адаптацию к будущим стрессам, а также проведение исследований на особях обоего пола, так как имеющиеся данные получены преимущественно на самцах [11]. На основании данных литературы, включающих и различную индивидуальную особенность к развитию стрессоустойчивости к одинаковым стрессовым условиям, была выдвинута гипотеза об уязвимости и устойчивости индивидуумов, подвергнутых стрессовым событиям в критические периоды жизни, к стрессу в последующем онтогенезе [17, 19, 20]. Основное внимание в этой гипотезе уделяется условиям, в которых осуществляется стресс на ранних этапах жизни и стресс во взрослом состоянии. При совпадении этих условий стресса можно ожидать положительный результат – устойчивость к стрессу, в противном случае организм оказывается уязвимым к чрезмерным нагрузкам, что приводит к развитию тревожно-депрессивных проявлений и различных заболеваний.
Ранее нами было обнаружено, что стресс в перинатальном периоде повышает способность противостоять стрессу у самцов крыс в препубертатном возрасте [21]. В упомянутой работе мы впервые использовали сочетание стресса самки крысы в период беременности, являющегося фактором риска для развития депрессии у потомства, и стресса воспалительной боли у новорожденных, встречающегося в неонатальной клинике. Оказалось, что у взрослых самцов, испытавших подобные события в перинатальном возрасте, интенсивность тонического болевого ответа была достоверно ниже, чем у контрольных самцов. Поведенческие исследования на животных определяют направление для изучения механизмов этого парадоксального явления на молекулярном уровне [22].
Цель настоящей работы состояла в исследовании влияния сочетания пренатального стресса и стресса в препубертатном возрасте на интенсивность тонического воспалительного болевого ответа, степень выраженности депрессивноподобного поведения, а также на стрессовую реактивность гормонального ответа у пренатально стрессированных взрослых крыс. Ранее мы показали, что стресс в перинатальном возрасте может изменить активность применяемых антидепрессантов [21], поэтому в настоящей работе исследовали еще и влияние ингибитора обратного захвата серотонина (5-HT) флуоксетина и агониста 5-HT1A-рецептора буспирона, которые вводились стрессированным матерям в период беременности, на изучаемые типы адаптивного поведения, нарушенного пренатальным стрессом, у потомства обоего пола.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования было потомство крыс линии Вистар, полученных из биоколлекции Института физиологии им. И.П. Павлова РАН (Санкт-Петербург) и доставленных в виварий лаборатории. Все процедуры работы с животными проводились в соответствии с принципами Базельской декларации и рекомендациями руководства ARRIVE [23]. Протоколы опытов утверждены комиссией по гуманному обращению с животными Института физиологии им. И.П. Павлова РАН. Все животные содержались в стандартных условиях (свободный доступ к воде и пище, 12-часовой день, свет с 8.00). Самки до беременности (n = 50) и самцы (n = 30) были помещены в стандартные клетки (в каждой клетке 5 самок и 3 самца). Беременность определяли по мазку из влагалища, наличие сперматозоидов в мазке обозначали как нулевой день беременности. С 9-х суток беременности до родов самки получали ежедневную внутрибрюшинную инъекцию флуоксетина (10 мг/кг, Sigma), буспирона (3.5 мг/кг, Sigma) или физиологического раствора, контрольные самки, подвергнутые только взятию в руки, оставались без воздействий. Ранее нами было показано, что пренатальный стресс вызывал достоверно более сильное увеличение воспалительного болевого ответа в формалиновом тесте (р < 0.05) и депрессивно-подобного поведения в тесте принудительного плавания (р < 0.001) у взрослых крыс по сравнению с болевым ответом и ответом депрессивно-подобного поведения у пренатально не стрессированных взрослых крыс, рожденных самками с введением физиологического раствора в период беременности [24], поэтому в качестве контроля в настоящей работе использовали пренатально не стрессированных крыс без введения физиологического раствора. Дозы препаратов были апробированы нами ранее [24] и соответствовали данным, имеющимся в литературе [25]. С 15-х суток беременности до родов самок с введением препаратов или физиологического раствора утром и вечером в течение 60 мин при ярком свете подвергали иммобилизационному стрессу, помещая их в цилиндры, резко ограничивающие движение крыс. Стресс беременной самки используют в качестве модели пренатального стресса для потомства: стресс в последнюю неделю беременности самки, вызывая у плода чрезмерное повышение уровня кортикостерона, приводит в дальнейшем к развитию депрессивноподобного поведения у потомства [7]. Введение стрессированным беременным крысам антидепрессанта флуоксетина или анксиолитика буспирона нивелирует негативное влияние стресса [21]. Рождение потомства проверяли каждые четыре часа (с 8 до 20 ч). На следующие сутки после рождения в каждом помете оставляли по 4 разнополых особи. Крысята находились в гнезде с матерью до 30-дневного возраста. Затем разнополых животных рассаживали в разные клетки. В исследование были включены следующие группы крыс: пренатально не стрессированные (контрольные), пренатально стрессированные с введением физиологического раствора, пренатально стрессированные с введением флуоксетина, пренатально стрессированные с введением буспирона.
На крысах обоего пола с перечисленными выше пренатальными воздействиями и на контрольных животных было проведено две серии экспериментов. В серии I (самки n = 38, самцы n = 38) при достижении крысами 90-дневного возраста у них оценивали интенсивность воспалительного болевого ответа в формалиновом тесте (подкожная инъекция 2.5%-ного раствора формалина, 50 мкл в подошву левой задней конечности) и через трое суток – уровень выраженности депрессивноподобного поведения в тесте принудительного плавания. В серии II (самки n = 44, самцы n = 40), животные в возрасте 25 дней были подвергнуты стрессу воспалительной боли (подкожная инъекция 10 мкл 2.5%-ного раствора формалина в подошву левой задней конечности) и через три дня – стрессу принудительного плавания. При достижении 90-дневного возраста у этих животных исследовали адаптивное поведение, как и у крыс серии I.
В формалиновом тесте, который широко используется для оценки антиноцицептивного действия препаратов на интенсивность воспалительной боли, регистрировали в течение 60 мин число сгибаний + встряхиваний (реакция, интегрированная на спинальном уровне) и продолжительность реакции вылизывания (супраспинальный уровень) в ответ на подкожную инъекцию формалина в подошву левой задней конечности в тоническую фазу двухфазного поведенческого ответа [26]. В тесте принудительного плавания каждую крысу на 5 мин помещали в цилиндр с водой (диаметр 25 см, высота 60 см, температура воды 24–25°С) и регистрировали время, проведенное крысой в неподвижном состоянии (время иммобильности – показатель депрессивноподобного поведения). Через 30 мин после завершения теста принудительного плавания у самок крыс серии II декапитацией собирали кровь. Самки в день эксперимента находились в стадии диэструса. Для определения базального уровня кортикостерона были использованы самки (n = 43), подвергнутые всем воздействиям, как и самки серии II, кровь у них собирали в 9 ч утра. Кровь центрифугировали, плазму крови хранили при температуре –20°С. Содержание кортикостерона в плазме крови определяли с помощью иммуноферментного анализа с использованием реактивов фирмы (Xema-Medica Co Cat No: K210R).
Анализ данных проводился с использованием трехфакторной модели дисперсионного анализа ANOVA. Факторы: серия (I, II), пол (самцы, самки) и воздействие (пренатально не стрессированные/физиологический раствор + пренатальный стресс/флуоксетин+пренатальный стресс/буспирон + пренатальный стресс) с последующими множественными апостериорными сравнениями по Бонферрони. В качестве зависимых переменных выступали: сгибание + встряхивание, продолжительность вылизывания, время иммобильности. Сила связи фактора и зависимой переменной измерялась при помощи величины η2 (Partial Eta Squared). Для кортикостерона применяли дисперсионный двухфакторный анализ ANOVA. Факторы: серия (базальный, серия II), и воздействие (пренатально не стрессированные/физиологический раствор + пренатальный стресс/флуоксетин + пренатальный стресс/буспирон + пренатальный стресс) с последующими сравнениями по Бонферрони. Данные представлены в виде среднего ± стандартная ошибка. Принятый уровень значимости составлял 5%. При анализе данных использовался программный комплекс SPSS Inc.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В формалиновом тесте для сгибания + встряхивания во второй тонической фазе ответа получено значимое влияние серии F(1,144) = 42.238, ***p < 0.001, η2 = 0.222 и влияние воздействия F(3,144) = 18.384, ***p < 0.001, η2 = 0.277. Для продолжительности вылизывания во второй тонической фазе ответа получено значимое влияние серии F(1,444) = 148.796, ***p < 0.001, η2 = 0.508, воздействия F(3,144) = 8.227, p < 0.001, η2 = 0.146, пола F(1,14) = 5.481, *p = 0.021, η2 = 0.037, также значимо взаимодействие серии и воздействия F(3,144) = 3.317, *p = 0.022, η2 = 0.065.
Тест Бонферрони обнаружил, что в серии I пренатальный стресс увеличил болевой ответ в показателях как спинального, так и супраспинального уровней у взрослых самцов (р < 0.01 в обоих случаях) (рис. 1A, C), у самок – на супраспинальном уровне (р = 0.004) (рис. 1D) по сравнению с идентичными показателями болевого воспалительного ответа у пренатально не стрессированных взрослых крыс. Флуоксетин уменьшил показатели болевого ответа у самцов на спинальном (р = 0.042) и супраспинальном (р = 0.021) уровнях (рис. 1А, C), а у самок – только на супраспинальном уровне (р = 0.034) (рис. 1D) по сравнению с показателями ответа у пренатально стрессированных крыс. Буспирон уменьшил показатели болевого ответа у самцов на спинальном (р = 0.043) и супраспинальном уровнях (р = 0.030) (рис. 1C), а у самок – на спинальном (р = 0.021) и супраспинальном уровнях (р = 0.018) (рис. 1B, D) по сравнению с показателями ответа у пренатально стрессированных крыс. Таким образом, в серии I повторное введение флуоксетина и буспирона беременным самкам крыс вызывало у взрослого потомства снижение усиленного пренатальным стрессом воспалительного болевого ответа, организованного на спинальном и супраспинальном уровнях.
Рис. 1.
Влияние пренатальных воздействий (пренатальное введение флуоксетина, буспирона, пренатальный стресс) (Серия I) и их сочетания со стрессом в препубертатный период развития (Серия II) на воспалительный болевой ответ в формалиновом тесте у взрослых самцов (A, B) и самок (C, D) крыс. По вертикали – число сгибаний + встряхиваний (спинальный уровень) (A, B) и продолжительность реакции вылизывания (супраспинальный уровень) (с) (C, D). Белые столбики – пренатально не стрессированные (контроль), серые столбики – пренатально стрессированные с физиологическим раствором, квадратная штриховка – пренатально стрессированные с флуоксетином, продольная штриховка – пренатально стрессированные с буспироном. Уровень значимости: *р < 0.05, **р < 0.01 между пренатально стрессированными с физиологическим раствором и контролем; +р < 0.05, ++р < 0.01 – между пренатально стрессированными с физиологическим раствором и пренатально стрессированными с флуоксетином; ^р < 0.05, ^^р < 0.01 – между пренатально стрессированными с физиологическим раствором и пренатально стрессированными с буспироном; #р < 0.05, ##р < 0.01, ###р < 0.001 – между серией I и серией II пренатально стрессированными с физиологическим раствором и пренатально стрессированными с флуоксетином. Данные представлены в виде среднего ± стандартная ошибка. Fig. 1. Effect of prenatal effects (prenatal administration of fluoxetine, buspirone, prenatal stress) (Series I) and their combination with the stress during the prepubertal period (Series II) on the inflammatory pain response in the formalin test in adult male (A, B) and female (C, D) rats. Vertically – the number of flexes + shakes (the spinal level) (A, B) and the licking duration (the supraspinal level) (s) (C, D). White columns – non-prenatally stressed (the control), gray columns - prenatally stressed with saline solution, square hatch - prenatally stressed with fluoxetine, the lengthwise hatch - prenatally stressed with buspirone. Significance level: *р < 0.05, **р < 0.01 between the prenatally stressed with saline and control; *p < 0.05, ++p < 0.01 – between the prenatally stressed with saline and the prenatally stressed with fluoxetine; *p < 0.05, ^^p < 0.01 – between the prenatally stressed with saline and the prenatally stressed with buspirone; #p < 0.05, ##p < 0.01, ###p < 0.001 – between the series I and series II prenatally stressed with saline and the prenatally stressed with fluoxetine. Data are presented as mean ± standard error.
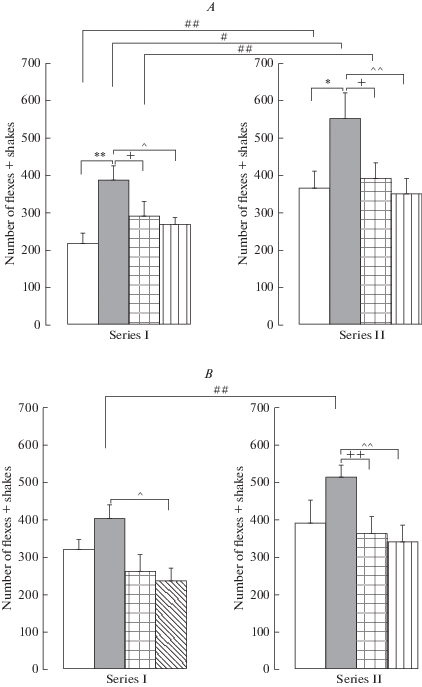
Рис. 1.
Окончание
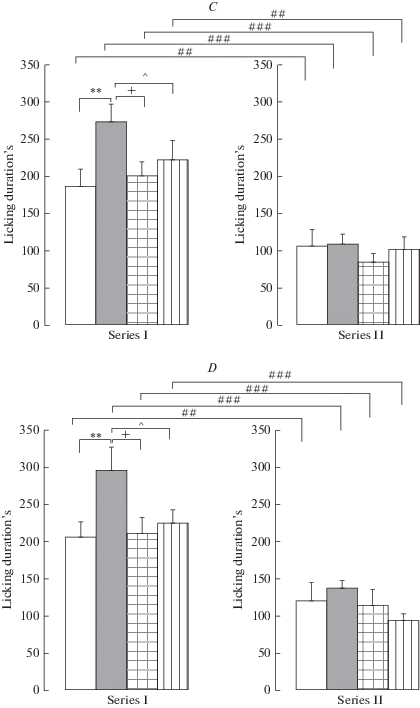
Тест Бонферрони обнаружил, что в серии II пренатальный стресс увеличил число сгибаний + встряхиваний у самцов (р = 0.011) и на уровне тенденции у самок (р = 0.063) (рис. 1A, B), но не изменил продолжительность вылизывания у крыс обоего пола (рис. 1C, D). Флуоксетин и буспирон уменьшили влияние пренатального стресса на болевой ответ в показателях спинального уровня у самцов (р = 0.020, р = 0.002) (рис. 1A) и самок (р = 0.006, р = 0.002) (рис. 1B) по сравнению с пренатально стрессированными крысами. Тест Бонферрони обнаружил следующие различия между сериями I и II в тоническом болевом ответе. Более высокие значения ответа были обнаружены в серии II в показателях спинального уровня у пренатально не стрессированных и пренатально стрессированных самцов (р = 0.009, р = 0.025) (рис. 1A) и пренатально стрессированных самок (р = 0.007) (рис. 1B). Важно, что в показателях супраспинального уровня более высокие показатели были обнаружены в серии I у пренатально не стрессированных самцов (р = 0.004) (рис. 1C) и самок (р = 0.005) (рис. 1D) и пренатально стрессированных самцов и самок (р < 0.001 в обоих случаях. Кроме того, в серии II по сравнению с серией I величина болевого ответа на супраспинальном уровне была меньше у пренатально стрессированных самцов с флуоксетином и буспироном (р < 0.001 и р = 0.002) (рис. 1C) и самок (р < 0.001 в обоих случаях) (рис. 1D), а на спинальном уровне - у пренатально стрессированных самцов с флуоксетином (р = 0.003) (рис. 1A). Таким образом, в серии II влияние сочетания стрессоров неодинаково проявилось в болевом ответе, организованном на спинальном и супраспинальном уровнях. Так, число сгибаний + встряхиваний у пренатально стрессированных крыс было увеличено, флуоксетин и буспирон нормализовали этот показатель. Продолжительность вылизывания, показатель болевого ответа, организованного на супраспинальном уровне, снизилась более чем на 50% у пренатально не стрессированных крыс и крыс с пренатальными воздействиями, притом различий в ответе между группами крыс не было обнаружено.
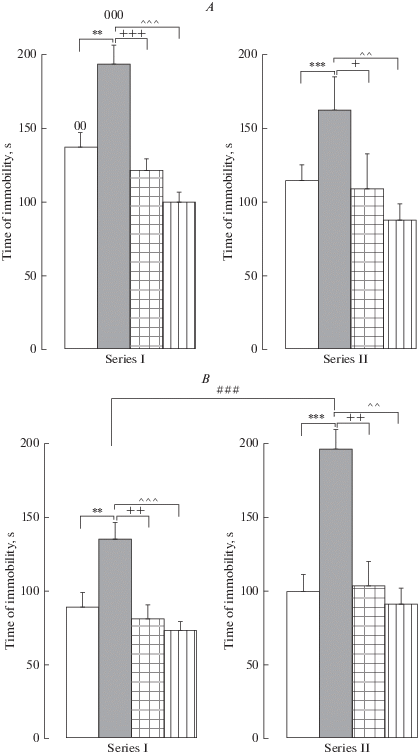
В тесте принудительного плавания для времени иммобильности получено значимое влияние воздействия F(3,144) = 51.853, ***p < 0.001, η2 = 0.519, пола F(1,144) = 7.429, **p = 0.007, η2 = 0.049, значимо взаимодействие серии и пола F(1,144) = 9.706, **p = 0.002, η2 = 0.063 и в тенденции взаимодействие серии, пола и воздействия F(3,144) = 2.239, p = 0.086, η2 = 0.045. Тест Бонферрони обнаружил, что в сериях I и II пренатальный стресс увеличил время иммобильности у самцов (р = 0.002, р < 0.001) (рис. 2A) и у самок (р = 0.004, р < 0.001) (рис. 2B) по сравнению с этим показателем у пренатально не стрессированных животных. В серии I флуоксетин и буспирон уменьшили время иммобильности у самцов (р < 0.001 в обоих случаях) (рис. 2A) и самок (р = 0.003, р = 0.001) (рис. 2B) по сравнению с этим показателем у пренатально стрессированных крыс. В серии II флуоксетин уменьшил время иммобильности у самцов (р = 0.02) и самок (р = 0.006) (рис. 2A, B), буспирон уменьшил этот показатель у крыс обоего пола (р = 0.002 в обоих случаях) (рис. 2A, B). Обнаружено достоверное различие между сериями во времени иммобильности у пренатально стрессированных самок (р < 0.001), с более высоким показателем депрессии в серии II (рис. 2B). Половые различия обнаружены только в серии I у пренатально не стрессированных (р < 0.01) и пренатально стрессированных (р < 0.001) крыс c более высокими показателями у самцов (рис. 2A, B). Таким образом, в серии I пренатальный стресс увеличил уровень выраженности депрессивноподобного поведения у взрослых крыс по сравнению с контролем, флуоксетин и буспирон нормализовали психоэмоциональное поведение. Стресс в препубертатном возрасте увеличил уровень депрессивноподобного поведения у пренатально стрессированных самок, но не изменил у пренатально стрессированных самцов. Половые различия, обнаруженные в серии I у пренатально не стрессированных и пренатально стрессированных животных, с более высоким показателем депрессивноподобного поведения у самцов, были нивелированы стрессом в препубертатный период развития.
Рис. 2.
Влияние пренатальных воздействий (пренатальное введение флуоксетина, буспирона, пренатальный стресс) (Серия I) и их сочетания со стрессом в препубертатный период развития (Серия II) на время иммобильности в тесте принудительного плавания у взрослых самцов (A) и самок (B) крыс. По вертикали – время иммобильности (с). Белые столбики – пренатально не стрессированные (контроль), серые столбики – пренатально стрессированные с физиологическим раствором, квадратная штриховка – пренатально стрессированные с флуоксетином, продольная штриховка – пренатально стрессированные с буспироном. Уровень значимости: **р < 0.01, ***р < 0.001 между пренатально стрессированными с физиологическим раствором и контролем; +р < 0.05, ++р < 0.01, +++р < 0.001 – между пренатально стрессированными с физиологическим раствором и пренатально стрессированными с флуоксетином; ^^р < 0.01, ^^^р < 0.001 – между пренатально стрессированными с физиологическим раствором и пренатально стрессированными с буспироном; ###р < 0.001 – между серией I и серией II пренатально стрессированными с физиологическим раствором и пренатально стрессированными с флуоксетином; 00р < 0.01, 000р < 0.001 – половые различия между пренатально не стрессированными и пренатально стрессированными крысами в серии I. Данные представлены в виде среднего ± стандартная ошибка. Fig. 2. Effect of prenatal effects (prenatal administration of fluoxetine, buspirone, prenatal stress) (Series I) and their combination with the stress during the prepubertal period (Series II) on immobility in the forced swimming test in adult males (A) and female (B) rats.Vertically – immobility time (s). White columns – non-prenatally stressed (the control), gray columns - prenatally stressed with saline solution, square hatch - prenatally stressed with fluoxetine, the lengthwise hatch - prenatally stressed with buspirone. Significance level: *р < 0.05, **р < 0.01 between the prenatally stressed with saline and control; *p < 0.05, ++p < 0.01 – between the prenatally stressed with saline and the prenatally stressed with fluoxetine; *p < 0.05, ^^p < 0.01 – between the prenatally stressed with saline and the prenatally stressed with buspirone; #p < 0.05, ##p < 0.01, ###p < 0.001 – between the series I and series II prenatally stressed with saline and the prenatally stressed with fluoxetine. Data are presented as mean ± standard error.
При исследовании уровня кортикостерона обнаружен значимый главный эффект для фактора серия F(1,75) = 25.1, *** p < 0.001, η2 = 0.25, а также выявлена тенденция для фактора воздействие F(3,75) = 2,6, p = 0.056, η2 = 0.096. Post hoc анализ обнаружил снижение уровня кортикостерона у пренатально стрессированных самок с введением буспирона (р = 0.011) по сравнению с уровнем гормона пренатально стрессированных с физиологическим раствором крыс, уровня флуоксетина – на уровне тенденции (р = 0.069). Post hoc анализ показал, что после теста принудительного плавания уровень кортикостерона повысился у пренатально не стрессированных крыс (р = 0.049) по сравнению с их базальным уровнем гормона, у пренатально стрессированных с физиологическим раствором крыс (р = 0.021) по сравнению с их базальным уровнем гормона, а также у пренатально стрессированных крыс с флуоксетином (р = 0.024) и пренатально стрессированных крыс с буспироном (р = 0.003) по сравнению с базальным уровнем кортикостерона у крыс этих групп. Не было выявлено достоверных различий в уровне кортикостерона между крысами пренатально не стрессированными, пренатально стрессированными с физиологическим раствором, пренатально стрессированными с флуоксетином и пренатально стрессированными с буспироном (табл. 1 ).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В проведенном исследовании мы идентифицировали условия стрессовых воздействий, которые повышают устойчивость к стрессу у взрослых крыс. Показано, что сочетание пренатальных воздействий (введение флуоксетина или буспирона стрессированным в период беременности самкам) и стресса в препубертатном возрасте (воспалительная боль и принудительное плавание) вызывало у взрослых крыс обоего пола достоверное снижение тонического болевого воспалительного ответа, интегрированного на супраспинальном уровне, по сравнению с соответствующим ответом у контрольных взрослых крыс. Сочетание стресса в пренатальный и препубертаный периоды развития нивелировало половые различия, обнаруженные в уровне психоэмоционального поведения у пренатально не стрессированных и пренатально стрессированных крыс. У самок, подвергнутых сочетанию пренатальных воздействий и стресса в препубертатном возрасте, уровень кортикостерона в плазме крови после принудительное плавания был достоверно выше базального уровня гормона у самок во всех исследованных группах, но достоверных различий в уровне стрессовой реактивности гормонального ответа после принудительного плавания обнаружено не было.
Пренатальный стресс вызвал у взрослых крыс увеличение продолжительности вылизывания в тоническую фазу формалинового теста и времени иммобильности (показатель депрессивноподобного поведения) в тесте принудительного плавания, что подтвердило наши ранее опубликованные данные на взрослых крысах [26]. Многочисленные данные литературы, полученные как на человеке [2, 4], так и на животных [7, 10, 11], указывают на негативные последствия в поведении, вызванные пренатальным стрессом, в частности, на усиление тревожно-депрессивного поведения. В настоящем исследовании впервые представлены данные о снижении, вызванном пренатальным введением флуоксетина, интенсивности воспалительного болевого ответа и уровня выраженности депрессивноподобного поведения у пренатально стрессированного женского взрослого потомства. Этот результат указывает на способность антидепрессанта флуоксетина вызывать антиноцицептивное влияние, что расширяет имеющиеся немногочисленные, часто противоречивые, данные о роли флуоксетина в ноцицепции [27, 28]. Хроническое введение буспирона стрессированным беременным самкам вызывало также снижение показателей исследованного адаптивного поведения у потомства, что подтвердило наши данные, полученные ранее на взрослых крысах [24] и пренатально стрессированных крысах препубертатного возраста, подвергнутых в пренатальный период развития действию буспирона и флуоксетина [14]. Таким образом, полученные результаты свидетельствуют о том, что антидепрессант флуоксетин и анксиолитик буспирон при определенных условиях способны вызывать антидепрессивный и антиноцицептивный эффекты.
Стресс в препубертатный период развития вызвал усиление болевого ответа, интегрированного на спинальном уровне, только у самцов. В литературе сообщается о последствиях стресса в препубертатный период развития (хронический комбинированный стресс или социальный стресс), обнаруженных в психоэмоциональном поведении и когнитивной сфере взрослых крыс [29, 30]. Неидентичность результатов определяется многими факторами, включая и половые различия.
В настоящей работе при исследовании интенсивности воспалительного болевого ответа в формалиновом тесте нами был обнаружен важный факт, свидетельствующий о зависимости результата влияния сочетания примененных стрессоров на интенсивность ответа от уровня интеграции болевой реакции. Так, продолжительность реакции вылизывания, интегрированной на супраспинальном уровне, сократилась (более чем на 50%) во всех группах самцов и самок крыс, подвергнутых стрессовым воздействиям в пренатальный и препубертатный периоды развития, что указывает на повышение стрессоустойчивости к воспалительной боли у взрослых крыс. В этих условиях влияние флуоксетина и буспирона не проявилось, различий в величине болевого ответа у крыс в разных группах не было выявлено, тогда как у крыс, не подвергнутых стрессу в препубертатном возрасте (серия I), флуоксетин и буспирон у пренатально стрессированных животных обоего пола вызывали антиноцицептивный эффект, подавляли проноцицептивное влияние пренатального стресса. Совсем другой эффект – увеличение интенсивности болевого ответа – был обнаружен в числе сгибаний + встряхиваний у самцов всех исследованных групп и только у пренатально стрессированных самок. Таким образом, последствия сочетания стрессоров в разные возрастные периоды проявились у взрослых крыс по-разному в реакциях, интегрированных на разных уровнях ЦНС: в повышенной чувствительности, то есть уязвимости, к стрессу воспалительной боли в реакциях спинального уровня и в устойчивости к стрессу в реакциях супраспинального уровня. Формалиновый тест, как известно, широко используется для оценки влияния разных препаратов на ноцицептивную систему [31]. Результаты нашей работы подтверждает информативность формалинового теста при оценке влияний стрессовых событий на болевую систему.
Мы не можем сравнить наши результаты с данными литературы, так как не обнаружили работ, в которых использовали стресс воспалительной боли в качестве стрессового воздействия в раннем возрасте в сочетании с каким-либо другим стрессом, хотя воспалительная боль часто встречается в неонатальной клинике. Каким образом сочетание стрессовых воздействий в критические периоды индивидуального развития вызывает усиление интегрированного на спинальном уровне воспалительного болевого ответа и снижение его на супраспинальном уровне у крыс во взрослом состоянии? На поставленный вопрос мы можем только сделать предположение: увеличение числа сгибаний и встряхиваний, вызванное сочетанием стрессоров, обусловлено возбуждающей глутаматергической системой, а сокращение продолжительности реакции вылизывания – усилением тормозного ГАМКергического влияния на супраспинальном уровне. Действительно, боль, вызванная формалином, активирует интенсивные реакции сгибания, встряхивания и вылизывания поврежденной воспалительным агентом конечности, сопровождающиеся доминирующим действием возбуждающей глутаматергической системы на спинальном уровне [32]. Известно, что в механизмах формирования ноцицептивного возбуждения в ответ на инъекцию формалина принимают участие разные уровни ЦНС, включая кору головного мозга [33]. По имеющимся данным, нисходящая из ядер шва моноаминергическая система регулирует ноцицептивный сигнал на уровне задних рогов спинного мозга; показаны как афферентные пути от нейронов спинного мозга к ядрам шва, так и эфферентные пути из ядер шва на спинальные нейроны [34]. Известно, что серотонинергическая, ГГНС, глутаматергическая, ГАМКергическая системы вовлечены в ноцицепцию и подвержены влиянию стресса [35–38]. Стресс нарушает баланс процессов возбуждения и торможения в ЦНС и функциональную активность ГГНС, которая влияет на системы контроля болевой нисходящей серотонинергической системы, и, таким образом, на нейрофизиологические механизмы, лежащие в основе восприятия боли. Принимая во внимание разную роль метаботропных и инотропных как глутаматергических [39], так и ГАМКергических [35] рецепторов во влиянии стресса на ноцицепцию, а также механизм котрансмиссии глутамата с серотонинергическими и ГАМКергическими нейронами [40], можно предположить, что эти факторы вовлечены в обнаруженные нами различия во влиянии стресса в разные периоды развития крысы на воспалительный болевой ответ, интегрированный на спинальном и супраспинальном уровнях ЦНС.
Надо отметить, что влияние препубертатного стресса, проявившееся в увеличении интенсивности болевого ответа спинального уровня, обнаружено у пренатально не стрессированных, пренатально стрессированных с физиологическим раствором и пренатально стрессированных с введением флуоксетина самцов, тогда как у самок – только в группе пренатально стрессированных с введением физиологического раствора. Однако не было обнаружено половых различий в интенсивности болевого ответа в обеих сериях экспериментов.
У взрослых пренатально стрессированных крыс как подвергнутых, так и не подвергнутых стрессированию в препубертатном возрасте, уровень выраженности депрессивноподобного поведения был повышен по сравнению с уровнем депрессивного поведения у контрольных крыс в соответствующих группах. Хроническое введение флуоксетина и буспирона стрессированным беременным самкам нормализовало этот тип поведения у взрослого потомства обоего пола. Различие между сериями I и II были выявлены в усилении времени иммобильности только у пренатально стрессированных самок. Несмотря на отсутствие в серии I достоверности во времени иммобильности у пренатально стрессированных с препаратами самцов и самок, степень выраженности депрессивноподобного поведения у самок как с флуоксетином, так и буспироном, была ниже, чем у самцов. Половые различия, обнаруженные в уровне депрессивноподобного поведения у пренатально не стрессированных и пренатально стрессированных крыс с введением физиологического раствора (серия I) были нивелированы стрессом в препубертатном возрасте (серия II). В литературе есть данные, что самки в препубертатном возрасте более чувствительны к стрессу, чем самцы [30], однако эти данные касаются только социального стресса. Итак, результаты, полученные как при исследовании воспалительного болевого ответа, так и уровня выраженности депрессивноподобного поведения, свидетельствуют о сложности механизмов долговременного влияния сочетания стресса в разные критические периоды развития на гормональные и нейротрансмиттерные системы. Хотя механизм этого важного адаптивного явления изучается на молекулярно-генетическом уровне, нрешенными остаются многие вопросы, включая вопрос: на каком этапе развития происходит трансформация нарушений в нейрогуморальной регуляции, вызванных стрессом в раннем возрасте, в адаптивный процесс.
Таким образом, полученные данные позволили идентифицировать условия стрессовых воздействий, повышающих устойчивость к стрессу у взрослых крыс. Установлено, что стресс в критические периоды развития формирует фенотип с повышенной стрессоустойчивостью к воспалительному болевому воздействию, что обнаружено в ответе, организованном на супраспинальном уровне у взрослых особей. Влияние стресса на депрессивно-подобное поведение проявляется в зависимости от пола животных. Важность положительного результата при взаимодействии двух негативных стрессоров очевидна: повышается стрессоустойчивость и появляется возможность отмены антидепрессантов, применение которых становится уже не эффективным. Полученные новые данные расширяют представление об уязвимости и устойчивости индивидуумов, подвергнутых стрессовым событиям в критические периоды жизни, к стрессу в последующем онтогенезе [17, 19, 20] и имеют практическое значение.
Список литературы
Matthews S.G., McGowan P.O. Developmental programming of the HPA axis and related behaviours: epigenetic mechanisms. J. Endocrinol. 242(1): T69−T79. 2019. https://doi.org/10.1530/JOE-19-0057
Monk C., Lugo-Candelas C., Trumpff C. Prenatal developmental origins of future psychopathology: mechanisms and pathways. Ann. Rev. Clin. Psychol. 15: 317−344. 2019.
LeMoult J. Humphreys K.L., Tracy A., Hoffmeister J.A., Ip E., Gotlib I.H. Meta-Analysis: Exposure to Early Life Stress and Risk for Depression in Childhood and Adolescence. J. Am. Acad. Child. Adolesc. Psychiatry. pii: S0890-8567(19)32111-2. https://doi.org/10.1016/j.jaac.2019.10.011
Targum S.D., Nemeroff C.B. The effect of early life stress on adult psychiatric disorders. Innov. Clin. Neurosci. 16(1–2): 35–37. 2019.
Tirelli E., Laviola G., Adriani W. Ontogenesis of behavioral sensitization and conditioned place preference induced by psychostimulants in laboratory rodents. Neurosci. Biobehav. Rev. 27 (1–2): 163–178. 2003.
Spear L.P. The adolescent brain and age-related behavioral manifestations. Neurosci. Biobehav. Rev. 24(4): 417–463. 2000.
Weinstock M. Prenatal stressors in rodents: Effects on behavior. Neurobiology of stress. 6: 3–13. 2017.
Gomes F.V., Zhu X., Grace A.A. Stress during critical periods of development and risk for schizophrenia. Schizophr Res. 2019. pii: S0920-9964(19)30020-9. https://doi.org/10.1016/j.schres.2019.01.030
Bourke C.H., Neigh G.N. Behavioral effects of chronic adolescent stress are sustained and sexually dimorphic. Horm. Behav. 60(1): 112–20. 2011.
Chen L., Jackson T. Early maternal separation and responsiveness to thermal nociception in rodent offspring: A meta-analytic review. Behav. Brain. Res. 299: 42–50. 2016. https://doi.org/10.1016/j.bbr.2015.11.022
Peña C.J., Nestler E.J., Bagot R.S. Environmental programming of susceptibility and resilience to stress in adulthood in male mice. Front. Behav. Neurosci. 13: 40. 2019. https://doi.org/10.3389/fnbeh.2019.00040
Lipner E., Murphy S.K, Ellman L.M. Prenatal maternal stress and the cascade of risk to schizophrenia spectrum disorders in offspring. Curr. Psychiatry. Rep. 21(10): 99. 2019. https://doi.org/10.1007/s11920-019-1085-1
Kiryanova V., Smith V.M., Antie M. C., Dyck R.H. Behavior of adult 5-HT1A receptor knockout mice exposed to stress during prenatal development. Neuroscience. 371: 16–28. 2018. https://doi.org/10.1016/j.neuroscience.2017.11.039
Butkevich I.P., Mikhailenko V.A., Vershinina E.A., Barr G.A. Differences between the prenatal effects of fluoxetine or buspirone alone or in combination on pain and affective behaviors in prenatally stressed male and female rats. Front. Behav. Neurosci. 13(125): 16. 2019. doi: 103389/fnbeh.2019.00125
Hervás I., Artigas F. Effect of fluoxetine on extracellular 5-hydroxytryptemine in rat brain. Role of 5-HT autoreceptors. Eur. J. Pharmacol. 358(1): 9–18. 1998.
Brummelte S., Mc Glanaghy E., Bonnin A., Oberlander T.F. Developmental changes in serotonin signaling: Implications for early brain function, behavior and adaptation. Neuroscience. 342: 212-231. 2017. https://doi.org/10.1016/j.neuroscience.2016.02.037
Van Camp G., Cigalotti J., Bouwalerh H., Mairesse J., Gatta E., Palanza P., Maccari S., Morley-Fletcher S. Consequences of a double hit of stress during the perinatal period and midlife in female rats: Mismatch or cumulative effect? Psychoneuroendocrinology. 93: 45—55. 2018. https://doi.org/10.1016/j.psyneuen.2018.04.004
Verstraeten B.S.E., McCreary J., Weyers S., Metz G.A.S., Olson D.M. Prenatal two-hit stress affects maternal and offspring pregnancy outcomes and uterine gene expression in rats: match or mismatch? Biol. Reprod. 100(1): 195–207. 2019. https://doi.org/10.1093/biolre/ioy166
Nederhof E., Schmidt M.V. Mismatch or cumulative stress: Toward an integrated hypothesis of programming effects. Physiol. Behav. 106: 691–700. 2012.
Daskalakis N.P., Bagot R.C., Parker K.J., Vinkers C.H., Kloet E.R. The three-hit concept of vulnerability and resilience: towards understanding adaptation to early-life adversity outcome. Psychoneuroendocrinology. 38(9): 1858–1873. 2013.
Михайленко В.А., Буткевич И.П., Вершинина Е.А. Влияние перинатального стресса и антидепрессантов на воспалительный болевой ответ и психоэмоциональное поведение у молодых самцов крыс. Рос. физиол. журн. им. И.М. Сеченова. 105(7): 888–901. 2019. [Mikhailenko V.A., Butkevich I.P., Vershinina E.A. Influence of perinatal stress and antidepressants on the acute and tonic pain responses and psycho-emotional behavior in young male rats. Russ. J. Physiol. 105(7): 880–901. 2019. (In Russ)].https://doi.org/10.1134/S0869813919070057
Marrocco J., Gray J.D., Kogan J.F., Einhorn N.R., O’Cinneide E.M., Rubin T.D., Carroll T.S., Schmidt E.F., McEwen B.S. Early life stress restricts translational reactivity in CA3 neurons associated with altered stress responses in adulthood. Front. Behav. Neurosci. 13: 157. 2019. https://doi.org/10.3389/fnbeh.2019.00157
Kilkenny C., Browne W.J., Cuthill I.C., Emerson M., Altman D.G. Improving bioscience research reporting: The ARRIVE guidelines for reporting animal res. PLoS. Biol. 8(6): e1000412. 2010.
Butkevich I., Mikhailenko V., Vershinina E., Semionov P., Makukhina G., Otellin V. Maternal buspirone protects against the adverse effects of in utero stress on emotional and pain-related behaviors in offspring. Physiol. Behav. 2011; 102(2): 137–42. https://doi.org/10.1016/j.physbeh.2010.10.023
Glover M.E., Clinton S.M. Of rodents and humans: A comparative review of the neurobehavioral effects of early life SSRI exposure in preclinical and clinical research. Int. J. Dev. Neurosci. 51: 50–72. 2016.
Butkevich I.P., Vershinina E. A. Maternal stress differently alters nociceptive behaviors in the formalin test in adult female and male rats. Brain Res. 961: 159–165. 2003.
Barakat A., Hamdy M.N., Elbadr M.M. Uses of fluoxetine in nociceptive pain management: A literature overview. Eur. J. Pharmacol. 829: 12–25. 2018.
Riediger C., Schuster T., Barlinn K., Maier S., Weitz J., Siepmann T. Adverse effects of antidepressants for chronic pain: a systematic review and meta-analysis. Front Neurol. 8: 307. 2017. https://doi.org/10.3389/fneur.2017.00307
Burke A.R., McCormick C. M., Pellis S.M., Lukkes J.L. Impact of adolescent social experiences on behavior and neural circuits implicated in mental illnesses. Neurosci. Biobehav. Rev. 76 (Pt B): 280–300. 2017. https://doi.org/10.1016/j.neubiorev.2017.01.018
McCormick C.M., Green M.R. From the stressed adolescent to the anxious and depressed adult: investigations in rodent models. Neuroscience. 249: 242–57. 2013. https://doi.org/10.1016/j.neuroscience.2012.08.063
Dulu T.D., Kanui T.I., Towett P.K., Maloiy G.M., Abelson K.S. In Vivo. The effects of oxotremorine, epibatidine, atropine, mecamylamine and naloxone in the tail-flick, hot-plate, and formalin tests in the naked mole-rat (Heterocephalus glaber). In Vivo. 28(1): 39–48. 2014.
Vidal-Torres A., Carceller A., Zamanillo D., Merlos M., Vela J.M., Fernandez-Pastor B. Evaluation of formalin-induced pain behavior and glutamate release in the spinal dorsal horn using in vivo microdialysis in conscious rats. J. Pharmacol. Sci. 120: 129–132. 2012.
Morrow T.J., Paulson P.E., Danneman P.J., Casey K.L. Regional changes in forebrain activation during the early and late phase of formalin nociception: analysis using cerebral blood flow in the rat. Pain. 75(2–3): 355–365. 1998.
Braz J.M., Enquist L.W., Basbaum A.I. Inputs to serotonergic neurons revealed by conditional viral transneuronal tracing. J. Comp. Neurol. 514(Iss.2): 145–160. 2009.
Goudet C., Magnaghi V., Landry M., Nagy F., Gereau R.W., Pin J-P. Metabotropic receptors for glutamate and GABA in pain. Brain. Res. Rev. 60: 43–56. 2009.
Quintero L., Cardenas R., Suarez-Roca H. Stress-induced hyperalgesia is associated with a reduced and delayed GABA inhibitory control that enhances post-synaptic NMDA receptor activation in the spinal cord. Pain. 152(8): 1909–22. 2011. https://doi.org/10.1016/j.pain.2011.04.017
Bannister K., Lockwood S., Goncalves L., Patel R., Dickenson A.H. An investigation into the inhibitory function of serotonin in diffuse noxious inhibitory controls in the neuropathic rat. Eur. J. Pain. 2017 Apr; 21(4): 750–760. https://doi.org/10.1002/ejp.979
Hernández-Vázquez F., Garduño J., Hernández-Lόpez S. GABAergic modulation of serotonergic neurons in the dorsal raphe nucleus. Rev. Neurosci. 30(3): 289–303. 2019. Doi: 10.1515/revneuro-2018-0014
Lian Y.N., Lu Q., Chang J.L., Zhang Y. The role of glutamate and its receptors in central nervous system in stress-induced hyperalgesia. Int. J. Neurosci. 128(3): 283–290. 2018 https://doi.org/10.1080/00207454.2017.1387112
Trudeau L.E., Mestikawy S. Glutamate Cotransmission in Cholinergic, GABAergic and Monoamine Systems: Contrasts and Commonalities. Front. Neural. Circuits. 12: 113. 2018. https://doi.org/10.3389/fncir.2018.00113
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


