Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 3, стр. 384-394
Влияние точечных мутаций в гене Disc1 у мышей линий L100P и Q31L на формирование поведения, подобного обсессивно-компульсивному
К. В. Смирнова 1, 2, М. В. Морозова 1, С. А. Татаурова 1, Т. Г. Амстиславская 1, 2, Е. А. Литвинова 1, 3, Е. Н. Кожевникова 1, 3, *
1 Научно-исследовательский институт физиологии и фундаментальной медицины
Новосибирск, Россия
2 Новосибирский государственный университет
Новосибирск, Россия
3 Сибирский федеральный научный центр агробиотехнологий РАН
Новосибирск, Россия
* E-mail: kozhevnikovaen@physiol.ru
Поступила в редакцию 20.12.2019
После доработки 06.02.2020
Принята к публикации 06.02.2020
Аннотация
Обсессивно-компульсивное расстройство (ОКР) является широко распространенным расстройством психики и приводит к ограничению социальной адаптации носителя заболевания. ОКР является ключевым примером ряда состояний, известных как обсессивно-компульсивные, и связанных с ними расстройств. Эти заболевания клинически гетерогенны и этиологически сложны, а их основные патофизиологические механизмы до сих пор неизвестны. Важную роль в понимании патогенеза ОКР играют полученные на лабораторных животных модели данного заболевания, дающие понимание молекулярных основ стереотипного поведения и генетической архитектуры ОКР. Ранее было показано, что мыши с делецией 2 и 3 экзонов гена Disc1 (disrupted in schizophrenia 1) проявляют поведение, подобное обсессивно-компульсивному. Мутации в гене Disc1 ассоциированы с развитием шизофрении у людей, одним из аспектов которой зачастую является обессивно-компульсивное поведение. В данной работе были использованы две линии мышей с точечными мутациями в гене Disc1 (линии L100P и Q31L) для выделения локуса данного гена, ответственного за формирование поведения, подобного обсессивно-компульсивному. Мы показали, что именно аминокислотная замена у мышей линии Q31L приводит к формированию поведенческих нарушений, ассоциированных с повторяющимися действиями в тесте закапывание шариков, тогда как замена у линии L100P не приводит к формированию подобного фенотипа. Кроме того, установлено, что поведение, подобное обсессивно-компульсивному, вызвано дефицитом активности серотонинергической системы, так как внутрибрюшинная инъекция метаболического предшественника синтеза серотонина – 5-гидрокситриптофана (5-НТР) нивелировала поведенческие нарушения, наблюдаемые в тесте закапывание шариков.
Обсессивно-компульсивное расстройство (ОКР) является психоневрологическим расстройством, которое характеризуется двумя различными феноменами: повторяющимися, беспокоящими, навязчивыми мыслями (обсессии) и явными повторными поведенческими актами (компульсии) [1–3]. Распространенность обсессивно-компульсивного расстройства составляет 2.3% [4]. Оно существенно мешает социальной адаптации и снижает социально-экономический статус носителя заболевания. ОКР клинически гетерогенно и этиологически сложно, и его основные патофизиологические механизмы до сих пор неизвестны [5, 6]. 30–40% пациентов с ОКР не дают адекватного ответа на лечение, кроме того, у 10% пациентов проявляется тяжелая хроническая форма резистентного состояния, вызванного традиционным лечением [7]. В связи с этим очевидно, что необходимо дальнейшее изучение патофизиологии ОКР и поиск новых стратегий лечения данного заболевания. Для этого необходимы адекватные модели, отражающие не только внешние проявления данного заболевания, но и эндофенотип.
Изначально сбалансированная хромосомная транслокация, вовлекавшая ген Disc1 (disrupted in schizophrenia 1), была обнаружена в большой шотландской семье, в которой наблюдалось существенное разнообразие психических расстройств: шизофрения, шизоаффективное расстройство, биполярное аффективное расстройство, монополярное аффективное расстройство и расстройство поведения подростков [8]. В настоящее время известно, что белок DISC1 является многофункциональным цитозольным каркасным белком, который участвует в передаче сигналов через ряд различных путей и регулирует многие процессы, например, организацию цитоскелета, клеточный цикл, пролиферацию клеток, передачу сигнала и внутриклеточный транспорт [9, 10]. Эти данные свидетельствуют о том, что DISC1 играет несколько ключевых ролей в нормальном развитии мозга, в то время как ряд механизмов, от нарушения структуры гена до аберрантной обработки белка, может приводить к развитию психических заболеваний [10].
Имеется несколько линий экспериментальных животных с нарушенным геном Disc1. Особый интерес представляют 2 линии мышей: Q31L, моделирующая депрессивно-подобное состояние, и L100P – общепризнанная генетическая модель шизофрении [11, 13–17]. У линии Q31L повышена иммобильность в тесте принудительного плавания, снижено социальное взаимодействие в тесте с другим животным и неживым объектом и уменьшено потребление сахарозы в тесте на предпочтение сахарозы, а у линии L100P существенно понижено преимпульсное ингибирование реакции вздрагивания на акустический сигнал, увеличена гиперактивность в открытом поле и снижена рабочая память в Т-образном лабиринте [11]. Линия мышей Q31L несет точечную мутацию (замена одного нуклеотида) во 2-м экзоне гена Disc1, приводящую к замене глутамина на лейцин в положении 31-й аминокислоты в белке DISC1, а мыши линии L100P – точечную мутацию во 2-м экзоне гена Disc1, приводящую к замене лейцина на пролин в положении 100-й аминокислоты в белке DISC1 [11].
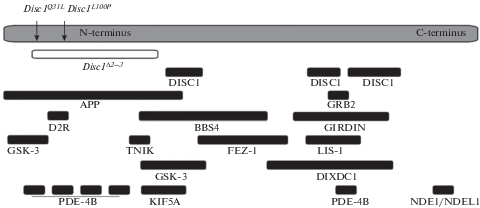
Интересно, что данные мутации попадают в область делеции экзонов 2 и 3 (рис. 1), которые были исследованы B. Wulaer с соавт. [12]. В этой работе было показано, что мыши, у которых отсутствует 2-й и 3-й экзон гена Disc1 проявляют поведение, подобное обсессивно-компульсивному. Авторы использовали один из самых распространенных поведенческих тестов на поведение, подобное обсессивно-компульсивному – тест на закапывание шариков [6]. Делеция 2-го и 3-го экзонов приводила к существенному увеличению числа закопанных шариков. Эти данные свидетельствуют о том, что мутации в гене Disc1 также могут быть моделями ОКР. Поскольку мутации, приводящие к аминокислотным заменам в линиях Q31L и L100P, нарушают взаимодействие белка DISC1 с рядом важных белковых партнеров, вовлеченных в передачу внутриклеточных сигналов, то представляется интересным определить их вклад в развитие поведенческих фенотипов, характерных для обсессивно-компульсивного поведения. Таким образом, целью нашей работы было исследовать поведение мышей линий L100P и Q31L на наличие ОКР-подобного поведенческого фенотипа и установить возможные механизмы, лежащие в основе данного нарушения.
Рис. 1.
Структура белка DISC1 и схема его взаимодействия с другими белками. Fig. 1. The structure of the DISC1 protein and the scheme of its interaction with other proteins.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные
Для работы были взяты половозрелые самцы линий мышей L100P и Q31L из уникальной научной установки “Биологическая коллекция – генетические биомодели нейропсихических заболеваний” (№ 493387) Научно-исследовательского института физиологии и фундаментальной медицины. В качестве контроля использовали самцов мышей линии C57Bl/6 (далее WT), поскольку данные мутации поддерживаются на генетическом фоне C57Bl/6. Протокол получения животных линий Q31L и L100P был описан ранее [11]. Возраст животных составлял 5 мес., средняя масса – 30 ± 4 г.
Животные содержались в открытых клетках размером 37 × 21 × 15 см по 3–4 особи при температуре помещения 22°С с постоянным доступом к пище и воде и добавлением материала для гнездования. Световой режим: 12 : 12 ч, свет выключался в 12:00 и включался в 00:00. Все тестирования проводились в темное время в свете красной лампы.
Работу с животными выполняли согласно биоэтическим нормам Директивы Евросоюза (ECC Directive 86/609/EEC) и приказу Министерства здравоохранения РФ от 1 апреля 2016 г. N 199н “Об утверждении Правил надлежащей лабораторной практики”. Проведение исследования одобрено локальным этическим комитетом, протокол № 8 от 15.08.2019.
Тестирование поведения
Было сформировано три экспериментальные группы животных: самцы линии С57Bl/6 (группа WT, n = 10), Q31L (n = 10) и L100P (n = 10), промежуток между различными поведенческими тестами составлял три дня. Тест открытое поле проводили в 2 последующих дня, используя по 5 животных из каждой группы в течение одного дня тестирования: мышь помещали в центр квадратной пластиковой установки 40 × 40 см с прозрачными стенками и непрозрачным дном, и в течение 6 мин фиксировали пройденный путь, активность, время, проведенное в центре арены, площадь исследованной арены и число стоек с помощью оборудования и программного обеспечения Ethovision XT 10 (Noldus International Technology) согласно следующим установкам: Центром поля считали участок 20 × 20 см в центре установки. Уровень активности измерялся в процентах “активных” пикселов от общей площади арены с усреднением по 5 кадрам (0.2 с; запись 25 кадров/с). Использованы следующие градации активности: высокая активность – более 0.5%, средняя активность – от 0.01 до 0.5% и отсутствие активности – менее 0.01%. Состояния длительностью менее 0.1 с в анализ не принимали. Стойками считали активность на уровне 75 мм над поверхностью арены открытого поля. Данное ограничение позволяет фиксировать только положение мыши на задних лапах без опоры на передние лапы. Время груминга и количество дефекаций считали вручную. Между тестированиями каждой мыши арена очищалась 70%-ным раствором этанола для удаления запахов.
Исследование на поведение, подобное обсессивно-компульсивному, проводили с использованием теста закапывание шариков. В клетку размером 37× 21 × 15 см насыпали подстил (березовые опилки) слоем 4 см, на поверхности подстила размещали 20 стеклянных шариков диаметром 1 см. В подготовленные клетки помещали по одному животному и оставляли на 30 мин. Затем мышей убирали в домашние клетки и считали количество шариков, которые были полностью закопаны в опилки [18, 19].
Введение 5-HTP
Введение 5-НТР проводили на интактной группе животных линии Q31L (n =10). 5-HTP растворяли в PBS (натрий-фосфатный буфер) и вводили внутрибрюшинно самцам линии Q31L по 40 мкг/кг массы животного из расчета 4 мл/кг [20]. Тестирование поведения было проведено в тестах открытое поле и закапывание шариков через 1.5 ч после введения препарата в два независимых дня.
Статистический анализ
Характер распределения выборки определяли при помощи описательной статистики в программе Statistica 10.0 с помощью критерия Колмогорова–Смирнова. Выборки, распределенные нормально, анализировали с помощью однофакторного дисперсионного анализа ANOVA с последующим тестом Тьюки HSD. Для статистической обработки распределений, отличных от нормального, использовали непараметрический метод множественных сравнений Краскела–Уоллиса с последующим применением критерия Манна–Уитни (U-тест).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Тест открытое поле
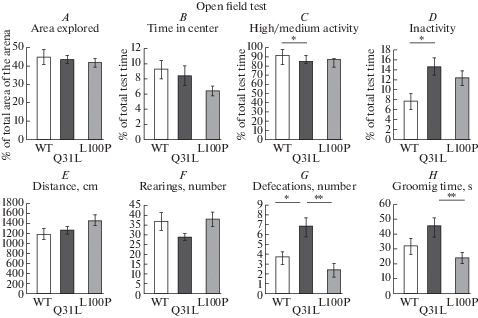
Для того, чтобы оценить двигательную и исследовательскую активность, а также отдельные признаки тревожности животных разных групп, был проведен тест открытое поле. Однофакторный дисперсионный анализ не выявил существенных различий между животными разных линий по площади исследованной арены и количеству стоек, которые отражают исследовательскую активность. Также мы не наблюдали достоверных различий по продолжительности нахождения в центре поля и на периферии, что считается критерием тревожности. Пройденный путь, который является показателем общей моторной активности, также не различался между группами (рис. 2). При этом однофакторный дисперсионный анализ показал наличие эффекта генотипа по отсутствию двигательной активности в процентах от общего времени тестирования (F(2,27) = 4.8617, p = 0.016) и по времени со средней и высокой активностью (%) (F(2,27) = 4.6469, p = 0.018). Последующая оценка с помощью критериия Тьюки HSD показала, что самцы линии Q31L существенно дольше были неактивными по сравнению с мышами линии WT (p = 0.013), тогда как различий между группами WT и L100P обнаружено не было (р = 0.119). При сравнении животных по времени средней и высокой активности обнаружено, что животные Q31L отличались от контроля существенным снижением доли времени нахождения в активном состоянии (Тьюки HSD: p = 0.016), тогда как мыши линий WT и L100P не различались по этому параметру (Тьюки HSD: p = 0.134). Увеличенное время неподвижности может свидетельствовать о депрессивном статусе. Также однофакторный дисперсионный анализ выявил различия между линиями по показателям, которые могут косвенно отражать эмоциональный статус животного: количество актов дефекации (F(2,27) = 8.8386, p = 0.001) и общее время груминга (F(2,25) = 5.4389, p = 0.011). У животных Q31L наблюдалось значительно большее число актов дефекации по сравнению с мышами WT (Тьюки HSD: p = 0.020) и по сравнению с животными L100P (Тьюки HSD: p = 0.001), при этом группы WT и L100P не различались по этому параметру (Тьюки HSD: p = 0.458). Общее время груминга было существенно выше у мышей Q31L по сравнению с L100P (Тьюки HSD: p = 0.008), но не отличалось между группами Q31L и WT (Тьюки HSD: р = 0.134) и L100P и WT (Тьюки HSD: р = 0.446. Эти результаты могут быть показателем повышенной тревожности мышей Q31L. Кроме того, увеличение общего времени груминга может быть объяснено смещенной активностью животных, вызванной повышенной тревожностью или склонностью к повторяющимся действиям.
Рис. 2.
Поведение мышей в тесте открытое поле. А – исследованная часть арены (доля от общей площади); В – время, проведенное в центре открытого поля (доля общего времени); С – высокая и средняя активность (доля от общего времени теста); D – время неподвижности (доля от общего времени теста); Е – пройденный путь в см; F – число стоек; G – количество актов дефекации; H – общее время грумингов. Данные представлены как среднее значение ± стандартная ошибка среднего, n = 10 для каждой группы, *p < 0.05, **p < 0.01 в соответствии с тестом Тьюки HSD. Fig. 2. The behavior of the test mice in the open field test. A – area explored and time spent in the center (B) of the arena; C – high and medium activity; D – immobility time; E – distance traveled in cm; F – the number of rearings; G – the number of defecations; H – total grooming time. Data are presented as mean ± standard error of the mean, n = 10 for each group * p <0.05, ** p <0.01 according to the HSD Tukey test.
Тест закапывание шариков
Ранее было показано, что делеция экзонов 2 и 3 в гене Disc1 приводит к формированию поведения, характерного для обсессивно-компульсивного: эти животные закапывают достоверно больше шариков в тесте закапывание шариков. Мы использовали такой же тест для оценки склонности животных линий Q31L и L100P к повторяющимся действиям. В этом эксперименте тест Краскела–Уоллиса показал достоверный эффект генотипа на число полностью закопанных шариков (H (2, n = 30) = 6.824959, p = 0.033). Применение критерия Манна–Уитни выявило существенные различия по количеству полностью закопанных шариков между группами животными (рис. 3). Самцы линии Q31L закапывали значительно больше шариков, чем мыши линий WT (U = 21, p = 0.028) и L100P (U = 22, p = 0.035). Животные L100P достоверно не отличались по числу полностью закопанных шариков от контрольных животных (U = 0, p = 1). Эти данные указывают на наличие компульсивного поведения у животных Q31L, но не у L100P.
Рис. 3.
Поведение животных линии Q31L в тесте закапывание шариков и эффект введения 5-HTP на поведение животных Q31L. А – количество полностью закопанных шариков в тесте закапывание шариков. В – количество полностью закопанных шариков в тесте закапывание шариков после инъекции 5-НТР (40 мг/кг). С – длина пройденного пути в тесте открытое поле после инъекции 5-НТР (40 мг/кг). Данные представлены как среднее значение ± стандартная ошибка среднего, n = 10 для каждой группы, *p < 0.05, по критерию Манна–Уитни для теста закапывание шариков. Fig. 3. The behavior Q31L mice in the marble burying test and the effect of 5-HTP on their behavior. A – the number of fully buried marbles in the marble burying test. В – the number of fully buried marbles in the marble burying test after 5-HTP injection (40 mg/kg). C – the distance traveled in the open field test after 5-HTP injection (40 mg/kg). The data are presented as mean ± standard error of the mean, n = 10 for each group, *p < 0.05, according to the Mann–Whitney U test for the marble burying test.
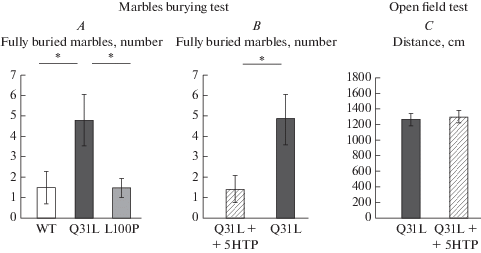
Поскольку одной из причин возникновения ОКР является снижение активности серотонинергической системы, то мы исследовали эффект введения метаболического предшественника синтеза серотонина 5-НТР на компульсивное поведение животных Q31L. После введения 5-НТР животных исследовали в тестах открытое поле и закапывание шариков. Статистический анализ с применением критерия Манна–Уитни показал, что самцы Q31L после инъекции 5-НТР (Q31L + 5НТР) закапывали существенно меньше шариков, чем самцы группы Q31L (U = 20.5, p = 0.028) (рис. 3). Для исключения вероятности того, что снижение закопанных шариков является следствием снижения общей активности животных, связанной со стрессом после введения препарата или побочным эффектом введения 5-НТР на моторную активность, был проведен тест открытое поле. В этом тесте животные Q31L + 5HTP проходили такой же путь, что и животные Q31L без введения препарата, что говорит об отсутствии эффекта 5-НТР на общую активность животного.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Тест закапывание шариков широко используется на экспериментальных животных как модель ОКР [21–24]. Данная модель у мышей соответствует двум основным требованиям, предъявляемым к экспериментальным моделям психопатологии: сходство симптомов расстройства с компульсивными чертами модели и сходство реакции на введение препаратов [21, 24]. Полагают, что шарики в тесте закапывание шариков вызывают исследовательское поведение у мышей, но вследствие отсутствия обратной связи не могут обеспечить животное необходимым стимулом для естественного завершения исследования, что приводит к компульсивному закапыванию [21, 22, 25].
Данный тест моделирует именно ОКР, а не другие виды поведения, поскольку показано, что сами шарики не вызывают у мышей повышение тревожности и избегания, а интенсивность закапывания шариков не коррелирует с тревожностью. В этот тест также не вносит вклад исследовательское поведение, поскольку при повторных тестированиях, когда шарики теряли свою новизну, закапывание шариков не снижалось [26]. Кроме того, показано, что флувоксамин (специфический ингибитор обратного захвата серотонина), который является эффективным средством для лечения ОКР, понижает число закапываемых шариков, не влияя на тревожность [18].
Самцы линии Q31L в тесте закапывание шариков закапывали существенно больше шариков, чем самцы контрольной линии WT. При этом в тесте открытое поле не было обнаружено существенных различий по пройденному пути у мышей разных групп. Более того, животные Q31L существенно больше времени были неактивны и соответственно меньше времени проявляли среднюю и высокую активность, поэтому наблюдаемое нами увеличение закапывания шариков не связано с повышением активности мышей. Таким образом, можно говорить о том, что у мышей линии Q31L проявляется поведение, подобное обсессивно-компульсивному.
ОКР характеризуется как расстройство, связанное с тревожностью [27]. У мышей линии Q31L отмечается повышенная тревожность, что выражается в существенно большем количестве грумингов и увеличенном количестве дефекаций в тесте открытое поле. Кроме того, показано, что пациенты с ОКР часто страдают сопутствующей депрессией [28]. Согласно этому снижение активности самцов Q31L в тесте открытое поле косвенно указывает на депрессивный статус животных. Наши данные согласуются с опубликованными ранее результатами, показавшими, что мыши линии Q31L проявляют депрессивно-подобное поведение и рассматриваются как модель депрессии [11, 17]. Исследовательская активность, которая выражается количеством стоек и, отчасти, площадью исследованной арены, у животных разных линий не различалась.
Существует несколько теорий патогенеза ОКР. Среди основных – нарушения в серотонинергической и дофаминергической системах мозга [1, 28, 29]. Мы предполагаем, что дофаминергическая система не играет ключевой роли в формировании поведенческого фенотипа в тесте “закапывание шариков” у животных Q31L, поскольку для лечения ОКР посредством воздействия на дофаминергическую систему используют малые дозы антагониста дофамина рисперидона, а у мышей Q31L уже снижен уровень дофамина в прилежащем ядре [17, 30].
Наиболее вероятно, что в нарушении поведения играет существенную роль именно серотонинергическая система. Наиболее распространенным терапевтическим средством для лечения ОКР на данное время являются ингибиторы обратного захвата серотонина [31]. Ранее T.V. Lipina с соавт. показали, что у мышей линии Q31L уровень серотонина в прилежащем ядре существенно ниже, чем у контрольной группы – мышей дикого типа [17]. Следует отметить, что прилежащее ядро является важной мишенью для глубокой стимуляции мозга, так как его дисфункция связана с ключевыми симптомами нескольких основных психических расстройств, включая ОКР [17, 32]. Для проверки этой гипотезы мышам Q31L был введен метаболический предшественник серотонина 5-HTP, который преодолевает гематоэнцефалический барьер и, попадая в мозг, метаболизируется декарбоксилазой ароматических аминокислот с образованием серотонина [20]. В нормальных физиологических условиях этот фермент не насыщен субстратом, поэтому введение 5-HTP приводит к усилению синтеза и повышению уровня серотонина [33, 34]. Тест закапывание шариков после введения препарата показал ослабление поведения, подобного обсессивно-компульсивному, что выражалось в уменьшении количества полностью закопанных шариков, это согласуется со сделанным ранее предположением. Двигательная активность, выраженная длиной пройденного пути, при этом не изменилась, следовательно, мы наблюдали снижение именно компульсивного поведения.
В то же время, поведение самцов L100P в данном тесте не отличалось от такового животных контрольной группы WT, что указывает на отсутствие эффекта замены данной аминокислоты на обсессивно-компульсивное поведение. Эти данные согласуются с полученными ранее, где показано отсутствие изменений на уровне серотонина в исследованных отделах мозга [17].
Мутации в гене Disc1 ассоциированы с развитием шизофрении у людей, одним из аспектов которой зачастую является обсессивно-компульсивное поведение. Результаты, полученные в данной работе, указывают на то, что именно N-терминальная часть гена Disc1 вовлечена в формирование этого аспекта шизофрено-подобного поведения, что согласуется с данными, полученными на большой делеции этого гена [12]. На основе приведенных результатов мышей линии Q31L можно также рассматривать как возможную модель ОКР, которая моделирует не только поведение, но и частично эндофенотип больных ОКР. Кроме того, наши данные указывают на то, что поведение подобное ОКР у мышей линии Q31L, вызвано сниженным уровнем серотонина в прилежащем ядре. Интересно, что именно замена у мышей линии Q31L, но не L100P, вызывает развитие ОКР-подобного фенотипа у животных. Из рис. 1 следует, что при замене глутамина на лейцин в положении 31-й аминокислоты в белке DISC1 нарушается его взаимодействие с рядом белков-партнеров: APP (предшественник амилоида), GSK-3 (гликогенсинтаза-киназа-3), PDE-4B (фосфодиэстераза). Наибольший интерес в данном случае представляет GSK-3, поскольку взаимодействие с APP и PDE-4B может нарушаться и при замене в положении 100-й аминокислоты в белке DISC1 – замене лейцина на пролин у животных L100P, однако ОКР-подобного поведения данное изменение не вызывает. Таким образом, гликогенсинтаза-киназа-3 могла бы стать одной из возможных мишеней для подбора лекарственных препаратов для борьбы с ОКР у людей. Проверка данной гипотезы требует дальнейших исследований.
Список литературы
Aouizerate B., Guehl D., Cuny E., Rougier A., Bioulac B., Tignol J., Burbaud P. Pathophysiology of obsessive–compulsive disorder: a necessary link between phenomenology, neuropsychology, imagery and physiology. Progr. Neurobiol. 72(3): 195–221. 2004.
Bartz J.A., Hollander E. Is obsessive–compulsive disorder an anxiety disorder? Progr. Neuro-psychopharmacol. Biol. Psychiatry. 30(3): 338–352. 2006.
Goddard A.W., Shekhar A., Whiteman A.F., McDougle C.J. Serotoninergic mechanisms in the treatment of obsessive-compulsive disorder. Drug Discov. Today. 13(7–8): 325–332. 2008.
Kessler R.C., Berglund P., Demler O., Jin R., Merikangas K.R., Walters E.E. Lifetime prevalence and age-of-onset distributions of DSM-IV disorders in the National Comorbidity Survey Replication. Arch. Gen. Psychiatry. 62(6): 593–602. 2005.
Pauls D.L., Abramovitch A., Rauch S.L., Geller D.A. Obsessive-compulsive disorder: an integrative genetic and neurobiological perspective. Nat. Rev. Neurosci. 15(6): 410–424. 2014.
Alonso P., Lopez-Sola C., Real E., Segalas C., Menchon J. M. Animal models of obsessive–compulsive disorder: utility and limitations. Neuropsychiatr. Dis. Treat. 11: 1939–1955. 2015.
Fineberg N.A., Gale T.M. Evidence-based pharmacotherapy of obsessive compulsive disorder. Int. J. Neuropsychopharmacol. 8(1): 107–129. 2005.
Millar J.K., Wilson-Annan J.C., Anderson S., Christie S., Taylor M.S., Semple C.A., Devon R.S., St Clair D.M., Muir W.J., Blackwood D.H., Porteous D.J. Disruption of two novel genes by a translocation co-segregating with schizophrenia. Hum. Mol. Genet. 9(9): 1415–1423. 2000.
Chubb J.E., Bradshaw N.J., Soares D.C., Porteous D.J. Millar J.K. The DISC locus in psychiatric illness. Mol. Psychiatry. 13(1): 36–64. 2008.
Brandon N.J., Millar J.K., Korth C., Sive H., Singh K.K., Sawa A. Understanding the role of DISC1 in psychiatric disease and during normal development. J. Neurosci. 29(41): 12768–12775. 2009.
Clapcote S.J., Lipina T.V., Millar K.J., Mackie S., Christie S., Ogawa F., Lerch J.P., Trimble K., Uchiyama M., Sakuraba Y., Kaneda H., Shiroishi T., Houslay M.D., Henkelman R.M., Sled J.G., Gondo Y., Porteous D.J., Roder J.C. Behavioral phenotypes of Disc1 missense mutations in mice. Neuron. 54 (3): 387–402. 2007.
Wulaer B., Nagai T., Sobue A., Itoh N., Kuroda K., Kaibuchi K., Nabeshima T. Yamada, K. Repetitive and compulsive-like behaviors lead to cognitive dysfunction in Disc1∆2–3/∆2–3 mice. Genes, Brain and Behavior. 17(8): e12478. 2018.
Lipina T.V., Niwa M., Jaaro-Peled H., Fletcher P.J., Seeman P., Sawa A., Roder J.C. Enhanced dopamine function in DISC1-L100P mutant mice: implications for schizophrenia. Genes Brain Behav. 9 (7): 777–789. 2010.
Lipina T.V., Kaidanovich-Beilin O., Patel S., Wang M., Clapcote S.J., Liu F., Woodgett J.R., Roder J.C. Genetic and pharmacological evidence for schizophrenia-related Disc1 interaction with GSK-3. Synapse. 65(3): 234–248. 2011.
Lipina T.V., Haque F.N., McGirr A., Boutros P.C., Berger T., Mak T.W., Roder J.C., Wong A.H. Prophylactic valproic acid treatment prevents schizophrenia-related behaviour in Disc1-L100P mutant mice. PloS One. 7(12): e51562. 2012.
Lipina T.V., Zai C., Hlousek D., Roder J.C., Wong A.H. Maternal immune activation during gestation interacts with Disc1 point mutation to exacerbate schizophrenia-related behaviors in mice. J. Neurosci. 33(18): 7654–7666. 2013.
Lipina T.V., Fletcher P.J., Lee F.H., Wong A.H., Roder J.C. Disrupted-in-schizophrenia-1 Gln31Leu polymorphism results in social anhedonia associated with monoaminergic imbalance and reduction of CREB and β-arrestin-1,2 in the nucleus accumbens in a mouse model of depression. Neuropsychopharmacology. 38(3): 423–36. 2013.
Ichimaru Y., Egawa T., Sawa A. 5-HT1A-receptor subtype mediates the effect of fluvoxamine, a selective serotonin reuptake inhibitor, on marble-burying behavior in mice. Jpn. J. Pharmacol. 68(1): 65–70. 1995.
Taylor G.T., Lerch S., Chourbaji S. Marble burying as compulsive behaviors in male and female mice. Acta Neurobiol. Exp. 77(3): 254–260. 2017.
Liu Y., Jiang Y., Si Y., Kim J., Chen Z., Rao Y. Molecular regulation of sexual preference revealed by genetic studies of 5-HT in the brains of male mice. Nature. 472(7341): 95–99. 2011.
Joel D. Current animal models of obsessive compulsive disorder: a critical review. Neuropsychopharmacol. Biol. Psychiatry. 30(3): 374-388. 2006.
Korff S., Harvey B.H. Animal models of obsessive-compulsive disorder: rationale to understanding psychobiology and pharmacology. Psychiatr. Clin. North. Am. 29(2): 371–390. 2006.
Li X., Morrow D., Witkin J.M. Decreases in nestlet shredding of mice by serotonin uptake inhibitors: comparison with marble burying. Life Sci. 78(17): 1933–1939. 2006.
Boulougouris V., Chamberlain S.R., Robbins T.W. Cross-species models of OCD spectrum disorders. Psychiatry Res. 170(1): 15–21. 2009
Londei T., Valentini A.M.V., Leone V.G. Investigative burying by laboratory mice may involve non-functional, compulsive, behavior. Behav. Brain. Res. 94(2): 249–254. 1998.
Thomas A., Burant A., Bui N., Graham D., Yuva-Paylor L.A., Paylor R. Marble burying reflects a repetitive and perseverative behavior more than novelty-induced anxiety. Psychopharmacology (Berl). 204(2): 361–373. 2009.
Sasson Y., Zohar J., Chopra M., Lustig M., Iancu I., Hendler T. Epidemiology of obsessive-compulsive disorder: A world view. J. Clin. Psychiatry. 58(suppl 12): 7–10. 1997.
Westenberg H.G.M., Fineberg N.A., Denys D. Neurobiology of obsessive-compulsive disorder: serotonin and beyond. CNS spectrums. 12(S3): 14–27. 2007.
Rosenberg D.R., Keshavan M.S. Toward a Neurodevelopmental Model of Obsessive Compulsive Disorder. Biol. Psychiatry. 43(9): 623–640. 1998.
da Rocha F.F., Correa H. Is circadian rhythm disruption important in obsessive-compulsive disorder (OCD)? A case of successful augmentation with agomelatine for the treatment of OCD. Clin. Neuropharmacol. 34(4): 139–140. 2011.
Greist J.H., Jefferson J.W. Obsessive-compulsive disorder. Focus. 5(3): 283–298. 2007.
Sesia T., Bulthuis V., Tan S., Lim L.W., Vlamings R., Blokland A., Harry W.M. Steinbusch, Sharp T., Visser-Vandewalle V., Temel Y. Deep brain stimulation of the nucleus accumbens shell increases impulsive behavior and tissue levels of dopamine and serotonin. Exp. Neurology 225(2): 302–309. 2010.
Moir A.T.B., Eccleston D. The effects of precursor loading in the cerebral metabolism of 5-hydroxyindoles. J. Neurochem. 15(10): 1093–1108. 1968.
Okada F., Saito Y., Fujieda T., Yamashita I. Monoamine changes in the brain of rats injected with L-5-hydroxytryptophan. Nature. 238(5363): 355–356. 1972.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


