Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 4, стр. 521-532
Математическая модель секреции АТР вкусовыми клетками типа II
С. С. Колесников *
Институт биофизики клетки РАН
Московская обл., Пущино, Россия
* E-mail: staskolesnikov@yahoo.com
Поступила в редакцию 29.01.2020
После доработки 12.02.2020
Принята к публикации 12.02.2020
Аннотация
Функциональной единицей вкусовой системы млекопитающих является вкусовая почка, включающая гетерогенную популяцию 50–80 различных клеток, в том числе, вкусовые клетки типа I, II и III. Помимо распознавания вкусовых молекул, вкусовые клетки кодируют сенсорную информацию в форме стимул-зависимой секреции афферентного нейротрансмиттера, стимулирующего вкусовой нерв. Афферентная нейропередача во вкусовых клетках типа II имеет много особенностей, ставящих их особняком в ряду экстерорецепторных клеток, функционирующих в сенсорных органах позвоночных. Так, клетки типа II в качестве нейротрансмиттера используют АТР, высвобождаемый через АТР-проницаемые ионные каналы. Хотя вкусовые клетки не имеют аксонов, клетки типа II электрически возбудимы и процесс секреции нейротрансмиттера контролируется потенциалом действия. Нами разработана математическая модель секреции АТР через потенциал-зависимый АТР-проницаемый ионный канал и проанализирована потенциал-зависимость секреции в стационарном случае и при импульсной стимуляции клетки. Выявленные закономерности секреции АТР позволяют прийти к заключению, что по сравнению с регуляцией выброса АТР градуальным рецепторным потенциалом, электрическая возбудимость вкусовых клеток расширяет динамический диапазон воспринимаемых вкусовых стимулов, обеспечивает большую надежность синаптической передачи и придает ей квантовый характер.
Функциональной единицей периферической вкусовой системы млекопитающих является вкусовая почка, формируемая плотно упакованной группой из 50–80 клеток четырех типов, включая вкусовые клетки типа I, II и III и базальные клетки. Эти клетки отличаются морфологически, функционально и на молекулярном уровне. Базальные клетки рассматриваются как прогениторные клетки вкусовой почки, способные дифференцироваться во взрослые вкусовые клетки различных типов. Клетки типа I выполняют преимущественно поддерживающую функцию подобно глиальным клеткам нервной системы [1]. Вкусовые клетки типа II являются основными хемосенсорными клетками вкусовой почки, которые специализируются на распознавании горьких и сладких стимулов и стимулов категории умами (аминокислоты, рибонуклеотиды, пептиды). Клетки типа III детектируют кислые [2] и некоторые соленые стимулы [3].
Вкусовая трансдукция достаточно хорошо детализирована для клеток типа II. Специфическая химическая чувствительность этих вкусовых клеток обеспечивается двумя семействами поверхностных рецепторов T1R и T2R, принадлежащих к суперсемейству GPCR (G-protein-coupled receptor)-рецепторов [4]. Группу T1R образуют три рецепторных белка T1R1–T1R3, которые формируют гетеродимерный рецептор сладких соединений (T1R2/T1R3) и рецептор аминокислот (T1R1/T1R3) [4]. Cемейство T2R включает порядка 30 GPCR-рецепторов, специализирующихся на распознавании горького [4, 5].
Для обеспечения однозначного кодирования вкусовой информации вкусовые клетки типа II формируют функционально непересекающиеся субпопуляции, каждая из которых распознает стимулы только одной вкусовой модальности, т.е. либо горькие, либо сладкие, либо умами [1, 6]. В остальном вкусовая трансдукция в клетках типа II универсальна. Вкусовые GPCR-рецепторы сопряжены специализированными G-белками с фосфолипазой Сβ2 (PLCβ2) [1, 6], которая катализирует гидролиз ключевого регуляторного/сигнального липида PIP2 (phosphatidylinositol (4,5)-bisphosphate), продуцируя тем самым два вторичных медиатора – IP3 (inositol 1,4,5-trisphosphate) и DAG (diacylglycerol) [7]. Роль DAG в физиологии вкусовых клеток неизвестна, а IP3 обеспечивает активацию IP3-рецепторов 3-го типа (IP3R3) [8, 9], являющихся, как и все IP3-рецепторы, внутриклеточными, IP3-активируемыми Са2+ каналами, функционирующими в эндоплазматическом ретикулуме и ответственными за высвобождение депонированного Са2+ [7]. Важным усилительным элементом в клетках типа II являются Са2+ -активируемые катионные каналы TRPM5 [10, 11], которые конвертируют стимул-зависимый выброс депонированного Са2+ в градуальный рецепторный потенциал, деполяризующий клетку. Последний инициирует активацию потенциал-зависимых (ПЗ) Na+ каналов [12] и генерацию серии потенциалов действия (ПД) [13].
Афферентная нейропередача во вкусовых клетках типа II имеет много особенностей, ставящих их особняком в ряду экстерорецепторных клеток, функционирующих в сенсорных органах позвоночных. Так, в ответ на стимуляцию хемосенсорные нейроны главного обонятельного эпителия и вомероназального органа генерируют ПД, которые распространяются по аксонам и вызывают секрецию глутамата по экзоцитозному механизму в гломерулах обонятельной луковицы [14]. Фоторецепторные клетки и волосковые клетки в органе Корти не имеют аксонов, электрически невозбудимы и используют градуальный рецепторный потенциал для контроля входа Са2+ и Са2+-зависимого экзоцитоза афферентного нейротрансмиттера глутамата [15].
Вкусовые клетки типа II, в которых классические пресинаптические структуры отсутствуют, коммуницируют с афферентным вкусовым нервом, используя неканонический и во многом уникальный механизм нейропередачи. В качестве афферентного нейротрансмиттера используется АТР [16], который секретируется Са2+-независимым образом при участии потенциал-зависимых АТФ-проницаемых ионных каналов [17, 18]. Ключевой субъединицей этого АТФ-проницаемого канала является канальный белок CALHM1 [19], функционирующий в комплексе с CALHM3 [20]. На данный момент неясно, какие эволюционные причины предопределили выбор данного механизма афферентной нейропередачи сенсорной информации во вкусовой клетке типа II. В частности, неясна физиологическая целесообразность генерации ПД вкусовыми клетками, поскольку у них нет аксона, а значит нет необходимости дистантной передачи сенсорной информации к ганглиозным нейрональным клеткам.
В настоящей работе представлена модель секреции АТР через АТР-проницаемый ионный канал, которая описывает потенциал-зависимость выброса АТР вкусовыми клетками и объясняет преимущества импульсной секреции, регулируемой ПД, в сравнении с градуальной, управляемой рецепторным потенциалом.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ ИХ ОБСУЖДЕНИЕ
Ионный канал, проницаемый для молекулы АТР, должен иметь водную пору достаточно большого диаметра. Действительно, оценки минимального диаметра поры ионного канала, формируемого канальным белком CALHM1, дали величину 14 Å [21], что соответствует характерной размерности АТР. Поскольку при такой относительно большой поре ионные потоки через этот канал можно считать независимыми, нами было получено следующее транспортное уравнение для нестационарного потока анионов АТР JATP(V, t) (см. приложение):
(1)
${{J}_{{{\text{ATP}}}}}\left( {V,\,\,t} \right) = L{{\left[ {ATP} \right]}_{{in}}}\frac{V}{{{{V}_{0}}}}\,\,\frac{{G\left( {V,\,\,t} \right)}}{{\exp \left( {{V \mathord{\left/ {\vphantom {V {{{V}_{0}}}}} \right. \kern-0em} {{{V}_{0}}}}} \right) - 1}},$СТАЦИОНАРНЫЙ СЛУЧАЙ
Для установившегося потока АТР транспортное уравнение имеет вид:
(2)
${{J}_{{{\text{ATP}}}}}\left( V \right) = L{{\left[ {ATP} \right]}_{{in}}}\frac{V}{{{{V}_{0}}}}\,\,\frac{{{{G}_{{\text{s}}}}\left( V \right)}}{{\exp \left( {{V \mathord{\left/ {\vphantom {V {{{V}_{0}}}}} \right. \kern-0em} {{{V}_{0}}}}} \right) - 1}}.$В стационарном состоянии вероятность открытого состояния как функция мембранного потенциала во многих случаях подчиняется уравнению Больцмана [22]
(3)
${{P}_{{\text{o}}}}(V) = {{{{P}_{{{\text{max}}}}}} \mathord{\left/ {\vphantom {{{{P}_{{{\text{max}}}}}} {(1}}} \right. \kern-0em} {(1}} + {\text{exp}}( - (W - {{QV)} \mathord{\left/ {\vphantom {{QV)} {kT}}} \right. \kern-0em} {kT}})),$(4)
${{G}_{s}}\left( V \right) = {{{{G}_{0}}} \mathord{\left/ {\vphantom {{{{G}_{0}}} {\left( {1 + {\text{exp}}\left( { - {{\left( {V - {{V}_{{\text{g}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {V - {{V}_{{\text{g}}}}} \right)} {{{V}_{{{\text{g}}0}}}}}} \right. \kern-0em} {{{V}_{{{\text{g}}0}}}}}} \right)} \right)}}} \right. \kern-0em} {\left( {1 + {\text{exp}}\left( { - {{\left( {V - {{V}_{{\text{g}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {V - {{V}_{{\text{g}}}}} \right)} {{{V}_{{{\text{g}}0}}}}}} \right. \kern-0em} {{{V}_{{{\text{g}}0}}}}}} \right)} \right)}},$(5)
${{J}_{{{\text{ATP}}}}}\left( V \right) = L{{\left[ {ATP} \right]}_{{in}}}\frac{V}{{{{V}_{0}}}}\,\,\frac{1}{{\exp \left( {\frac{V}{{{{V}_{0}}}}} \right) - 1}}\,\,\frac{{{{G}_{0}}}}{{\exp \left( {\frac{{V - {{V}_{g}}}}{{{{V}_{{g0}}}}}} \right) + 1}}.$В этом выражении множитель, назовем его фактор Гольдмана FG,
(6)
${{F}_{G}} = \frac{V}{{{{V}_{0}}}}\frac{1}{{{\text{exp}}\left( {\frac{V}{{{{V}_{0}}}}} \right) - 1}}$Рис. 1.
Зависимость фактора FG, стационарной АТР-проводимости и потока АТР от потенциала. А – FG(V) рассчитывался по уравнению (6) при V0 = 13 мВ и нормировался на значение фактора при V = –100 мВ (синяя кривая). Стационарная АТР-проводимость Gs(V) рассчитывалась по уравнению (4) и нормировалась на значение проводимости при V = 80 мВ. Черная кривая, полученная при Vg = 31 мВ, Vg0 = 11 мВ, удовлетворительно описывает экспериментальную зависимость (символы). Красная и зеленая кривые генерировались при Vg = 25 мВ и Vg0 = 14 мВ и при Vg = 40 мВ и Vg0 = 9 мВ соответственно. B – Поток АТР, нормированный на максимальное значение, рассчитывался по уравнению (5) при различных Gs(V), показанных в (A). Fig. 1. Factor FG, steady-state ATP-conductance, and АТР efflux as functions of membrane voltage. А – FG(V) was calculated by using Eq. 6 at V0 = 13 mV and normalized on its value at V = –100 мВ (blue curve). The steady-state АТР-conductance Gs(V) was calculated based on Eq.4 and normalized on its value at V = 80 mV. The black curve, which was obtained at Vg = 31 mV, Vg0 = 11 mV, satisfactorily fits the experimental dependence (symbols). The red and green lines were generated at Vg = 25 mV and Vg0 = 14 mV and Vg = 40 mV and Vg0 = 9 mV, respectively. B –АТР efflux normalized on the maximal values was calculated at variable Gs(V) shown in (А) by using Eq. 5.
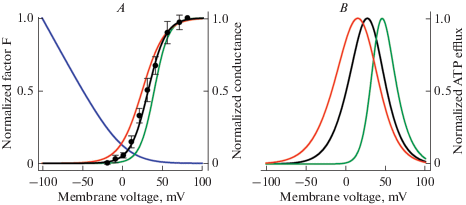
Как проиллюстрировано на рис. 1А, фактор FG (синяя кривая) уменьшается, а стационарная АТР-проводимость Gs увеличивается с ростом потенциала V. При значениях параметров Vg = 31 мВ и Vg0 = 11 произведение FG и Gs дает колоколообразную зависимость, представленную черной кривой на рис.1Б. Следует отметить, что активность рекомбинантного АТР-проницаемого канала CALHM1 сильно зависит от экстраклеточного Са2+, так что в терминах уравнения (4) параметры интегральной проводимости, детерминируемой CALHM1, варьируют от Vg = –76 мВ и Vg0 = 40 мВ в отсутствие Са2+ до Vg = 82 и Vg0 = 16 мВ в присутствии 5 мМ Са2+ [25]. Поскольку в условиях плотно упакованной популяции клеток вкусовой почки электрическая активность клеток может приводить к заметным изменениям концентрации экстраклеточных ионов, включая Са2+, то потенциал-зависимость АТР-проводимости в клетках типа II может заметно варьировать. Мы проиллюстрировали эту возможность, используя транспортную модель в форме уравнения (5) и внося относительно небольшие “Са2+-индуцируемые” отклонения параметров уравнения (4). Так, при Vg = 25 мВ и Vg0 = 14 мВ, а также Vg = 40 мВ и Vg0 = 9 мВ, уравнение (4) дает зависимости, отображенные красной и зеленой кривыми соответственно (рис. 1А). Для этих параметров уравнение (5) дает для потока АТР-зависимости, представленные на рис.1Б красной и зеленой кривыми. Эти зависимости показывают, что, относительно небольшие девиации потенциал-зависимости проводимости за счет крутой зависимости фактора FG от потенциала конвертируются в существенные изменения потенциал-зависимости потока АТР. В частности, для зависимости, иллюстрируемой зеленой кривой, невозможен выброс АТР в области физиологических потенциалов, а значит регуляция секреции этого нейротрансмиттера градуальным рецепторным потенциалом. Эти вычислительные эксперименты показывают, что квази-стационарный поток АТР через АТР-проницаемый канал вряд ли может быть надежным носителем сенсорной информации.
НЕСТАЦИОНАРНЫЙ СЛУЧАЙ
Поскольку в реальности выброс нейротрансмиттера АТР в клетках типа II регулируется стимул-зависимой серией ПД, ниже в рамках транспортного уравнения (1) мы рассмотрим нестационарный поток через АТР-проницаемый канал и проанализируем связь его кинетических параметров и параметров импульсной стимуляции с количеством секретируемого АТР.
Характерной особенностью АТР-проницаемых каналов является их медленная активация в ответ на деполяризацию и медленная деактивация при реполяризации мембраны [18, 25]. Поскольку во вкусовых клетках типа II преимущественно эти каналы ответственны за ПЗ выходящие токи [18, 19], мы на основе экспериментов, проводившихся ранее [18], анализировали аналитически кинетические характеристики АТР-проницаемых каналов, ответственных за выходящие ПЗ токи в клетках типа II в условиях диализа внутриклеточным раствором CsCl (рис. 2). Деполяризация этих клеток, поддерживаемых при –70 мВ, вызывала быстро инактивирующиеся входящие ПЗ Na+ токи и медленно активирующиеся выходящие токи [18] (рис. 2А). Последние удовлетворительно аппроксимировались уравнением (рис. 2A, кружечки):
(7)
$\begin{gathered} I\left( {V,\,\,t} \right) = {{I}_{{\text{l}}}}\left( V \right) + \left( {{{I}_{{\text{s}}}}\left( V \right) - {{I}_{{\text{l}}}}\left( V \right)} \right)\left( {1 - \exp \left( {{{ - t} \mathord{\left/ {\vphantom {{ - t} {{{\tau }_{a}}}}} \right. \kern-0em} {{{\tau }_{a}}}}} \right)} \right), \\ {{I}_{{\text{l}}}}\left( V \right) = {{G}_{{\text{l}}}}\left( {V - {{V}_{{\text{l}}}}} \right), \\ {{I}_{{\text{s}}}}\left( V \right) = {{G}_{{\text{s}}}}\left( V \right)\left( {V - {{V}_{{{\text{VG}}}}}} \right), \\ \end{gathered} $Рис. 2.
Кинетические характеристики выходящих ПЗ токов. A – типичное семейство ПЗ выходящих токов, стимулируемых деполяризацией клетки типа II 100 мс импульсами до –10… 50 мВ. Реполяризация мембраны к –70 мВ инициирует хвостовые токи, обусловленные деактивацией АТР-проницаемых каналов. Черные кружочки соответствуют уравнению (7). B – потенциал-зависимость характерных времен активации и деактивации АТР-проницаемых каналов. Символы – экспериментальные данные из работы (18), толстая и тонкая линии получены из уравнения (10) и (11) соответственно. Fig. 2. Kinetics of outward VG currents A – Typical family of VG outward currents stimulated 100-ms pulses depolarizing a type II cell from –10 to 50 mV. The membrane repolarization to –70 mV initiated inward tail currents resulted from inactivation of ATP-permeable channels. The black circles correspond to Eq. 7. B – Characteristic times of activation and deactivation of ATP-permeable channels versus membrane voltage. The symbols represent experimental data from the work (18); the thin and thick lines correspond to Eq. 10 and Eq. 11, respectively.
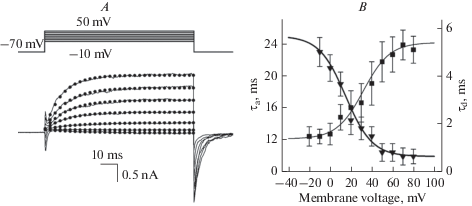
Деактивация ПЗ тока в ответ на реполяризацию была практически моноэкспоненциальной, и хвостовые токи (рис. 2А) хорошо аппроксимировалась уравнением:
(8)
${{I}_{{\text{t}}}}\left( {V,\,\,t} \right) = {{I}_{{\text{l}}}}\left( V \right) + {{I}_{{{\text{tp}}}}}\left( V \right)\exp \left( {{{ - t} \mathord{\left/ {\vphantom {{ - t} {{{\tau }_{{\text{d}}}}}}} \right. \kern-0em} {{{\tau }_{{\text{d}}}}}}} \right),$Полагая физиологически целесообразным отсутствие секреции АТР при потенциале покоя, из уравнений (7) и (8) следует, что при импульсной стимуляции эволюцию АТР-проницаемости во времени можно описать следующим образом:
(9)
$\begin{gathered} \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\text{при}}\,\,\,\,t < 0, \hfill \\ G\left( {V,\,\,t} \right) = {{G}_{{\text{s}}}}\left( V \right)\,\left[ {1 - \exp \left( {{{ - t} \mathord{\left/ {\vphantom {{ - t} {{{\tau }_{{\text{a}}}}}}} \right. \kern-0em} {{{\tau }_{{\text{a}}}}}}} \right)} \right]\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\text{при}}\,\,\,0 \leqslant t \leqslant T, \hfill \\ \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{{G}_{{\text{s}}}}\left( V \right)\,\left[ {1 - \exp \left( {{{ - T} \mathord{\left/ {\vphantom {{ - T} {{{\tau }_{{\text{d}}}}}}} \right. \kern-0em} {{{\tau }_{{\text{d}}}}}}} \right)} \right]\exp \left( {{{\left( {T - t} \right)} \mathord{\left/ {\vphantom {{\left( {T - t} \right)} {{{\tau }_{{\text{d}}}}}}} \right. \kern-0em} {{{\tau }_{{\text{d}}}}}}} \right)\,\,\,\,\,{\text{при}}\,\,\,t > T. \hfill \\ \end{gathered} $Отметим, что характерные времена активации τa и деактивации τd ПЗ выходящего тока зависели от потенциала, и для дальнейшего анализа мы аппроксимировали экспериментальные данные аналитическими зависимостями. Экспериментальная зависимость τa (рис. 2B, треугольники) аппроксимировалась выражением (рис. 2B), толстая линия):
(10)
${{\tau }_{{\text{a}}}}\left( V \right) = {{\tau }_{{{\text{a0}}}}} + {{{{\tau }_{{{\text{a1}}}}}} \mathord{\left/ {\vphantom {{{{\tau }_{{{\text{a1}}}}}} {(1 + {\text{exp}}(\left( {V - {{{{V}_{{\text{a}}}})} \mathord{\left/ {\vphantom {{{{V}_{{\text{a}}}})} {{{V}_{{{\text{a0}}}}}}}} \right. \kern-0em} {{{V}_{{{\text{a0}}}}}}}} \right)}}} \right. \kern-0em} {(1 + {\text{exp}}(\left( {V - {{{{V}_{{\text{a}}}})} \mathord{\left/ {\vphantom {{{{V}_{{\text{a}}}})} {{{V}_{{{\text{a0}}}}}}}} \right. \kern-0em} {{{V}_{{{\text{a0}}}}}}}} \right)}}$(11)
${{\tau }_{{\text{d}}}}\left( V \right) = {{\tau }_{{{\text{d0}}}}} - {{{{\tau }_{{{\text{d1}}}}}} \mathord{\left/ {\vphantom {{{{\tau }_{{{\text{d1}}}}}} {(1 + {\text{exp}}(\left( {V - {{{{V}_{{\text{d}}}})} \mathord{\left/ {\vphantom {{{{V}_{{\text{d}}}})} {{{V}_{{{\text{d0}}}}}}}} \right. \kern-0em} {{{V}_{{{\text{d0}}}}}}}} \right)}}} \right. \kern-0em} {(1 + {\text{exp}}(\left( {V - {{{{V}_{{\text{d}}}})} \mathord{\left/ {\vphantom {{{{V}_{{\text{d}}}})} {{{V}_{{{\text{d0}}}}}}}} \right. \kern-0em} {{{V}_{{{\text{d0}}}}}}}} \right)}}$Используя уравнения 1, 7–11 при указанных параметрах, можно вычислить количество АТР, высвобождаемое клеткой через АТР-проницаемые каналы в ответ на импульсную стимуляцию длительностью T, деполяризующую мембрану от поддерживаемого потенциала Vh до потенциала V. Следует отметить, что в период активации канала в ответ на деполяризацию поток АТР детерминируется потенциалом V. Последний определяет как кинетику активации АТР-проводимости, так и движущую силу для АТР потока, который за время T переносит количество АТР Qa. В период деактивации канала, вызванной реполяризацией мембраны к поддерживаемому потенциалу (рис. 2A), соответствующий поток АТР происходит при постоянном потенциале Vh, высвобождая количество АТР Qd. В результате импульсной стимуляции общее количество выброшенного АТР QATP = Qa + Qd, где
(12)
${{Q}_{{\text{a}}}} = \int\limits_0^T {{{J}_{{{\text{ATP}}}}}} \left( {t,V} \right)dt,\,\,\,\,{{Q}_{{\text{d}}}} = \int\limits_T^\infty {{{J}_{{{\text{ATP}}}}}} \left( {t,V} \right)dt.$Комбинируя уравнения 7–12, можно получить следующие соотношения:
(13)
${{Q}_{{\text{a}}}}\left( {T,\,\,V} \right) = L{{\left[ {ATP} \right]}_{{in}}}\frac{V}{{{{V}_{0}}}}\,\,\frac{1}{{\exp \left( {\frac{V}{{{{V}_{0}}}}} \right) - 1}}\,\,\frac{{{{G}_{0}}}}{{\exp \left( { - \frac{{V - {{V}_{{\text{g}}}}}}{{{{V}_{{{\text{g0}}}}}}}} \right) + 1}}{{K}_{{\text{a}}}}(T),$(14)
${{Q}_{{\text{d}}}}\left( {T,\,\,V} \right) = L{{\left[ {ATP} \right]}_{{in}}}\frac{{{{V}_{{\text{h}}}}}}{{{{V}_{0}}}}\,\,\frac{1}{{\exp \left( {\frac{{{{V}_{{\text{h}}}}}}{{{{V}_{0}}}}} \right) - 1}}\,\,\frac{{{{G}_{0}}}}{{\exp \left( { - \frac{{V - {{V}_{g}}}}{{{{V}_{{g0}}}}}} \right) + 1}}{{K}_{{\text{d}}}}(T).$(15)
${{K}_{{\text{a}}}}\left( T \right) = T - {{\tau }_{{\text{a}}}}\left( {1 - \exp \left( {{{ - T} \mathord{\left/ {\vphantom {{ - T} {{{\tau }_{{\text{a}}}}}}} \right. \kern-0em} {{{\tau }_{{\text{a}}}}}}} \right)} \right),$(16)
${{K}_{{\text{d}}}}\left( T \right) = {{\tau }_{{\text{d}}}}\left( {1 - \exp \left( {{{ - T} \mathord{\left/ {\vphantom {{ - T} {{{\tau }_{{\text{a}}}}}}} \right. \kern-0em} {{{\tau }_{{\text{a}}}}}}} \right)} \right).$Поскольку уравнение (13) с точностью до множителя Ka(T) совпадает с уравнением (5), Qa(T, V) является колоколообразной функцией потенциала V (рис. 3А, B, красные кривые) при любой длительности стимуляции T. В то же время, в выражении для Qa(T, V) переменным по V является лишь множитель, описывающий стационарную АТР-проводимость, и в целом Qd(T, V) является монотонной функцией с насыщением типа изотермы Ленгмюра (рис. 3А, B, синие кривые). Отношение
Рис. 3.
Зависимость количества секретируемого АТР от величины деполяризующего импульса и его длительности. A, B – черные кривые, теоретическое значение QATP = Qa + Qd при деполяризации в течение 2 с (А) и 100 мс (B) импульсом потенциала от –70 мВ до –60… 90 мВ; красная и синяя кривые – Qa и Qd как функции деполяризующего потенциала. Величины Qa и Qd вычислялись с использованием уравнений (13) и (14) соответственно. C, D – экспериментально оцененное [18] количество АТР (символы), выброшенное вкусовой клеткой типа II при данном потенциале при импульсной деполяризации в течение 2 с (C) и 100 мс (D). В (C) темно-серая полоса обозначает область деполяризующих потенциалов, в которой секреция АТР пренебрежимо мала. Fig. 3. ATP release depending on a value and duration of a depolarizing pulse. A, B – Black curves represent QATP = Qa + Qd calculated at 2-s (А) и 100-ms (B) depolarization from –70 mV to –60… 90 мВ mV; the red and blue curves represent Qa and Qd calculated at different membrane voltages by using Eq. 13 and Eq. 14, respectively. C, D – Voltage dependence of experimentally evaluated [18] quantity of ATP (symbols) released by taste cells of the type II upon 2-s (C) and 100-ms (D) pulse depolarization. In (C), the dark-gray strip highlights the range of membrane voltages, wherein ATP secretion is negligible.
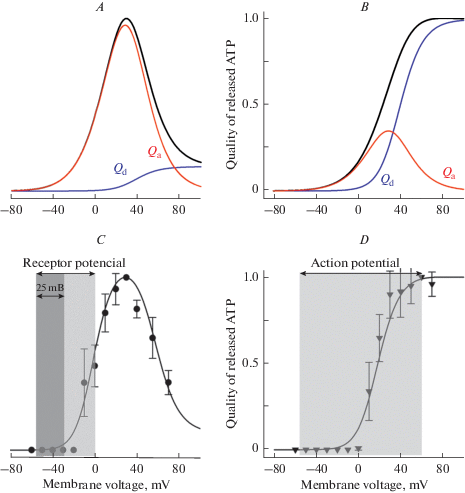
Теперь рассмотрим физиологические последствия потенциал-зависимости секреции АТР при разных стимуляциях. Следует отметить, что потенциал покоя вкусовых клеток оценивался в нескольких работах и полученные величины лежат в диапазоне –65…–45 мВ [26, 27]. Учитывая электрическую возбудимость вкусовых клеток типа II, физиологически целесообразно поддерживать потенциал покоя Vr не выше –50 мВ, чтобы обеспечить достаточно большую фракцию не инактивированных потенциал-зависимых (ПЗ) Na+ каналов. Это также целесообразно, чтобы минимизировать утечку АТР из покоящихся клеток. Поэтому в качестве достаточно правдоподобной оценки примем Vr = –55 мВ. Как следует из анализа выброса АТР в ответ на 2-секундную деполяризацию (рис. 4 А), имитирующей действие рецепторного потенциала, градуальная регуляция секреции АТР создает ряд проблем для афферентной синаптической передачи. Во-первых, рецепторный потенциал во вкусовых клетках типа II генерируется при участии катионных каналов TRPM5, примерно в равной степени проницаемых для ионов Na+ и K+ и поэтому потенциал реверсии генераторного тока близок к нулю [28]. В силу этого рецепторный потенциал может деполяризовать вкусовую клетку не более чем до 0 мВ (рис. 4 А), Потенциал-зависимость секреции АТР такова, что в области градуальных потенциалов –55…–30 мМ она пренебрежимо мала, это означает, что рецепторные потенциалы, вызванные малыми и средними по интенсивности вкусовыми стимулами фактически не могли бы инициировать афферентную передачу сенсорной информации. Кроме того, как уже обсуждалось выше, поток АТР, регулируемый градуальным потенциалом, должен быть весьма вариабельным при незначительных сдвигах активационной кривой АТР-проницаемого канала, вызванных изменениями в микроокружении (рис. 1).
Более целесообразной выглядит стратегия кодирования вкусовой информации посредством импульсной секреции АТР при участии ПД. Действительно, порог генерации ПД во вкусовых клетках лежит в области –45 мВ [18] и поэтому пороговому вкусовому стимулу достаточно сдвинуть мембранный потенциал на величину порядка 10 мВ. Важной особенностью ПД-регулируемой секреции является то, что потенциал-зависимость выброса АТР описывается кривой с насыщением (рис. 4B ), с плато в области характерных величин ПД [18]. Для такой зависимости небольшие сдвиги активационной кривой АТР-проницаемого канала практически не скажутся на секреции АТР. Кроме того, в силу своей кратковременности и универсальности формы, каждый ПД должен инициировать выброс лишь незначительного, но одинакового количества АТР, детерминируя квантовый характер секреции нейротрансмиттера, как это имеет место в классических химических синапсах. В этом случае сенсорная информация кодируется количеством ПД, генерируемых пропорционально интенсивности вкусового стимула.
Таким образом, рассмотренные выше закономерности секреции АТР через АТР-проницаемый ионный канал позволяют прийти к заключению, что по сравнению с регуляцией выброса АТР градуальным рецепторным потенциалом, электрическая возбудимость вкусовых клеток обеспечивает более надежную синаптическую передачу и более широкий динамический диапазон воспринимаемых вкусовых стимулов.
Список литературы
Roper S.D., Chaudhari N. Taste buds: cells, signals and synapses. Nat. Rev. Neurosci. 18: 485–497. 2017.
Huang Y.A., Maruyama Y., Stimac R., Roper S.D. Presynaptic (Type III) cells in mouse taste buds sense sour (acid) taste. J. Physiol. 586: 2903–2912. 2008.
Oka Y., Butnaru M., von Buchholtz L., Ryba N.J., Zuker C.S. High salt recruits aversive taste pathways. Nature. 494: 472–475. 2013.
Chandrashekar J., Hoon M.A., Ryba N.J., Zuker C.S. The receptors and cells for mammalian taste. Nature. 444: 288–294. 2006.
Behrens M., Meyerhof W. Vertebrate bitter taste receptors: Keys for survival in changing environments. J. Agric. Food Chem. 66: 2204−2213. 2018.
Zhang Y., Hoon M.A., Chandrashekar J., Mueller K.L., Cook B., Wu D., Zuker C.S., Ryba N.J.P. Coding of sweet, bitter, and umami tastes: different receptor cells sharing similar signaling pathways. Cell. 112: 293–301. 2003.
Berridge M.J. The inositol trisphosphate/calcium signaling pathway in health and disease. Physiol. Rev. 96: 1261–1296. 2016.
Clapp T.R., Stone L.M., Margolskee R.F., Kinnamon S.C. Immunocytochemical evidence for co-expression of Type III IP3 receptor with signaling components of bitter taste transduction. BMC Neurosci. 2: 6. 2001.
Miyoshi M.A., Abe K., Emori Y. IP(3) receptor type 3 and PLCbeta2 are co-expressed with taste receptors T1R and T2R in rat taste bud cells. Chem. Senses. 26: 259–265. 2001.
Perez C.A., Huang L., Rong M., Kozak J.A., Preuss A.K., Zhang H., Max M., Margolskee R.F. A transient receptor potential channel expressed in taste receptor cells. Nat. Neurosci. 5: 1169–1176. 2002.
Hofmann T., Chubanov V., Gudermann T., Montell C. TRPM5 is a voltage-modulated and Ca2+-activated monovalent selective cation channel. Curr. Biol. 13: 1153–1158. 2003.
Gao N., Lu M., Echeverri F., Laita B., Kalabat D., Williams M.E., Hevezi P., Zlotnik A., Moyer B.D. Voltage-gated sodium channels in taste bud cells. BMC Neurosci. 10: 20. 2009.
Yoshida R., Sanematsu K., Shigemura N., Yasumatsu K., Ninomiya Y. Taste receptor cells responding with action potentials to taste stimuli and their molecular expression of taste related genes. Chem. Senses. 30 (suppl 1): i19–i20. 2005.
Wilson R.I., Mainen Z.F. Early events in olfactory processing. Annu. Rev. Neurosci. 29: 163–201. 2006.
Matthews G., Fuchs P. The diverse roles of ribbon synapses in sensory neurotransmission. Nat. Rev. Neurosci. 11: 812–822. 2010.
Finger T.E., Danilova V., Barrows J., Bartel D.L., Vigers A.J., Stone L., Hellekant G., Kinnamon S.C. ATP signaling is crucial for communication from taste buds to gustatory nerves. Science 310: 1495–1499. 2005.
Romanov R.A., Rogachevskaja O.A., Bystrova M.F., Jiang P., Margolskee R.F., Kolesnikov S.S. Afferent neurotransmission mediated by hemichannels in mammalian taste cells. EMBO J. 26: 657–667. 2007.
Romanov R.A., Rogachevskaja O.A., Khokhlov A.A., Kolesnikov S.S. Voltage dependence of ATP secretion in mammalian taste cells. J. Gen. Physiol. 132: 731–744. 2008.
Taruno A., Vingtdeux V., Ohmoto M., Ma Z., Dvoryanchikov G., Li A., Adrien L., Zhao H., Leung S., Abernethy M., Koppel J., Davies P., Civan M.M., Chaudhari N., Matsumoto I., Hellekant G., Tordoff M.G., Marambaud P., Foskett J.K. CALHM1 ion channel mediates purinergic neurotransmission of sweet, bitter and umami tastes. Nature. 495: 223–226. 2013.
Ma Z., Taruno A., Ohmoto M., Jyotaki M., Lim J.C., Miyazaki H., Niisato N., Marunaka Y., Lee R.J., Hoff H., Payne R., Demuro A., Parker I., Mitchell C.H., Henao-Mejia J., Tanis J.E., Matsumoto I., Tordoff M.G., Foskett J.K. CALHM3 is essential for rapid ion channel-mediated purinergic neurotransmission of GPCR-mediated tastes. Neuron. 98: 547–561. 2018.
Ma Z., Tanis J.E., Taruno A., Foskett J.K. Calcium homeostasis modulator (CALHM) ion channels. Pflugers Arch. 468: 395–403. 2016.
Hille B. Ion channels of excitable membranes. Sinauer Associates. Sunderland. Massachusetts. USA, 3rd edition. 2001.
Gonzalez D., J.M. Gomez-Hernandez L.C. Barrio. 2007. Molecular basis of voltage dependence of connexin channels: An integrative appraisal. Prog. Biophys. Mol. Biol. 94: 66–106.
Bezanilla F. The voltage sensor in voltage-dependent ion channels. Physiol. Rev. 80: 555–592. 2000.
Ma Z., Siebert A.P., Cheung K.H., Lee R.J., Johnson B., Cohen A.S., Vingtdeux V., Marambaud P., Foskett J.K. Calcium homeostasis modulator 1 (CALHM1) is the pore-forming subunit of an ion channel that mediates extracellular Ca2+ regulation of neuronal excitability. Proc. Natl. Acad. Sci. U S A 109: E1963–E1971. 2012.
Romanov R.A., Rogachevskaja O.A., Bystrova M.F., Kolesnikov S.S. Electrical excitability of taste cells. Mechanisms and possible physiological significance Biochemistry (Moscow). Suppl. Series A: Membrane and Cell Biology. 6: 169–185. 2012.
Ma Z., Saung W.T., Foskett J.K. Action potentials and ion conductances in wild-type and CALHM1-knockout Type II taste cells. J. Neurophysiol. 117: 1865–1876. 2017.
Zhang Z., Zhao Z., Margolskee R., Liman E. The transduction channel TRPM5 is gated by intracellular calcium in taste cells. J. Neurosci. 27: 5777–5786. 2007.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


