Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 6, стр. 720-727
Изменения экспрессии стероидогенного фактора 1 (SF-1) в нейронах вентромедиального ядра гипоталамуса крысы при старении
К. Ю. Моисеев 1, А. А. Спиричев 1, П. А. Вишнякова 1, А. Д. Ноздрачев 2, П. М. Маслюков 1, *
1 Ярославский государственный медицинский университет
Ярославль, Россия
2 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: mpm@ysmu.ru
Поступила в редакцию 15.02.2020
После доработки 06.03.2020
Принята к публикации 03.04.2020
Аннотация
Экспрессия стероидогенного фактора 1 в нейронах вентромедиального ядра гипоталамуса крысы исследовалась при помощи иммуногистохимического метода и вестерн-блоттинга у молодых (2–3 мес.) и старых (2–2.5 г.) крыс самцов и самок. Стероидогенный фактор 1 содержится в подавляющем большинстве нейронов вентромедиального ядра гипоталамуса молодых и старых крыс в дорсомедиальной части ядра. У старых крыс доля иммунореактивных нейронов к стероидогенному фактору 1 в дорсомедиальной части ядра достоверно снижалась с 88 до 68% у самцов и с 82 до 66% у самок. В каждой из возрастных групп не было отмечено достоверных половых различий по числу иммунопозитивных нейронов. Экспрессия стероидогенного фактора 1 достоверно уменьшалась у старых самцов и самок крыс и по данным вестерн-блоттинга. Таким образом, старение связано с изменением нейрохимического состава вентромедиального ядра гипоталамуса, участвующего в регуляции энергетического обмена и полового поведения.
Гипоталамус — филогенетически старый отдел промежуточного мозга, который играет важную роль в поддержании постоянства внутренней среды и обеспечении интеграции функций автономной, эндокринной, соматической систем. Есть предположение об участии гипоталамуса в механизмах старения [1, 2], при этом важная роль отводится средней группе ядер, включая вентромедиальное ядро (ВМЯ) гипоталамуса [2, 3].
ВМЯ известно своим участием в регуляции сексуального и пищевого поведения, хотя оно также регулирует кровяное давление и болевые пути [3–6]. Повреждения в ВМЯ изменяют пищевое поведение и связаны с гиперфагией и развитием ожирения [7]. Внутренние часы ВМЯ играют роль в контроле периферических циркадных ритмов [8].
Считается, что вентролатеральная часть ВМЯ (влВМЯ) в основном отвечает за половое поведение у самок крыс и связана с присутствием нейронов, которые экспрессируют рецепторы эстрогена [9, 10], в то время как дорсомедиальная часть ВМЯ (дмВМЯ) больше связана с регуляцией аппетита [11]. ВМЯ содержит гетерогенные нейрональные популяции, отличающиеся по функциональной идентичности, а также по биохимической идентичности. Разные субпопуляции нейронов в ВМЯ экспрессируют разные нейропептиды, пептидные рецепторы и факторы транскрипции и имеют разные внутренние свойства. ВМЯ также содержит нейроны, которые отвечают на изменения содержания внеклеточной глюкозы [12].
Стероидогенный фактор 1 (SF-1) представляет собой ядерный рецептор, экспрессирующийся в надпочечниках, гонадах, переднем гипофизе и ВМЯ гипоталамуса [13]. SF-1 имеет жизненно важное значение не только для развития ВМЯ, но и для его физиологических функций [14]. У мышей нокаут SF-1 вызывал ожирение и аномальное развитие ВМЯ [15], а у людей мутации SF-1 приводили к ожирению и диабету 2 типа [16].
Целью исследования явилось изучение экспрессии SF1 в ВМЯ гипоталамуса молодых и старых крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проведено на 40 белых крысах самках (n = 20) и самцах (n = 20) линии Вистар в возрасте 2–3 мес. (молодые, n = 20) и 2–2.5 г. (старые, n = 20) с соблюдением “Правил проведения работ с использованием экспериментальных животных” (приказ № 775 от 12.08.1977 г. МЗ СССР) в соответствии с принципами Базельской декларации. После введения летальной дозы уретана (3 г/кг, внутрибрюшинно), животных перфузировали транскардиально раствором стандартного фоcфатно-cолевого буфеpа (PBS; 0.01 М, pH 7.4) (БиолоТ, Россия).
С целью проведения иммуногистохимических исследований, животных (n = 20) затем перфузировали 4%-ным pаcтвоpом паpафоpмальдегида (Sigma, США) на PBS. После перфузии головной мозг извлекали и иссекали участок гипоталамуса, содержащий ВМЯ, согласно координатам атласа мозга крыс [17]. Серии коронарных срезов гипоталамуса толщиной 14 мкм изготовляли на криостате Shandon E (Thermo Scientific, Великобритания). Выявление SF1 проводили с использованием меченых антител: первичные моноклональные мышиные антитела против SF-1, разведение 1 : 150 (Invitrogen, кат. номер 434200, США); вторичные ослиные антитела (Jackson ImmunoResearch Laboratories, США) против мышиного иммуноглобулина G, конъюгированные с флуоресцеин-изотиоцианатом – FITC, флуоресцирующим в зеленой области спектра, разведение 1 : 100. Окраску клеток всей популяции нейронов проводили красителем, флуоресцирующим в красной области спектра, NeuroTrace Red Fluorescent Nissl Stains (Molecular Probes, США) – разведение 1 : 200. После этого срезы отмывали в PBS и заключали в среду для иммунофлуоресценции VectaShield (Vector Laboratories, США). Для исключения неспецифической реакции, часть срезов инкубировали без первичных и/или вторичных антител.
Анализ препаратов проводили на флуоресцентном микроскопе Olympus BX43 (Токио, Япония) с соответствующим набором светофильтров и охлаждаемой цифровой CCD камерой Tucsen TCC 6.1ICE c программным обеспечением ISCapture 3.6 (Китай). Долю SF1-иммунореактивных (ИР) нейронов определяли как их отношение к общему количеству нейронов, выявленных NeuroTrace Fluorescent Nissl Stains, которое принимали за 100%. Анализу подлежали нейроны, срез которых прошел через ядро с видимым ядрышком и с флуоресценцией, превышающей фоновое свечение. Процент ИР нейронов определяли с помощью программы Image J (NIH, США).
Вестерн-блоттинг проводился на 20 крысах, по 5 в каждой группе (самцы, самки, молодые, старые). На вибротоме делались срезы гипоталамуса толщиной 300 мкм. Под стереомикроскопом на срезах вырезались ВМЯ, которые затем гомогенизировали с буфером для лизиса. Каждый лизат ткани разводили в образце буфера (Bio-Rad Laboratories Inc., США) и денатурировали при 95°С в течение 5 мин. Эквивалентное количество образцов были загружены и разделены с помощью электрофореза в полиакриламидном геле и затем перенесены на мембраны ПВДФ передачи (AppliChem, Германия). Мембраны блокировали блокирующим раствором, содержащим 3%-ное обезжиренное сухое молоко (AppliChem, Германия) в TBS-T (0.1% Tween 20, 0.2 мМ Трис, 137 мМ NaCl), в течение 30 мин при комнатной температуре. После промывки TBS-T, мембраны инкубировали с первичными моноклональными мышиными антителами против SF-1, разведение 1 : 500 (Invitrogen, кат. номер 434 200, США) и поликлональными кроличьими антителами против GAPDH (глицеральдегид-3-фосфат-дегидрогеназа), разведение 1 : 2500 (Abcam, Великобритания), при 4°C в течение ночи. После промывки TBS-T мембраны инкубировали с вторичными антителами (козьи HRP-конъюгированные анти-кроличьи и анти-мышиные IgG, (Abcam, Великобритания)) в соотношении 1 : 3000. Иммуноблоты были обнаружены хемилюминесценцией (ECL Prime детектирующий реагент вестерн-блоттинга, BioRad) с гель-документирующей системой Syngene G : BOX Chemi XR5E (Syngene, Великобритания). Хемилюминесцентные сигналы были определены количественно при помощи программного обеспечения Gene Tools Gel Analysis (Syngene, Великобритания), и их оптическая плотность выражалась относительно GAPDH. Маркеры молекулярной массы белков были включены в каждый вестерн-блот-анализ.
Математическая обработка данных и построение графиков выполнено с использованием программы Sigma Plot (Systat Software, США). Все величины представлены как средняя арифметическая ± ошибка среднего (М ± m). Две независимые группы сравнивались с помощью U-критерия Манна–Уитни, три и более с помощью рангового анализа вариаций по Краскелу–Уоллису с последующим парным сравнением групп тестом Манна–Уитни с применением поправки Данна при оценке значения р. За уровень статистической значимости был взят p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты иммуногистохимических исследований показали, что SF-1 содержится в подавляющем большинстве нейронов ВМЯ гипоталамуса молодых и старых крыс самцов и самок в дорсомедиальной части ядра (рис. 1). В влВМЯ обнаруживались лишь отдельные SF-1-ИР нейроны. Одиночные SF1-ИР нейроны располагались и в области между ВМЯ и дугообразным ядром, а также в области дугообразного ядра.
Рис. 1.
Флуоресцентное обзорное микрофото нейронов ВМЯ (красный цвет, окраска NeuroTrace Red Fluorescent Nissl Stains) самки старой крысы, иммунореактивных к SF-1 (зеленый цвет). Головки стрелок указывают на отдельные нейроны, расположенные за пределами ВМЯ. VMHdm – дорсомедиальная, VMHc – центральная, VMHvl – вентролатеральная область ВМЯ в соответствии с атласом мозга крысы [17]. Масштаб – 300 мкм. Fig. 1. Fluorescence observational microphoto of neurons located in the ventromedial hypothalamic (VMH) nucleus (red color, NeuroTrace Red Fluorescent Nissl Stains stain) immunoreactive to SF-1 (green color) of female old rat. The arrowheads point to individual neurons located outside of the VMH. VMHdm is the dorsomedial, VMHc is the central, VMHvl is the ventrolateral region of the VMH in accordance with the atlas of the rat brain [17]. The scale is 300 µm.

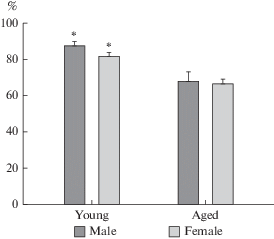
У старых крыс процент SF-1-ИР нейронов дмВМЯ достоверно снижался с 88 ± 2.5 до 68 ± 5.5 у самцов и с 82 ± 2.5 до 66 ± 2.7 у самок (p < 0.05, рис. 2, 3). В каждой из возрастных групп не было отмечено достоверных половых различий по числу SF-1-ИР нейронов (p > 0,05).
Рис. 2.
Микрофотографии нейронов, содержащих SF-1 в дмВМЯ (А, Young) молодых, (B, Aged) старых крыс самок. Двойное мечение. SF-1-негативные нейроны указаны стрелками. Флуоресценция FITC (зеленый, SF-1), NeuroTrace Red Fluorescent Nissl Stains (красный). Масштаб – 50 мкм. Fig. 2. Microphotographs of neurons containing SF-1 in the VMHdm of (A) young, (B) aged female rats. Double labeling. SF-1-negative neurons are indicated by arrows. Fluorescence FITC (green, SF-1), NeuroTrace Red Fluorescent Nissl Stains (red). The scale is 50 µm.
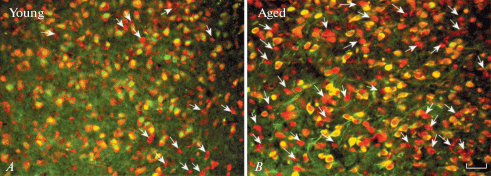
Рис. 3.
Процент SF-1-ИР нейронов в дмВМЯ молодых (Young) и старых (Aged) крыс самцов (male) и самок (female). *p < 0.05; различия достоверны по сравнению со старыми животными. Fig. 3. Percentage of SF-1-IR neurons in the VMHdm of young and aged male and female rats. *p < 0.05; differences are significant compared to old animals.
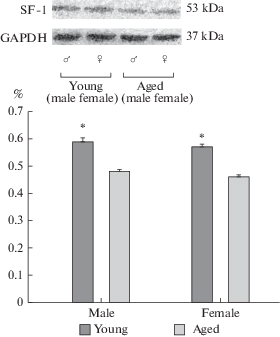
Экспрессия SF-1 в ВМЯ определялась методом вестерн-блоттинга, при этом у всех животных в обоих ядрах выявлялись полосы, соответствующие молекулярной массе белка 55 кДа. Экспрессия белка достоверно уменьшалась у старых самцов крыс с 0.59 ± 0.03 до 0.48 ± 0.01 и у самок с 0.57 ± 0.02 до 0.48 ± 0.01 (p < 0.05, рис. 4) относительно GAPDH. Не было выявлено половых различий по степени экспрессией вышеназванного белка в каждой из возрастных групп (p > 0.05).
Рис. 4.
Экспрессия SF-1 и GAPDH в дмВМЯ молодых (Young), старых (Aged) крыс самцов (male) и самок (female). Данные представлены как отношение к уровню экспрессии GAPDH. Над гистограммой представлены соответствующие иммуноблоты. *p < 0.05; различия достоверны по сравнению со старыми животными. Fig. 4. Expression of SF-1 and GAPDH in the VMHdm of young and aged male and female rats. Data are presented as ratio to GAPDH expression level. The corresponding immunoblots are above the histogram. *p < 0.05; differences are significant compared to old animals.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные нами результаты о селективной экспрессии SF-1 в дмВМЯ и центральной части ВМЯ крыс согласуются с данными литературы, полученными на мышах. В гипоталамусе мышей-самцов SF-1 выявлялся в нейронах на всем протяжении ВМЯ в эмбриональном периоде, но к моменту рождения SF-1 не определялся в влВМЯ [18]. Впервые нами были продемонстрированы и SF-1-ИР нейроны, расположенные за пределами ВМЯ, в частности, одиночные нейроны в области дугообразного ядра. Тем не менее, близость этих нейронов к ВМЯ все же говорит в пользу их общего происхождения и выполняемых функций совместно с основной популяцией дмВМЯ.
Нами не было выявлено половых различий по числу и характеру распределения SF-1-ИР нейронов в ВМЯ. влВМЯ и дмВМЯ структурно и функционально различны. Данные литературы свидетельствуют, что половая специфичность у грызунов характерна для влВМЯ. Нейроны влВМЯ и дмВМЯ экспрессируют сравнительно высокие уровни стероидных рецепторов у самок [19], тогда как рецепторы к лептину и кортикотропин-релизинг-гормону 2 типа (CRFR2) выявляются преимущественно в дмВМЯ [20, 21]. Таким образом, SF-1-содержащие нейроны дмВМЯ играют важную роль в регуляции обмена веществ.
Установленное нами возрастное снижение экспрессии SF-1 в ВМЯ согласуется с ранее полученными нами результатами об изменении нейрохимических особенностей нейронов ВМЯ крысы при старении, в частности процентного содержания нейронов, содержащих синтазу оксида азота, а также кальций-связывающие белки кальбиндин и кальретинин [22]. В геронтологии согласно элевационной теории старения ключевое значение придается возрастному повышению порога чувствительности гипоталамуса к гомеостатическим сигналам [23]. Старение у млекопитающих, в том числе у грызунов и человека, сопровождается увеличением массы тела и количества жировой ткани. ВМЯ гипоталамуса, ответственное за регуляцию обмена веществ и энергии в организме, а также участвующее в контроле периферических циркадных ритмов, предположительно играет важную роль и в процессах старения [24].
Таким образом, полученные результаты подтверждают гипотезу о том, что старение связано с изменением нейрохимического состава вентромедиального ядра гипоталамуса, участвующего в регуляции энергетического обмена и полового поведения. Молекулярные механизмы, приводящие к снижению экспрессии SF-1 в гипоталамусе, требуют дальнейшего исследования.
Список литературы
Zhang Y., Kim M.S., Jia B., Yan J., Zuniga-Hertz J.P., Han C., Cai D. Hypothalamic stem cells control ageing speed partly through exosomal miRNAs. Nature. 548 (7665): 52–57. 2017.
Kim K., Choe H.K. Role of hypothalamus in aging and its underlying cellular mechanisms. Mech. Ageing Dev. 177: 74–79. 2019.
Mobbs C.V., Moreno C.L., Poplawski M. Metabolic mystery: aging, obesity, diabetes, and the ventromedial hypothalamus. Trends Endocrinol. Metab. 24(10): 488–494. 2013.
Watts A.G., Donovan C.M. Sweet talk in the brain: glucosensing, neural networks, and hypoglycemic counterregulation. Front. Neuroendocrinol. 31: 32–43. 2010.
Briski K.P., Mandal S.K., Bheemanapally K., Ibrahim M.M.H. Effects of acute versus recurrent insulin-induced hypoglycemia on ventromedial hypothalamic nucleus metabolic-sensory neuron AMPK activity: Impact of alpha1-adrenergic receptor signaling. Brain Res. Bull. 157: 41–50. 2020.
Kammel L.G, Correa S.M. Selective sexual differentiation of neurone populations may contribute to sex-specific outputs of the ventromedial nucleus of the hypothalamus. J. Neuroendocrinol. 32(1): e12801. 2020.
King B.M. The rise, fall, and resurrection of the ventromedial hypothalamus in the regulation of feeding behavior and body weight. Physiol. Behav. 87: 221–244. 2006.
Orozco-Solis R., Aguilar-Arnal L., Murakami M., Peruquetti R., Ramadori G., Coppari R., Sassone-Corsi P. The Circadian Clock in the Ventromedial Hypothalamus Controls Cyclic Energy Expenditure. Cell Metab. 23(3): 467–478. 2016.
Simerly R.B., Chang C., Muramatsu M., Swanson L.W. Distribution of androgen and estrogen receptor mRNA-containing cells in the rat brain: an in situ hybridization study. J. Comp. Neurol. 294: 76–95. 1990.
Krause W.C., Ingraham H.A. Origins and Functions of the Ventrolateral VMH: A Complex Neuronal Cluster Orchestrating Sex Differences in Metabolism and Behavior. Adv. Exp. Med. Biol. 1043: 199–213. 2017.
Dhillon H., Zigman J.M., Ye C., Lee C.E., McGovern R.A., Tang V., Kenny C.D., Christiansen L.M., White R.D., Edelstein E.A., Coppari R., Balthasar N., Cowley M.A., Chua S. Jr, Elmquist J.K., Lowell B.B. Leptin directly activates SF1 neurons in the VMH, and this action by leptin is required for normal body-weight homeostasis. Neuron. 49(2): 191–203. 2006.
Routh V.H., Hao L., Santiago A.M., Sheng Z., Zhou C. Hypothalamic glucose sensing: making ends meet. Hypothalamic glucose sensing: making ends meet. Front. Syst. Neurosci. 8: 236. 2014.
Parker K.L., Schimmer B.P. Steroidogenic factor 1: a key determinant of endocrine development and function. Endocr. Rev. 18: 361–377. 1997.
Ikeda Y., Luo X., Abbud R., Nilson J.H., Parker K.L. The nuclear receptor steroidogenic factor 1 is essential for the formation of the ventromedial hypothalamic nucleus. Mol. Endocrinol. 9: 478–486. 1995.
Majdic G., Young M., Gomez-Sanchez E., Anderson P., Szczepaniak L.S., Dobbins R.L., McGarry J.D., Parker K.L. Knockout mice lacking steroidogenic factor 1 are a novel genetic model of hypothalamic obesity. Endocrinology 143: 607–614. 2002.
Liu W., Liu M., Fan W., Nawata H., Yanase T. The Gly146Ala variation in human SF-1 gene: its association with insulin resistance and type 2 diabetes in Chinese. Diabetes Res. Clin. Pract. 73: 322–328. 2006.
Paxinos G., Watson C. The Rat Brain in Stereotaxic Coordinates. 5th Edition. Elsevier. Acad. Press. 2005.
Cheung C.C., Kurrasch D.M., Liang J.K., Ingraham H.A. Genetic labeling of steroidogenic factor-1 (SF-1) neurons in mice reveals ventromedial nucleus of the hypothalamus (VMH) circuitry beginning at neurogenesis and development of a separate non-SF-1 neuronal cluster in the ventrolateral VMH. J. Comp. Neurol. 521(6): 1268–1288. 2013.
Wagner C.K., Morrell J.I. Levels of estrogen receptor immunoreactivity are altered in behaviorally-relevant brain regions in female rats during pregnancy. Brain Res. Mol. Brain Res. 42(2): 328–36. 1996.
Chao H., Digruccio M., Chen P., Li C. Type 2 corticotropin-releasing factor receptor in the ventromedial nucleus of hypothalamus is critical in regulating feeding and lipid metabolism in white adipose tissue. Endocrinology. 153: 166–176. 2012.
Schwartz M.W., Seeley R.J., Campfield L.A., Burn P., Baskin D.G. Identification of targets of leptin action in rat hypothalamus. J. Clin. Invest. 98: 1101–1106. 1996.
Порсева В.В., Корзина М.Б., Спиричев А.А., Вишнякова П.А., Аряева Д.А., Ноздрачев А.Д., Маслюков П.М. Изменения иммуногистохимических характеристик нейронов некоторых ядер гипоталамуса при старении. Морфология. 156 (5): 39–43. 2019. [Porseva V.V., Korzina M.B., Spirichev A.A., Vyshnyakova P.A., Aryaeva D.A., Nozdrachev A.D., Masliukov P.M. Changes of the immunohistochemical characteristics of neurons of the middle group of the hypothalamic nuclei during aging. Morfologiia. 156 (5): 39–43. 2019.(In Russ)].
Dilman V.M., Revskoy S.Y., Golubev A.G. Neuroendocrine-ontogenetic mechanism of aging: toward an integrated theory of aging. Int. Rev. Neurobiol. 28: 89–156. 1986.
Escrivá F., Gavete M.L., Fermín Y., Pérez C., Gallardo N., Alvarez C., Andrés A., Ros M., Carrascosa J.M. Effect of age and moderate food restriction on insulin sensitivity in Wistar rats: role of adiposity. J. Endocrinol. 194(1): 131–141. 2007.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


