Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 8, стр. 1025-1040
Уремический синдром вызывает нарушение деформационно-функциональных характеристик эритроцитов у пациентов хронического гемодиализа
Ю. А. Борисов 1, Ю. С. Судницына 2, 3, *, Т. Д. Власов 1, Л. В. Дульнева 1, В. О. Аболмасов 1, И. В. Миндукшев 3, А. В. Смирнов 1
1 Первый Санкт-Петербургский государственный медицинский университет
им. акад. И.П. Павлова
Санкт-Петербург, Россия
2 Центр теоретических проблем физико-химической фармакологии РАН
Москва, Россия
3 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: julia.sudnitsyna@gmail.com
Поступила в редакцию 03.03.2020
После доработки 19.04.2020
Принята к публикации 30.05.2020
Аннотация
Хроническая болезнь почек в терминальной, V стадии (ХБП V), сопровождается структурными и функциональными нарушениями эритроцитов, представляющими угрозу их стабильному функционированию, однако механизмы этих явлений недостаточно изучены. Методом лазерной дифракции было исследовано влияние ХБП V и самого сеанса гемодиализа (ГД) на деформационно-функциональные показатели эритроцитов пациентов c ХБП V. ГД сессия не влияла на деформационные характеристики эритроцитов. Однако было показано двухэтапное ухудшение деформационно-функциональных свойств эритроцитов у пациентов с ХБП V: стадия увеличения хрупкости эритроцитов (повышение Vi, снижение Tmax) у пациентов, находящихся на ХГД до 25 мес. (группа 1), и стадия увеличения ригидности (снижение Vi, увеличение Tmax) у пациентов, находящихся на хроническом гемодиализе (ХГД) от 25 до 250 мес. (группа 2). В междиализном промежутке было выявлено увеличение концентрации уремических токсинов, приводящее к гиперосмоляльности плазмы (до 330 мОсм/кгH2O в группе 1 и до 340 мОсм/кгH2O в группе 2), однако концентрация Na+ и глюкозы оставались в пределах нормы. Таким образом, мы показали отсутствие влияния самой ГД сессии, вместе с тем, было выявлено двухэтапное ухудшение деформационных характеристик эритроцитов пациентов с ХБП V, вызванное уремическим синдромом, которое может приводить к почечной анемии и сердечно-сосудистым осложнениям, характерным для пациентов ХГД.
Хроническая болезнь почек в терминальной, V стадии (ХБП V), характеризуется прогрессирующей утратой почками их функции, сопровождаемой осложнениями и высокой смертностью, в большей степени вызванной сердечно-сосудистыми нарушениями [1]. ХБП V вызывает в организме ряд изменений, нарушающих гомеостаз [2–6]. Одним из таких изменений является нормоцитарная нормохромная анемия, существенно ухудшающая качество жизни пациентов с ХБП V [7–11]. Одной из основных причин возникновения почечной анемии считается сниженная продукция эритропоэтина [11], однако, сокращение жизненного цикла эритроцитов и уремические токсины также могут играть существенную роль [9, 12–17]. Сокращенный жизненный цикл эритроцитов может быть обусловлен как токсическим влиянием окружающей уремической плазмы на эритроциты [13], так и следствием лечения хроническим гемодиализом (ХГД) [9]. Известно, что помимо снижения общего количества эритроцитов в условиях уремии им присущи многочисленные структурные и функциональные нарушения: сниженная антиоксидантная активность [18, 19], повышенная адгезионная способность к эндотелию и прокоагулянтная активность [20, 21], изменения экспрессии белков плазматической мембраны [13]. Все перечисленные факторы представляют непосредственную угрозу стабильному функционированию эритроцитов [1, 8, 17], однако, механизмы развития этих явлений недостаточно изучены.
Структура и целостность цитоплазматической мембраны эритроцита регулирует вязко-эластичные свойства (деформируемость) клетки, обеспечивающие возможность прохождения сквозь микроциркуляторное русло и имеющие решающее значение для нормального функционирования эритроцитов [13, 22, 23]. Снижение деформируемости может приводить к нарушению микроциркуляции, гемолизу внутри капилляров и преждевременной секвестрации эритроцитов ретикуло-эндотелиальной системой, что также может служить причиной анемии [24–28].
Процесс лечения ХГД сопряжен с компрессией эритроцитов в экстракорпоральном круге кровообращения [4], кровь пациента подвергается физическому и химическому воздействию на протяжении длительного времени [29], что может негативно влиять как на продолжительность жизни эритроцитов, так и на их деформационно-функциональные характеристики [30–33]. Эти данные указывают на возможное усугубление почечной анемии, вызванное лечением ХГД.
Таким образом, при лечении анемии, сопряженной с ХБП V, детальное изучение показателей физико-химических свойств эритроцитов и механизмов воздействия на них травмирующих факторов имеет важное значение для отработки клинических методов коррекции состояния пациентов. До сих пор остается неясным, является ли основным повреждающим фактором уремический синдром или же сам сеанс гемодиализа (ГД).
В представленной работе методом лазерной дифракции в модели аммонийного стресса исследовали влияние ХПБ V и сеанса ГД на деформационно-функциональные показатели эритроцитов. Было выявлено, что сам сеанс ГД не приводит к значимым изменениям деформационных показателей эритроцитов у пациентов ХГД, в то время как продолжительность воздействия уремического синдрома и/или лечения ХГД приводит к двухэтапному нарушению деформационно-функциональных свойств эритроцитов. На первой стадии происходит увеличение хрупкости (до 25 мес. лечения ХГД), а на второй – увеличение ригидности эритроцитов (от 25 до 250 мес. лечения ХГД).
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследовали свойства эритроцитов 19 человек без ренальной патологии – доноры (Me 44 года: 30, 49) и 23 пациентов отделения хронического гемодиализа (группа 1 – до 25 месяцев на лечении ХГД, n = 10, Me 49 лет: 36, 61; группа 2 – от 25 до 250 мес. на лечении ХГД, n = 13, Me 53 года: 36, 67) НИИ Нефрологии ПСПбГМУ им. акад. И.П. Павлова до и после ГД сессии. Группа пациентов состояла из больных с ХБП (V стадия), получающих лечение хроническим ГД, из них 11 мужчин и 12 женщин: 5 больных страдали хроническим гломерулонефритом, у 14 отмечался нефросклероз, у двоих – хронический пиелонефрит, у одного больного диагностирован поликистоз и еще у одного – амилоидоз почек. Проведение всех процедур было одобрено этическим комитетом ПСПБГМУ им. акад. И.П. Павлова (протокол № 217 от 17.01.2020) и соответствовало Хельсинкской декларации.
Реактивы. В экспериментах были использованы: изотоническая среда № 1 – HEPES-буфер (в мМ: NaCl 140; KCl 5; Hepes 10; MgCl2 2; D-глюкоза 5; EGTA 2; рН 7.4, осмоляльность 300 мОсм/кгH2O) и изотоническая аммонийная среда № 2 – ${\text{NH}}_{4}^{ + }$-буфер (в мМ: NH4Cl 140; KCl 5; HEPES 10; MgCl2 2; CaCl2 1; D-глюкоза 5; pH 7.4, осмоляльность 300 мОсм/кгH2O) для модели аммонийного стресса. Все реактивы были приобретены в Sigma Aldrich (Германия).
Подготовка суспензии эритроцитов. Кровь доноров и пациентов, после подписания ими письменного согласия, отбирали в вакутейнеры с ЭДТА в качестве антикоагулянта. Эритроциты получали центрифугированием цельной крови (10 мин, 400 g) и ресуспендировали в среде № 1 (RBC = 0.5 × 106 кл/мл, HCT 5%).
Исследование функциональных характеристик эритроцитов. Изменение деформационно-функциональных показателей эритроцитов исследовали методом лазерной дифракции на анализаторе частиц LaSca-T (Биомедицинские системы, СПб), адаптированном для цитологических исследований [34–36]. Изменение начальной скорости увеличения объема клеток (Vi) характеризовали по данным кинетики прямого светорассеяния в диапазоне угла 1°. Для количественного описания кинетики гемолиза использовали параметры Tmax (время достижения максимальной скорости гемолиза) и Vmax (максимальная скорость гемолиза). В основе метода – регистрация рассеянного излучения под разными углами с помощью многоэлементного детектора. По полученной зависимости интенсивности рассеянного излучения от угла рассеяния (индикатриса рассеяния) осуществляется расчет размеров частиц и распределения частиц по размерам, таким образом, в каждый момент времени считывается распределение всей популяции по объемам. Для оценки динамики изменения среднего объема клеток (MCV) использовали алгоритм оценки размеров частиц программного обеспечения LaSca_32 v.1498. Методические приемы, использованные в работе, подробно описаны ранее [34–38].
Модель аммонийного стресса. На основании уникального, присущего лишь эритроцитам (среди клеток крови), свойства при помещении в изотоническую аммонийную среду увеличивать клеточный объем до критических значений и лизировать [39–41], нами ранее был разработан аммонийный стресс-тест для характеристики деформационно-функциональных свойств эритроцитов [37, 38]. Для создания модели аммонийного стресса в 7 мл изотонического ${\text{NH}}_{4}^{ + }$-буфера (t 25°C) вносили 20 мкл суспензии эритроцитов (RBC = 0.5 × 106 кл/мл, HCT = 5%, конечная концентрация 5 × 105 кл/мл), регистрацию показателей светорассеяния проводили до окончания лизиса (рис. 1).
Рис. 1.
Графическое определение скорости начального увеличения объема клеток (Vi), максимальной скорости гемолиза (Vmax) и времени достижения максимальной скорости гемолиза (Tmax) в модели аммонийного стресса в диапазоне угла 1° при 25°С. В 7 мл изотонического HEPES-буфера вносили суспензию эритроцитов (RBC 5 × 105 кл/мл) в качестве контроля, затем заменяли буфер на ${\text{NH}}_{4}^{ + }$-буфер с добавкой 5 × 105 кл/мл эритроцитов. Регистрировали увеличение сигнала светорассеяния, соответствующее увеличению объема клеток, и последующее снижение сигнала, соответствующее гемолизу (пунктирная линия).
Fig. 1. Graphic determination of the initial velocity of cell swelling (Vi), maximal hemolysis rate (Vmax) and time to peak hemolysis (Tmax) in the ammonium stress model (forward scattering at 1°, 25°С). The intensity of scattering light was registered for RBCs (5 × 105 cells/mL) resuspended in 7mL of isotonic HEPES-buffer and taken as control. Then, the buffer was changed to isotonic ${\text{NH}}_{4}^{ + }$-buffer with 5 × 105 cells/mL RBCs, and the intensity of scattering light was also registered. The initial increase of the light intensity with the following decrease in the light intensity corresponding to cell swelling and hemolysis (dashed line), respectively, are shown.

Статистический анализ. Во всех экспериментах данные представлены как Me (25%, 75%). Статистическую значимость результатов определяли с помощью программы SPSS Statistics v.24 непараметрическими методами статистического анализа, используя критерии Манна–Уитни и Краскела–Уоллиса для несвязанных выборок (доноры vs. пациенты группы 1 и 2 до и после ГД; пациенты группы 1 до и после ГД vs. пациенты группы 2 до и после ГД), Уилкоксона для связанных выборок (пациенты до vs. после сеанса ГД). Различия между группами считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Сеанс ГД не вызывает изменения деформационно-функциональных характеристик эритроцитов пациентов ХГД. Поскольку неизвестно, какой фактор вызывает изменение деформационно-функциональных характеристик эритроцитов пациентов ГД, сам сеанс ГД или уремический синдром, были исследованы Vmax, Tmax и Vi пациентов до и после сеанса ГД. Анализ показателей Vmax, Tmax и Vi не выявил значимых отличий до и после сеанса ГД как внутри группы 1, так и внутри группы 2 (рис. 2–5).
Рис. 2.
Сеанс ГД не вызывает значимого изменения Tmax у пациентов с ХБП V. Время достижения максимальной скорости гемолиза (Tmax) до и после сеанса ГД не различается (критерий Вилкоксона для связанных выборок), однако, у доноров Tmax выше, чем у пациентов группы 1 до ГД, при этом этот показатель у группы 1 до ГД значимо ниже, чем у пациентов групы 2 до и после ГД (критерий Манна–Уитни для несвязанных выборок).
Fig. 2. HD session does not affect significantly Tmax in patients with CKD-V. Time to peak hemolysis rate (Tmax) before and after the HD session had no differences (Wilcoxon matched pair test) between the groups. At the same time, Tmax for donors was significantly higher than in patients of Group 1 before HD, and Tmax for Group 2 before and after the HD session surpassed significantly that for Group №1 before HD (Mann–Whitney U-test).

Рис. 3.
Сеанс ГД не вызывает значимого изменения Vmax у пациентов с ХБП V. Максимальная скорость гемолиза (Vmax) до и после ГД сессии не отличалась (критерий Вилкоксона для связанных выборок), однако, у доноров в сравнении с пациентами группы 2 после ГД Vmax достоверно выше (критерий Манна–Уитни для несвязанных выборок).
Fig. 3. HD session does not affect significantly Vmax in patients with CKD-V. Maximal rate of hemolysis (Vmax) did not differ before and after HD session (Wilcoxon matched pair test) whilst Vmax for donors was significantly higher than Vmax for patients of Group 2 after HD (Mann–Whitney U-test).
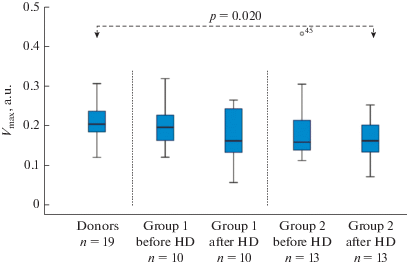
Рис. 4.
Сеанс ГД не вызывает значимого изменения Vi у пациентов с ХБП V. Начальная скорость увеличения объема эритроцитов (Vi) не отличалась до и после ГД сессии (критерий Вилкоксона для связанных выборок), однако, у пациентов группы 1 до ГД и после ГД Vi была достоверно выше, чем у пациентов группы 2, кроме того, Vi доноров была достоверно выше, чем у пациентов группы 1 как до, так и после ГД (критерий Манна–Уитни для несвязанных выборок).
Fig. 4. HD session does not affect significantly Vi in patients with CKD-V. The initial rate of cell swelling (Vi) did not differ before and after HD session (Wilcoxon matched pair test), whilst Vi for patients of Group 1 both before and after HD were higher than those for patients of Group 2. Moreover, Vi was significantly higher in donors than in patients of Group 1 before and after HD session (Mann–Whitney U-test).

Рис. 5.
Сеанс ГД не вызывает значимого изменения MCV у пациентов с ХБП V. А – исходные показатели MCV эритроцитов; B – показатели максимального увеличения MCV в аммонийном стресс-тесте; C – % увеличения объема в аммонийном стресс-тесте по сравнению с исходным MCV. Значимых изменений MCV до и после ГД сессии не выявлено (критерий Вилкоксона для связанных выборок), однако, исходные показатели MCV доноров были достоверно ниже, чем у пациентов группы 1 до ГД (критерий Манна–Уитни для несвязанных выборок).
Fig. 5. HD session does not affect significantly MCV in patients with CKD-V. A – control RBCs MCV values; B – MCV values of maximally swollen RBCs in ammonium stress-test; C – MCV increase of control RBCs in comparison with ammonium stress-test (in %). There were no significant differences in MCV before and after the HD session (Wilcoxon matched pair test), however the control values of MCV in donors were significantly lower than in patients of Group№1 before the HD session (Mann–Whitney U-test).

Уремический синдром, сопровождающий ХБП V, вызывает двухэтапное нарушение деформационно-функциональных свойств эритроцитов. Для выявления влияния ХБП V на деформационно-функциональные показатели эритроцитов исследовали эритроциты пациентов с ХБП V (группа 1 до/после ГД, группа 2 до/после ГД) в сравнении с эритроцитами контрольной группы без ренальной патологии – доноры.
Tmax у доноров – 453.6 с (360, 586) была достоверно выше (p = 0.039), чем у пациентов группы 1 до ГД – 401.4 с (350.2, 427.5), при этом Tmax у пациентов группы 1 до ГД – 401.4 с (350.2, 427.5) была достоверно ниже (p = 0.016), чем у пациентов группы 2 до ГД – 557.6 с (400.7, 702.0) и чем у пациентов группы 2 после ГД – 586 с (402; 721) (рис. 2).
Vmax доноров – 0.202 отн.ед. (0.179, 0.240) была достоверно (p = 0.020) выше, чем у пациентов группы 2 после ГД – 0.160 отн. ед. (0.127, 0.206) (рис. 3). Сравнение с другими выборками не выявило достоверных отличий.
Vi у доноров – 0.518 отн. ед. (0.386, 0.601) была значимо (p = 0.010) ниже, чем у пациентов группы 1 до ГД – 0.611 отн. ед. (0.542, 0.876) и после ГД – 0.633 отн. ед. (0.533, 0.901) (рис. 4). Кроме того, Vi у пациентов группы 1 до ГД – 0.611 отн. ед. (0.542, 0.876) была значимо (p = 0.047) выше, чем у пациентов группы 2 до ГД – 0.453 отн. ед. (0.366, 0.760). После ГД Vi группы 1 – 0.633 отн. ед. (0.533, 0.901) была также значимо выше (p = 0.047), чем у пациентов группы 2 – 0.516 отн. ед. (0.341, 0.608) (рис. 4).
Исследование изменений среднего объема эритроцитов (MCV) не выявило достоверных отличий у пациентов группы 1 и группы 2 до и после сеанса ГД. Однако МCV у доноров – 84.43 фл (81.85, 87.3) был достоверно (p = 0.017) ниже, чем у пациентов группы 1 до ГД – 88.59 фл (85.85, 91.92). В аммонийном стресс-тесте объем эритроцитов в среднем увеличивался на 68% (от 84.43 до 129.15 фл) у доноров, на 72% (от 88.59 до 125.4 фл) у пациентов группы 1 до ГД. В остальных группах не наблюдалось значимых различий.
Показатели клинического и биохимического анализа крови пациентов групп 1 и 2 до и после ГД с референсными значениями нормы представлены в табл. 1.
Таблица 1.
Показатели клинического и биохимического анализа крови пациентов до и после сеанса ГД Table 1. Complete blood count and blood chemistry for patients before and after the HD session
| Возраст, годы Age, years |
Время на ГД, месяцы Time on HD, month |
RBC*1012, кл/л RBC*1012, cells/L |
WBC*109, кл/л WBC*109, cells/L |
HGB, г/л HGB, g/L |
Креатинин, мМ/л Creatinine, mM/L |
Мочевина, мМ/л Urea, mM/L |
Мочевая к-та, мкМ/л Uric acid, uM/L |
Натрий, мМ/л Sodium, mM/L |
Фосфор, мМ/л Phosphorus, mM/L |
Кальций, мМ/л Calcium, mM/L |
Калий, мМ/л Potassium, mM/L |
|
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Группа 1 до ГД (n = 10) Group1 before HD (n = 10) |
49 (36, 61) |
10.5 (5.3, 18.3) |
3.09 (2.87, 3.57) |
7.2 (6.70, 9.47) |
106 (97.75, 113.75) |
0.89 (0.67, 1.01) |
21.85 (17.60, 25.55) |
430 (368, 515) |
138 (137, 145) |
1.99 (1.83, 2.19) |
2.20 (2.03, 2.26) |
4.9 (4.70, 5.78) |
| Группа 1
после ГД (n = 10) Group1 after HD (n = 10) |
0.36** (0.29, 0.39) |
7.9* (7.45, 11.18) |
109* (108, 179) |
140.9 (137.7, 143.5) |
1.02* (0.94, 1.14) |
2.44* (2.35, 2.51) |
3.75** (3.45, 4.10) |
|||||
| Группа 2
до ГД (n = 13) Group 2 before HD (n = 13) |
53 (36, 67) |
105 (46, 134) |
3.2 (2.85, 3.75) |
6.5 (4.1, 8.1) |
99 (91.5, 112.5) |
0.97 (0.89, 1.17) |
29.45$ (22.7, 36.3) |
404 (328.5, 406.5) |
138.8 (137.0, 140.8) |
2.19 (1.72, 2.48) |
2.14 (2.09, 2.44) |
5.7 (4.9, 6.1) |
| Группа 2
после ГД (n = 13) Group 2 after HD (n = 13) |
0.36## (0.30, 0.47) |
8.3## (6.75, 12.00) |
100.5# (70.3, 154.3) |
140# (138.8, 142.7) |
1## (0.75, 1.08) |
2.49## (2.36, 2.61) |
3.7## (3.6, 4.0) |
|||||
| Референсные значения Reference range |
3.8–5.7 | 4.5–11.0 | 117–173 | 0.53–1.15 | 2.1–7.1 | 208–476 | 136–145 | 0.78–1.42 | 2.10–2.55 | 3.5–5.1 |
* p < 0.05, критерий Уилкоксона для связанных выборок; **p < 0.005, критерий Уилкоксона для связанных выборок – группа 1 после ГД по сравнению с группой 1 до ГД;#p < 0.05, критерий Уилкоксона для связанных выборок;##p < 0.005, критерий Уилкоксона для связанных выборок – группа 2 после ГД по сравнению с группой 2 до ГД;$p < 0.05, критерий Краскела–Уоллиса для независимых выборок – группа 2 до ГД по сравнению с группой 1 до ГД. * p < 0.05, Wilcoxon matched pair test; **p < 0.005, Wilcoxon matched pair test – group 1 after HD vs. group 1 before HD;#p < 0.05, Wilcoxon matched pair test; ##p < 0.005, Wilcoxon matched pair test – group 2 after HD vs. group 2 before HD;$p < 0.05, Kruskal–Wallis test – group 2 before HD vs. group 1 before HD.
Анализ этих показателей выявил, что концентрация мочевины в плазме группы 1 до ГД была значимо ниже (p < 0.05) концентрации мочевины в плазме группы 2 до ГД 29. Суммарная концентрация уремических токсинов (мочевины, мочевой кислоты, креатинина) до ГД поднималась до 30 мМ, что значительно увеличивало расчетную осмоляльность плазмы – до 330 (группа 1 до ГД) и до 340 (группа 2 до ГД) мОсм/кгH2O при норме – 275–298 мОсм/кгH2O. У пациентов не отмечалось ни гипернатремии (концентрации Na+ была в пределах нормы – 140 мМ в обеих группах), ни гипергликемии (концентрация глюкозы в группе 1 – 4.45 мМ (4.35, 5.08), в группе 2 – 4.3 мМ (3.90, 4.95)). Сеанс ГД снимал уремический синдром, однако показатель уровня мочевины превышал норму в обеих группах даже после ГД сессии.
Полученные результаты указывают на ухудшение деформационно-функциональных свойств эритроцитов пациентов с ХБП V, при этом ухудшение является двухэтапным: стадия увеличения хрупкости эритроцитов (повышение Vi, снижение Tmax) пациентов, находящихся на ХГД до 25 месяцев, и стадия увеличения ригидности (снижение Vi, увеличение Tmax) у пациентов, находящихся на ХГД от 25 до 250 мес. Кроме того, гиперосмоляльность плазмы, вызванная повышением концентрации уремических токсинов, в совокупности с самим действием уремических токсинов может приводить к почечной анемии, преждевременно запуская апоптоз эритроцитов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Уремический синдром характеризуется задержкой и аккумуляций ряда соединений – уремических токсинов, в норме экскретируемых почками. Уремические токсины показывают широкий спектр физико-химических характеристик, механизмов генерации и патофизиологического воздействия на клеточном и молекулярном уровнях [42, 43]. Пациенты с ХБП V подвержены большему риску сердечно-сосудистых осложнений, который увеличивается с ухудшением функции почек, приводя к высокой смертности [13].
У пациентов с ХБП V диагностируют анемию различной степени выраженности, при этом анемия имеет мультифакторное происхождение и преимущественно возникает вследствие недостаточной продукции эритропоэтина в почках наравне с сокращенным жизненным циклом эритроцитов и хроническим воспалением [44]. В норме срок жизни эритроцита составляет 100–120 дней [45], тогда как жизненный цикл эритроцитов у пациентов ХГД снижен до 73 (38, 116) дней [46]. В условиях уремии жизненный цикл эритроцита может быть снижен не только из-за уремических токсинов (акролеин, метилглиоксаль, индоксил сульфат и др.), но и из-за стрессорных воздействий – осмотических сдвигов, окислительного стресса и энергетического истощения [46].
Cредняя продолжительность жизни эритроцитов может снижаться из-за компрессий и деформаций клеток в экстракорпоральном круге кровообращения при лечении ХГД [12]. Способность эритроцитов к обратимым деформациям – деформируемость имеет решающее значение для микроциркуляции, таким образом, снижение деформируемости связано с многими патологиями [28]. В окружении уремической плазмы эритроциты предрасположены ко многим перестройкам, которые могут оказывать негативное влияние на сердечно-сосудистую систему [13]. Полученные нами результаты дополняют данные [12] и указывают на отсутствие непосредственного влияния сеанса ГД на функциональные параметры эритроцитов.
Уремия оказывает негативное влияние на ряд гематологических параметров, таких как продукция и деструкция эритроцитов, функция тромбоцитов, лимфоцитов и эритроцитов, и активация коагуляционной системы. Уремические токсины могут не только влиять на функцию клеток извне, но и аккумулироваться внутри клетки [1]. В пользу этого говорят результаты исследований, в которых была выявлена способность эритроцитов импортировать и экспортировать (в порядке возрастания): гиппуровую кислоту (HA) < индоксил сульфат (IS) < p-крезил сульфат (pCS) < индол-3-уксусную кислоту (IAA). Импорт и экспорт HA и импорт pCS ингибировались блокатором AE1 (белок полосы 3) – DIDS [43]. Таким образом, в импорте ряда уремических токсинов в эритроцит задействован один из главных структурных белков, основными функциями которого является поддержание структурной целостности мембраны эритроцита и внутриклеточного pHi [37, 47, 48].
Структурная целостность сети цитоскелета – основной фактор, определяющий вязко-эластичные свойства эритроцита и его деформируемость [49]. Изменение/снижение экспрессии мембранных белков может быть причиной изменения вязко-эластичных свойств эритроцита и может воздействовать на молекулярные пути сигналинга в эритроцитах [1, 13]. Методами протеомного анализа было выявлено, что экспрессия белков в цитоплазматической мембране эритроцитов пациентов, страдающих от уремического синдрома, значительно отличается от здоровых людей. В уремических эритроцитах показаны: сниженная экспрессия спектрина, белка полосы 3 (AE1), палладина, актина, стоматина и CD47 (маркер, препятствующий фагоцитозу) [50, 51]; и изменения в экспрессии таких белков, как бета-аддуцин, тропомодулин-1, эзрин, радиксин [1, 5, 52, 53]. Описанные модификации, вероятно, вовлечены в патогенез нарушения способности эритроцитов к обратимым деформациям, которое наблюдается у пациентов с ХБП V [1, 13].
Характеристики, описывающие деформационную способность эритроцитов пациентов с ХБП V и, соответственно, функциональный статус эритроцитов, ранее не были описаны. Применение метода лазерной дифракции позволило охарактеризовать эритроциты с новой стороны – по изменению функционального статуса клеток в условиях ХБП V.
Наши данные, описывающие снижение деформационно-функциональных характеристик эритроцитов, являются серьезным дополнением к биохимическим и протеомным данным, полученным ранее [1, 5, 13, 43, 50–53], и вносят вклад в понимание процессов изменения/снижения функции эритроцитов в условиях ХБП V. Измеряемые параметры являются существенными для характеристики функционального статуса эритроцитов: начальная скорость увеличения объема эритроцитов (Vi) указывает на изменение функции AE1; максимальная скорость гемолиза (Vmax) и время достижения максимальной скорости гемолиза (Tmax) описывают скорость разрушения клеток и, соответственно, являются характеристикой хрупкости клеток. Патологические изменения выявлялись аммонийным стресс-тестом. Сравнение Vi, Vmax, Tmax у пациентов ХГД с нормой (доноры) позволило выявить существенные различия.
Деформационные характеристики, начальная скорость увеличения объема эритроцитов (Vi) и время достижения максимальной скорости гемолиза (Tmax) эритроцитов пациентов ХГД значительно отличались от нормы (группа доноров) (рис. 2, 4). У пациентов с ХБП V, находящихся на ХГД до 25 мес., было выявлено повышение Vi и снижение Tmax по сравнению с группой доноров, что указывает на увеличение хрупкости эритроцитов. У пациентов, находящихся на ХГД от 25 до 250 мес., наблюдалось снижение Vi и увеличение Tmax по сравнению с контролем (рис. 2, 4), указывающие на увеличение ригидности клеток. Полученные результаты показали, что срок лечения программным ХГД и/или подверженность воздействию уремических токсинов приводят к двухстадийному ухудшению деформационно-функциональных свойств эритроцитов пациентов с ХБП V: (i) стадии увеличения хрупкости для пациентов, находящихся на ХГД до 25 мес., и (ii) стадии повышения ригидности для пациентов, находящихся на ХГД от 25 до 250 мес.
В норме в изоосмотической среде эритроциты человека имеют форму двояковогнутого диска, что придает им высокое соотношение поверхности к объему и возможность подвергаться широкому диапазону объемных изменений. В гипоосмотической среде эритроциты трансформируются в стоматоциты и увеличивают свой объем до 74%, в гиперосмотической среде – сжимаются на 34% и трансформируются в эхиноциты [54, 55]. Несмотря на способность подвергаться различным деформациям и находиться в растворах с широким диапазоном осмоляльности, влияние циклического долговременного нахождения в гиперосмолярной среде на транспортные характеристики эритроцитов изучено не в полной мере. Выявленное в наших экспериментах циклическое долговременное (до 48 ч) нахождение в окружении гиперосмоляльной (до 340 мОсм/кгH2O) уремической плазмы также может влиять на изменение деформационно-функциональных показателей эритроцитов.
ХБП V ассоциирована с нарушениями артериального давления, химического состава крови и продукции эритроцитов, что может негативно влиять на функции мозга. Плейоморфные проявления уремии возникают параллельно с ухудшением работы почек и включают снижение когнитивной деятельности, нарушение нейромышечной функции с мышечной слабостью, эпилептиформные припадки [5, 56, 57]. Ранее было показано, что ХБП V сопровождается субкортикальными ишемическими поражениями, атрофией и нарушениями когнитивной деятельности [58, 59]. Однако механизмы воздействия ХБП V на функцию мозга и временная динамика остаются неизученными. Группа Liu [60] подтвердила систематические эффекты расчетной скорости клубочковой фильтрации, уровня гематокрита и артериального давления на мозговой кровоток, вызывающие нарушения регионального мозгового кровотока, что может отражать нарушенное функционирование мозга, обуславливающее нейрокогнитивные симптомы при ХБП V [60]. Описанные нейродегенеративные симптомы, сопутствующие ХБП V, могут быть также обусловлены гипераммониемией [61].
Ранее нами было показано, что эритроциты человека способны транспортировать и импортировать аммоний/аммиак [37, 41]. Эти клетки, по-видимому, играют важную роль в поддержании азотистого баланса в организме. Кроме того, эритроциты также могут являться маркерами патологических нарушений, происходящих в организме, поэтому контроль состояния эритроцитов крайне важен. В связи с этим, качество эритроцитов и их способность выполнять свою функцию приобретают существенное значение в группах риска гипераммониемии: пациенты отделения хронического гемодиализа (нарушение биохимического гомеостаза и постоянное агрессивное химическое и физическое воздействие на клетки), новорожденные с транзиторной гипераммониемией (нарушение функциональных свойств эритроцитов), взрослые с повышенной физической нагрузкой (неспособность организма справиться с избыточным потоком аммония/аммиака). Исследование данной области патофизиологии поможет в улучшении и своевременной коррекции терапевтических подходов, используемых для пациентов групп риска гипераммониемии, таким образом появится возможность улучшить качество диагностики и, что важнее, качество жизни пациентов.
ЗАКЛЮЧЕНИЕ
Анализ деформационно-функциональных параметров эритроцитов пациентов с ХБП V до и после сеанса гемодиализа не выявил значимых отличий, в то время как сравнение показателей Vi, Tmax и Vmax доноров, пациентов, находящихся на лечении ХГД до 25 мес. (группа 1) и пациентов, находящихся на лечении ХГД от 25 до 250 мес. (группа 2), выявило двухэтапное ухудшение деформационно-функциональных свойств эритроцитов пациентов с ХБП V: стадия увеличения хрупкости эритроцитов (повышение Vi, снижение Tmax) пациентов группы 1 и стадия увеличения ригидности (снижение Vi, увеличение Tmax) у пациентов группы 2. Кроме того, в междиализные промежутки концентрация уремических токсинов суммарно повышалась до 30 мМ при неизменной концентрации Na+ 140 мM и глюкозы <5 мМ, тем самым приводя к гиперосмоляльности плазмы (до 330 мОсм/кгH2O в группе 1, до 340 мОсм/кгH2O в группе 2), что также может способствовать ухудшению деформационных характеристик эритроцитов пациентов ХГД.
Полученные результаты указывают на то, что у пациентов отделения хронического гемодиализа уремическая интоксикация и постоянное нахождение эритроцитов в окружении гиперосмолярной плазмы/при воздействии уремических токсинов, а не сам сеанс гемодиализа, вызывают нарушение деформационно-функциональных характеристик эритроцитов, приводящее к анемическому синдрому.
Список литературы
Bonomini M., Pieroni L., Ronci M., Sirolli V., Urbani A. Blood Cell Proteomics in Chronic Kidney Disease. Open Urology and Nephrology. 11: 28–38. 2018.
Liu Z.Z., Bullen A., Li Y., Singh P. Renal oxygenation in the pathophysiology of chronic kidney disease. Front. Physiol. 8: 385. 2017.
Fishbane S., Spinowitz B. Update on anemia in ESRD and earlier stages of CKD: Core Curriculum 2018. Am. J. Kidney. Dis. 71(3): 423–435. 2018.
Bowry S.K., Gatti E. Impact of hemodialysis therapy on anemia of chronic kidney disease: the potential mechanisms. Blood Purif. 32(3): 210–219. 2011.
Scherer A., Günther O.P., Balshaw R.F., Hollander Z., Wilson-McManus J., Ng R., McMaster W.R., McManus B.M., Keown P.A. Alteration of human blood cell transcriptome in uremia. BMC Med. Genomics. 6: 23. 2013.
Sotirakopoulos N., Tsitsios T., Stambolidou M., Athanasiou G, Peiou M, Kokkinou V, Mavromatidis K. The red blood cell deformability in patients suffering from end stage renal failure on hemodialysis or continuous ambulatory peritoneal dialysis. Ren. Fail. 26(2): 179–183. 2004.
Bae S.Y., Jeon J.W., Kim S.H., Baek C.H., Jang J.W., Yang W.S., Kim S.B., Park S.-K., Lee S.K., Kim H. Usefulness of mid-week hemoglobin measurement for anemia management in patients undergoing hemodialysis: a retrospective cohort study. BMC Nephrol. 20(1): 295. 2019.
Fuertinger D.H., Kappel F., Zhang H., Thijssen S., Kotanko P. Prediction of hemoglobin levels in individual hemodialysis patients by means of a mathematical model of erythropoiesis. PLoS One. 13(4): e0195918. 2018.
Bonomini M., Del Vecchio L., Sirolli V., Locatelli F. New Treatment Approaches for the Anemia of CKD. Am. J. Kidney Dis. 67(1): 133–142. 2016.
Cernaro V., Coppolino G., Visconti L., Rivoli L., Lacquaniti A., Santoro D., Buemi A., Loddo S., Buemi M. Erythropoiesis and chronic kidney disease–related anemia: From physiology to new therapeutic advancements. Med. Res. Rev. 39: 427–460. 2019.
Brenner N., Kommalapati A., Ahsan M., Ganguli A. Red cell transfusion in chronic kidney disease in the United States in the current era of erythropoiesis stimulating agents. J. Nephrol. [published online ahead of print, 2019 Nov 28]. 2019.
Luo J.F., Li J.H., Nie J.J., Li P.P., Zhang H.D., Ma Y.J. Effect of hemodialysis on the red blood cell life span in patients with end-stage kidney disease. Ther. Apher. Dial. 23(4): 336–340. 2019.
Bonomini M., Pandolfi A., Sirolli V., Arduini A., Liberato L.D., Di Pietro N. Erythrocyte alterations and increased cardiovascular risk in chronic renal failure. Nephro-Urol. Mon. 9(3): e45866. 2017.
Babitt J.L., Lin H.Y. Mechanisms of anemia in CKD. J. Am. Soc. Nephrol. 23(10): 1631–1634. 2012.
Ertan N.Z., Bozfakioglu S., Ugurel E., Sinan M., Yalcin O. Alterations of erythrocyte rheology and cellular susceptibility in end stage renal disease: Effects of peritoneal dialysis. PLoS One. 12(2): e0171371. 2017.
Kuhn V., Diederich L., Keller T.C.S. 4th, Kramer C.M., Lückstädt W., Panknin C., Suvorava T., Isakson B.E., Kelm M., Cortese-Krott M.M. Red blood cell function and dysfunction: Redox Regulation, Nitric Oxide Metabolism, Anemia. Antioxid. Redox. Signal. 26(13): 718–742. 2017.
Kruse A., Uehlinger D.E., Gotch F., Kotanko P., Levin N.W. Red blood cell lifespan, erythropoiesis and hemoglobin control. Contrib. Nephrol. 161: 247–254. 2008.
Ayala A., Muñoz M.F., Argüelles S. Lipid peroxidation: production, metabolism, and signaling mechanisms of malondialdehyde and 4-hydroxy-2-nonenal. Oxid. Med. Cell Longev. 2014: 360438. 2014
Sindhu R.K., Ehdaie A., Farmand F., Dhaliwal K.K., Nguyen T., Zhan C.D., Roberts C.K., Vaziri N.D. Expression of catalase and glutathione peroxidase in renal insufficiency. Biochim. Biophys. Acta. 1743(1–2): 86–92. 2005.
Gao C., Xie R., Yu C., Ma R., Dong W., Meng H., Zhang Y., Si Y., Zhang Z., Novakovic V., Zhang Y., Kou J., Bi Y., Li B., Xie R., Gilbert G.E., Zhou J., Shi J. Thrombotic Role of Blood and Endothelial Cells in Uremia through Phosphatidylserine Exposure and Microparticle Release. PLoS One. 10(11): e0142835. 2015.
Bonomini M., Sirolli V., Merciaro G., Antidormi T., Di Liberato L., Brummer U., Papponetti M., Cappelli P., Di Gregorio P., Arduini A. Red blood cells may contribute to hypercoagulability in uraemia via enhanced surface exposure of phosphatidylserine. Nephrol. Dial. Transplant. 20(2): 361–366. 2005.
Liu L., Huang S., Xu X., Han J. Study of individual erythrocyte deformability susceptibility to INFeD and ethanol using a microfluidic chip. Sci. Rep. 6: 22929. 2016.
Huisjes R., Bogdanova A., van Solinge W.W., Schiffelers R.M., Kaestner L., van Wijk R. Squeezing for Life - Properties of Red Blood Cell Deformability. Front. Physiol. 9:656. 2018.
Kikuchi Y., Koyama T., Koyama Y., Tozawa S., Arai T., Horimoto M., Kakiuchi Y. Red blood cell deformability in renal failure. Nephron. 30(1): 8–14. 1982.
Pretini V., Koenen M.H., Kaestner L., Fens M.H.A.M., Schiffelers R.M., Bartels M., Van Wijk R. Red Blood Cells: Chasing Interactions. Front. Physiol. 10: 945. 2019.
Barns S., Balanant M.A., Sauret E., Flower R., Saha S., Gu Y. Investigation of red blood cell mechanical properties using AFM indentation and coarse-grained particle method. Biomed. Eng. Online. 16(1): 140. 2017.
Brown C.D., Ghali H.S., Zhao Z., Thomas L.L., Friedman E.A. Association of reduced red blood cell deformability and diabetic nephropathy. Kidney Int. 67(1): 295–300. 2005.
Faustino V., Rodrigues R.O., Pinho D., Costa E., Santos-Silva A., Miranda V., Amaral J.S., Lima R. A Microfluidic Deformability Assessment of Pathological Red Blood Cells Flowing in a Hyperbolic Converging Microchannel. Micromachines (Basel). 10(10): pii: E645. 2019.
Mourikis P., Helten C., Dannenberg L., Hohlfeld T., Stegbauer J., Petzold T., Levkau B., Zeus T., Kelm M., Polzin A. Platelet reactivity in patients with chronic kidney disease and hemodialysis. J. Thromb. Thrombolysis. 49(1): 168–172. 2020.
Dutka P. Guarding against hidden hemolysis during dialysis:an overview. Nephrol. Nurs. J. 35:45. 2008.
Medina A., Ellis C., Levitt M.D. Use of alveolar carbon monoxide measurements to assess red blood cell survival in hemodialysis patients. Am. J. Hematol. 46: 91–4. 1994.
Ahmadmehrabi S., Tang W.H.W. Hemodialysis-induced cardiovascular disease. Semin. Dial. 31(3): 258–267. 2018.
Vos F.E., Schollum J.B., Coulter C.V., Doyle T.C., Duffull S.B., Walker R.J. Red blood cell survival in long-term dialysis patients. Am. J. Kidney Dis. 58(4): 591–598. 2011.
Mindukshev I.V., Senchenkova E.Y., Goncharov N.V., Vivulanets E.V., Krivoshlyk V.V. New methods for studing platelets and red blood cells, based upon the low-angle light scattering technique. In: Handbook of hematology research. Eds. Tondre R., Lebegue C. New York. Nova Biomed. Books. 2010.
Mindukshev I., Gambaryan S., Kehrer L., Schuetz C., Kobsar A., Rukoyatkina N., Nikolaev V. O., Krivchenko A., Watson S. P., Walter U., Geiger J. Low angle light scattering analysis: a novel quantitative method for functional characterization of human and murine platelet receptors. Clin. Chem. Lab. Med. 50. (7): 1253–62. 2012.
Mindukshev I., Kudryavtsev I., Serebriakova M., Trulioff A., Gambaryan S., Sudnitsyna J., Khmelevskoy D., Voitenko N., Avdonin P., Jenkins R., Goncharov N. Flow cytometry and light scattering technique in evaluation of nutraceuticals. In: Neutraceuticals. Efficacy, Safety and Toxicity. Elsevier. 319–332. 2016. ISBN 978-0-12-802147-7
Sudnitsyna J.S., Skvertchinskaya E.A., Dobrylko I.A., Nikitina E.R., Krivchenko A.I., Gambaryan S.P., Mindukshev I.V. Human Erythrocyte Ammonium Transport Is Mediated by Functional Interaction of Ammonium (RhAG) and Anion (AE1) Transporters. Biochemistry (Moscow). Suppl. Ser. A: Membrane and Cell Biology. 10 (4): 301–310. 2016.
Mindukshev I.V., Sudnitsyna J.S., Skverchinskaya E.A., Andreyeva A.Yu., Dobrylko I.A., Senchenkova E.Yu., Krivchenko A.I., Gambaryan S.P. Erythrocytes’ reactions to osmotic, ammonium, and oxidative stress are inhibited under hypoxia. Biochemistry (Moscow). Suppl. Ser. A: Membrane and Cell Biology. 13(4): 352–364. 2019.
Jacobs M.H. Observation of the hemolytic actions of ammonium salts. Am. J. Physiol. 68: 134–135. 1924.
Chernyshev A.V., Tarasov P.A., Semianov K.A., Nekrasov V.M., Hoekstra A.G., Maltsev V.P. Erythrocyte lysis in isotonic solution of ammonium chloride: Theoretical modeling and experimental verification. J. Theor. Biol. 251: 93–107. 2008.
Sudnitsyna J.S., Gambaryan S.P., Krivchenko A.I., Mindukshev I.V. Ammonia/Ammonium Influx in Human Erythrocytes. Biol. Ьembrany. 35(5): 398–402. 2018.
Glassock R.J. Uremic toxins: what are they? An integrated overview of pathobiology and classification. J. Ren. Nutr. 18(1): 2–6. 2008.
Deltombe O., Van Biesen W., Glorieux G., Massy Z., Dhondt A., Eloot S. Exploring Protein Binding of Uremic Toxins in Patients with Different Stages of Chronic Kidney Disease and during Hemodialysis. Toxins (Basel). 7(10): 3933–3946. 2015.
Bonan N.B., Steiner T.M., Kuntsevich V., Virzì G.M., Azevedo M., Nakao L.S., Barreto F.C., Ronco C., Thijssen S., Kotanko P., Pecoits-Filho R., Moreno-Amaral A.N. Uremic Toxicity-Induced Eryptosis and Monocyte Modulation: The Erythrophagocytosis as a Novel Pathway to Renal Anemia. Blood Purif. 41(4): 317–323. 2016.
Bosman G.J. Survival of red blood cells after transfusion: processes and consequences. Front. Physiol. 4: 376. 2013.
Tozoni S.S., Dias G.F., Bohnen G., Grobe N., Pecoits-Filho R., Kotanko P., Moreno-Amaral A.N. Uremia and Hypoxia Independently Induce Eryptosis and Erythrocyte Redox Imbalance. Cell Physiol. Biochemistry. 53: 794–804. 2019.
Swietach P., Tiffert T., Mauritz J.M., Seear R., Esposito A., Kaminski C.F., Lew V.L., Vaughan-Jones R.D. Hydrogen ion dynamics in human red blood cells. J. Physiol. 588(Pt 24): 4995–5014. 2010.
Bruce L.J., Beckmann R., Ribeiro M.L., Peters L.L., Chasis J.A., Delaunay J., Mohandas N., Anstee D.J., Tanner M.J. A band 3-based macrocomplex of integral and peripheral proteins in the RBC membrane. Blood. 101(10): 4180–4188. 2003.
Evans E.A., Hochmuth R.M. Membrane viscoelasticity. Biophys. J. 16(1): 1–11. 1976.
Oldenborg P.A., Zheleznyak A., Fang Y.F., Lagenaur C.F., Gresham H.D., Lindberg F.P. Role of CD47 as a marker of self on red blood cells. Science. 288(5473): 2051–2054. 2000.
Costa E., Rocha S., Rocha-Pereira P., Castro E, Miranda V, do Sameiro Faria M., Loureiro A., Quintanilha A., Belo L., Santos-Silva A. Altered erythrocyte membrane protein composition in chronic kidney disease stage 5 patients under haemodialysis and recombinant human erythropoietin therapy. Blood Purif. 26(3): 267–273. 2008.
Alvarez-Llamas G., Zubiri I., Maroto A.S., de la Cuesta F., Posada-Ayala M., Martin-Lorenzo M., Barderas M.G., Fernandez-Fernandez B., Ramos A., Ortiz A., Vivanco F. A role for the membrane proteome in human chronic kidney disease erythrocytes. Transl. Res. 160(5): 374–383. 2012.
Antonelou M.H., Kriebardis A.G., Velentzas A.D., Kokkalis A.C., Georgakopoulou S.C., Papassideri I.S. Oxidative stress-associated shape transformation and membrane proteome remodeling in erythrocytes of end stage renal disease patients on hemodialysis. J. Proteomics. 74(11): 2441–2452. 2011.
Itano H.A., Keitel H.G., Thompson D. Hyposthenuria in sickle cell anemia: a reversible renal defect. J. Clin. Invest. 35(9): 998–1007. 1956.
Sugie J., Intaglietta M., Sung L.A. Water transport and homeostasis as a major function of erythrocytes. Am. J. Physiol. Heart Circ. Physiol. 314(5): H1098–H1107. 2018.
Moodalbail D.G., Reiser K.A., Detre J.A., Schultz R.T., Herrington J.D., Davatzikos C., Doshi J.J., Erus G., Liu H.S., Radcliffe J., Furth S.L., Hooper S.R. Systematic review of structural and functional neuroimaging findings in children and adults with CKD. Clin. J. Am. Soc. Nephrol. 8(8): 1429–1448. 2013.
Drew D.A., Weiner D.E., Sarnak M.J. Cognitive Impairment in CKD: Pathophysiology, Management, and Prevention. Am. J. Kidney Dis. 74(6): 782–790. 2019.
Hooper S.R., Gerson A.C., Butler R.W., Gipson D.S., Mendley S.R., Lande M.B., Shinnar S., Wentz A., Matheson M., Cox C., Furth S.L., Warady B.A. Neurocognitive functioning of children and adolescents with mild-to-moderate chronic kidney disease. Clin. J. Am. Soc. Nephrol. 6(8): 1824–1830. 2011.
Seidel U.K., Gronewold J., Volsek M., Todica O., Kribben A., Bruck H., Hermann D.M. The prevalence, severity, and association with HbA1c and fibrinogen of cognitive impairment in chronic kidney disease. Kidney Int. 85(3): 693–702. 2014.
Liu H.S., Hartung E.A., Jawad A.F., Ware J.B., Laney N., Port A.M., Gur R.C., Hooper S.R., Radcliffe J., Furth S.L., Detre J.A. Regional Cerebral Blood Flow in Children and Young Adults with Chronic Kidney Disease. Radiology. 288(3): 849–858. 2018.
Gupta S., Fenves A.Z., Hootkins R. The Role of RRT in Hyperammonemic Patients. Clin. J. Am. Soc. Nephrol. 11(10): 1872–1878. 2016.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


