Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 8, стр. 1002-1015
Роль NO и H2S в регуляции тонуса церебральных сосудов при хронической болезни почек
Г. И. Лобов 1, И. Б. Соколова 1, *
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: SokolovaIB@infran.ru
Поступила в редакцию 28.02.2020
После доработки 19.03.2020
Принята к публикации 30.05.2020
Аннотация
Хроническая болезнь почек (ХБП) широко распространена и является фактором риска развития цереброваскулярных заболеваний и неврологических осложнений. К настоящему времени мало известно о процессах, посредством которых ХБП усиливает риск повреждения мозга. В нашем исследовании на модели ХБП у самцов крыс линии Вистар in vivo изучались NO- и H2S-опосредованные изменения клеточных и молекулярных механизмов регуляции тонуса церебральных артерий. ХБП моделировали посредством удаления 5/6 почечной ткани в возрасте 4 мес. Через 4 мес. удаляли часть теменной кости и твердой мозговой оболочки и под микроскопом измеряли диаметр артерий при действии блокаторов и ингибиторов сигнальных путей. У нефрэктомированных крыс реакции церебральных артерий на аппликацию ацетилхолина проявлялись преимущественно в виде констрикции, тогда как в контрольной группе преобладала вазодилатация. Нитропруссид натрия приводил к дилатации артерий, амплитуда которой у крыс с ХБП была значительно меньше по сравнению с контролем. Метиленовый синий и глибенкламид у крыс с ХБП приводили к незначительному ослаблению реакций на ацетилхолин, в то время как у контрольных крыс дилатация артерий значительно уменьшалась. Степень дилатации церебральных артерий на H2S у крыс с ХБП была значительно меньше по сравнению с контролем. Пропаргилглицин вызывал слабые изменения диаметра артерий у крыс с ХБП, в то время как в контроле реакции при применении пропаргилглицина были достоверно значимы. Делается заключение, что ХБП способствует ослаблению эндотелий-зависимых и эндотелий-независимых NO- и H2S-опосредованных дилататорных реакций в церебральных артериях.
В многочисленных исследованиях показано, что хроническая болезнь почек (ХБП), которой страдает 23.4% населения (1–5 стадии) [1], является фактором риска сердечно-сосудистых заболеваний. Пациенты с ХБП имеют в 15–30 раз более высокий риск этих заболеваний, смертность у пациентов с ХБП 5-й стадии от сердечно-сосудистых заболеваний примерно в 15 раз выше, чем в общей популяции [2]. ХБП является независимым фактором риска развития цереброваскулярных заболеваний, особенно заболеваний мелких сосудов, которые могут проявляться в различных вариантах, начиная от микрокровоизлияний и лакунарных инфарктов и заканчивая болезнями белого вещества, когнитивными нарушениями и инсультами. Такая ситуация наблюдается не только у пациентов с терминальной стадией почечной недостаточности, но также у пациентов с легкой или умеренной ХБП [3]. Мета-анализ когортных исследований показывает, что ХБП увеличивает риск инсульта на 71–92% [4]. При ХБП на сосудистую стенку действует множество повреждающих факторов: повышенное артериальное давление, повышенный окислительный стресс, гиперфосфатемия, кальцификация, дисфункция тромбоцитов, хроническое воспаление и уремические токсины [5].
Наряду с нейрогенными и гуморальными механизмами эндотелиальные клетки в сосудистой системе мозга, синтезируя вазоактивные вещества, поддерживают необходимый уровень тонуса артерий и артериол и величину церебрального кровотока [6]. Ацетилхолин, брадикинин, АТФ и АДФ активируют рецепторы, расположенные на эндотелии, который, в свою очередь, генерирует различные сигнальные молекулы, влияющие на цереброваскулярный тонус в нормальных условиях и во время болезни. Эндотелиальные клетки секретируют дилататоры: оксид азота (NO), эндотелиальный гиперполяризующий фактор (EDHF) и простациклин (PGI2). Имеются данные, свидетельствующие о том, что в нормальных условиях в крупных мозговых артериях преобладает высвобождение NO, тогда как EDHF более важен в мелких артериях и артериолах. Производимый эндотелием PGI2 не вносит значительного вклада в цереброваскулярный тонус покоя у здоровых взрослых в нормальных условиях [7].
Известно, что за образование NO из L-аргинина в физиологических условиях ответственна эндотелиальная синтаза оксида азота (еNOS) [8]. В ряде публикаций показано, что в процессе контроля мозгового кровообращения EDHF дополняет NO, продуцируемый эндотелием, в особенности в мелких сосудах [9]. Полагают, что при патологических состояниях активация EDHF может компенсировать дисфункцию в системе NO для поддержания мозгового кровотока [10]. В ряде работ приводятся данные, доказывающие, что в кровеносных сосудах роль EDHF выполняет H2S, который гиперполяризует мембрану сосудистых гладкомышечных клеток артерий и приводит к их дилатации [11].
Эндотелиальные клетки регулируют тонус церебральных сосудов посредством взаимодействия с гладкомышечными клетками [12]. При ХБП комплекс различных патологических факторов инициирует и способствует прогрессированию нарушений структуры и функции гладкомышечных клеток церебральных артерий [13].
Целью данной работы было исследование NO- и H2S-опосредованной регуляции тонуса церебральных артерий у крыс с моделью ХБП.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа проведена на животных из “Коллекции лабораторных млекопитающих разной таксономической принадлежности” Института физиологии им. И.П. Павлова РАН. Исследования проводились в соответствии с регламентом, установленным Директивой 2010/63/EU Европейского парламента и Совета Европейского Союза по охране животных, используемых в научных целях и рекомендациями биоэтической комиссии Института физиологии им. И.П. Павлова РАН.
Эксперименты проведены на крысах-самцах линии Вистар (n = 35). Животных содержали в стандартных условиях вивария при естественном освещении и свободном доступе к воде и пище. В начале эксперимента возраст животных составлял 3 мес., масса 250–280 г; в конце эксперимента – 7 мес. и 400–500 г соответственно. Все хирургические и экспериментальные действия были проведены на животных, наркотизированных внутрибрюшинно (золетил 20 мг/кг, Virbac, Франция); эвтаназия проведена путем введения увеличенной дозы наркотического вещества. Для проведения исследования были сформированы две группы животных: 1 – нефрэктомированные крысы (n = 17, артериальное давление (АД) 159 ± 3.5 мм рт. ст.), 2 – ложнооперированные крысы (n = 18, АД 117 ± 1.5 мм рт. ст.). Распределение животных по группам в начале эксперимента было проведено методом случайной выборки. Нефрэктомию (НЭ) у крыс проводили по описанной ранее методике [14] в 2 этапа: на первом этапе удаляли 2/3 части левой почки, на втором – правую почку полностью. Контролем служили ложнооперированные крысы, которые подвергались аналогичному оперативному вмешательству, но без удаления почечной ткани.
Через 4 мес. после операций проводили прижизненное исследование реакций пиальных артерий сенсомоторной коры головного мозга на воздействие вазоактивных веществ. Для этого у наркотизированных крыс в теменной области черепа высверливали отверстие (S ≈ 1 см2), твердую мозговую оболочку в пределах отверстия удаляли, тем самым открывая поле сенсомоторной коры для дальнейшего исследования. Поверхность мозга непрерывно орошали раствором Кребса (в мМ: NaCl 120.4; KCl 5.9; NaHCО3 15.5; MgCl2 1.2; CaCl2 2.5; NaH2PO4 1.2; глюкоза 11.5; pH 7.4), температура раствора составляла 38°C. На протяжении всего эксперимента контролировали среднее АД инвазивным методом через катетер в бедренной артерии, соединенный с датчиком DTXPlusTM (Argon Critical Care Systems, Сингапур), с помощью компьютерной программы, разработанной в нашей лаборатории. АД животных в течение всего эксперимента оставалось примерно на одном уровне. Температуру тела животного поддерживали на уровне 38°C. Визуализацию пиальных артерий (при общем увеличении оптической системы 160 крат) проводили с помощью оригинальной установки, включающей в себя стереоскопический микроскоп MC-2ZOOM (Микромед, Россия), цветную камеру-видеоокуляр для микроскопа DCM-510 (Scopetek, Китай) и персональный компьютер.
У экспериментальных крыс все исследованные пиальные артерии были разбиты на группы по исходным диаметрам: более 80, 60–80, 40–60, 20–40 и менее 20 мкм. У каждого экспериментального животного было исследовано более 20 сосудов. В начале эксперимента у каждого животного измеряли диаметр пиальных артерий (у нефрэктомированных крыс n = 530; у ложнооперированных n = 455) в стандартных условиях при непрерывном орошении поверхности мозга раствором Кребса. Затем у этих же крыс измеряли диаметр тех же сосудов при аппликации на поверхность мозга раствора различных веществ, активирующих или ингибирующих внутриклеточные сигнальные пути: ацетилхолин (Acetylcholine chloride, Sigma-Aldrich, 0.1 мкМ), метиленовый синий (Methylene blue, Sigma-Aldrich, 10 мкМ), нитропруссид натрия (Sodium nitroprusside, Sigma-Aldrich, 10 мкМ), гидросульфид натрия (Sodium hydrosulfide monohydrate, Sigma-Aldrich, 30 мкМ), L-NAME (N(ω)-nitro-l-arginine methyl ester, Sigma-Aldrich, 100 мкМ), пропаргилглицин (D-Propargylglycine, Sigma-Aldrich, 5 мМ), индометацин (Indomethacin, Sigma-Aldrich, 100 мкМ), глибенкламид (Glybenclamide, Sigma-Aldrich, 10 мкМ), пинацидил (Pinacidil monohydrate, Sigma-Aldrich, 200 мкМ). Применяемые вещества растворяли перед экспериментом в растворе Кребса. Индометацин, глибенкламид и пинацидил предварительно растворяли в диметилсульфоксиде (DMSO) и перед воздействием необходимое количество концентрата добавляли в физиологический раствор. Концентрация DMSO в конечном растворе не превышала 0.1%. Ранее проведенные исследования показали, что DMSO в такой концентрации не оказывает влияния на тонус церебральных артерий.
Проверка выборки на нормальность распределения и математическая обработка полученных данных проведена с использованием пакета статистических программ Microsoft Excel 2003 и программы InStat 3.02 (GraphPad Software Inc., США). Данные представлены в виде среднего арифметического значения и его ошибки. Сравнение средних данных независимых выборок при нормальном характере распределения вариант в совокупности данных (выборке) рассчитывали при помощи t-критерия Стьюдента. При распределении вариант в выборке, отличном от нормального, при сравнении двух групп применяли U-критерий Манна–Уитни. Достоверным уровнем отличий считали вероятность не менее 95% (р < 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
С целью исследования эндотелий-зависимой дилатации пиальных артерий в физиологических условиях в раствор, омывающий поверхность мозга, вводили ацетилхолин, широко применяемый для стимуляции синтазы NO. У ложнооперированных животных ацетилхолин приводил к дилатации 50–80% пиальных артерий: диаметр крупных артерий (60–80 мкм) увеличился на 8.2 ± 1.3%, мелких (<20 мкм) – на 31.1 ± 2.2%. У нефрэктомированных крыс аппликация ацетилхолина сопровождалась вазоконстрикцией в среднем у 80% исследованных артерий. Максимальное уменьшение размеров наблюдалось в артериях диаметром менее 40 мкм. С целью выяснения возможной роли простаноидов в развитии вазоконстрикции в физиологический раствор добавляли индометацин. Предварительная аппликация индометацина привела к уменьшению констрикторной реакции артерий на ацетилхолин (рис. 1).
Рис. 1.
Изменения диаметра крупных (60–80 мкм) и мелких (<20 мкм) пиальных артерий при действии ацетилхолина. Контроль – ложнооперированные крысы, NE – нефрэктомированнык крысы, L-NAME – ингибитор синтазы NO, Indo – индометацин. Исходный диаметр артерий принят за 100%. * – р < 0.05; # – р < 0.01; & – р < 0.001.
Fig. 1. Changes in the diameter of large (60–80 microns) and small (<20 microns) pial arteries under the action of acetylcholine. Control – false-operated rats, NE – nephrectomized rats, L-NAME – NO-synthase inhibitor, Indo – indomethacin. The initial diameter of the arteries is taken as 100%. * – p < 0.05; # – p < 0.01; & – p < 0.001.
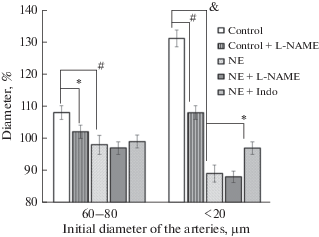
Вторая серия опытов по исследованию эндотелий-зависимой NO-опосредованной дилатации церебральных артерий заключалась в предварительной аппликации на поверхность мозга L-NAME (неселективный ингибитор NO-синтазы) и последующем воздействии ацетилхолина. Действие L-NAME приводило у ложнооперированных животных к выраженной констрикции пиальных артерий, максимальная констрикция наблюдалась в мелких артериях (уменьшение диаметра составило 23 ± 1.6%). Действие ацетилхолина на фоне L-NAME сопровождалось увеличением диаметра (рис. 1). У нефрэктомированных крыс реакции церебральных артерий на применение L-NAME отличались от таковых у контрольных животных, уменьшение диаметра было менее выраженным. Максимальные различия были зарегистрированы в мелких артериях (разница в амплитуде вазоконстрикции крыс контрольной группы и нефрэктомированных крыс составила около 12%). Применение ацетилхолина на фоне действия L-NAME приводило к незначительной констрикции артерий (рис. 1)
В следующей серии экспериментов оценивали эндотелий-независимую вазодилатацию. С этой целью в физиологический раствор добавляли нитропруссид натрия, являющийся донором NO. Нитропруссид натрия оказывал выраженный дилататорный эффект на пиальные артерии крыс. В группе ложнооперированных крыс увеличение диаметра крупных артерий при действии нитропруссида натрия составило 31.4 ± 3.6%, а в мелких – 93.4 ± 7.7%. У нефрэктомированных крыс реакция на нитропруссид натрия была менее выраженной (диаметр крупных артерий увеличился на 19.8 ± 2.1%, а мелких – на 49.6 ± 3.8%).
Затем проводили исследование функциональной активности сигнальной цепочки: растворимая гуанилатциклаза (рГЦ) → циклический гуанозинмонофосфат (цГМФ) → → АТФ-чувствительные К+-каналы в гладкомышечных клетках пиальных артерий крыс. У ложнооперированных животных применение метиленового синего (ингибитор рГЦ) приводило к констрикции всех артерий. Реакции крупных артерий ложнооперированных и нефрэктомированых крыс на метиленовый синий и на ацетилхолин на фоне метиленового синего не имели достоверных отличий. В мелких артериях (диаметром <20 мкм) контрольных животных под влиянием метиленового синего диаметр уменьшился на 19.3%, добавление ацетилхолина привело к уменьшению констрикции. Реакции мелких артерий нафрэктомированных крыс при действии метиленового синего отличались от таковых в группе ложнооперированных – их диаметр уменьшился на 14.2 ± 1.8%. При добавлении ацетилхолина в раствор с метиленовым синим развивалась дополнительная вазконстрикция (рис. 2).
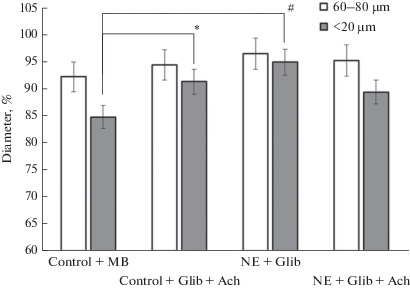
Рис. 2.
Изменения диаметра крупных (60–80 мкм) и мелких (<20 мкм) пиальных артерий при действии метиленового синего (MB) и ацетилхолина (Аch). Контроль – ложнооперированные крысы, NE – нефрэктомированные крысы. Исходный диаметр артерий принят за 100%. * – р < 0.05.
Fig. 2. Changes in the diameter of large (60–80 μm) and small (<20 μm) pial arteries under the action of methylene blue (MB) and acetylcholine (Ach). Control – false-operated rats, NE – nephrectomized rats. The initial diameter of the arteries is taken as 100%. * – p < 0.05.

В следующей серии опытов исследовали роль АТФ-чувствительных К+-каналов гладкомышечных клеток в реализации эффектов ацетилхолина. АТФ-чувствительные К+-каналы блокировали глибенкламидом [15] Применение глибенкламида на протяжении 10 мин привело у контрольных животных к достоверному уменьшению диаметра всех пиальных артерий (на 8–15%). Действие ацетилхолина на фоне глибенкламида у ложнооперированных животных сопровождалось дилатацией всех артерий, однако степень расширения была значительно меньше по сравнению с эффектом ацетилхолина в физиологическом растворе. У нефрэктомированных крыс аппликация глибенкламида сопровождалась слабой вазоконстрикцией. Действие ацетилхолина на фоне глибенкламида приводило к недостоверным изменениям диаметра крупных артерий и уменьшению диаметра мелких артерий.
Второй вариант изучения роли АТФ-чувствительных К+-каналов гладкомышечных клеток церебральных артерий в регуляции их тонуса заключался в применении пинацидила (активатор АТФ-чувствительных К+-каналов). Пинацидил приводил к выраженной дилатации церебральных артерий как ложнооперированных, так и нефрэктомированных крыс. Степень расширения крупных и мелких артерий нефрэктомированных крыс на пинацидил была достоверно ниже по сравнению с таковой у ложнооперированных животных. Максимальная дилатация была зарегистрирована в мелких артериях ложнооперированных крыс – 38.3 ± 2.6% от исходного диаметра.
Рис. 3.
Изменения диаметра крупных (60–80 мкм) и мелких (<20 мкм) пиальных артерий при действии глибенкламида (Glib) и ацетилхолина (Ach) на фоне глибенкламида. Контроль – ложнооперированные крысы, NE –нефрэктомированнык крысы. Исходный диаметр артерий принят за 100%. * – р < 0.05; # – р < 0.01.
Fig. 3. Changes in the diameter of large (60–80 μm) and small (<20 μm) pial arteries under the action of glibenclamide (Glib) and acetylcholine (Ach) against the background of glibenclamide. Control – false-operated rats, NE – nephrectomized rats. The initial diameter of the arteries is taken as 100%. * – p < 0.05; # – p < 0.01.
После NO вторым по важности газотрансмтиттером, регулирующим различные физиологические функции, является сероводород (H2S). В нашем исследовании в качестве донора H2S мы использовали гидросульфит натрия (NaHS) в концентрации 30 мкМ. При растворении в воде NaHS быстро гидролизуется с образованием H2S. Аппликация NaHS на поверхность мозга приводила к дилатации церебральных артерий как в контрольной группе, так и у нефрэктомированных крыс. Увеличение диаметра крупных пиальных артерий при аппликации NaHS составило 9.7 ± 0.7%, а мелких (диаметром менее 20 мкм) – 35.4 ± 2.2%. Аналогичное воздействие на пиальные артерии нефрэктомированных крыс также сопровождались их дилатаций, однако амплитуда дилатации была меньшей во всех группах артерий. Увеличение диаметра крупных артерий составило 3.3 ± 0.4%, увеличение диаметра мелких артерий – 10.2 ± 0.9% (рис. 4).
Рис. 4.
Изменения диаметра крупных (60–80 мкм) и мелких (<20 мкм) пиальных артерий при действии гидросульфида натрия (NaНS) и гидросульфида натрия на фоне L-NAME. Контроль – ложнооперированные крысы, NE –нефрэктомированные крысы. За 100% принят исходный диаметр артерий (первая и третья пара столбиков) и диаметр артерий после воздействия L-NAME (вторая и четвертая пара столбиков). * – р < 0.01.
Fig. 4. Changes in the diameter of large (60–80 μm) and small (<20 μm) pial arteries under the action of sodium hydrosulfide (NaHS) and sodium hydrosulfide against the background of L-NAME. Control – false-operated rats, NE – nephrectomized rats. The initial diameter of the arteries (the first and third pair of columns) and the diameter of the arteries after exposure to L-NAME (the second and fourth pair of columns) are taken as 100%. * – p < 0.01.

В последние годы проведено довольно много исследований, в которых изучалось взаимодействие NO и H2S в различных тканях, в том числе и в сосудах. Мы оценили взаимодействие NO и H2S в церебральных артериях крыс. С этой целью ингибировали продукцию NO посредством аппликации L-NAME. На фоне L-NAME действие H2S у крыс приводило к увеличению диаметра крупных церебральных артерий на 4.1 ± 0.4%, мелких – на 11.4 ± 0.8%. У нефрэктомированных крыс изменения диаметра при действии H2S на фоне L-NAME составили +2.1 ± 0.4% и +5.6 ± 0.6% соответственно (рис. 4).
В заключительной серии опытов исследовали возможность образования эндогенного H2S в стенке церебральных артерий у ложнооперированных и нефрэктомированных крыс. С этой целью в физиологический раствор, апплицируемый на поверхность мозга, добавляли пропаргилглицин (ППГ), являющийся ингибитором цистатион-γ-лиазы (CSE) – фермента, продуцирующего H2S в сосудистой стенке. Действие ППГ не приводило к достоверным изменениям диаметра крупных пиальных артерий контрольных и нефрэктомированных крыс. Уменьшение диаметра мелких артерий под действием ППГ у контрольных животных составило 9.3 ± 1.1%, у нефрэктомированных – 3.7 ± 0.6%.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В регуляции мозгового кровотока принимают участие нейрогенные, гуморальные, а также эндотелий-зависимые и эндотелий-независимые локальные механизмы. Поток крови зависит не только от расширения артериол, непосредственно переходящих в капиллярное русло, но также от расширения более крупных артерий [16]. Имеются экспериментальные данные, доказывающие, что эндотелий церебральных артерий может играть главную роль в проведении дилататорного ответа вдоль сосудистого русла от мелких артерий к более крупным [17]. Синтез и выделение NO эндотелиальными клетками является одним из основных факторов местной регуляции тонуса церебральных артерий и мозгового кровотока [18, 7 ]. В нашем исследовании мы изучали NO- и H2S-опосредованные механизмы регуляции тонуса церебральных артерий у крыс с моделью ХБП. В процессе работы мы измеряли диаметры всех пиальных артерий, но в данной публикации представлены результаты исследования только крупных артерий (диаметром 60–80 мкм), которые выполняют преимущественно функцию коллекторов, и мелких (диаметром менее 20 мкм), осуществляющих резистивную функцию в сложной сосудистой сети мозга [19]. Результаты исследования показали, что ацетилхолин, являющийся классическим активатором эндотелиальной NO-синтазы [20], оказывает преимущественно дилататорный эффект на пиальные артерии крыс контрольной группы, при этом максимальная дилатация была зарегистрирована в мелких артериях (рис. 1). Предварительная аппликация L-NAME значительно уменьшала или полностью подавляла дилататорный ответ артерий на ацетилхолин, это свидетельствует о том, что основным фактором, способствующим дилатации пиальных артерий крыс в физиологических условиях, является NO. У нефрэктомированных крыс реакция большинства артерий на ацетилхолин проявлялась в виде констрикции. В крупных артериях (82% от исследованных) степень уменьшения диаметра была минимальной и часто недостоверной, в мелких артериях (73% от исследованных) в среднем составляла 11.3 ± 0.8% от исходного диаметра. Также мы показали, что ингибитор NO-синтазы – L-NAME у нефрэктомированных крыс не приводит к достоверным изменениям диаметра. Эти данные свидетельствуют о том, что у нефрэктомированных животных в церебральных артериях происходит ингибирование NO-синтазы.
Отсутствие ацетилхолин-индуцируемой дилатации в большинстве церебральных артерий объясняется ингибированием NO-синтазы, но в этих артериях у нефрэктомированных крыс при действии ацетилхолина была зарегистрирована вазоконстрикция. Механизм констрикции церебральных артерий нефрэктомированных крыс на ацетилхолин пока не изучен. Мы предположили возможное участие метаболитов арахидовой кислоты в активации сокращений гладкомышечных клеток. Мы ингибировали циклооксигеназу индометацином и на фоне индометацина апплицировали ацетилхолин. Предварительное введение индометацина не оказывало значимых эффектов в крупных церебральных артериях нефрэктомированных крыс, а в мелких – приводило к уменьшению амплитуды или подавлению вазонстрикции. Мы предполагаем, что в констрикции мелких артерий нефрэктомированных крыс при действии ацетилхолина принимают участие простаноиды, обладающие констрикторными свойствами, в частности, 20-НЕТЕ, являющийся мощным вазоконстриктором. Так, при обследовании пациентов с прогрессирующей ХБП было выявлено значительное увеличение концентрации 20-НЕТЕ в различных органах и, в частности, в стенке кровеносных сосудов. Авторы исследования установили, что под влиянием уремических токсинов метаболизм арахидоновой кислоты смещается в пользу CYP4F2, активность которого приводит к образованию избыточного количества 20-НЕТЕ [21].
Применение донора NO – нитропруссида натрия показало, что и в крупных и в мелких артериях развивается выраженная эндотелий-независимая дилатация. При этом диаметр мелких артерий увеличивался в среднем на 93.4 ± 5.2%. У нефрэктомированных крыс дилататорная реакция церебральных артерий на нитропруссид натрия была значительно слабее (увеличение диаметра мелких артерий составило в среднем 47.6 ± 2.7% от исходного уровня). Значительное ослабление дилататорных реакций на экзогенный NO в церебральных артериях нефрэктомированных крыс свидетельствует о нарушениях в сигнальном пути (или в сократительном механизме) в гладкомышечных клетках артерий этих животных. Мы предположили, что в гладкомышечных клетках артерий нефрэктомированных крыс нарушена сигнальная цепочка рГЦ–цГМФ–АТФ-чувствительные К+-каналы (протеинкиназа G).
С целью исследования сигнального пути, активируемого NO в гладкомышечных клетках церебральных артерий (растворимая гуанилатциклаза (рГЦ) → циклический гуанозинмонофосфат (цГМФ) → АТФ-чувствительные К+-каналы), мы применяли метиленовый синий, являющийся ингибитором рГЦ. Действие метиленового синего на церебральные артерии контрольных крыс проявлялось в виде констрикции (диаметр крупных артерий уменьшился на 13.8 ± 1.6%, мелких – на 19.3 ± 1.5%). Применение ацетилхолина на фоне метиленового синего не приводило к значимым изменениям диаметра церебральных артерий ложнооперированных крыс. Реакции крупных и мелких церебральных артерий нефрэктомированных крыс не отличались от реакций артерий ложнооперированных животных. Применение ацетилхолина на фоне метиленового синего в мелких артериях привело к дополнительной констрикции (диаметр уменьшился на 25.8 ± 2.1%). Сравнение данных показывает, что в мелких артериях нефрэктомированных крыс механизмы дилатации ослаблены, преобладает констрикция. Экспериментальное ингибирование одного из механизмов вазодилатации (NO → рГЦ → цГМФ) сопровождается у нефрэктомированных крыс выраженной констрикцией. Это, вероятно, связано с тем, что и другие механизмы вазодилатации (простациклин- и ЭГФ-опосредованные), которые в норме в значительной степени компенсируют дефицит NO [22, 23], функционируют недостаточно эффективно. Об ингибировании механизмов дилатации при уремии свидетельствует также отмеченный выше факт, что ацетилхолин-индуцируемая вазодилатация, выявляемая у контрольных животных в физиологических условиях, сменяется у нерфэктомированных животных на ацетилхолин-индуцируемую вазоконстрикцию.
Мы также исследовали роль АТФ-чувствительных К+-каналов гладкомышечных клеток в дилатации церебральных артерий у контрольных и нефрэктомированных крыс. Было установлено, что аппликация глибенкламида, являющегося блокатором АТФ-чувствительных К+-каналов, сопровождается констрикцией артерий в обеих группах животных, при этом степень сужения у контрольных животных была значительно больше по сравнению с нефрэктомированными. Эти данные показывают, что АТФ-чувствительные К+-каналы гладкомышечных клеток в физиологических условиях принимают участие в снижении тонуса церебральных артерий, по-видимому, будучи активированными спонтанно продуцируемым NO (сигнальная цепочка: NO → рГЦ → цГМФ → АТФ-чувствительные К+-каналы). Ранее при исследовании функций NO в артериях различных органов у разных животных было показано, что у здоровых животных эндотелий постоянно продуцирует NO, высвобождение которого может возрастать при действии различных физических и химических факторов [24, 25]. Накопление уремических токсинов у нефрэктомированных животных приводит к ингибированию NO-синтазы, уменьшению количества продуцируемого ею NO и ослаблению активации АТФ-чувствительных К+-каналов клеток. Также есть основания полагать, что у нефрэктомированных крыс снижена плотность АТФ-чувствительных К+-каналов на мембране гладкомышечных клеток церебральных артерий или их чувствительность к вазоактивным веществам (в наших экспериментах в мелких артериях нефрэктомированных крыс реакция на пинацидил (активатор АТФ-чувствительных К+-каналов) была достоверно меньше по сравнению с реакций артерий контрольных животных). Ранее при исследовании изолированных колец брыжеечных артерий нефрэктомированных крыс также были выявлены нарушения механизмов вазодилатации, которые авторы объясняют действием уремических токсинов на АТФ-чувствительные К+-каналы мембраны гладкомышечных клеток артерий [26].
Исследования последнего десятилетия показывают, что в нормальных условиях в различных тканях животных и человека образуется H2S, который играет важную роль в регуляции деятельности многих систем и органов [27]. В частности, в сердечно-сосудистой системе H2S образуется в гладкомышечных клетках, эндотелиальных клетках сосудов и кардиомиоцитах и обладает антиоксидантными, антиапоптотическими, противовоспалительными и вазоактивными свойствами [28]. Имеются данные о том, что нарушения в образовании и биодоступности H2S является важным показателем повреждения эндотелиальных клеток и эндотелиальной дисфункции [28, 29]. У пациентов с ХБП и у животных с моделью ХБП выявлено снижение концентрации H2S в биологических жидкостях [30, 31]. Добавление доноров сероводорода приводит к повышению сероводорода в плазме крови и повышению активности еNOS, что сопровождается снижением АД и улучшением функции почек [32]. В нашем исследовании мы изучали реакции церебральных артерий контрольных и нефрэктомированных крыс на экзогенный H2S, механизмы его действия на артерии и возможность образования эндогенного H2S в стенке артерий. Мы применяли NaHS в концентрации 30 мкМ, поскольку ранее было показано, что концентрация H2S в плазме крови крыс разных линий составляет 10–46 мкМ [33]. Было установлено, что донор H2S – NaHS приводил к дилатации большинства изученных церебральных артерий. Максимальная дилатация была зарегистрирована в мелких артериях, их диаметр увеличился в среднем на 36.2 ± 1.9%. У нефрэктомированных крыс увеличение диаметра мелких артерий при действии H2S составило 10.2 ± 1.1%.
В последние годы появляется все больше свидетельств того, что H2S и NO не являются независимыми регуляторами, но имеют перекрывающиеся сигнальные пути трансдукции. H2S и NO не только влияют на биосинтез друг друга, но также производят новые виды сигнальных молекул посредством химического взаимодействия [34]. Хорошо известно, что H2S может увеличивать активность eNOS и, следовательно, последующую продукцию NO непосредственно или через сигнальный путь AMPK/Akt. В эндотелиальных клетках H2S увеличивает образование NO в два раза посредством активации eNOS [35]. Есть данные, что H2S может усиливать активность eNOS путем S-сульфгидратации. Известно, что NO вырабатывается только димерами eNOS. H2S способствует образованию димера eNOS для увеличения образования NO. В свою очередь, NO повышает активность и экспрессию CSE, что ведет к усилению выработки Н2S [29, 36] Однако в литературе имеются и другие данные о взаимодействии H2S и NO. Так, при исследовании брыжеечных артерий мышей было показано, что предварительная обработка сосудов H2S приводила к снижению вазорелаксантного эффекта нитропруссида натрия [37]. Примерно такие же результаты были получены при исследовании аорты крыс [38].
Как было отмечено выше, L-NAME приводил к констрикции церебральных артерий. Максимальное уменьшение диаметра наблюдали в мелких артериях. Добавление H2S на фоне действия L-NAME вызывало дилатацию сосудов, амплитуда которой была меньше по сравнению с эффектом H2S в растворе Кребса (рис. 4). Меньший дилататорный эффект H2S на цереребральные артерии при снижении производства NO свидетельствует о том, что часть этого эффекта в физиологических условиях реализуется с участием NO. Ослабление дилатации мелких артерий нефрэктомированных крыс при действии H2S можно частично объяснить ингибированием у этих животных eNOS и продукцией меньшего количества NO, который необходим для реализации дилататорного эффекта H2S. Ранее при исследовании эндотелиальных клеток пупочной вены было показано, что H2S стимулирует выработку NO и защищает эндотелиоциты путем индукции сигнального пути Akt/eNOS [39].
В заключительной серии экспериментов мы оценили способность клеток стенки церебральных артерий продуцировать эндогенный H2S. Известно, что основными ферментами, образующими в сосудистой стенке H2S, являются цистатион-γ-лиаза (CSE) и цистатион-β-синтаза (CBS) [40]. В наших опытах мы ингибировали CSE посредством добавления в апплицируемый раствор пропаргилглицина – селективного ингибитора CSE [41]. Было установлено, что пропаргилглицин практически не оказывал влияния на крупные церебральные артерии и приводил к выраженной дилатации мелких артерий у контрольных животных. Уменьшение диаметра мелких артерий у нефрэктомированных крыс было незначительным и часто недостоверным. Полученные данные показали наличие в стенке мелких церебральных артерий крыс CSE и базальной продукции ею H2S в физиологических условиях. Уремия, характерная для нефрэктомированных животных, ингибирует продукцию H2S в стенке мелких церебральных артерий крыс.
Мы приходим к заключению, что ХБП способствует ослаблению эндотелий-зависимых и эндотелий-независимых NO- и H2S-опосредованных дилататорных реакций в церебральных артериях.
Список литературы
Imtiaz S., Salman B., Qureshi R., Drohlia M., Saudi A. A review of the epidemiology of chronic kidney disease in Pakistan: A global and regional perspective. J. Kidney Dis. Transpl. 29(6): 1441–1451. 2018.
Muntner P., He J., Hamm L., Loria C., Whelton P. Renal insufficiency and subsequent death resulting from cardiovascular disease in the United States. J. Am. Soc. Nephrol. 13(3): 745–753. 2002.
Chillon J-M., Massy Z., Stengel B. Neurological complications in chronic kidney disease patients. Contrib. Nephrol. 179: 1–6. 2013.
Toyoda K. Cerebrorenal interaction and stroke. Cardiol. Res. Pract. 179: 1–6. 2013.
Lau W., Huisa B., Fisher M. The cerebrovascular-chronic kidney disease connection: perspectives and mechanisms. Transl. Stroke Res. 8(1): 67–76. 2017.
Hainsworth A., Oommen A., Bridges L. Endothelial cells and human cerebral small vessel disease. Brain Pathol. 25(1): 44–50. 2015.
Faraci F. Role of endothelium-derived relaxing factor in cerebral circulation: large arteries vs. microcirculation. Am. J. Physiol. Heart Circ. Physiol. 261: H1038–H1042. 1991.
Atochin D., Demchenko I., Astern J., Boso A., Piantadosi C., Huang P. Contributions of endothelial and neuronal nitric oxide synthases to cerebrovascular responses to hyperoxia. J. Cereb. Blood Flow Metab 23: 1219–1226. 2003.
You J., Johnson T., Marrelli S., Bryan R. Functional heterogeneity of endothelial P2 purinoceptors in the cerebrovascular tree of the rat. Am. J. Physiol. Heart Circ. Physiol. 277: H893–H900. 1999.
Marrelli S. Altered endothelial Ca2+ regulation after ischemia/reperfusion produces potentiated endothelium-derived hyperpolarizing factor-mediated dilations. Stroke. 33: 2285–2291. 2002.
Tang G., Yang G., Jiang B., Ju Y., Wu L., Wang R. H2S is an endothelium-derived hyperpolarizing factor. Antioxid. Redox Signal. 19(14): 1634–1646. 2013.
Hill R., Tong L., Yuan P., Murikinati S., Gupta S., Grutzendler J. Regional blood flow in the normal and ischemic brain is controlled by arteriolar smooth muscle cell Contractility and not by capillary pericytes. Neuron. 87(1): 95–110. 2015.
Alesutan I. Augmentation of phosphate-induced osteo-/chondrogenic transformation of vascular smooth muscle cells by homoarginine. Cardiovasc. Res 110(3): 408–418. 2016.
Смирнов А.В., Добронравов В.А., Неворотин А.И., Хохлов С.Е., Сиповский В.Г., Барабанова В.В., Чефу С.Г., Жлоба А.А., Блашко Э.Л. Гипергомоцистеимия усугубляет повреждения нефрона при экспериментальной хронической почечной недостаточности. Нефрология. 9(4): 67–74. 2005. [Smirnov A.V., Dobronravov V.A., Nevorotin A.I., Khokhlov S.E., Sipovsky V.G., Barabanova V.V., Chefu S.G., Zhloba A.A., Blashko E.L. Hyperhomocyst Greedyemia aggravates nephron damage in experimental chronic renal failure. Nephrology. 9(4): 67–74. 2005. (In Russ)].
Bonev A., Nelson M. ATP-sensitive potassium channels in smooth muscle cells from guinea pig urinary bladder. Am. J. Physiol. 264(5 Pt 1): 1190–1200. 1993.
Segal S. Communication among endothelial and smooth muscle cells coordinates blood flow control during exercise. News Physiol. Sci. 7: 152–156. 1992.
Horiuchi T., Dietrich H., Hongo K., Dacey R. Mechanism of extracellular K+-induced local and conducted responses in cerebral penetrating arterioles. Stroke. 33: 2692–2699. 2002.
Iadecola C. Neurovascular regulation in the normal brain and in Alzheimer’s disease. Nat. Rev. Neurosci. 5: 347–360. 2004.
Avolio A., Kim M., Adji A., Gangoda S., Avadhanam B., Tan I., Butlin M. Crebral haemodynamics: effects of systemic arterial pulsatile function and hypertension. Curr. Hypertens. Rep. 20(3): 20–25. 2018.
Han J., Chen Z., He G. Acetylcholine- and sodium hydrosulfide-induced endothelium-dependent relaxation and hyperpolarization in cerebral vessels of global cerebral ischemia-reperfusion rat. J. Pharmacol. Sci. 121(4): 318–326. 2013.
Afshinnia F., Zeng L., Byun J., Wernisch S., Deo R., Chen J., Hamm L., Miller E., Rhee E., Fischer M., Sharma K., Feldman H., Michailidis G., Pennathur S. Elevated lipoxygenase and cytochrome P450 products predict progression of chronic kidney disease. Nephrol. Dial Transplant. 35(2): 303–312. 2020.
Yada T., Shimokawa H., Tachibana H. Endothelium-dependent hyperpolarization-mediated vasodilatation compensates nitric oxide-mediated endothelial dysfunction during ischemia in diabetes-induced canine coronary collateral microcirculation in vivo. Microcirculation. 25(5): e12456. 2018.
Mokhtar S., Vanhoutte P., Leung S., Yusof M., Wan Sulaiman W., Mat Saad A., Suppian R., Rasool A. Endothelium dependent hyperpolarization-type relaxation compensates for attenuated nitric oxide-mediated responses in subcutaneous arteries of diabetic patients. Nitric Oxide. 53: 35–44. 2016.
Bohlen H. Nitric oxide and the cardiovascular system. Compar. Physiol. 5(2): 808–823. 2015.
Giles T., Sander G., Nossaman B., Kadowitz P. Impaired vasodilation in the pathogenesis of hypertension: focus on nitric oxide, endothelial-derived hyperpolarizing factors, and prostaglandins. J. Clin. Hypertens. (Greenwich). 14(4): 198–205. 2012.
Kalliovalkama J., Jolma P., Tolvanen J., Kдhцnen M., Hutri-Kдhцnen N., Saha H., Tuorila S., Moilanen E., Pцrsti I. Potassium channel-mediated vasorelaxation is impaired in experimental renal failure. Am. J. Physiol. 277(4): H1622–H1629. 1999.
Черток В.М., Коцюба А.Е. Эндотелиальный (интимный) механизм регуляции мозговой гемодинамики: трансформация взглядов. Тихоокеанский мед. журн. 2: 17–26. 2012. [Chertok V.M., Kotsyuba A.E. Endothelial (intimal) mechanism of cerebral hemodynamics regulation: changing views. Pacific Med. J. 2: 17–26. 2012. (In Russ)].
Kanagy N., Szabo C., Papapetropoulos A. Vascular biology of hydrogen sulfide. Am. J. Physiol. Cell Physiol. 312(5): C537–C549. 2017.
Sun H., Wu Z., Nie X., Bian J. Role of endothelial dysfunction in cardiovascular diseases: the link between inflammation and hydrogen sulfide. Front. Pharmacol. 10: 1568. 2020.
Perna A., Lanza D., Sepe I., Di Nunzio A., Conzo G., Satta E., Capasso G., Ingrosso D. Vasodilatation caused by endogenous hydrogen sulfide in chronic renal failure. J. Ital. Nefrol. 30(2): 18–25. 2013.
Perna A., Luciano M., Ingrosso D., Raiola I., Pulzella P., Sepe I., Lanza D., Violetti E., Capasso R., Lombardi C., De Santo N. Hydrogen sulfide, the third gaseous signaling molecule with cardiovascular properties, is decreased in hemodialysis patients. J. Ren. Nutr. 20(5): S11–S14. 2010.
Pushpakumar S., Kundu S., Sen U. Hydrogen sulfide protects hyperhomocysteinemia-induced renal damage by modulation of caveolin and eNOS interaction. Sci. Rep. 9(1): 2223. 2019.
Wang R. The gasotransmitter role of hydrogen sulfide. Antioxidants & Redox Signal. 5(4): 493–501. 2003.
Testai L., D’Antongiovanni V., Piano I., Martelli A., Citi V., Duranti E., Virdis A., Blandizzi C., Gargini C., Breschi M., Calderone V. Different patterns of H2S/NO activity and cross-talk in the control of the coronary vascular bed under normotensive or hypertensive conditions. Nitric Oxide. 47: 25–33. 2015.
Predmore B., Julian D., Cardounel A. Hydrogen sulfide increases nitric oxide production from endothelial cells by an Akt-dependent mechanism. Front. Physiol. 2: 104–108. 2011.
Wu D., Hu Q., Zhu D. An Update on Hydrogen Sulfide and Nitric Oxide Interactions in the Cardiovascular System. Oxid Med. Cell Longev. 2018: 4579140. 2018. https://doi.org/10.1155/2018/4579140
Tang G., Yang G., Jiang B., Ju Y., Wu L., Wang R. H2S is an endothelium-derived hyperpolarizing factor. Antioxidants & Redox Signal. 19(14): 1634–1646. 2013.
Ali M., Ping C., MokY., Ling L., Whiteman M., Bhatia M., Moore1P. Regulation of vascular nitric oxide in vitro and in vivo; a new role for endogenous hydrogen sulphide? Br. J. Pharmacol. 149(6): 625–634. 2006.
Xiao L., Dong J., Teng X., Jin S., Xue H., Liu S., Guo Q., Shen W., Ni X., Wu Y. Hydrogen sulfide improves endothelial dysfunction in hypertension by activating peroxisome proliferator-activated receptor delta/endothelial nitric oxide synthase signaling. J. Hypertens. 36(3): 651–665. 2018.
Szijбrty I., Marky L., Filipovic M., Miljkovic J., Tabeling C., Tsvetkov D., Wang N., Rabelo L., Witzenrath M., Diedrich A., Tank J., Akahoshi N., Kamata S., Ishii I., Gollasch M. Cystathionine γ-Lyase-Produced Hydrogen Sulfide Controls Endothelial NO Bioavailability and Blood Pressure. Hypertension. 71(6): 1210–1217. 2018.
Wang M., Hu Y., Fan Y., Guo Y., Chen F., Chen S., Li Q., Chen Z. Involvement of hydrogen sulfide in endothelium-derived relaxing factor-mediated responses in rat serebral arteries. J. Vasc. Res. 53(3–4): 172–185. 2016.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


