Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 8, стр. 964-973
Активность фактора Виллебранда у крыс после кратковременной ишемии головного мозга
В. Н. Шуваева 1, *, О. П. Горшкова 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: shuvaevavn@infran.ru
Поступила в редакцию 20.12.2019
После доработки 23.03.2020
Принята к публикации 30.05.2020
Аннотация
Одним из ведущих факторов риска повторных нарушений мозгового кровообращения после перенесенной ишемии головного мозга является дисфункция сосудистого эндотелия. Фактор Виллебранда (vWF) – общепризнанный маркер эндотелиальной дисфункции, связанной с дисбалансом выработки эндотелием веществ с прокоагулянтой активностью. Исследовались активность vWF и показатель гематокрита у крыс Вистар после ишемии головного мозга, вызванной 12-минутной окклюзией обеих сонных артерий с одновременной гипотензией (45 ± 2 мм рт. ст.). Постишемические изменения оценивали в 5-ти группах крыс: через 1 ч и на 3-й, 7-й, 14-й и 21-й день после ишемии/реинфузии (И/Р). Контролем служили крысы линии Вистар, перенесшие такое же оперативное вмешательство, но без пережатия сонных артерий и гипотензии. Увеличение активности vWF проявлялось уже через 1 ч после И/Р. К 3-му дню постишемического периода концентрация vWF в плазме крови уменьшалась в результате гемодилюции, о чем свидетельствовало снижение гематокрита. Через 7 дней после ишемии отмечено резкое увеличение активности маркера. В дальнейшем активность vWF снижалась и к 21-му дню после И/Р значения активности маркера достигали значений у контрольных крыс. Полученные данные свидетельствуют о том, что однократная 12-минутная И/Р головного мозга приводит к развитию сосудистой эндотелиальной дисфункции, связанной с дисбалансом выработки эндотелием веществ с прокоагулянтой активностью, сохраняющейся на протяжении 14 дней после ишемии.
Согласно современным представлениям одной из главных причин острого нарушения мозгового кровообращения является атеросклеротическое поражение экстра- и интракраниальных артерий [1], приводящее к стенозу (оклюзии) магистральных артерий головы или артерий мозга, тромбозу или эмболии церебральных артерий и снижению кровоснабжения головного мозга [2], вследствие чего нарушается его метаболизм, в результате образуется очаг инфаркта. Проблема последствий острых ишемических нарушений мозгового кровообращения была и остается актуальной. Большинство работ, посвященных изучению этой проблемы, связаны с исследованием изменений в сосудистой системе головного мозга в момент ишемии и в течение нескольких часов острого постишемического периода [3, 4]. Но процессы, происходящие в более поздний постишемический период, изучены недостаточно полно, хотя они играют значительную роль в возникновении повторных ишемических поражений головного мозга [1].
В связи с этим представляется перспективным исследование особенностей функционирования мозгового сосудистого русла в течение достаточно длительного периода после перенесенной ишемии для уточнения физиологических механизмов, лежащих в основе повторных ишемических поражений головного мозга. Большое значение в развитии постишемических цереброваскулярных нарушений имеет изменение функциональных свойств сосудистой стенки. Сосудистый эндотелий участвует в поддержании физиологического состояния сосудистой стенки, вырабатывая различные биологически активные вещества и проявляя про- и антикоагулянтную активность [5, 6]. В нормальном состоянии эндотелий, поддерживая кровоток, препятствует коагуляции и агрегации клеток крови [7]. Нарушение кровоснабжения мозга при ишемии сопровождается развитием эндотелиальной дисфункции, в основе которой может лежать изменение прокоагулянтной активности сосудистого эндотелия [5, 8, 9].
В настоящее время одним из общепризнанных маркеров нарушений функции эндотелия, связанных с увеличением выработки эндотелием веществ с прокоагулянтой активностью, является фактор Виллебранда (vWF) [10–13], при повреждении эндотелия он секретируется в субэндотелий и плазму крови [14]. Связь повышения концентрации vWF в крови со степенью повреждения сосудистого эндотелия была доказана в модельных экспериментах на крысах при эндотоксинемии и механическом повреждении эндотелия еще в 1989 г. Reldy и соавт. [15]. При состояниях, сопровождающихся острым или хроническим повреждением эндотелия, уровень vWF в крови значительно повышается. При этом наибольший вклад в дисфункцию эндотелия вносит плазменный, синтезируемый эндотелиоцитами vWF, в отличие от синтезируемого тромбоцитами [4]. Основная часть исследований, связанных с фактором Виллебранда, посвящена изучению механизмов его повреждающего действия и способов ингибирования последнего и выполнена на модели фокальной ишемии с использованием окклюзии средней мозговой артерии; при этом очаг инфаркта остается локальным, а наблюдения выполнены в период, как правило, не превышающий 24 ч после ишемии/реперфузии [2–4].
Целью настоящей работы было определение активности фактора Виллебранда как показателя функционального состояния сосудистого эндотелия (эндотелиальной дисфункции) в отдаленном постишемическом периоде в течение трех недель после перенесенной крысами кратковременной транзиторной глобальной ишемии головного мозга, вызванной билатеральной окклюзией сонных артерий на фоне гипотензии.
Такая модель ишемии, известная в англоязычной литературе как “2-vessel occlusion + hypotention model” [16], адекватна для исследования мозговых нарушений, реактивности мозговых сосудов и нарушений функции эндотелия, тогда как простое пережатие сонных артерий у крыс не приводит к существенному снижению кровоснабжения мозга. В этом случае кровоснабжение может осуществляться по вертебральным и базилярной артериям и многочисленным коллатералям. К тому же ауторегуляция мозгового кровотока позволяет сохранять относительно неизменной объемную скорость мозгового кровотока при изменении разницы между системным артериальным и внутричерепным давлением в широких пределах посредством изменения тонуса резистивных пиальных микрососудов [17].
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проведены на половозрелых крысах-самцах линии Вистар массой 250–280 г в соответствии с принципами Базельской декларации, Правилами проведения работ с использованием экспериментальных животных, принятых Европейской конвенцией 19.07.2014 и требованиями Комиссии по контролю за содержанием и использованием лабораторных животных Института физиологии им. И.П. Павлова РАН. Животные содержались по 6 особей в клетках Т4 на стандартной лабораторной диете в условиях искусственного освещения с циклом 12 ч свет/12 ч темнота.
Бедренные артерии катетеризировали на обеих лапах для мониторинга артериального давления (АД) и забора/реинфузии крови при воспроизведении ишемии. Среднее системное АД измеряли с помощью устройства для инвазивного измерения АД у крыс (Россия). У наркотизированных (хлоралгидрат, внутрибрюшинно, 43 мг/100 г массы тела) крыс оно составляло 98.9 ± 2.6 мм рт. ст.
У наркотизированных крыс ишемию воспроизводили посредством 12-минутной окклюзии обеих сонных артерий с одновременной управляемой гипотензией: АД снижали и поддерживали строго на уровне 45 ± 2 мм рт.ст. путем забора/реинфузии крови в гепаринизированный шприц [9, 18]. Для минимизации влияния гепарина на кровь использовали его малые дозы: количество гепарина в шприце не превышало 20 МЕ/100 г массы тела. Этого достаточно для предотвращения коагуляции вблизи катетера [9].
Исследование проводилось на 82 крысах, которые случайным образом были разделены на 11 групп: 5 групп – опыт (n = 32), 5 групп – контроль, ложнооперированные крысы (n = 30) и 1 группа крыс (интактные) для определения референсных значений vWF (n = 20). Постишемические изменения активности vWF и показателя гематокрита (Ht) исследовали в следующих отдельных группах крыс: через 1 ч (n = 6), на 3-й (n = 7), 7-й (n = 6), 14-й (n = 7) и 21-й (n = 6) день после ишемии. Контролем к каждой группе экспериментальных крыс служили ложнооперированные крысы (5 групп): по 6 крыс в каждой группе, которые подвергались такому же операционному вмешательству, как и экспериментальные, но без пережатия сонных артерий и снижения АД. Операции и тесты проводили в одни и те же сроки у опытных и контрольных крыс параллельно. Для проведения тестов кровь из сонной артерии животных через канюлю отбирали в пластиковые пробирки с 3.8%-ным раствором цитрата натрия в отношении 9 : 1. Дополнительно в пробирку вносили 0.05 мл 1%-ного раствора протамина сульфата для связывания гепарина. Кровь центрифугировали в течение 15 мин при 1500 g и тотчас отделяли плазму. Показатель Ht определяли в градуированных капиллярах после центрифугирования крови в течение 15 мин при 3000 оборотов/мин. Схема эксперимента приведена на рис. 1.
Активность фактора Виллебранда определяли в бедной тромбоцитами цитратной плазме агглютинационным методом (РЕНАМ, Россия), основанном на способности vWF вызывать агглютинацию тромбоцитов в присутствии антибиотика ристомицина. Фиксировали время от момента добавления Виллебранд-реагента (смесь фиксированных тромбоцитов с ристомицином) к плазме до появления агглютинатов. Согласно рекомендации производителя реагента (РЕНАМ) по калибровочному графику рассчитывали активность vWF. Для построения калибровочного графика использовали серию разведений плазмы-калибратора с активностью от 50 до 200%, откладывая по логарифмической шкале на оси ординат время образования агглютинатов в секундах, а по оси абсцисс – активность vWF в %. Референсные значения для активности vWF были определены у наркотизированных хлоралгидратом (внутрибрюшинно, 43 мг/100 г массы тела) крыс (n = 20) массой 250–280 г, у которых производился только забор крови. Среднюю активность vWF в каждой группе крыс рассчитывали, используя ее среднее значение из 3-х измерений у отдельных особей.
Для уточнения вопроса о повышении прокоагулянтной активности эндотелия в ответ на операционное вмешательство дополнительно к vWF определяли уровень фибриногена в цитратной плазме коагулометрическим методом по Клаусу (коагулометр CoaDATA 4001, Великобритания) у интактных (n = 5) и у ложнооперированных крыс (n = 5) через 1 ч после катетеризации бедренных артерий.
Статистический анализ полученных данных проводили с использованием пакета статистических программ Microsoft Excel 2003 и программы InStat 3.02 (GraphPad Software Inc., США) с применением парного непараметрического критерия Манна–Уитни. Данные представляли в виде среднего арифметического значения и его средней ошибки. Достоверным уровнем отличий считали вероятность не менее 95% (р < 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Определенные нами референсные значения активности vWF для интактных (не подвергнутых операционному вмешательству) крыс составили 55–130%. Через 1 ч после ишемии активность vWF составила 209.8 ± 4.8% (рис. 2). Эти значения были достоверно выше (p = 0.0427, U = 0.5000), чем у ложнооперированных крыс через 1 ч после операции (192.0 ± 9.6%), хотя и сопоставимы. Повышение активности vWF относительно референсных значений у ложнооперированных и ишемизированных животных через 1 ч после операционного вмешательства либо ишемического воздействия, вероятно, связано с активацией эндотелия в результате повреждения сосудов при катетеризации, вследствие чего vWF, наряду с другими прокоагулянтами, секретируется в субэндотелий и поступает в плазму крови [14]. Поскольку vWF участвует в тромбоцитарном и коагуляционном звене гемостаза, в частности транспортирует фактор VIII к месту повреждения, стабилизирует его и защищает от инактивации [19, 20], то повышение vWF свидетельствует об активации прокоагулянтной активности эндотелия в ответ на повреждение сосуда [9]. По нашим данным уровень фибриногена в плазме крови у ложнооперированных крыс через 1 ч после операции составил 1.50 ± 0.07 г/л, а у интактных крыс – 1.08 ± 0.11 г/л (р = 0.0106, U = 24.0), что указывает на повышенный уровень фибриногена у крыс с катетеризацией сосудов. Авторы работы [21] также продемонстрировали, что эндоваскулярные вмешательства вызывали увеличение уровней vWF и фибриногена в крови пациентов, что приводило к дисфункции эндотелия и гиперкоагуляции крови.
Рис. 2.
Активность фактора Виллебранда у крыс. 1 – ишемия, 2 – контроль. Пунктир – область референсных значений (55–130%). *p = 0.0427, U = 0.5, **p = 0.008, U = 1.0, ***p = 0.0001, U = 0.0001, #p = = 0.0182#, U = 42.0, критерий Манна–Уитни, относительно контроля.
Fig. 2. Activity of von Willebrand factor in rats. 1 – ischemia, 2 – control. The dotted line is the range of reference values (55–130%).*p = 0.0427, U = 0.5, ** p = 0.008, U = 1.0, ***p = 0.0001, U=0.0001, #p = 0.0182#, U = 42.0, Mann–Whitney test, relative to control.
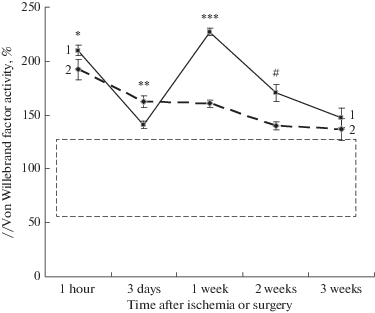
Ранее мы показали [22], что через 1 ч после ишемии/реинфузии головного мозга наблюдается увеличение перфузии, связанное с возникновением постишемической гиперемии [23, 24]. Гиперемия способствует усилению кровотока и, следовательно, увеличению напряжения сдвига на внутренних стенках сосудов. Напряжение сдвига стимулирует выработку здоровым эндотелием вазодилататоров, прежде всего оксида азота (NO); при нарушенной функции эндотелия наблюдается дефицит NO, приводящий к изменению свойств сосудистой стенки [7], что может служить причиной высвобождения vWF и повышения его активности у крыс в первые часы после ишемии относительно значений у ложнооперированных животных [7, 19].
Через 3 дня после операции у ложнооперированных крыс активность vWF достоверно снижалась примерно на 16% до 162.3 ± 5.1% (p = 0.3030, U = 3.0) по сравнению со значениями через 1 ч после ишемии (192.0 ± 9.6%). Изменения, вероятно, связаны с относительным дефицитом vWF по сравнению с его массивным выбросом в первые часы после операционного воздействия. В дальнейшем на протяжении 21 дня у ложнооперированных крыс наблюдалось стойкое и постепенное снижение активности vWF, что может указывать на постепенное уменьшение степени дисфункции эндотелия у этих животных (рис. 2). У крыс, перенесших ишемию, через 3 дня после ишемии активность vWF также снижалась почти на 33% с 209.8 ± 4.8 (через 1 ч после ишемии) до 141.0 ± 3.2% (p < 0.0001, U = 0.0001), но это снижение было более сильным, чем у ложнооперированных животных (с 209.8 ± 4.8 до 141.0 ± 3.2% и со 192.0 ± 9.6 до 162.3 ± 5.1% соответственно, p = 0.008, U = 1.0), как показано на рис. 2. Уменьшение активности vWF может быть связано с разбавлением крови за счет увеличения проницаемости сосудов для интерстициальной жидкости, приводящим к снижению концентрация vWF, а, следовательно, и его активности [5, 19]. Об этом свидетельствует обнаруженное нами у крыс, перенесших ишемию, снижение Ht на 3-й день постишемического периода (с 0.415 ± 0.012 через 1 ч после ишемии до 0.373 ± 0.009, p < 0.05), тогда как у ложнооперированных крыс в период от 1 ч до 3 дней после операции этот показатель не изменялся (0.411 ± 0.009 и 0.417 ± 0.012 соответственно) (табл. 1). Причиной уменьшения количества эритроцитов в плазме может быть поступление в сосуды интерстициальной жидкости вследствие повреждения эндотелия (ишемия/реинфузия, оксидативный стресс, постишемическое воспаление) и увеличения его проницаемости [19, 25]. Эндотелиальная гиперпроницаемость возникает вследствие повышенной полимеризации актинового цитоскелета и, как следствие, образования зазора, вызванного разрушением β-катенина и VE-кадгерина в межэндотелиальных соединениях [26, 27].
Таблица 1.
Показатель гематокрита на протяжении 21 дня после кратковременной транзиторной ишемии головного мозга у крыс Table 1. Hematocrit for 21 days after short-term transient cerebral ischemia in rats
| Сроки после операции/ишемии Terms after surgery/ischemia | Через 1 ч After 1 hour | На 3-й день On the 3rd day | На 7-й день On the 7rd day | На 14-й день On the 14 day | На 21-й день On the 21 day |
|---|---|---|---|---|---|
| Контроль Control |
0.411 ± 0.009 | 0.417 ± 0.012 | 0.400 ± 0.015 | 0.408 ± 0.004 | 0.407 ± 0.018 |
| После ишемии (опыт) After ischemia (experiment) |
0.415 ± 0.012 | 0.373 ± 0.009* | 0.389 ± 0.008 | 0.439 ± 0.005*** | 0.403 ± 0.011 |
На 7-й день постишемического периода активность vWF существенно превышала значение у ложнооперированных крыс (227.0 ± 3.5 и 160.7 ± 3.2% соответственно, p = 0.0001, U = 0.0001) и была достоверно выше, чем через 1 ч после ишемии (227.0 ± 3.5 и 209.8 ± 4.8% соответственно, p = 0.459, U = 37.0) (рис. 2), что может указывать на повреждение эндотелия. Известно, что увеличение концентрации vWF в плазме крови может возникать не только при стимуляции эндотелия, но и при его повреждении [28]. В предыдущих наших исследованиях были получены данные о том, что через 7 дней после ишемии/реинфузии у крыс в периферической крови в среднем в 2 раза увеличивается количество десквамированных эндотелиальных клеток [29]. Следовательно, резкое увеличение активности vWF у крыс, перенесших ишемию, может свидетельствовать о прогрессирующем нарастании тяжести эндотелиальной дисфункции, приводящей к структурному повреждению эндотелия. Дисфункция эндотелия начинается с дисбаланса синтеза вазодилататоров и констрикторов, прокоагуляционных и антикоагуляционных факторов, про- и противовоспалительных медиаторов, и если стимуляция эндотелия становится чрезмерной, например, провоспалительными цитокинами и другими факторами, то возникают структурные нарушения [7, 30]. Так, авторами работы [31] в экспериментах на мышах были зафиксированы повышенные уровни vWF на модели геморрагического инсульта, а инъекция vWF мышам вызывала повышенную экспрессию провоспалительных медиаторов.
К 14-му дню постишемического периода активность vWF у крыс, перенесших ишемию, относительно значений у ложнооперированных животных оставалась повышенной (170.4 ± 8.1 и 139.7 ± 3.8% соответственно, p = 0.0182, U = 42.0), что указывает на сохраняющуюся дисфункцию эндотелия (рис. 2). Наряду с этим отмечено повышение Ht (0.439 ± 0.005 по сравнению с 0.408 ± 0.004 в контроле, p = 0.0009, U = 2.0), Сосудистая стенка играет важную роль в обеспечении гемостатических реакций [32]. Увеличение Ht может отражать обнаруженное нами ранее в этот отрезок постишемического периода усиление гемокоагуляционных процессов [9]. Гиперкоагуляция является следствием функциональной несостоятельности эндотелия в результате возникновения дисбаланса синтезируемых протромбогенных и антитромбогенных сосудистых факторов [7].
К 21-му дню постишемического периода активность vWF составляла 147.1 ± 9.0% и достоверно не отличалась от значений у ложнооперированных крыс (136.9 ± 10.1%), хотя и превышала референсные значения (рис. 2). Эти данные подтверждаются работой [33], в которой указывается, что после острой стадии цереброваскулярных заболеваний значения vWF постепенно уменьшались к 3-й неделе.
ЗАКЛЮЧЕНИЕ
Таким образом, анализ изменения активности vWF как одного из общепризнанных маркеров эндотелиальной дисфункции, связанной с дисбалансом выработки эндотелием веществ с анти- и прокоагулянтой активностью, показал, что однократная 12-минутная ишемия/реинфузия головного мозга на фоне гипотензии приводит к развитию сосудистой эндотелиальной дисфункции, сохраняющейся на протяжении 14 дней после ишемии.
Увеличение активности маркера проявляется уже через 1 ч после перенесенной ишемии/реинфузии. К 3-му дню постишемического периода концентрация vWF в плазме крови уменьшается, как мы полагаем, в результате разбавления крови за счет поступления в кровеносное русло интерстициальной жидкости, о чем свидетельствует снижение Ht. Через 7 дней после ишемии отмечается резкое увеличение активности vWF, указывающее на нарастание тяжести эндотелиальной дисфункции. В дальнейшем активность vWF постепенно снижается, в результате чего к 21-му дню постишемического периода значения активности vWF достигают контрольных, что может указывать на снижение степени эндотелиальной дисфункции. Таким образом, vWF можно использовать в эксперименте в качестве теста для быстрого определения функциональных нарушений эндотелия.
Работа выполнена на животных из ЦКП Биоколлекция ИФ РАН.
Список литературы
Гончар И.А., Степанова Ю.И., Прудывус И.С. Биохимические предикторы и маркеры инфаркта головного мозга. Под ред. В.С. Камышникова. Минск. БелМАПО. 2013. [Gontschar I.A., Stepanova J.I., Prudyvus I.S. Biochemical Predictors and Markers of Ischemic Stroke. Ed. V.S. Kamyschnikov. Minsk. Belarus. Med. Acad. Postgraduate Education. 2013. (In Russ)].
Denorme F., De Meyer S.F. The VWF-GPIb axis in ischaemic stroke: lessons from animal models. J. Thromb. Haemost. 116(04): 597–604. 2016. https://doi.org/10.1160/TH16-01-0036
Khan M.M., Motto D.G., Lentz S.R., Chauhan A.K. ADAMTS13 reduces VWF-mediated acute inflammation following focal cerebral ischemia in mice. J. Thromb. Haemost. 10(8): 1665–1671. 2012. https://doi.org/10.1111/j.1538-7836.2012.04822.x
Dhanesha N., Prakash Pr., Doddapattar P., Khanna I., Pollpeter M.J., Nayak M.K., Staber J.M., Chauhan A.K. Endothelial cell-derived von Willebrand factor is the major determinant that mediates von Willebrand factor-dependent acute ischemic stroke by promoting postischemic thrombo-inflammation. Arterioscler. Thromb. Vasc. Biol. 36(9): 1829–1837. 2016. https://doi.org/10.1161 / ATVBAHA. 116,307660
Суслина З.А., Танашян М.М., Домашенко М.А., Ионова В.Г., Чечёткин А.О. Дисфункция эндотелия при ишемических нарушениях мозгового кровообращения. Анналы клинич. и эксперимент. неврологии. 2(1): 4–11. 2008. [Suslina Z.A., Tanashyan M.M., Domashenko M.A., Ionova V.G., Chechetkin A.O. Endothelial dysfunction in patients with ischemic stroke. Ann. Clin. Exper. Neurology. 2(1): 4–11. 2008. (In Russ)].
Esper R.J., Nordaby R.A., Vilarico J.O., Paragano A, Cacharryn J.L, Machado R.A. Endothelial dysfunction: a comprehensive appraisal. Cardiovasc. Diabetol. 5: 4–21. 2006. PMCID: PMC1434727https://doi.org/10.1186/1475-2840-5-416504104
Полонецкий О.Л., Полонецкий Л.З. Дисфункция эндотелия и атеросклероз. Мед. новости. 6: 6–11. 2012. [Polonetskiy O.L., Polonetskiy L.Z. Endothelial dysfunction and atherosclerosis. Med. News. 6: 6–11. 2012. (In Russ)].
Воронков А.В., Поздняков Д.И., Мамлеев А.В. Изучение вазодилатирующей и антиттромботической функции эндотелия сосудов головного мозга крыс на различных моделях его ишемического повреждения. Соврем. проблемы науки и образования. 5. 2015. [Voronkov A.V., Pozdnyakov D.I., Mamleev A.V. Stady of vasodilating fnd antitrombotic functions of rat brain vessels endothelium on various models of its ischemic damage. Modern Problems Science and Education. 5. 2015. (In Russ)]. URL: http://science-education.ru/ru/article/view?id=22406
Шуваева В.Н., Горшкова О.П., Дворецкий Д.П. Коагуляционный гемостаз у крыс линии Вистар после кратковременной транзиторной ишемии головного мозга. Рос. физиол. журн. им. И.М. Сеченова. 105(9): 1189–1196. 2019. [Shuvaeva V.N., Gorshkova O.P., Dvoretsky D.P. Coagulation hemostasis of the Wistar line after short-term transitor ischemia of the brain. Russ. J. Physiol. 105 (9): 1189–1196. 2019. (In Russ)].
Arba F., Giannini A., Piccardi B., Biagini S., Palumbo V., Giusti B., Nencini P., Maria Gori A., Nesi M., Pracucci G., Bono G., Bovi P., Fainardi E., Consoli D., Nucera A., Massaro F., Orlandi G., Perini F., Tassi R., Sessa M., Toni D., Abbate R., Inzitari D. Small vessel disease and biomarkers of endothelial dysfunction after ischaemic stroke. Eur. Stroke J. 4(2): 119–126. 2019. https://doi.org/10.1177/2396987318805905
Poggesi A., Marco P., Francesca P., Pantoni L., Inzitari D. Circulating biologic markers of endothelial dysfunction in cerebral small vessel disease: a review. J. Cerebr. Blood Flow Metab. 36(1): 72–94. 2016. https://doi.org/10.1038/jcbfm.2015.116
Повзун С.А. Важнейшие синдромы: патогенез и патологическая анатомия. СПб. ООО ИПК КОСТА. 2009. [Povzun S.A. The most important syndromes: pathogenesis and pathological anatomy. SPb. LLC IPK COSTA. 2009. (In Russ)].
Horvth B., Hegedьs D., Szapбry L., Mбrton Z., Alexy T., Koltai K., Gyevnбr Z., Juricskay I., Tyth K., Kйsmбrky G. Investigation of von Willebrand-factor as a marker of endothelial dysfunction in atherosclerotic patients. Orv. Hetil. 144(50): 2471–2476. 2003.
Бабичев А.В. Роль эндотелия в механизмах гемостаза. Педиатр. IV(1): 122–127. 2013. [Babichev A.V. The role of endothelium in the mechanisms of hemostasis. Pediatrician. IV(1): 122–127. 2013. (In Russ)].
Reldy M.A., Chopek M., Chao S., McDonald T., Schwartz S.M. Injury induses increase of von Willebrand factor in rat endotelian cells. Am. J. Pathol. 134(4): 857–864. 1989.
Smith M.L., Bendek G., Dahlgren N., Rosen I., Wieloch T., Siesjo B.K. Models for studying long-term recovery following forebrain ischemia in the rat: 2. A 2-vessel occlusion model. Acta Neurol. Scand. 69: 385–401. 1984.
Кособян Е.П., Ярек-Мартынова И.Р., Ясаманова А.Н., Колесникова Т.И., Мартынов М.Ю. Роль эндотелиальной дисфункции в развитии цереброваскулярного поражения у пациентов с сахарным диабетом. Сахарный диабет. 1: 42–48. 2012. [Kosobyan E.P., Yarek-Martynova I.R., Yasmanova A.N., Kolesnikova T.I., Martynov M.Yu. The role of endothelial dysfunction in the development of cerebrovascular disease in patients with diabetes mellitus. Diabetes. 1: 42–48. 2012. (In Russ)].
Горшкова О.П., Ленцман М.В., Артемьева А.И., Дворецкий Д.П. Динамика изменения реактивности пиальных сосудов после кратковременной ишемии головного мозга. Регионарное кровообращение и микроциркуляция. 14(1): 74–78. 2015. [Gorshkova O.P., Lensman M.V., Artem’eva A.I., Dvoretsky D.P. Dynamic of pial vessels reactivity after brief cerebral ischemia. Regional Hemodynamics and Microcirculation. 14(1): 74–78. 2015. (In Russ)].
Чубуков Ж.А. Фактор Виллебранта и дисфункция эндотелия при стрессе. Проблемы здоровья и экологии. 2(32): 40–45. 2012. [Chubukov Zh.A. Willebrant factor and endothelial dysfunction under stress. Health and Ecology Problems. 2(32): 40–45. 2012. (In Russ)].
Дмитриев В.В. Практические вопросы клинической коагулологии. Минск. Белорусская наука. 2017. ISBN: 978-985-08-2158-4 [Dmitriev V.V. Practical Issues in Clinical Coagulology. Minsk. Belarusian Science. 2017. ISBN: 978-985-08-2158-4 (In Russ)].
Yao H.Q., Wang F.J., Kang Z. Effects of Endovascular Interventions on vWF and Fb Levels in Type 2 Diabetic Patients with Peripheral Artery Disease. Ann. Vasc. Surg. 33: 159–66. 2016. https://doi.org/10.1016/j.avsg.2015.11.018
Горшкова О.П., Шуваева В.Н. Динамика постишемических изменений микроциркуляции в коре головного мозга крыс. Рос. физиол. журн. им И.М. Сеченова. 103(8): 866–872. 2017. [Gorshkova O.P., Shuvaeva V.N. Dynamics of post-ischemic microcirculation changes in the cerebral cortex rats. Russ. J. Physiol. 103(8): 866–872. 2017. (In Russ)].
Onetti Y., Dantas A.P., Pйrez B., Cugota R., Chamorro A., Planas A.M., Vila E., Jimйnez-Altayy F. Middle cerebral artery remodeling following transient brain ischemia is linked to early postischemic hyperemia: a target of uric acid treatment. Am. J. Physiol. Heart Circ. Physiol. 308(8): H862–H874. 2015. https://doi.org/10.1152/ajpheart.0000.2015
Скворцова В.И. Ишемический инсульт: патогенез ишемии, терапевтические подходы. Невролог. журн. 6(3): 4–9. 2001. [Skvortsova V.I. Ischemic stroke: pathogenesis of ischemia, therapeutic approaches. Neurolog. J. 6(3): 4–9. 2001. (In Russ)].
Ceulemans A., Zgavc T., Kooijman R., Hachimi-Idrissi S., Sarre S., Michotte Y. The dual role of the neuroinflammatory response after ischemic stroke: modulatory effects of hypothermia. J. Neuroinflammation. 7: 74. 2010. https://doi.org/10.1186/1742-2094-7-74
Skaria T., Bachli E., Schoedon G. RSPO3 impairs barrier function of human vascular endothelial monolayers and synergizes with pro-inflammatory IL-1. Mol. Med. 24(1): 45-51. 2018. https://doi.org/10.1186/s10020-018-0048-z
Claesson-Welsh L. Vascular permeability – the essentials. Ups. J. Med. Sci. 120(3): 135–143. 2015. https://doi.org/10.3109/03009734.2015.1064501
Юдакова Т.Н., Гирш А.О., Максимишин С.В., Мальков О.А. Сопряженность показателей сердечно-сосудистой системы и эндотелиальной дисфункции у больных с геморрагическим шоком. Анестезиология и реаниматология. 6: 11–13. 2013. [Yudakova T.N., Hirsch A.O., Maksimishin S.V., Mal’kov O.A. The correlation of indicators of the cardiovascular system and endothelial dysfunction in patients with hemorrhagic shock. Anesthesiology and resuscitation. 6: 11–13. 2013. (In Russ)].
Горшкова О.П., Шуваева В.Н., Ленцман М.В., Артемьева А.И. Постишемические изменения вазомоторной функции эндотелия. Современные проблемы науки и образования. 5. 2016. [Gorshkova O.P., Shuvaeva V.N., Lensman M.V., Artem’eva A.I. Postischemic changes in the vasomotor function of the endothelium. Modern problems of science and education. 5. 2016. (In Russ)]. URL: http://www.science-education.ru/ru/article/view?id=25270
Boos C.J., Balakrishnan B., Blann A.D., Lip G.Y. The relationship of circulating endothelial cells to plasma indices of endothelial damage/dysfunction and apoptosis in acute coronary syndromes: implications for prognosis. J. Thromb. Haemost. 6(11): 1841–1850. 2008. https://doi.org/10.1111/j.1538-7836.2008.03148.x
Zhu X., Cao Y., Wei L., Cai P., Xu H., Luo H., Bai X., Lu L., Liu J.R., Fan W., Zhao B.Q. Von Willebrand factor contributes to poor outcome in a mouse model of intracerebral haemorrhage. Sci. Rep. 6: 35901–35911. 2016. https://doi.org/10.1038/srep35901
Flaumenhaft R. Protein disulfide isomerase as an antithrombotic target. Trends Cardiovasc. Med. 23: 264–268. 2013. https://doi.org/10.1016/j.tcm.2013.03.001
Wang Y. A study of plasma von Willebrand factor concentration in patients with cerebrovascular disease. Zhonghua Shen Jing Jing Shen Ke Za Zhi. 25(2): 106–108.1992.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова



