Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 12, стр. 1583-1596
Роль калиевых токов в формировании фазы следовой гиперполяризации внеклеточных потенциалов действия вентрикулярных кардиомиоцитов крысы в норме и при стрептозотоциновом сахарном диабете
И. В. Кубасов 1, А. В. Степанов 1, А. А. Панов 1, О. В. Чистякова 1, И. Б. Сухов 1, М. Г. Добрецов 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург,, Россия
* E-mail: dobretsovmaxim@gmail.com
Поступила в редакцию 24.09.2021
После доработки 05.10.2021
Принята к публикации 07.10.2021
Аннотация
Роль Ca2+-зависимых калиевых каналов низкой проводимости (SK-каналы) в патогенезе диабетической кардиомиопатии остается малоизученной. В наших исследованиях в крысиной модели стрептозотоцин-вызванного сахарного диабета 1 типа (СТЗ-СД1) было продемонстрировано существенное по сравнению с контролем увеличение фракции внеклеточных потенциалов действия (вПД) эпикардиальных миоцитов левого желудочка сердца, характеризующихся выраженной фазой следовой гиперполяризации (вПДСГ). В экспериментах с локальной доставкой в зону регистрации вПДСГ блокаторов различных К+-каналов только доставка селективного блокатора SK-каналов апамина в концентрации 500 нМ сопровождалась подавлением фазы следовой гиперполяризации вПДСГ. Полученные данные предполагают, что фаза следовой гиперполяризации вПД связана с активностью SK-каналов и что развитие СТЗ-СД1 ведет к увеличению экспрессии и/или активности этих каналов эпикардиальными кардиомиоцитами левого желудочка сердца крыс.
Ранее, в ряде исследований с использованием метода регистрации потенциалов действия (ПД) с использованием внеклеточных микроэлектродов с диаметром кончика 2–5 мкм (loose patch метод) были выявлены существенные различия в характере генерации ПД и ионных токов на поверхностной мембране и в t-трубочках изолированных скелетных мышц [1] и кардиомиоцитов в составе изолированного сердца [2]. Согласно этим данным, внеклеточно регистрируемые ПД (вПД) миоцитов с помощью пипетки с узким кончиком представляют собой полиморфный сигнал, форма которого определяется активностью электрогенных механизмов (ионных каналов и транспортеров), локализованных на плазматической мембране миоцита непосредственно под кончиком регистрирующего электрода. Стандартный вПД желудочкового кардиомиоцита представляет собой волну, характеризующуюся одним (вПД1) или двумя (вПД2) выраженными негативными пиками. Имеющиеся данные [2] позволяют говорить, что вПД1 и первый негативный пик в составе вПД2 формируются в результате активации потенциал-зависимых натриевых каналов поверхностной мембраны клетки. Наличие второго негативного пика в волне вПД2 сигнала отражает активность Са2+-каналов входящего тока, локализованных в Т-системе кардиомиоцита (система регулярных инвагинаций/впячиваний плазматической мембраны внутрь клетки или t-трубочек), и свидетельствует о наличии одного или нескольких устьев t-трубочек на поверхности клетки непосредственно в зоне под кончиком регистрирующего внеклеточного электрода. В согласии с этим, большинство вПД, регистрируемых с помощью пипетки с узким кончиком (наружный диаметр 5 мкм) от кардиомиоцитов желудочков (высокая плотность t-трубочек) и предсердий (низкая плотность t-трубочек) сердец нормальных крыс относится, соответственно, к категории вПД2 и вПД1 сигналов [3]. Ожидаемо, что вПД1 существенно короче, чем вПД2, однако спад, отражающий инактивацию натриевых и Са2+-каналов и активацию токов выходящего направления (в основном калиевых), обыкновенно представлял собой относительно монотонный процесс снижения потенциала к базовому уровню. Тем не менее, встречались вПД1сг и вПД2сг, которые имели более сложную форму, завершаясь выраженной фазой следовой гиперполяризации (СГ). В норме регистрации вПДсг были редки (не более 7% от всех регистраций в левом желудочке сердца крысы). Однако наши предварительные данные [4] показали, что в левых желудочках сердец крыс с экспериментально вызванным диабетом 1-го типа СГ сопутствует большинству регистрируемых вПД. Эти последние наблюдения поставили вопрос о выяснении ионной природы фазы СГ и проведении более детального анализа профилей вПД, регистрируемых от левых желудочков сердец нормальных и диабетических крыс. При рассмотрении вопроса о природе СГ было учтено, что эта фаза завершает вПДсг, когда в кардиомиоцитах желудочков сердца крысы активны два основных типа К+-каналов: потенциал-зависимые каналы сверхмедленного (quasi-steady-state, Iss) тока и каналы тока обратного выпрямления (IK1) [5–9]. Активация и/или изменения в экспрессии соответствующих каналов может быть существенным фактором, определяющим параметры реполяризации кардиомиоцитов при сердечной патологии [10], в том числе диабетической кардиомиопатии [8, 11].Это относится и к ряду других калиевых каналов реполяризационного резерва, таких как глибенкламид-чувствительные, АТФ-зависимые К+-каналы (IKATP, Kir6.2 каналы) [12], апамин-чувствительные, Са2+-зависимые К+-каналы низкой проводимости (IKCa, SK каналы) [13] и Kir3.x (IKACh, ацетилхолин-зависимого тока входящего выпрямления) [14].
МЕТОДЫ ИССЛЕДОВАНИЯ
Все эксперименты проводились в соответствии с Правилами проведения работ с подопытными животными, утвержденными комиссией по этике Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН. Исследования проводили на самцах крыс линии Вистар массой 230–430 г в возрасте 3–4 мес. Части животных в дозе 30–45 мг/кг внутрибрюшинно вводили стрептозотоцин (СТЗ), растворенный в 0.1 М цитратном буфере (рН 4.6) (СТЗ-группа). Оставшиеся животные получали инъекцию эквивалентного объема цитратного буфера (контроль). Развитие СД1 подтверждали на основании измерений уровня случайной глюкозы, определяемого независимо от времени предыдущего приема пищи в последний день эксперимента. Уровень глюкозы измеряли с помощью глюкометра One Touch Select Plus Flex (LifeScan Europe, Швейцария). В данное исследование были включены только крысы СТЗ-группы с уровнем случайной глюкозы, превышающим 11 мМ.
Электрофизиологические эксперименты с использованием loose patch метода проводились на левых желудочках изолированных сердец крыс в условиях сохраненного синусового ритма при постоянной перфузии по методу Лангендорфа. Раствор для перфузии представлял собой аэрируемый карбогеном (5% CО2 и 95% О2) раствор Тироде, содержащий (мМ): 140 NaCl, 4.5 KCl, 1 CaCl2, 1 MgCl2, 10 HEPES, 10 глюкоза, pH 7.2–7.4. Первоначально изолированное сердце с вставленной в аорту пластиковой канюлей на 20–30 мин вывешивалось на колонку, заполненную аэрируемым стандартным раствором Тироде при комнатной температуре для промывки сердца от крови и проверки его на жизнеспособность. Далее сердце, показавшее устойчивую сократительную активность, переносилось в заземленную экспериментальную камеру, выполненную из оргстекла объемом 10 мл, и подключалось к термостатируемой перфузионной системе, заполненной раствором Тироде. Скорость перфузии составляла 5–7 мл/мин. Выведение из экспериментальной камеры избыточного раствора осуществлялось через силиконовую трубочку диаметром 1 мм, подключенную к аспиратору. Устранение сократительных ответов обеспечивалось добавлением в перфузирующий раствор блокатора миозиновой АТФазы 2,3-бутадион-моноксима (BDM, Sigma) в концентрации 20 мМ. Эксперименты проводились при температуре 38–39°С. Изготовление микроэлектродов производилось с использованием программируемого пуллера (Sutter Jnstr., Model P-1000, США). Для регистрации электрических ответов использовалась описанная ранее авторская методика микроэлектродного картирования наружной поверхности миокарда – narrow tipped pipettes loose patch [2] с использованием микроэлектродов с диаметром кончика ∼5 мкм. Перемещение микроэлектрода от одного сайта регистрации на поверхности левого желудочка сердца к другому осуществлялось при помощи микроманипулятора NMH-21 (Narishige, Япония). Регистрируемые сигналы подавались на вход усилителя АM-1500 (National Instruments, США), затем оцифровывались с помощью АЦП (частота оцифровки – 10 кГц) и сохранялись для последующей обработки на жестком диске компьютера. Для локальной доставки фармакологических агентов в зону регистрации эти агенты добавлялись в раствор Тироде, заполняющий электрод. Использовались следующие блокаторы К+-каналов: 4-аминопиридин (4-АР, блокатор ультрабыстрого, быстрого и медленного компонентов тока задержанного выпрямления, Kv1.5, 1.4 и 4.2/4.3 каналы; 5 мМ, Sigma, США), апамин (блокатор IKCa, SK-каналы; Tocris, США; 500 нM), глибенкламид (блокатор IKATP, Kir6.1/6.2 каналы; Tocris, США; 100 мкМ) и Ba2+ (в низких, 1 или менее мМ, концентрациях специфический блокатор каналов обратного выпрямления, IK1, Kir2.1/2.2; Sigma, США; 5 мкМ BaCl2). Время непрерывной регистрации от каждого конкретного сайта составляло 1–2 мин в обычных экспериментах и примерно 30 мин в экспериментах с использованием блокаторов К+-каналов.
Рис. 1 иллюстрирует представительные примеры регистрируемых сигналов и их классификацию, применяемую в данной работе.
Рис. 1.
Примеры и классификация типов внеклеточных потенциалов. a – примеры вПД1 и вПД1сг сигналов (АР1 и АР1AH); b – примеры вПД2 и вПД2сг сигналов (АР2 и АР2AH). Треки вПД и вПДсг сигналов показаны сплошной и пунктирной линиями, соответственно. Первый и второй (когда присутствует) негативные пики сигнала пронумерованы – цифры около соответствующего пика.

Если в наших более ранних работах [1–3] все регистрируемые вПД подразделялись на два типа, вне зависимости от наличия или отсутствия фазы следовой гиперполяризации (вПД1 – 1 негативный пик и вПД2 – 2 негативных пика; рис. 1a и b, соответственно), то теперь сигналы с выраженной (пиковая амплитуда более 5% от амплитуды первого негативного пика) фазой следовой гиперполяризацией были выделены в отдельные группы (вПД1сг и вПД2сг) и анализировались независимо от других типов сигналов. Для анализа временных характеристик использовался параметр Т90 – время спада единственного (вПД1 и вПД1сг) или второго (вПД2 и вПД2сг) негативного пика на 90% от его абсолютной амплитуды.
Полученные в экспериментах данные были проверены на нормальность распределения (критерий Шапиро–Вилка; в выборках малого объема, не позволяющего применение этого критерия (n < 6), распределение данных предполагалось нормальным). В соответствии с результатами этой проверки, различия между значениями в контрольной и экспериментальной группах принимали как достоверные при p < 0.05, используя соответствующие параметрические или непараметрические статистические критерии. Представленные в тексте и на рисунках данные приведены в виде средних значений и их ошибок.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Изменения уровня глюкозы и массы животных
Выборки контрольных и СТЗ крыс достоверно не различались по начальной массе (358 ± 12 и 349 ± 7 г) и уровню случайной глюкозы (6.0 ± 0.1 и 6.1 ± 0.1 мМ, контрольная группа 14 крыс и СТЗ группа 21 крыса, соответственно; р > 0.05, t-критерий Стьюдента). На протяжении 2-х–8-ми нед. эксперимента масса и уровень случайной глюкозы в крови контрольных животных достоверно не изменялись по сравнению с исходными значениями этих параметров (табл. 1). Средние уровни случайной глюкозы, измеренные у СТЗ-СД1 групп крыс на последний день эксперимента (29–20 мМ), существенно превышали таковые, измеренные у этих же крыс в начале эксперимента и у контрольных животных на соответствующих сроках, 2-х–8-ми недель эксперимента (табл. 1). Кроме того, достоверное снижение массы СТЗ-СД1 крыс было зафиксировано в группах 2- и 4-недельных СТЗ-СД1 крыс (табл. 1).
Таблица 1.
Масса тела и содержание случайной глюкозы в крови исследованных крыс на разных сроках эксперимента (среднее значение ± стандартная ошибка)
| Неделя эксперимента | Масса тела, г | Глюкоза, мМ | ||
|---|---|---|---|---|
| контроль | СТЗ-СД | контроль | СТЗ-СД | |
| 0 | 358 ± 12 (n = 14) |
349 ± 7 (n = 21) |
6.0 ± 0.1 (n = 14) |
6.1 ± 0.1 (n = 21) |
| 2 | 380 ± 10 (n = 4) |
310 ± 12* (n = 8) |
5.9 ± 0.4 (n = 4) |
29 ± 2* (n = 8) |
| 4 | 420 ± 15 (n = 4) |
305 ± 9* (n = 6) |
5.8 ± 0.3 (n = 4) |
27 ± 3* (n = 6) |
| 8 | 362 ± 17 (n = 6) |
324 ± 17 (n = 7) |
6.2 ± 0.1 (n = 6) |
20 ± 4*$ (n = 7) |
Частота встречаемости разных типов внеклеточно регистрируемых ПД кардиомиоцитов у крыс в контроле и после 2-х, 4-х и 8-ми недель СТЗ-СД
Все описанные выше четыре категории вПД наблюдали в экспериментах в контрольных сердцах. Однако количество регистраций вПД1СГ и вПД2СГ было незначительным, составляя в среднем 6.8 ± 2.3% от всех зарегистрированных ПД (13 крыс, 31 из 423 сайтов регистрации). Средняя, нормализованная к амплитуде первого негативного пика ответа амплитуда СГ таких ответов была 19.4 ± 8.5%. Т90 вПД1 и вПД1сг достоверно не отличались (5.2 ± 0.3 мс vs 5.9 ± 0.4 мс; p > 0.05, one-way ANOVA), тогда как вПД2СГ характеризовались значительно укороченным по сравнению с вПД2 спадом (Т90: 22.7 ± 4.0 мс vs 35.9 ± 1.7 мс, p < 0.05, one-way ANOVA).
В сердцах СТЗ-СД крыс, начиная уже с 2-недельного срока СД, наблюдались существенные изменения в отношении характеристик вПДсг сигналов. В первую очередь это касалось прогрессивного увеличения фазы СГ и очевидно связанного с этим подавления второго негативного пика и слияния его с первым негативным пиком вПД2сг. В этих условиях нашим критерием различения вПД1сг и вПД2сг потенциалов было либо, как в контрольных экспериментах, наличие второго негативного пика, либо присутствие отчетливой ступеньки на спаде первого негативного пика регистрируемого сигнала (рис. 2).
Рис. 2.
Репрезентативные примеры регистраций вПДсг в контроле и на разных сроках диабета и их разделения на классы вПД1сг (штриховые линии) и вПД2сг (сплошные линии) сигналов. Стрелки на рисунках отмечают второй негативный пик сигнала или ступеньку на спаде первого негативного пика сигналов, которые классифицировались как вПД2сг. Надписи над панелями рисунка – экспериментальная группа животных.
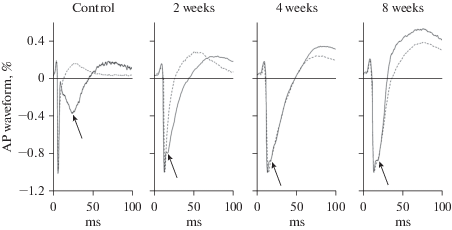
С учетом этой модификации классификационного подхода полученные данные демонстрируют статистически значимое (в сердцах СД животных по сравнению с контролем) увеличение относительной частоты регистрации вПД1, вПД1СГ и вПД2СГ и снижение частоты встречаемости вПД2 (рис. 3a, p < 0.05, one-way ANOVA). Более того, дальнейший анализ этих данных выявил наличие существенной взаимосвязи между встречаемостью вПД2 и вПДсг (вПД1сг и вПД2сг) в контроле и на разных сроках СД (рис. 3b).
Рис. 3.
Частота встречаемости разных типов внеклеточных ПД, регистрируемых в левом желудочке изолированного сердца в контроле и на разных сроках СД. a – частота встречаемости вПД1, вПД2, вПД1СГ и вПД2СГ (AP1, AP2, AP1AH, AP2AH) в контроле (13 крыс, 423 сайтов) и на разных сроках СТЗ-СД (2 недели – 8 крыс, 212 сайтов регистрации, 4 нед. – 6 крыс, 204 сайта регистрации и 8 недель – 8 крыс, 224 сайта регистрации). b – взаимосвязь между частотами встречаемости вПД2 и вПДсг (AP2 и APAH – объединенная выборка вПД1сг и вПД2сг сигналов) в контроле и на разных сроках СД (срок диабета в неделях указан цифрой около соответствующего символа).

Прогрессивное возрастание амплитуды следовой гиперполяризации с увеличением срока СД было сходно для вПД1СГ и вПД2СГ сигналов (рис. 4a). Однако соответствующие изменения длительности этих классов ПД носили диаметрально противоположный характер: вПД1сг замедлялись, тогда как длительность (Т90) вПД2 была снижена в СТЗ крысах по сравнению с контролем (рис. 4b). На 4-й и 8-й неделях СД вПД1сг и вПД2сг статистически не различались ни по одному из измеренных параметров (амплитуда следовой гиперполяризации или Т90).
Рис. 4.
Изменение характеристик вПД1СГ и вПД2СГ (открытые и закрытые символы соответственно) в контроле (ноль оси абсцисс) и на разных сроках СТЗ-СД. а – средние (6–13 крыс, 23–54 сайта регистрации на точку) значения амплитуды следовой гиперполяризации (AH amplitude) вПД1 СГ и вПД2 СГ. b – Т90 этих же сигналов (AP T90) в контроле и на сроках 2-х, 4-х и 8-ми недель СТЗ-СД.

Влияние локальной доставки блокаторов К+- каналов на профили вПДсг
Поскольку в левых желудочках сердец контрольных крыс встречаемость вПДсг сравнительно низка (рис. 3a), все эксперименты с применением блокаторов К+-каналов были проведены на сердцах животных с 2–4-недельным СД. Для локальной доставки к месту регистрации выбранный блокатор загружался в регистрирующую пипетку и эффективность его действия оценивалась из сравнения пиковых амплитуд следовой гиперполяризации вПД, измеренных немедленно после установления контакта пипетки с мышечным волокном и через 30 мин непрерывной регистрации вПДсг от данного сайта. В контрольных экспериментах (электрод заполнен стандартным внеклеточным раствором) и в экспериментах с локальной перфузией сайта регистрации глибенкламидом или ВаCl2, 30-минутная непрерывная регистрация вПД не сопровождалась изменениями амплитуды следовой гиперполяризации регистрируемого сигнала (рис. 5). Локальная аппликация 4-АР приводила к достоверному увеличению СГ от 12.8 ± 3.4% до 26.2 ± 2.4% к 30-й минуте регистрации (рис. 5; p < 0.05).
Рис. 5.
Амплитуда следовой гиперполяризации вПДсг в начале и через 30 мин (открытые и затемненные столбцы, соответственно) непрерывной регистрации от данного сайта при заполнении регистрирующей пипетки нормальным физиологическим раствором (контроль) или раствором с добавлением выбранного блокатора К+-каналов. Приведены средние значения (± стандартная ошибка) для исследованных сайтов в контрольных условиях и при локальной перфузии 4-АР (5 мМ), глибенкламида (100 мкМ) или BaCl2 (5 microM). Количество исследованных сайтов/крыс указано цифрами над соответствующими столбцами гистограммы.

Полученные данные демонстрируют отсутствие каких-либо эффектов, связанных с длительной непрерывной регистрацией от одного и того же сайта (например, с повреждением мембраны кардиомиоцитов в зоне регистрации), а также предполагают, что формирование фазы следовой гиперполяризации вПД не может быть приписано активации 4-аминопиридин-, глибенкламид- или Ва2+-чувствительных К+-каналов плазматической мембраны кардиомиоцита.
Результаты экспериментов с локальной доставкой к сайту регистрации блокатора SK-каналов апамина (500 нМ) резко контрастировали с вышеизложенным. В этих экспериментах не наблюдалось изменения профилей стандартных вПД 1-го и 2-го типа миоцитов левого желудочка сердца крыс. Однако, уже начиная с 10-й мин после формирования контакта микропипетки, содержащей апамин, с поверхностью миоцита наблюдалось подавление фазы следовой гиперполяризации у вПДсг с постепенной трансформацией профилей как вПД1сг, так и вПД2сг в сигналы, соответствующие по форме “классическим” вПД2 сигналам (рис. 6).
Рис. 6.
Примеры изменений разных типов внеклеточных ПД в экспериментах с локальной доставкой апамина к сайту регистрации. Сплошными и пунктирными линиями показаны треки сигнала, полученного в начале и под конец 30-минутной непрерывной регистрации с пипеткой, заполненной апамин-содержащим раствором (500 нМ). Верхние панели – примеры регистрации вПД1 и вПД2 сигналов; нижние панели – вПД1сг и вПД2сг сигналы.

Прогрессивное подавление фазы следовой гиперполяризации вПДсг в этих экспериментах ассоциировалось и с прогрессивным затягиванием спада этих сигналов (рис. 7).
Рис. 7.
Изменения временных параметров вПД в экспериментах с локальной доставкой апамина к сайту регистрации вПД1 и вПД1сг (a) и вПД2 и вПД2сг (b). Представлены средние значения (± стандартная ошибка), рассчитанные для выборок вПД1, вПД1сг, вПД2 и вПД2сг, зарегистрированных в разных сайтах сердец СТЗ-СД крыс (4, 5, 3, и 5 сайтов, и 3, 4, 2 и 3 крысы, соответственно).

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Скорость реполяризации кардиомиоцитов является одним из критических для поддержания нормальной сердечной активности параметров. Как замедление, так и ускорение реполяризации кардиомиоцитов может вести к нарушениям регулярности в сердечном ритме. Более того, аномальное замедление ПД кардиомиоцитов сопровождается нарушением диастолического расслабления сердечной мышцы – ведущим фактором развития кардиомиопатии и сердечной недостаточности, в частности у больных СД [8, 11]. В связи с последним, результаты нашего исследования, проведенного на модели стрептозотоцинового СД1 (СТЗ-СД1) у крыс, представляют особый интерес.
В наших исследованиях было показано существенное по сравнению с контролем увеличение вПДсг фракции вПД эпикардиальных миоцитов левых желудочков сердец СТЗ-СД1 крыс. Частота встречаемости таких сигналов значимо увеличена уже после двух недель экспериментального диабета и остается высокой на протяжении как минимум еще 6-ти недель СД (рис. 3). Ранее было показано, что на тех же сроках СТЗ-СД (1–8 нед.) внутриклеточно-регистрируемые ПД желудочковых кардиомиоцитов крыс замедлены из-за подавления К+-токов реполяризационного резерва. А именно, были приведены свидетельства сниженной в кардиомиоцитах СТЗ-СД1 крыс активности/экспрессии трех типов К+-каналов: каналов 4-АР чувствительного transient-outward (Ito) тока, каналов сверхмедленного (quasi-steady-state, Iss) тока и каналов тока обратного выпрямления (IK1) [5–9]. Наши результаты предполагают, что патогенез СТЗ-СД1 в отношении изменений ионных проводимостей желудочковых кардиомиоцитов более сложен, и наряду с подавлением существует также и активация, возможно компенсаторная, какого-то тока реполяризационного резерва, обеспечивающего появление/усиление фазы следовой гиперполяризации и увеличение фракции вПДсг регистрируемых в сердцах СТЗ-СД1 крыс. При рассмотрении вопроса о природе этого тока следует учесть, что эта фаза следовой гиперполяризации завершает вПД, когда в кардиомиоцитах желудочков сердца крысы активны К+-каналы сверхмедленного (Iss) тока и тока обратного выпрямления (IK1) [5–9], а также, потенциально, могут активироваться такие токи реполяризационного резерва, как глибенкламид-чувствительные, АТФ-зависимые К+-каналы (IKATP, Kir6.2 каналы) [12], апамин-чувствительные, Са2+-зависимые К+-каналы низкой проводимости (IKCa, SK-каналы) [13] и Kir3.x (IKACh, ацетилхолин-зависимого тока входящего выпрямления) [14]. Однако участие Iss и IK1 токов в формировании фазы следовой гиперполяризации маловероятно, поскольку эти токи подавлены в сердцах СТЗ-СД1 крыс (см. ссылки выше). Более того, роль активации каналов IK1 тока может быть исключена также и на основании отсутствия изменений в форме вПДсг при их регистрации с помощью электродов, заполненных Ва2+-содержащим раствором (рис. 5). Из трех других, использованных нами в экспериментах с локальной доставкой к месту регистрации блокаторов калиевых каналов, только локальная доставка апамина (блокатор Са2+-зависимых К+-каналов низкой проводимости; SK [13]) вела к подавлению фазы следовой гиперполяризации вПДсг (рис. 6). Глибенкламид (блокатор IKATP) не влиял, а 4-АР (блокатор Ito) увеличивал амплитуду следовой гиперполяризации (рис. 5). Таким образом, на основании полученных данных именно активность SK-каналов представляется ответственной за формирование вПДсг. При этом следует отметить, что мы не наблюдали изменения формы регистрируемых вПД в контрольных экспериментах с локальной доставкой апамина к сайтам регистрации в которых регистрировались “классические” вПД1 или вПД2, не имеющие выраженной фазы следовой гиперполяризации (рис. 6). Наиболее простое объяснение этого феномена заключается в отсутствие мишени для апамина (SK-каналов) в зоне регистрации вПД в этих случаях. Наконец, предположение о ведущей роли активности SK-каналов в генерации следовой гиперполяризации подтверждается и, казалось бы, неожиданным, увеличением амплитуды следовой гиперполяризации в экспериментах с локальной доставкой к месту регистрации вПДсг 4-аминопиридина. 4-АР в сердечных кардиомиоцитах подавляет Ito, калиевый ток, ответственный за раннюю реполяризацию и, соответственно, существенно ограничивающий активацию Са2+- каналов и вход Са2+ в клетку. Снятие этого ограничения при блокаде ранней реполяризации 4-АР, вне сомнения, должно сопровождаться активацией всех Са2+-зависимых механизмов, включая увеличение тока через SK-каналы и увеличение амплитуды следовой гиперполяризации.
SK-каналы широко распространены в тканях млекопитающих, включая сердце грызунов. Известны SK1, SK2 и SK3 изоформы каналов, кодируемые соответственно KCNN1, KCNN2 и KCNN3 генами [13]. Вне зависимости от изоформы все эти каналы характеризуются небольшой проводимостью (10–20 ps) для калия и активируются не напряжением, а внутриклеточным свободным Са2+ в субмикромолярных концентрациях [13]. В сердце грызунов, SK1 и SK2 изоформы наиболее представлены в предсердиях, тогда как SK3 изоформа демонстрирует сходные уровни экспрессии как в предсердиях, так и в желудочках [15, 16]. Нормальная активность предсердных SK-каналов является важным механизмом контроля длительности потенциалов действия кардиомиоцитов, а нарушения в этой активности – одним из патогенетических механизмов фибрилляции предсердий при инфаркте миокарда, сердечной недостаточности, предсердной и желудочковой аритмии [17, 18]. Тем не менее, в целом, вопрос о роли SK-каналов в норме и при сердечной патологии остается открытым. В частности, насколько нам известно, роль SK-каналов при развитии диабетической кардиомиопатии была исследована только в одной работе на СТЗ-модели Т1СД мыши [19] и в двух работах, использующих крысиные модели Т2СД [11, 20]. Все эти исследования были ограничены анализом экспрессии и функции предсердных SK и сходны в демонстрации подавляющего SK-токи в предсердных кардиомиоцитах эффекта СД. Полученные нами данные предполагают, что эффект СД на активность/экспрессию SK-каналов желудочковых кардиомиоцитов может быть диаметрально противоположен описанному ранее для предсердий, приводя к существенному (по сравнению с контролем) увеличению фракции вПДсг в экспериментах на желудочках сердец 2–8-недельных СТЗ-СД1 крыс. Подтверждение предполагаемого феномена, уточнение его природы и функционального значения требует дальнейших исследований, в частности, поскольку увеличение активности SK-каналов в кардиомиоцитах эпикарда желудочков сердца было идентифицировано как одна из причин развития желудочковой аритмии сердца [21].
Отдельного обсуждения заслуживает обновленная в данной работе классификация форм вПД (вПДсг выделены в отдельные категории сигналов) и наблюдения того, что при действии апамина вПД1сг трансформируются в вПД2 (рис. 6, левая нижняя панель), а в сердцах СТЗ-крыс увеличиваются по сравнению с контролем встречаемости вПД1 (однопиковых вПД без следовой гиперполяризации), вПД1сг и вПД2сг, но не вПД2 (двух-пиковые вПД без фазы следовой гиперполяризации (рис. 3a). Более того, фракция вПДсг возрастает пропорционально убыванию фракции вПД2 (рис. 3b). Ранее нами было обосновано, что с большой долей вероятности первый и второй негативные пики вПД волны формируются в результате активации, соответственно, входящих натриевого и кальциевого токов кардиомиоцита в зоне внеклеточной регистрации. Далее были также предоставлены аргументы в пользу того, что вПД1 регистрируется в тех случаях, когда кончик регистрирующего микроэлектрода (при условии его малого размера) оказался помещенным в зону клетки, свободную от выходов t-трубочек, характеризующуюся низкой плотностью кальциевых каналов. В то же время наличие под электродом выходов t-трубочек и доступа к Т-системе кардиомиоцита, мембрана которой насыщена Са2+-каналами, является условием регистрации вПД2 [22]. В рамках этой трактовки наши новые наблюдения предполагают, что вПД1сг – это в действительности вПД2 сигналы, в которых входящий Са2+-ток полностью маскируется выходящим К+-током SK-каналов (что объясняет трансформацию вПД1сг в вПД2 при в экспериментах с локальной доставкой апамина к месту регистрации). Второе, как было показано и ранее с использованием конфокальной микроскопии [3, 4], СТЗ-СД1 ассоциирован с дезорганизацией Т-системы кардиомиоцитов и уменьшением плотности устьев t-трубочек на поверхности мембраны (что объясняет увеличение фракции вПД1 в экспериментах в СТЗ-СД1 модели крысы). Наконец, в-третьих, предполагаемое увеличение активности SK-каналов в кардиомиоцитах диабетических животных происходит за счет увеличения экспрессии этих каналов в Т-системе кардиомиоцитов (объясняя обратную пропорциональность изменений во фракции вПДсг и вПД2 форм сигналов, регистрируемых в контроле, и на 2-й и более поздних неделях СТЗ-СД1).
В заключение, представленные здесь данные позволяют предположить, что СТЗ-СД1 ассоциируется с увеличением активности/экспрессии SK-каналов в кардиомиоцитах левого желудочка сердца крысы. Подтверждение этого предположения, а также изучение механизмов и выявление функционального значения предполагаемых изменений требует дальнейших исследований.
Список литературы
Kubasov IV, Dobretsov M (2012) Two types of extracellular action potentials recorded with narrow-tipped pipettes in skeletal muscle of frog, Rana temporaria. J Physiol 590: 2937–44. https://doi.org/10.1113/jphysiol.2012.230813
Kubasov IV, Stepanov A, Bobkov D, Radwanski PB, Terpilowski MA, Dobretsov M, Gyorke S (2018) Sub-cellular electrical heterogeneity revealed by loose patch recording reflects differential localization of sarcolemmal ion channels in intact rat hearts. Front Physiol 9: 1–9. https://doi.org/10.3389/fphys.2018.00061
Кубасов ИВ, Добрецов МГ, Бобков ДЕ, Панов АА (2020) Возможная взаимосвязь между полиморфизмом внеклеточно регистрируемых потенциалов действия и организацией Т-системы миоцитов желудочков и предсердий сердца крысы. Журн эвол биохим физиол 56: 299–302. [Kubasov IV, Dobretsov M, Bobkov DE, Panov AA (2020) Putative relationship between polymorphism of extracellularly recorded action potentials and organization of the T-tubular system in rat ventricular and atrial cardiomyocytes. J Evol Biochem Fusiol 56: 299–302. (In Russ)]. https://doi.org/10.31857/s0044452920040075
Кубасов ИВ, Чистякова ОВ, Сухов ИБ, Панов АА, Добрецов МГ (2020) Изменения внеклеточно регистрируемых потенциалов действия изолированного сердца крысы при развитии стрептозотоцинового диабета. Рос физиол журн им ИМ Сеченова 106: 1266–1277. [Kubasov IV, Chistyakova OV, Sukhov IB, Panov AA, Dobretsov M (2020) Functional changes in the T-system of cardiomyocytes of the isolated rat heart during development of streptozotocin-induced diabetes. Russ J Physiol 106: 1266–1277. (In Russ)]. https://doi.org/10.31857/s0869813920100052
Jourdon P, Feuvray D (1993) Calcium and potassium currents in ventricular myocytes isolated from diabetic rats. J Physiol 470: 411–429.
Shimoni Y, Ewart HS, Severson D (1998) Type I and II models of diabetes produce different modifications of K+ currents in rat heart: role of insulin. J Physiol 507 (Pt 2): 485–496.
Shimoni Y, Ewart HS, Severson D (1999) Insulin stimulation of rat ventricular K+ currents depends on the integrity of the cytoskeleton. J Physiol 514: 735–745. https://doi.org/10.1111/j.1469-7793.1999.735ad.x
Casis O, Gallego M, Iriarte M, Sánchez-Chapula JA (2000) Effects of diabetic cardiomyopathy on regional electrophysiologic characteristics of rat ventricle. Diabetologia 43: 101–109. https://doi.org/10.1007/s001250050013
Brouillette J, Clark RB, Giles WR, Fiset C (2004) Functional properties of K+ currents in adult mouse ventricular myocytes. J Physiol 559: 777–798. https://doi.org/10.1113/jphysiol.2004.063446
Grunnet M (2010) Repolarization of the cardiac action potential. Does an increase in repolarization capacity constitute a new anti-arrhythmic principle? Acta Physiol 198 (Suppl): 1–48.
Fu X, Pan Y, Cao Q, Li B, Wang S, Du H, Duan N, Li X (2018) Metformin restores electrophysiology of small conductance calcium-activated potassium channels in the atrium of GK diabetic rats. BMC Cardiovasc Disord 18: 1–8. https://doi.org/10.1186/s12872-018-0805-5
Negroni J, Lascano E, del Valle H (2012) Glibenclamide action on myocardial function and arrhythmia incidence in the healthy and diabetic heart. Cardiovasc Hematol Agents Med Chem 5: 43–53. https://doi.org/10.2174/187152507779315868
Gu M, Zhu Y, Yin X, Zhang DM (2018) Small-conductance Ca2+-activated K+ channels: insights into their roles in cardiovascular disease. Exp Mol Med 50: 1–7. https://doi.org/10.1038/s12276-018-0043-z
Мельников КН, Вислобоков АИ, Колпакова МЭ, Борисова ВА, Игнатов ЮД (2009) Калиевые ионные каналы клеточных мембран. Обзоры по клинической фармакологии и лекарственной терапии 7: 3–27. [Mel’nikov KN, Vislobokov AI, Ignatov YD, Kolpakova ME, Borisova VA (2009) Potassium of ionic channels of cellular membranes Reviews on clinical pharmacology and drug therapy 7: 3–27. (In Russ)].
Xu Y, Tuteja D, Zhang Z, Xu D, Zhang Y, Rodriguez J, Nie L, Tuxson HR, Young JN, Glatter KA, Vázquez AE, Yamoah EN, Chiamvimonvat N (2003) Molecular identification and functional roles of a Ca(2+)-activated K+ channel in human and mouse hearts. J Biol Chem 278: 49085–49094. https://doi.org/10.1074/jbc.M307508200
Tuteja D, Xu D, Timofeyev V, Lu L, Sharma D, Zhang Z, Xu Y, Nie L, Vázquez AE, Nilas Young J, Glatter KA, Chiamvimonvat N (2005) Differential expression of small-conductance Ca2+-activated K+ channels SK1, SK2, and SK3 in mouse atrial and ventricular myocytes. Am J Physiol Hear Circ Physiol 289: 2714–2723. https://doi.org/10.1152/ajpheart.00534.2005
Diness JG, Bentzen BH, Sørensen US, Grunnet M (2015) Role of calcium-activated potassium channels in atrial fibrillation pathophysiology and therapy. J Cardiovasc Pharmacol 66: 441–448. https://doi.org/10.1097/FJC.0000000000000249
Daniel E Shumer NJNNPS (2017) SK Channels and Ventricular Arhythmias in Heart Failure. Physiol Behav 176: 139–148. https://doi.org/10.1016/j.tcm.2015.01.010.SK
Yi F, Ling TY, Lu T, Wang XL, Li J, Claycomb WC, Shen WK, Lee HC (2015) Down-regulation of the small conductance calcium-activated potassium channels in diabetic mouse atria. J Biol Chem 290: 7016–7026. https://doi.org/10.1074/jbc.M114.607952
Liu CH, Hua N, Fu X, Pan YL, Li B, Li XD (2018) Metformin regulates atrial SK2 and SK3 expression through inhibiting the PKC/ERK signaling pathway in type 2 diabetic rats. BMC Cardiovasc Disord 18: 1–9. https://doi.org/10.1186/s12872-018-0950-x
Gui L, Bao Z, Jia Y, Qin X, Cheng ZJ, Zhu J, Chen QH (2013) Ventricular tachyarrhythmias in rats with acute myocardial infarction involves activation of small-conductance Ca2+-activated K+ channels. Am J Physiol Hear Circ Physiol 304: 118–130. https://doi.org/10.1152/ajpheart.00820.2011
Hong TT, Shaw RM (2017) Cardiac t-tubule microanatomy and function. Physiol Rev 97: 227–252. https://doi.org/10.1152/physrev.00037.2015
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


