Российский физиологический журнал им. И.М. Сеченова, 2021, T. 107, № 9, стр. 1100-1111
Антагонист грелина [D-Lys3]-GHRP-6 снижает проявления поведения риска в модели игровой зависимости у крыс, изменяя обмен дофамина и серотонина
А. А. Лебедев 1, *, И. В. Карпова 1, Е. Р. Бычков 1, Н. Д. Якушина 1, И. Ю. Тиссен 1, К. Е. Грамота 1, Н. С. Ефимов 1, П. Д. Шабанов 1
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
* E-mail: aalebedev-iem@rambler.ru
Поступила в редакцию 15.01.2021
После доработки 30.03.2021
Принята к публикации 31.03.2021
Аннотация
Исследовали действие антагониста рецепторов грелина [D-Lys3]-GHRP-6 на элементы игровой зависимости и обмен моноаминов в головном мозге крыс. У самцов крыс в течение 21-го дня вырабатывали пищевой рефлекс в трехлучевом лабиринте. В качестве вознаграждения использовали семена подсолнечника. В течение первых пяти дней в конце 1-го рукава животные получали 1 семя, в конце 2-го рукава – 2 семени и в конце 3-го рукава – 3 семени. Далее режим выдачи подкрепления изменяли: в 1-ом рукаве за каждый заход животные продолжали получать 1 семя, во 2-ом рукаве – по 2 семени, но за каждый 2-й заход, а в 3-ем рукаве – по 3 семени, но за каждый 3-й заход в данный рукав. Таким образом, при посещении первого рукава величина вознаграждения была минимальной, а вероятность его получения – максимальной. Посещение третьего рукава подкреплялось максимально, но с самой низкой долей вероятности. Крысам, выработавшим устойчивый навык побежек в лабиринте, интраназально вводили 0.9%-ный раствор NaCl или D-Lys3-GHRP-6 и исследовали поведение животных. Через 3 дня после тестирования поведения под действием препарата крысам повторно вводили 0.9%-ный NaCl или D-Lys3-GHRP-6. Через 80 мин крыс декапитировали, из головного мозга выделяли гипоталамус, гиппокамп, стриатум и обонятельный бугорок (компонент вентрального стриатума), где методом ВЭЖХ определяли содержание дофамина, серотонина и их метаболитов. Показано, что антагонист рецепторов грелина [D-Lys3]-GHRP-6 (20 мкл, 1 мг/мл, интраназально) повышал количество заходов в 1-й рукав лабиринта (с самой высокой вероятностью, но наименьшей величиной вознаграждения). Препарат не влиял на показатели обмена дофамина и серотонина в гипоталамусе. Под действием [D-Lys3]-GHRP-6 в левом гиппокампе достоверно повышалось содержание серотонина. Показатели обмена моноаминов в обонятельном бугорке и стриатуме изменялись только в правом полушарии, при этом в обеих структурах возрастало отношение содержания 5-гидроксииндолуксусной кислоты к содержанию серотонина. В правом стриатуме данные изменения также сопровождались повышением содержания метаболитов серотонина и дофамина. Таким образом, в основе способности препарата [D-Lys3]-GHRP-6 измененять стратегию выбора в пользу наибольшей вероятности, но наименьшей величины подкрепления лежит возрастание активности дофаминергической и серотонинергической систем в дорсальном и ветральном стриатуме правого полушария головного мозга и содержания серотонина – в гиппокампе левого полушария.
Игровая зависимость как объект для изучения представляет особый интерес. В международных классификаторах современных редакций (ICD 10 и DSM-5) она выделяется в виде отдельного заболевания, является одной из нехимических форм зависимости и имеет все присущие традиционному пониманию этого термина характеристики: развитие толерантности (привыкание), развитие собственно зависимости и соответствующего ей синдрома отмены [1]. Несмотря на общее признание игромании как самостоятельного заболевания, не существует единых или общепринятых подходов к терапии данного состояния, как нет и ни одного зарегистрированного по данному показанию лекарственного средства. Существует однако опыт использования различных психотерапевтических подходов [2]. Современная терапия использует препараты различных классов: антидепрессанты, антагонисты опиоидных рецепторов, нормотимики, NMDA-антагонисты и антипсихотики [3].
Методы скрининговой диагностики игромании сосредоточены на использовании опросников, а наиболее объективным способом оценки степени проявления азартности субъекта в лабораторных условиях является метод IOWA gambling task, основанный на помещении субъекта в ситуацию непредсказуемого или частично предсказуемого выбора с разновероятностным подкреплением и последующей оценке способности испытуемого рационально действовать в условиях непредсказуемого выбора для максимизации собственной выгоды. В последние годы IOWA gambling task стал применяться в опытах на животных [4]. В нашей лаборатории был разработан вариант модели данного теста в трехлучевом лабиринте у крыс [5].
Стимулом для проведения настоящего исследования послужили данные об участии нейропептидов и моноаминов в механизмах игровой зависимости [4, 6]. В формировании игровой зависимости участвует ряд нейропептидов: CRF, орексин, грелин и опиоиды [7, 8]. Изменения в регуляции гипоталамо-гипофизарно-надпочечниковой системы также непосредственно связаны с появлением поведения риска и азарта при формировании игровой зависимости. В частности, игровая зависимость связана с высоким уровнем кортизола и адреналина [9].
Особый интерес могут предствлять нейропептиды, для которых было показано участие в процессах формирования других форм зависимостей и в механизмах подкрепления. К таким нейропептидам, в частности, относится грелин. Он вырабатывается в желудке и гипоталамусе, состоит из 28 аминокислот, его рецептором служит GHSR1A [10, 11]. Грелин участвует в механизмах подкрепления и в формировании зависимости от психоактивных средств на фоне стрессорных факторов и обстановочных раздражителей [12, 13]. Показано наличие рецепторов грелина в структурах мозга с высоким содержанием моноаминов и участвующих в развитии игровой зависимости: вентральной области покрышки, вентромедиальном ядре гипоталамуса, гиппокампе [14]. Кроме того, грелиновый рецептор проявляет способность к димеризации с рецепторами дофамина, серотонина и меланокортина [15]. Таким образом, в основе механизмов участия грелина в этих процессах может лежать его взаимодействие с моноаминергическими системами головного мозга. Поскольку у лабораторных грызунов обнаружена асимметрия содержания моноаминов [16], мы предположили, что характер данного взаимодействия в симметричных зонах левого и правого полушария может быть различным.
Целью работы было изучение проявления поведения риска в модели игровой зависимости на фоне действия антагониста грелина [D-Lys3]-GHRP-6, также его влияние на содержание дофамина, серотонина и их метаболитов в симметричных отделах головного мозга у крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
В работе было использовано 26 крыс-самцов линии Вистар, полученных из питомника лабораторных животных “Рапполово” (Ленинградская область). Животных содержали в условиях вивария в стандартных клетках при свободном доступе к воде и пище в условиях инвертированного света 8.00–20.00 при температуре 22 ± 2°С. Все опыты проведены в соответствии с Женевской конвенцией International guiding principles for biomedical research involving animals (Geneva, 1990), Хельсинской декларацией 2000 г. и протоколом GLP о гуманном отношении к животным (Директива Европейского сообщества № 2010/63/ЕС).
Установка для тестирования элементов игровой зависимости состояла из стартовой площадки (35 × 50 × 35 см) и трех рукавов по 50 × 15 × 35 см. В конце каждого рукава установки находилась кормушка. В качестве вознаграждения служили семена подсолнечника. Крысу помещали на стартовую площадку, затем она совершала побежку по рукаву лабиринта и достигала пищевого подкрепления. Когда крыса возвращалась обратно на стартовую площадку, в кормушку, расположенную в конце посещенного рукава, автоматически подавалась новая порция пищевого подкрепления. Определяли число заходов в рукава и выходы из них в течение 10 мин. В дни эксперимента животных кормили только после окончания опыта, длящегося в течение 4-х ч, поэтому к следующему опыту животных 20 ч выдерживали без пищи. Обучение длилось в течение 21-го дня. В первые 5 дней тестирования заход в первый рукав лабиринта подкреплялся 1 семенем подсолнечника, заход во второй рукав – 2 семенами и заход в третий рукав – 3 семенами. На 6-й день животных переводили на стандартный режим кормления, и обучение в лабиринте не производили. На 7-й день обучение также не производили, но возобновляли 20-ти часовую пищевую депривацию. Начиная с 8-го дня, в течение двух недель в кормушку 1-го рукава подавали 1 семя при каждой побежке в данный рукав, в кормушку 2-го рукава подавали 2 семени после каждого второго посещения данного рукава, в кормушку 3-го рукава – 3 семени после каждого третьего его посещения. Крыс, которые не обучались в течение первых 5-ти дней (не производили побежек в лабиринте, 15% животных), в дальнейшем в эксперименты не включали [5].
В качестве антагониста рецепторов грелина использовали D-Lys3-GHRP-6 (Tocris, Великобритания). Препарат в концентрации 1 мг/мл вводили интраназально в объеме 20 мкл (10 мкл в каждую ноздрю), таким образом, разовая доза препарата на животное составляла 20 мкг. Контрольные крысы получали эквивалентный объем 0.9%-ного раствора NaCl. На протяжении исследования препарат животным вводили дважды: в первый раз – за 20 мин до исследования поведения, во второй – через три дня после тестирования поведения, за 80 мин до декапитации крыс.
Определение содержания дофамина, серотонина и их метаболитов в структурах мозга проводили методом высокоэффективной жидкостной хроматографии с электрохимической детекцией (ВЭЖХ/ЭД). Известно, что продолжительность действия фармакологических препаратов пептидной природы обычно ограничивается 48-ю часами, поэтому исследование действия пептидного антагониста грелина [D-Lys3]-GHRP-6 на обмен моноаминов проводили через 3 дня после тестирования его влияния на поведение. Крыс декапитировали через 80 мин после интраназального введения [D-Lys3]-GHRP-6. С вентральной поверхности мозга отщипывали обонятельный бугорок (элемент вентрального стриатума). Дорсальный стриатум (в дальнейшем – стриатум), гипоталамус и дорзальный гиппокамп (в дальнейшем – гиппокамп) выделяли из коронарных срезов мозга в соответствии с атласом мозга крысы [17]. Ткани соответствующих структур левой и правой сторон мозга помещали в отдельные пробирки и хранили до хроматографического анализа при температуре –80°С.Образцы мозга гомогенизировали в 0.1 N растворе HCl и центрифугировали при 14 000 g в течение 15 мин. Содержание дофамина (ДА), диоксифенилуксусной кислоты (ДОФУК), гомованилиновой кислоты (ГВК), серотонина (5-ГТ) и гидроксииндолуксусной кислоты (5-ГИУК) определяли на хроматографической системе BeckmanCoulter с амперометрическим детектором LC-4CBAS [18]. На аналитическую колонку Phenomenex (4.6 × 250.0 мм) с сорбентом SphereCloneODS2 наносили 20 мкл супернатанта образца мозга. Определение содержания моноаминов и их метаболитов проводили при потенциале +0.70 В. Подвижная фаза содержала 5.5 мМ цитрат-фосфатного буфера, 0.7 мМ октансульфоновой кислоты, 0.5 мМ EDTA и 8% ацетонитрила (рН 3.0). Скорость потока подвижной фазы составляла 1 мл/мин. Содержание моноаминов и их метаболитов в структурах мозга выражали в нг на мг ткани.
Полученные данные анализировали с использованием пакета статистических программ GraphPad PRISM 6.0 (GraphPad Software, США). Результаты исследования поведения животных обрабатывали методом однофакторного дисперсионного анализа ANOVA, используя критерий попарных сравнений групп Стьюдента–Ньюмена–Кейлса и Данна. Межполушарные различия в показателях обмена моноаминов в структурах мозга оценивали с помощью парного критерия Вилкоксона, а различия в соответствующих показателях между контрольной и экспериментальной группами животных – с помощью непарного критерия Манна–Уитни.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
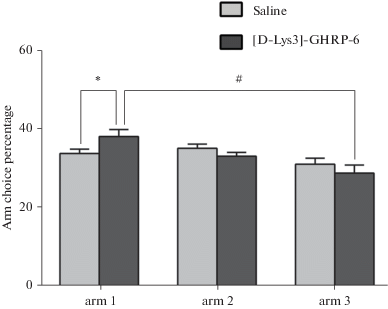
В течение первых 5–6 дней обучения у крыс часто наблюдали локомоторную активность и исследовательские реакции в в пределах стартовой площадки установки для тестирования игровой зависимости. На второй неделе обучения пищевой рефлекс стал полностью доминировать в поведении: животные производили заходы в рукава с кормушками и достигали пищи. К концу третьей недели тестирования крысы демонстрировали до 50 побежек к кормушкам за эксперимент. При этом количество побежек к кормушкам каждого из рукавов лабиринта был на одном уровне. Повторение тестирования в течение четырех дней показало, что процентное соотношение числа побежек к кормушкам 1-го, 2-го и 3-го рукавов сохранялось на одном уровне, т.е. в целом по обученной группе крыс не наблюдалось преобладания какого-либо из рукавов лабиринта (рис. 1). Последнее обстоятельство является важным для стабилизации полученного навыка по группе животных в условиях применения IOWA теста. При тестировании действия антагониста грелиновых рецептров [D-Lys3]-GHRP-6 у животных достоверно (p ≤ 0.05) изменялось соотношение побежек к кормушкам 1-го, 2-го и 3-го рукавов по сравнению с контролем (0.9%-ный раствор NaCl). После введения [D-Lys3]-GHRP-6 процент числа заходов в первый рукав (к кормушке 1) повышался достоверно (p ≤ 0.05) по сравнению с контролем (0.9%-ный раствор NaCl) и по сравнению с заходами в третий рукав (к кормушке 3) (p ≤ 0.05) (рис. 1).
Рис. 1.
Влияние интраназального введения [D-Lys3]-GHRP-6 на поведение животных в трехлучевом лабиринте в ситуации выбора вероятности и величины пищевого подкрепления. * – p ≤ 0.05 по сравнению с группой животных, получавших физиологический раствор; # – p ≤ 0.05 внутригрупповое сравнение заходов в различные рукава трехлучевого лабиринта у животных, получавших [D-Lys3]-GHRP-6.
Введение антагониста рецепторов грелина [D-Lys3]-GHRP-6 у крыс сопровождалось унилатеральными изменениями метаболизма моноаминов в гиппокампе, обонятельном бугорке и стриатуме. После введения препарата содержание 5-ГТ в левом гиппокампе достоверно повышалось на 53.4% (p ≤ 0.05, табл. 1) по сравнению с введением физиологического раствора (контроль). При этом соотношение 5-ГИУК/5-ГТ в данной структуре мозга снижалось на 29.8% (p ≤ 0.05). В правом обонятельном бугорке данное соотношение, напротив, достоверно повышалось на 25.7% (p ≤ 0.05, табл. 1). В правом стриатуме после введения [D-Lys3]-GHRP-6 было зарегистрировано повышение содержания 5-ГИУК на 37.5% (p ≤ 0.05). Кроме изменения уровня метаболита 5-ГТ, в правом стриатуме после введения препарата увеличивалось содержание метаболитов ДА: уровень ДОФУК по сравнению с введением физиологического раствора возрастал на 38.9% (p ≤ 0.05, табл. 2), а ГВК – в 2.2 раза (p ≤ 0.05, табл. 3). В гипоталамусе достоверных изменений показателей обмена моноаминов после введения [D-Lys3]-GHRP-6 отмечено не было (табл. 1–3).
Таблица 1.
Уровень серотонина, его метаболита (нг/мг ткани) и значение показателя обмена серотонина в структурах головного мозга крыс после введения антагониста рецепторов грелина [D-Lys3]-GHRP-6
| Группа крыс | 5-ГТ | 5-ГИУК | 5-ГИУК/5-ГТ | |||
|---|---|---|---|---|---|---|
| левое полушарие |
правое полушарие |
левое полушарие |
правое полушарие |
левое полушарие |
правое полушарие |
|
| Гиппокамп | ||||||
| Контроль (0.9%-ный NaCl) |
0.19 ± 0.02 | 0.21 ± 0.01 | 0.28 ± 0.03 | 0.32 ± 0.02 | 1.48 ± 0.08 | 1.46 ± 0.02 |
| [D-Lys3]-GHRP-6 | 0.30 ± 0.03* | 0.25 ± 0.04 | 0.29 ± 0.01 | 0.33 ± 0.03 | 1.04 ± 0.08* | 1.34 ± 0.11 |
| Обонятельный бугорок | ||||||
| Контроль (0.9%-ный NaCl) |
0.47 ± 0.03 | 0.51 ± 0.02 | 0.33 ± 0.01 | 0.34 ± 0.01 | 0.71 ± 0.04 | 0.68 ± 0.03 |
| [D-Lys3]-GHRP-6 | 0.45 ± 0.04 | 0.43 ± 0.05 | 0.36 ± 0.03 | 0.36 ± 0.03 | 0.80 ± 0.04 | 0.86 ± 0.05* |
| Стриатум | ||||||
| Контроль (0.9%-ный NaCl) |
0.29 ± 0.03 | 0.22 ± 0.02 | 0.32 ± 0.02 | 0.25 ± 0.03 | 1.15 ± 0.14 | 1.19 ± 0.15 |
| [D-Lys3]-GHRP-6 | 0.26 ± 0.03 | 0.30 ± 0.02 | 0.34 ± 0.03 | 0.35 ± 0.03* | 1.37 ± 0.19 | 1.17 ± 0.04 |
| Гипоталамус | ||||||
| Контроль (0.9%-ный NaCl) |
0.43 ± 0.036 | 0.40 ± 0.03 | 0.40 ± 0.05 | 0.38 ± 0.03 | 0.91 ± 0.05 | 0.96 ± 0.08 |
| [D-Lys3]-GHRP-6 | 0.47 ± 0.04 | 0.44 ± 0.02 | 0.45 ± 0.04 | 0.48 ± 0.04 | 0.98 ± 0.10 | 1.11 ± 0.11 |
Таблица 2.
Уровень дофамина, диоксифенилуксусной кислоты (нг/мг ткани) и значение соотношения ДОФУК/ДА в структурах головного мозга крыс после введения антагониста рецепторов грелина [D-Lys3]-GHRP-6
| Группа животных | ДА | ДОФУК | ДОФУК/ДА | |||
|---|---|---|---|---|---|---|
| левое полушарие |
правое полушарие |
левое полушарие |
правое полушарие |
левое полушарие |
правое полушарие |
|
| Обонятельный бугорок | ||||||
| Контроль (0.9%-ный NaCl) |
0.32 ± 0.02 | 0.34 ± 0.02 | 0.19 ± 0.02 | 0.21 ± 0.02 | 0.61 ± 0.06 | 0.63 ± 0.07 |
| [D-Lys3]-GHRP-6 | 0.30 ± 0.04 | 0.31 ± 0.03 | 0.19 ± 0.03 | 0.23 ± 0.02 | 0.63 ± 0.02 | 0.74 ± 0.07 |
| Стриатум | ||||||
| Контроль (0.9%-ный NaCl) |
0.54 ± 0.05 | 0.42 ± 0.04 | 0.37 ± 0.05 | 0.27 ± 0.02 | 0.67 ± 0.04 | 0.65 ± 0.07 |
| [D-Lys3]-GHRP-6 | 0.50 ± 0.03 | 0.51 ± 0.03 | 0.39 ± 0.05 | 0.37 ± 0.03* | 0.76 ± 0.06 | 0.73 ± 0.03 |
| Гипоталамус | ||||||
| Контроль (0.9%-ный NaCl) |
0.05 ± 0.01 | 0.04 ± 0.01 | 0.03 ± 0.01 | 0.04 ± 0.01 | 0.60 ± 0.15 | 0.91 ± 0.10 |
| [D-Lys3]-GHRP-6 | 0.08 ± 0.01 | 0.06 ± 0.01 | 0.06 ± 0.01 | 0.04 ± 0.01 | 0.82 ± 0.19 | 1.11 ± 0.24 |
Таблица 3.
Уровень метаболита дофамина – гомованилиновой кислоты – и значение соотношения ГВК/ДА в стриатуме и гипоталамусе крыс после введения антагониста рецепторов грелина [D-Lys3]-GHRP-6
| Группа животных | ГВК (нг/мг ткани) | ГВК/ДА | ||
|---|---|---|---|---|
| левое полушарие |
правое полушарие |
левое полушарие |
правое полушарие |
|
| Обонятельный бугорок | ||||
| Контроль (0.9%-ный NaCl) |
0.14 ± 0.02 | 0.11 ± 0.03 | 0.44 ± 0.07 | 0.39 ± 0.05 |
| [D-Lys3]-GHRP-6 | 0.10 ± 0.03 | 0.14 ± 0.03 | 0.39 ± 0.13 | 0.43 ± 0.08 |
| Стриатум | ||||
| Контроль (0.9%-ный NaCl) |
0.21 ± 0.05 | 0.09 ± 0.04 | 0.36 ± 0.07 | 0.22 ± 0.10 |
| [D-Lys3]-GHRP-6 | 0.26 ± 0.03 | 0.21 ± 0.02* | 0.54 ± 0.07 | 0.41 ±0.02 |
| Гипоталамус | ||||
| Контроль (0.9%-ный NaCl) |
0.19 ± 0.07 | 0.11 ± 0.05 | 2.98 ± 1.18 | 2.16 ± 0.69 |
| [D-Lys3]-GHRP-6 | 0.24 ± 0.05 | 0.22 ± 0.06 | 2.72 ± 0.43 | 3.55 ± 1.59 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как было показано в настоящих экспериментах, антагонист грелиновых рецепторов [D-Lys3]-GHRP-6 повышал число побежек в первый рукав лабиринта, что говорит о проявлении у животных менее рискованного поведения, наблюдающегося в ситуации выбора разновероятного подкрепления. Ранее нами были показаны разнонаправленные эффекты грелина и [D-Lys3]-GHRP-6 в трехлучевом лабиринте. Введение грелина повышало соотношение побежек в сторону третьего рукава лабиринта с низкой вероятностью, но большей величиной вознаграждения [8]. Таким образом, настоящими исследованиями мы подтвердили включение грелиновой системы в механизмы разновероятного подкрепления и применили эти группы животных для дальнейшего анализа обмена медиаторов в головном мозге после введения антагониста грелина [D-Lys3]-GHRP-6.
В настоящем исследовании с помощью ВЭЖХ/ЭД были получены достоверные различия показателей обмена ДА и 5-ГТ в структурах переднего мозга после введения антагониста грелина [D-Lys3]-GHRP-6 у крыс (табл. 1–3). При введении [D-Lys3]-GHRP-6 содержание 5-ГТ достоверно повышалось в в гиппокампе левого полушария, при этом уровень 5-ГИУК (метаболита 5-ГТ) не изменялся, в результате чего соотношение 5-ГТ/5-ГИУК уменьшалось. Таким образом, обнаруженное нами повышение уровня 5-ГТ в гиппокампе не обязательно свидетельствует о возрастании синаптического выброса данного медиатора, а, напротив, может быть следствием накопления медиатора в терминалях. Остальные изменения касались только правого полушария. В частности, отношение 5-ГИУК/5-ГТ в обонятельном бугорке достоверно повышалось в правом полушарии, что свидетельствует либо о повышенном выбросе 5-ГТ, либо об активации серотонинового транспортера в данной структуре мозга. В стриатуме правого полушария повышалось не только содержание 5-ГИУК – метаболита серотонина, но и уровень метаболитов ДА (ГВК и ДОФУК). Поскольку фермент образования ГВК – катехол-О-метилтрансфераза (КОМТ) – локализован экстраклеточно, повышение уровня данного метаболита свидетельствует об усилении синаптического выброса ДА. В свою очередь, возрастание уровня ДОФУК и 5-ГИУК позволяют предположить, что под влиянием препарата в правом стриатуме может повышаться активность моноаминовых транспортеров. Таким образом, у крыс, согласно нашим данным, выбор менее рискованной программы поведения, происходящий под действием препарата [D-Lys3]-GHRP-6, ассоциируется со снижением активности серотонинергической системы в гиппокампе левого полушария мозга и ее возрастании в структурах дорсального (собственно стриатум) и вентрального (обонятельный бугорок) стриатума правого полушария мозга, которое в правом стриатуме сопровождается усилением дофаминергической передачи.
Полученные данные во многом согласуются с данными литературы, хотя прямых соответствий не отмечается. Ранее было показано, что появление исследовательского и рискованного поведения в IOWA тесте у мышей C57Bl/6J связано с высоким уровнем ДА, 5-ГТ и норадреналина в гиппокампе [19]. Согласно данным литературы, у животных, склонных к рискованному поведению, в гиппокампе также происходит активация рецепторов глутамата [20]. Предполагается, что изменение активности основных медиаторных систем головного мозга в гиппокампе происходит в результате взаимодействия внутриклеточных сигнальных систем. Показано, что грелин стимулирует фосфорилирование NR1 субъединицы NMDA-рецепторов через протеинкиназа-А-зависимые механизмы [20]. В настоящей работе интраназальное введение антагониста рецепторов грелина вызывало изменение активности серотонинергической системы в гиппокампе левого полушария, что, возможно, приводило к снижению глутаматергической нейропередачи в данной стуктуре мозга. На поведенческом уровне это проявлялось выбором подкрепления с меньшей силой, но с большей вероятностью его получения. Ранее было показано, что гиппокампэктомированные крысы проявляют ответы только на пищевое подкрепление с высокой вероятностью [21]. При этом у них полностью сохраняется способность к формированию новых временных связей. В то же время известно, что после удаления гиппокампа у животных дифференцировка при образовании условных рефлексов вырабатывается даже быстрее, чем у контрольных крыс. Таким образом, гиппокамп отвечает на подрепляющие агенты среды, которые могут реализоваться с малой вероятностью [21]. Антагонист рецепторов грелина, по-видимому, снижает активацию гиппокампа на сигналы маловероятных событий, что и является перспективой для коррекции игровой зависимости.
Однонаправленные повышения содержания метаболитов ДА и 5-ГТ, а также увеличение соотношения метаболит/медиатор в структурах вентрального и дорсального стриатума правого полушария после введения [D-Lys3]-GHRP-6 говорит о повышении активности указанных нейрохимических систем правого полушария, что также может служить одним из внутримозговых механизмов коррекции поведения при игровой зависимости. Таким образом, в основе выбора более высоковероятного, но, в то же время, меньшего подкрепления на фоне [D-Lys3]-GHRP-6 лежит правосторонняя активация мезолимбической и нигростриатной дофаминергических систем на фоне усиления выброса 5-ГТ в стриатуме правого полушария. Исходное снижение активности указанных нейрохимических систем у лиц с игровой зависимостью было отмечено ранее в ряде исследований. Показано, что дофаминергическая и серотонинергическая системы, которые, как известно, способствуют функциональной связи между лимбической и корковой областями, являются важными кандидатами для модуляции принятия решений.
Важно отметить, что несмотря на то, что рецепторы грелина активно экспрессируются в гипоталамусе [14], [D-Lys3]-GHRP-6 достоверно не влиял на показатели обмена ДА и 5-ГТ в данной структуре мозга. Таким образом, изменение стратегии поведения, происходящее под действием препарата, в большей степени ассоциируется со способностью препарата влиять на обмен моноаминов в структурах переднего мозга.
Сдвиги в функционировании указанных нейрохимических систем лежат в основе патологической зависимости от азартных игр, психического расстройства, связанного с чрезмерным рискованным поведением и неадекватным принятием решений [22]. У человека было выделено несколько полиморфизмов в генах ферментов метаболизма 5-ГТ и ДА, которые влияют на функцию лобной коры и лимбической системы, определяющих личностные черты (например, невротизм, избегание опасности, настойчивость и стремление к новизне), которые играют центральную роль в принятии решений [23]. С результатами наших экспериментов согласуются данные, полученные на человеке, свидетельствующие о том, что существует обратная зависимость между уровнем 5-ГТ и импульсивностью, которая может влиять на принятие решений. Например, лица, употребляющие серотонинергический нейротоксический препарат МДМА, демонстрируют повышенную импульсивность [24]. Некоторые варианты генов, связанных с функционированием серотонинергической системы, ассоциируются с дефицитом в принятии решений во время азартных игр. В частности, пациенты с депрессией, которые совершали ошибки и демонстрировали повышенный выбор неблагоприятных вариантов в игре, оказались носителями особой формы гена серотонинового транспортера (5‑HTTLPRs) [25]. Одно из предположений заключается в том, что люди, несущие аллель 5-HTTLPRs, обладают повышенной бдительностью, что является преимуществом, когда стимулы окружающей среды можно контролировать и управлять ими. Действительно, в задаче принятия рискованного решения с явным указанием вероятности выбора испытуемые выбирали более выгодные решения из-за повышенного риска неблагоприятных исходов. Напротив, в условиях неопределенности стимулов, например, во время игрового теста, носители аллеля 5-HTTLPRs проявляли дезадаптивное поведение [26]. В целом, эти данные указывают на то, что серотонинергическая синаптическая передача может отрицательно влиять на принятие решений в игровых тестах. Обнаруженная нами способность препарата [D-Lys3]-GHRP-6, снижающего проявления рискованного поведения, активировать серотонинергическую систему согласуется с данными представлениями.
В исследованиях на человеке было показано, что изменения в дофаминергической системе также влияют на выбор более выгодных решений в игровом тесте. Снижение эффективности выбора наблюдалось у больных с патологией, связанной с дисфункцией ДА, в частности, при шизофрении, болезни Паркинсона, наркомании и игромании [27]. По данным позитронно-эмиссионной томографии, у здоровых мужчин высвобождение ДА в вентральном стриатуме положительно коррелирует с показателями игровой активности, а у патологических игроков – отрицательно [28]. Тем не менее, в нашем исследовании на крысах не было обнаружено влияния антагониста грелина [D-Lys3]-GHRP-6 на показатели обмена ДА в обонятельном бугорке, который является частью вентрального стриатума. Вместе с тем, в дорсальном стриатуме препарат вызывал существенное возрастание содержания метаболитов ДА, что свидетельствует о повышении выброса и обратного захвата данного медиатора в структуре мозга, которая в большей степени ассоциируется с организацией двигательных программ, чем с регуляцией эмоционального состояния. Примечательно, что указанный эффект был отмечен только в правом стриатуме. Таким образом, можно предположить, что активация дофаминергической системы правого стриатума у крыс ассоциируются с выбором программы поведения, направленной на регулярное получение подкрепления, а не на достижение максимального, но маловероятного вознаграждения. Известно, что ДА участвует в ассоциативном обучении, восприятии времени и передаче сигналов в системе вознаграждения, которые являются фундаментальными процессами, необходимыми для принятия решений. Снижение уровня ДА ухудшает процесс принятия решений у здоровых людей. Это может быть связано со снижением восприятия вероятности и времени [29]. В задаче по принятию решения о риске, в которой испытуемые были разделены на группы на основе того выбора из предложенных вариантов, который они совершали, носители аллеля DRD4 были более склонны к риску по сравнению с людьми с отсутствием данного аллеля. Последнее говорит о том, что аллель DRD4 связан с новизной. Что касается полиморфизма в гене DRD4, здоровые мужчины-носители аллеля этого гена выбирают значительно больше карт из неблагоприятных колод [29]. В совокупности, эти данные говорят о том, что ДА, возможно, во взаимодействии с 5-ГТ, может модулировать принятие решений при игровых тестах.
ВЫВОДЫ
1. Выбор наименьшей степени риска при снижении величины подкрепления на фоне введения [D-Lys3]-GHRP-6 сопровождается однонаправленным повышением содержания метаболитов дофамина и серотонина, а также увеличением соотношения метаболит/медиатор в вентральном и дорсальном стриатуме правого полушария, что говорит о повышении активности указанных нейрохимических систем правого полушария и может являться одним из внутримозговых механизмов коррекции игровой зависимости.
2. Выбор наименьшей степени риска при снижении величины подкрепления на фоне введения [D-Lys3]-GHRP-6 ассоциируется с повышением содержания серотонина в гиппокампе левого полушария. Антагонист рецепторов грелина, по-видимому, снижает активацию гиппокампа на сигналы маловероятных событий за счет воздействия на серотонинергическую передачу в данной структуре мозга левого полушария, что делает препарат перспективным для коррекции игровой зависимости.
Список литературы
Blaszczynski A, Collins P, Fong D, Ladouceur R, Nower L, Shaffer HJ, Tavares H, Venisse JL (2011) Responsible gambling: general principles and minimal requirements. J Gambl Stud 27(4): 565–573. https://doi.org/10.1007/s10899-010-9214-0
Petry NM (2003) Patterns and correlates of Gamblers Anonymous attendance in pathological gamblers seeking professional treatment. Addict Behav 28: 1049–1062. https://doi.org/10.1016/s0306-4603(02)00233-2
Grant JE, Odlaug BL, Schreiber LRN (2014).Pharmacological treatments in pathological gambling. Br J Clin Pharmacol 77(2): 375–381. https://doi.org/10.1111/j.1365-2125.2012.04457.x
Zeeb FD, Robbins TW, Winstanley CA (2009) Serotonergic and dopaminergic modulation of gambling behavior as assessed using a novel rat gambling task. Neuropsychopharmacology 34(10): 2329–2343. https://doi.org/10.1038/npp.2009.62
Лебедев АА, Якушина НД, Грамота КЕ, Тиссен ИЮ, Бычков ЕР, Шабанов ПД (2018) Моделирование игровой зависимости у крыс в ситуации выбора силы и вероятности пищевого подкрепления в лабиринте. Наркология 17(5): 31–35 [Lebedev AA, Yakushina ND, Diploma KE, ThyssenI.Yu, Bychkov ER, Shabanov PD (2018) Modeling of gambling in rats in the situation of choosing the strength and the probability of food reinforcement in the maze. Narcology 17(5): 31–35 (In Russ)]. https://doi.org/10.25557/1682-8313.2018.05.31-35
Шабанов ПД, Якушина НД Лебедев АА (2020) Фармакология пептидных механизмов игрового поведения у крыс. Вопр наркол 187(4): 24–44 [Shabanov PD, Yakushina ND Lebedev AA (2020) Pharmacology of peptide mechanisms of play behavior in rats. Vopr Narkol 187(4): 24–44 (In Russ)]. https://doi.org/10.47877/0234-0623_2020_4_24
Lebedev AA, Bessolova YuN, Efimov NS, Bychkov ER, Droblenkov AV, Shabanov PD (2020) Role of orexin peptide system in emotional overeating induced by brain reward stimulation in fed rats. Res Results Pharmacol 6(1): 81–91. https://doi.org/10.3897/rrpharmacology6.52180
Лебедев АА, Хохлов ПП, Якушина НД, Грамота КЕ, Тиссен ИЮ, Бычков ЕР, Айрапетов МИ, Шабанов ПД (2019) Фармакологический и биохимический анализ участия пептидной системы грелина в поведенческих проявлениях игровой зависимости у крыс. Экспер клин фармаколо 82(6): 16–20. [Lebedev AA, Khokhlov PP, Yakushina ND, Gramota KE, Thyssen IYu, Bychkov ER, Airapetov MI, Shabanov PD (2019) Pharmacological and biochemical analysis of the involvement of the ghrelin peptide system in behavioral manifestations of gambling in rats. Exper Clin Pharmacol 82(6): 16–20 (In Russ)].
Wallin-Miller K, Li G, Kelishani D, Wood RI (2018) Anabolic-androgenic steroids alter decision making in a balanced rodent model of the Iowa gambling task. Neuroscience 132(3): 152–160. https://doi.org/10.1037/bne0000243
Kojima M, Hosoda H, Date Y, Nakazato M, Matsuo H, Kangawa K (1999) Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature 402(6762): 656–660. https://doi.org/10.1038/45230
Yin Y (2014) The growth hormone secretagogue receptor: Its intracellular signaling and regulation Int J Mol Sci 15(3): 4837–4855. https://doi.org/10.3390/ijms15034837
Шабанов ПД, Лебедев АА, Бычков ЕР, Лавров НВ, Морозов ВИ (2020) Нейрохимические механизмы и фармакология грелинов. Обзоры по клин фармакол и лекарств терапии 18(1): 5–22. [Shabanov PD., Lebedev AA, Bychkov ER, Lavrov NV, Morozov VI (2020) Neurochemical mechanisms and pharmacology of ghrelin. Rev Clin Pharmacol Drug Therapy 18(1): 5–22 (In Russ)]. https://doi.org/10.17816/RCF1815-22
Gomez JL, Cunningham CL, Finn DA (2015) Differential effects of ghrelin antagonists on alcohol drinking and reinforcement in mouse and rat models of alcohol dependence. Neuropharmacology 97(10): 182–193. https://doi.org/10.1016/j.neuropharm.2015.05.026
Andrews ZB (2011) The extra-hypothalamic actions of ghrelin on neuronal function. Trends Neurosci 34(1): 31–40.https://doi.org/10.1016/j.tins.2010.10.00121035199
Kern A, Albarran-Zeckler R, Walsh HE, Smith RG (2012) Apo-ghrelin receptor forms heteromers with DRD2 in hypothalamic neurons and is essential for anorexigenic effects of DRD2 agonism. Neuron 73(2): 317–332. https://doi.org/10.1016/j.neuron.2011.10.038
Rosen GD, Finklestein S, Stoll AL, Yutzey DA, Denenberg VH (1984)Neurochemical asymmetries in the albino rat’s cortex, striatum, and nucleus accumbens. Life Sci 34(12): 1143–1148. https://doi.org/10.1016/0024-3205(84)90085-7
Paxinos G, Watson C (2007) The Rat Brain in Stereotaxic Coordinates: 6th Ed. San Diego Acad Press.
Krasnova IN, Bychkov ER, Lioudyno VI, Zubareva OE, Dambinova SA (2000). Intracerebroventricular administration of substance P increases dopamine content in the brain of 6-hydroxydopamine-lesioned rats. Neuroscience 95(1): 113–117. https://doi.org/10.1016/s0306-4522(99)00400-5
Pittaras E, Callebert J, Chennaoui M, Rabat A, Granon S (2016) Individual behavioral and neurochemical markers of unadapted decision-making processes in healthy inbred mice. Brain Struct Funct 221(9): 4615–4629. https://doi.org/10.1007/s00429-016-1192-2
de Laat B, Weerasekera A, Leurquin-Sterk G et al. (2018) Glutamatergic biomarkers for cocaine addiction: a longitudinal study using MR spectroscopy and mGluR5 PET in self-administering rats. Nucl Med 59(6): 952–959. https://doi.org/10.2967/jnumed.117.202614
Симонов ПВ (ред) (1981) Эмоциональный мозг. М. Наука [Simonov PV (ed) (1981) Emotsional’nyy mozg [The emotional brain] M. Nauka (In Russ)].
Marazziti D, Golia F, Picchetti M, Pioli E, Mannari P, Lenzi F, Conversano C, Carmassi C, Ca-tena Dell’osso M, Consoli G, Baroni S, Giannaccini G, Zanda G, Dell’osso L (2008) Decreased density of the plate let serotonin transporter in pathological gamblers. Neuropsychobiology 57(1–2): 38–43. https://doi.org/10.1159/000129665
Paloyelis Y, Asherson P, Mehta MA, Faraone SV, Kuntsi J (2010) DAT1 and COMT effects on delay discounting and trait impulsivity in male adolescents with attention deficit/hyperactivity disorder and healthy controls. Neuropsychopharmacology 35(12): 2414–2426. https://doi.org/10.1038/npp.2010.124
Hanson KL, Luciana M, Sullwold K (2008) Reward-related decision-making deficits and elevated impulsivity among MDMA and other drug users. Drug Alcohol Depend 96(1–2): 99–110. https://doi.org/10.1016/j.drugalcdep.2008.02.003
Stoltenberg SF, Vandever JM (2010) Gender moderates the association between 5-HTTLP Rand decision-making under ambiguity but not under risk. Neuropharmacology 58(2): 423–428. https://doi.org/10.1016/j.neuropharm.2009.09.010
Homberg JR, Lesch KP (2010) Looking on the bright side of serotonin transporter gene variation. Biol Psychiatry 69(6): 513–519. https://doi.org/10.1016/j.biopsych.2010.09.024
Mimura M, Oeda R, Kawamura M (2006) Impaired decision-making in Parkinson’s disease. Parkinsonism Relat Disord 12(3): 169–175. https://doi.org/10.1016/j.parkreldis.2005.12.003
Linnet J, Moller A, Peterson E, Gjedde A, Doudet D (2011) Dopamine release in ventral striatum during Iowa gambling task performance is associated with increased excitement levels in pathological gambling. Addiction 106(2): 383–390. https://doi.org/10.1111/j.1360-0443.2010.03126.x
van den Bos R, Homberg J, Gijsbers E, Den Heijer E, Cuppen E (2009) The effect of COMT Val158Met genotype on decision-making and preliminary findings on its interaction with the 5-HTTLPR in healthy females. Neuropharmacology 56(2): 493–498. https://doi.org/10.1016/j.neuropharm.2008.10.002
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


