Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 11, стр. 1542-1550
Моделирование гиперкортикостеронемии у крыс с помощью осмотических насосов
М. В. Онуфриев 1, *, Ю. В. Моисеева 1, Н. В. Гуляева 1, **
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: mikeonuf1@mail.ru
** E-mail: nata_gul@ihna.ru
Поступила в редакцию 25.09.2022
После доработки 12.10.2022
Принята к публикации 12.10.2022
- EDN: ABNXYC
- DOI: 10.31857/S0869813922110085
Аннотация
Для моделирования ситуаций, связанных с воздействием различных стрессорных факторов на мозг, часто используют введение гормона надпочечников кортикостерона посредством инъекции или подкожной имплантации форм с его дозированным высвобождением. В настоящем методическом исследовании была изучена возможность применения осмотических насосов производства Alzet емкостью 200 мкл и скоростью высвобождения 1 мкл/ч, загруженных растворами кортикостерона 25, 50 и 100 мг/мл или растворителем (диметилсульфоксид/полиэтиленгликоль-400). Целью работы явилось выявление оптимальной концентрации раствора кортикостерона, загружаемого в осмотические насосы, для создания повышенного уровня гормона в крови и областях мозга крыс. Возрастание уровня кортикостерона в крови отмечено только на 3-и сутки в группе крыс, которым имплантировали осмотические насосы с максимальной концентрацией кортикостерона – 100 мг/мл (ОН-100). Также на 3-и сутки после имплантации в группе ОН-100 существенно возросла аккумуляция кортикостерона во фронтальной коре, неокортексе и гиппокампе. Таким образом, для создания повышенного уровня кортикостерона в крови и областях мозга крыс применимы осмотические насосы с раствором кортикостерона в диметилсульфоксид/полиэтиленгликоле-400, концентрацией гормона 100 мг/мл и скоростью высвобождения 1 мкл/ч.
Глюкокортикоидные гормоны (кортизол у человека и кортикостерон у грызунов) секретируются надпочечниками в результате действия стрессорных факторов и с кровью достигают всех органов и тканей организма. В связи с наличием глюкокортикоидных рецепторов практически во всех клетках глюкокортикоиды взаимодействуют с ними, запуская различные сигнальные каскады. В мозге экспрессия таких рецепторов высокая, особенно в нейронах лимбической системы мозга, в т.ч. гиппокампа. Особенно высока плотность минералокортикоидных и глюкокортикоидных рецепторов в гиппокампе, который обеспечивает реализацию когнитивных и эмоциональных процессов, а также контролирует гипоталамо-гипофизарно-надпочечниковую ось. Это позволяет реализовать контроль стрессорными гормонами определенных форм поведения, обеспечивая адекватные острые и долгосрочные адаптивные реакции [1]. Однако избыток глюкокортикоидов может приводить к дегенерации и гибели нейронов гиппокампа. Избыточная аккумуляция кортикостерона (КС) в гиппокампе и фронтальной коре крыс была описана нами при моделировании инсульта окклюзией средней мозговой артерии [2] и моделировании черепномозговой травмы латеральным гидродинамическим ударом [3]; в обеих моделях наблюдали также провоспалительные процессы в гиппокампе. Глюкокортикоидные гормоны, регулирующие многочисленные процессы в организме, в определенных ситуациях обладают выраженными противовоспалительными свойствами, хотя понимание механизмов про- и противовоспалительных свойств глюкокортикоидов до конца неясно, как и условий реализации таких механизмов в разных ситуациях [4]. Для выяснения участия глюкокортикоидов в различных патологических процессах в мозге оптимальным является воспроизводимое моделирование гиперкортикостеронемии у животных, исследование аккумуляции в отделах мозга КС и процессов, которые он запускает. Различные варианты введения КС посредством инъекции или подкожной имплантации лекарственных форм с дозированным высвобождением часто используют для моделирования острого или хронического стрессорного воздействия.
Противовоспалительные свойства глюкокортикоидов давно используются в клинике. Глюкокортикоиды широко применяются в качестве лекарственной терапии в различных патологических ситуациях, в том числе при хронических воспалительных заболеваниях, злокачественных новообразованиях или бронхиальной астме [5, 6]. Разработка стратегий лечения на основе глюкокортикоидов или моделирование хронического стресса в экспериментальных условиях часто требуют длительного и непрерывного введения глюкокортикоидов. Тем не менее, во многих исследованиях, в которых использовали непрерывное введение кортикостероидов, эффективность соответствующих систем доставки глюкокортикоидов не была протестирована и чаще всего их уровень не определяли ни в крови, ни тем более в областях мозга [7–9].
Среди применяемых методов одним из технически наименее затратным методом является доставка глюкокортикоидов через питьевую воду [10, 11]. Однако животные не пьют воду непрерывно, что может вызвать чрезмерные колебания концентраций циркулирующих глюкокортикоидов. Другим простым подходом является повторная подкожная или внутрибрюшинная инъекция растворов глюкокортикоидов [12, 13]. Тем не менее, инъекции растворов глюкокортикоидов, во-первых, вызывают резкое возникновение пика их концентрации в плазме, после которого следует быстрое снижение их циркулирующего уровня и, во-вторых, повторные инъекции приводят к значительному стрессу у животных, а неконтролируемое высвобождение эндогенных кортикостероидов может маскировать изменения уровня экзогенных глюкокортикоидов в плазме. Напротив, микроосмотические насосы и медленно рассасывающиеся таблетки для подкожной имплантации могут, как заявляют их производители, обеспечивать постоянные скорости доставки кортикостероидов и исключают недостатки их повторных инъекций [14–16].
Доступные у компаний-производителей таблетки для имплантации емкостью от 0.001 до 200 мг КС позволяют моделировать гиперкортикостеронемию у крыс и мышей в широком диапазоне концентраций экзогенного КС, но являются дорогостоящим продуктом, а для формирования контрольной группы необходимы таблетки аналогичной емкости с холестерином, который не является абсолютно индиферентным веществом [17]. Альтернативу таблеткам составляют микроосмотические насосы с дозированным высвобождением загруженных в них растворов препаратов, которые более доступны по стоимости, однако в случае КС имеют ограничения по используемым концентрациям в связи с его низкой растворимостью в воде.
Цель настоящего исследования заключалась в выявлении оптимальной для осмотических насосов концентрации раствора КС, которая вызывает повышение его уровня в крови и в отделах мозга крыс, а также в определении динамики изменения уровня КС в крови из хвостовой вены индивидуально у каждого животного.
МЕТОДЫ ИССЛЕДОВАНИЯ
Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам Института высшей нервной деятельности и нейрофизиологии РАН и утвержденным правовым актам РФ и международных организаций. Протокол эксперимента утвержден Этической комиссией Института высшей нервной деятельности и нейрофизиологии РАН. Самцы крыс линии Вистар были получены из Филиала “Андреевка” Федерального Государственного бюджетного учреждения науки “Научный центр биомедицинских технологий” Федерального медико-биологического агентства (Московская обл., РФ) и размещены в клетках вивария.
Подготовка осмотических насосов. В эксперименте были использованы самцы крыс линии Вистар массой 200–250 г. Из списка осмотических насосов (Alzet, США) была выбрана модель 2001 с максимальным объемом загрузки 200 мкл и высвобождением раствора со скоростью 1 мкл/ч в течение 7 дней. Навеску кортикостерона ацетата (КС, Serva, Германия) предварительно растворяли в 100%-ном диметилсульфоксиде (ДМСО), затем смешивали с полиэтиленгликолем-400 (ПЭГ-400) в соотношении 1 : 1 для получения растворов со следующими концентрациями КС – 25 мг/мл (ОН-25), 50 мг/мл (ОН-50) и 100 мг/мл (ОН-100), что соответствовало дневной дозе КС 2.5, 5 и 10 мг/кг/24 ч. Для приготовления раствора с максимальной концентрацией КС, 100 мг/мл, было необходимым нагревать и содержать раствор при 37°С, поскольку при комнатной температуре растворимость КС снижалась. Работу с заполнением насосов и их активацией проводили в стерильных условиях. Растворы ДМСО/ПЭГ-400 или КС в объеме 220 мкл шприцом вводили во внутреннюю камеру насосов, помещали в пробирки на 50 мл со стерильным 0.9%-ным раствором NaCl и оставляли на ночь в термостате при 37°С для активации.
Имплантация осмотических насосов. Операцию по имплантации насосов осуществляли в стерильных условиях. Крыс анестезировали с помощью изофлурана, на 2 см ниже шеи на спине сбривали шерсть и делали поперечный надрез длиной 5 мм, через который подкожно имплантировали осмотический насос, и с помощью кожного степлера закрывали раневую поверхность с последующей обработкой антисептиком.
Сбор и подготовка биологического материала. Кровь из хвостовой вены собирали у наркотизированных крыс до, а также на 1-е и 3-и сутки после имплантации насосов во временной интервал с 11 до 13 ч. На 3-и сутки после последнего забора крови из хвостовой вены крысы были выведены из эксперимента, и после декапитации животных был получен следующий биологический материал: постдекапитационная кровь, фронтальная кора (ФК), неокортекс (НК), включающий теменную, височную и затылочную доли, и гиппокамп (Гип). В дальнейшем кровь центрифугировали при 1500 g в течение 15 мин при охлаждении (4°С) для получения сыворотки. Выделенные регионы мозга гомогенизировали в гомогенизаторе Поттера с использованием стандартного 0.01 М фосфатно-солевого буфера (состав в мМ: 10 фосфата натрия, 1.76 фосфата калия, 2.7 KCl, рН 7.3–7.5), содержащего 0.1% нонидета P-40 и коктейль ингибиторов протеаз (Thermo Scientific, США). Полученные гомогенаты центрифугировали при 13 000 g в течение 30 мин при охлаждении (4°С) для получения растворимой фракции белков (супернатант), которую аликвотировали и хранили при –80°С до проведения биохимических исследований.
Определение уровня кортикостерона. Для определения уровня КС в сыворотке крови и супернатантах фронтальной коры, остатка коры и гиппокампа использовали наборы для иммуноферментного анализа Corticosterone ELISA (EIA-4164, DRG, Германия), с помощью которых детектировали как свободный, так и связанный с транспортными белками КС методом конкурентного иммуноферментного анализа.
Статистическая обработка результатов. Полученные данные проверяли на нормальность распределения с помощью W-критерия Shapiro–Wilk, результаты которого не отрицали нормальность распределения данных по всем исследованным показателям. Для статистической обработки данных по динамике изменения уровня КС в крови из хвостовой вены применяли дисперсионный анализ ANOVA (Repeated measures ANOVA) с последующим post-hoc анализом Tukey HSD test. Для сопоставления данных при сравнении значений показателей в экспериментальных группах с контрольной группой животных на 3-и сутки после имплантации насосов использовали One-way ANOVA с последующим Tukey HSD test. Достоверно различающимися считали группы при p < 0.05, а при p < 0.1 имеющими тенденцию к различию. Результаты представлены в виде M ± SEM.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Исходно уровень КС в крови из хвостовой вены (рис. 1a) статистически значимо не различался в исследуемых группах. На 1-е сутки после имплантации осмотических насосов с различной концентрацией КС (ОН-25, ОН-50, ОН-100) существенных различий между группами не наблюдали, и повышение уровня КС в контрольной группе из-за разброса данных не было статистически значимым. Возрастание уровня КС происходило на 3-и сутки только в группе ОН-100, и вдвое превышало уровень гормона в контрольной группе в этой временной точке. На уровень КС оказывали статистически значимое влияние факторы “время” (F(2.42) = 4.49; p = 0.01), “группа”(F(3.21) = 3.99; p = 0.02) и с тенденцией к достоверности взаимодействие факторов “время” и “группа” (F(6.42) = 2.02; p = 0.09).
Рис. 1.
Динамика изменения уровня КС в крови из хвостовой вены (a) и уровень КС в постдекапитационной крови (b) на 3-и сутки после имплантации осмотических насосов с различной концентрацией КС. * – отличия от контрольной группы (ДМСО/ПЭГ) на 3-и сутки при p < 0.05.
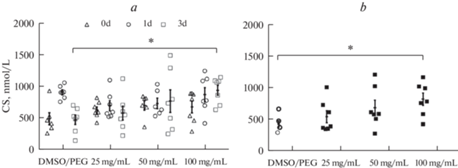
Дозозависимое повышение уровня КС на 3-и сутки в постдекапитационной крови происходило после имплантации насосов ОН-25, ОН-50, ОН-100, но статистически значимые отличия от контроля наблюдались только в группе ОН-100 (рис. 1b). На уровень КС оказывал достоверное влияние фактор “группа” (F(3.22) = 3.26; p = 0.04).
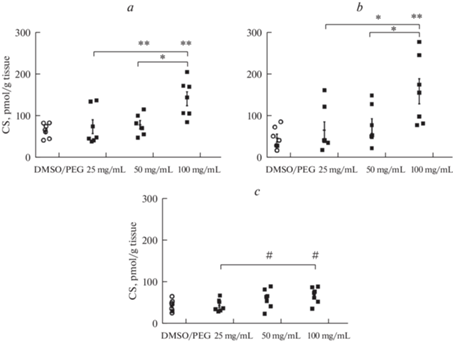
Во фронтальной коре группы ОН-100 (рис. 2a) аккумуляция КС на 3-и сутки после имплантации осмотических насосов статистически значимо превышала контрольный уровень более чем в 2 раза. Уровень КС во фронтальной коре группы ОН-100 также был достоверно выше, чем в группах ОН-25 и ОН-50, при этом в группах ОН-25 и ОН-50 данный показатель не отличался от контрольного уровня. Уровень КС во фронтальной коре статистически значимо зависел от фактора “группа” (F(3.23) = 6.91; p = 0.002). Похожая ситуация наблюдалась и в неокортексе (рис. 1b), где в группе ОН-100, ОН-25 и ОН-50 уровень КС был статистически значимо выше контроля – в 3.3, 2.4 и 2.1 раза соответственно. В неокортексе на уровень КС статистически значимо влиял фактор “группа” (F(3.24) = 5.75; p = 0.004). По сравнению с фронтальной корой и неокортексом в гиппокампе (рис. 2c) КС накапливался в меньшей степени и его уровень в группе ОН-100 превышал таковой в контроле и группе ОН-25 с тенденцией к достоверности в 1.5 раза. Фактор “группа” (F(3.24) = 3.25; p = 0.04) также оказывал достоверное влияние на кровень КС в гиппокампе.
Рис. 2.
Уровень КС во фронтальной коре (a), неокортексе (b) и гиппокампе (c) на 3-и сутки после имплантации осмотических насосов с различной концентрацией КС. **, *, # – различия между группами или отличие от контрольной группы (ДМСО/ПЭГ) при p < 0.01, p < 0.05 и p < 0.1 соответственно.
Корреляционный анализ по Спирмену выявил возможные взаимосвязи между уровнем КС на 3-и сутки в постдекапитационной крови и в неокортексе в группах ОН-25 (r = 0.85, p < 0.05) и ОН-50 (r = 0.86, p < 0.05), однако в группе ОН-100 данная корреляция отсутствовала. В группе ОН-50 обнаружены корреляции между уровнем КС на 3-и сутки в постдекапитационной крови и в гиппокампе (r = 0.93, p < 0.05) и между уровнем КС в неокортексе и в гиппокампе (r = 0.96, p < 0.05). Тем не менее, в группе ОН-100, как и в группе ОН-50, сохранилась корреляция между уровнем КС в неокортексе и в гиппокампе (r = 0.89, p < 0.05) и возникла корреляция между уровнем КС в неокортексе и фронтальной коре (r = 0.93, p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В связи с очевидной научной и трансляционной значимостью исследования влияния стресса на организм применяют подходы моделирования гиперкортикостеронемии и повышенного связывания кортикостерона с рецепторами в тканях в условиях введения экзогенного кортикостерона. При этом используются различные подходы, каждый из которых имеет свои преимущества и недостатки. В исследовании Herrmann и соавт. [18] сравнивали три метода введения экзогенного КС. Экспериментальным группам мышей осуществляли однократную подкожную инъекцию КС (10 мг/кг), подкожную имплантацию осмотических насосов (cкорость высвобождения КС 0.22 мкл/ч, концентрация раствора КС 150 мг/мл, дневная доза 30 мг/кг/24 ч) и подкожную имплантацию таблеток емкостью 10 мг КС. В результате подкожной инъекции уровень КС в плазме крови мышей возрос через 1 ч, а через 4 ч не отличался от исходного уровня. Имплантация таблеток индуцировала гиперкортикостеронемию через 24 ч, однако в последующие 7 дней уровень КС не отличался от исходного. При этом применение осмотических насосов не вызвало существенных изменений уровня КС в плазме крови на 7- и 14-й дни после имплантации, что, по-видимому, связано с отсутствием ранних точек регистрации, например, 24 и 48 ч [18]. Тем не менее, после имплантации мышам (возраст 7 нед., масса тела 20 ± 1.5 г) осмотических насосов с раствором КС концентрацией 18 мг/мл и скоростью высвобождения 0.5 мкл/ч (10.8 мг/кг/24 ч) максимальная концентрация КС в крови самцов и самок зарегистрирована на 2-е сутки после имплантации, на 9- и 15-сутки она снижалась, но все еще превышала контрольный уровень КС. Через 2 нед. в поле СА3 гиппокампа самцов мышей выявили более выраженную атрофию нейронов, чем у самок [19].
В преобладающей части исследований, в которых применяли осмотические насосы с раствором КС, использовали различные линии мышей, и только в единичных работах осмотические насосы с КС имплантировали крысам, что, по-видимому, отчасти связано с большей вариабельностью в выборе концентрации малорастворимого КС в пересчете на массу животного с меньшей массой тела. К тому же не во всех найденных публикациях, где использовали крыс, детектировали уровень КС в крови [20]. В одной из них максимальная концентрация раствора КС в осмотических насосах, имплантированных 15-дневным крысятам, составляла 50 мг/мл в растворе ПЭГ-400. В результате применения данных насосов (cкорость высвобождения КС 1 мкл/ч и время экспозиции 3 дня) уровень КС в крови через 24 ч после операции возрос почти в два раза, что, как справедливо считают авторы, укладывается в физиологический диапазон колебаний концентрации циркулирующего КС. В дальнейшем на 28-й день у крысят после введения КС зарегистрировали ухудшение гиппокамп-зависимого обучения. C учетом средней массы тела крысят, составлявшей 72.2 ± 2.8 г, дневная доза КС была 16.6 мг/кг/24 ч [21].
В нашем исследовании на взрослых крысах в группах ОН-25 (2.7 мг КС/кг/24 ч) и ОН-50 (5.4 мг КС/кг/24 ч) уровень КС хотя и повышался в крови из хвостовой вены и постдекапитационной крови на 1-е и 3-и сутки, но эти изменения не были статистически значимыми. Только в группе ОН-100 (10.8 мг КС/кг/24 ч) содержание КС почти в два раза возросло в крови из хвостовой вены и постдекапитационной крови через 3 дня после имплантации, и с учетом циркадианных колебаний концентрации циркулирующего КС выявленное его повышение укладывается в физиологический диапазон. Очевидно, что степень влияния экзогенного КС на регуляцию гипоталамо-гипофизарно-надпочесниковой системы неодинакова у молодых и взрослых крыс, и нарушение механизма этой регуляции по отрицательной обратной связи более выражено у молодых крыс, чем у взрослых.
В доступной научной литературе не найдены работы, где после имплантации осмотических насосов или таблеток с КС кроме оценки уровня циркулирующего КС определяли его содержание в областях мозга. В нашем исследовании впервые зарегистрирована аккумуляция КС во фронтальной коре, неокортексе и гиппокампе на 3-и сутки после имплантации ОН-100, что совпадало с его повышенным уровнем в крови.
Таким образом, для создания повышенного уровня КС в крови и областях мозга крыс применимы осмотические насосы с раствором КС в ДМСО/ПЭГ-400, с концентрацией КС 100 мг/мл и скоростью высвобождения 1 мкл/ч.
Список литературы
Gulyaeva NV (2019) Biochemical Mechanisms and Translational Relevance of Hippocampal Vulnerability to Distant Focal Brain Injury: The Price of Stress Response. Biochemistry (Mosc) 84: 1306–1328. https://doi.org/10.1134/S0006297919110087
Onufriev MV, Moiseeva YV, Zhanina MY, Lazareva NA, Gulyaeva NV (2021) A Comparative Study of Koizumi and Longa Methods of Intraluminal Filament Middle Cerebral Artery Occlusion in Rats: Early Corticosterone and Inflammatory Response in the Hippocampus and Frontal Cortex. Int J Mol Sci 22: 13544.https://doi.org/10.3390/ijms222413544
Komoltsev IG, Tret’yakova LV, Frankevich SO, Shirobokova NI, Volkova AA, Butuzov AV, Novikova MR, Kvichansky AA, Moiseeva YV, Onufriev MV, Bolshakov AP, Gulyaeva NV (2022) Neuroinflammatory Cytokine Response, Neuronal Death, and Microglial Proliferation in the Hippocampus of Rats During the Early Period After Lateral Fluid Percussion-Induced Traumatic Injury of the Neocortex. Mol Neurobiol 59: 1151–1167.https://doi.org/10.1007/s12035-021-02668-4
Bolshakov AP, Tret’yakova LV, Kvichansky AA, Gulyaeva NV (2021) Glucocorticoids: Dr. Jekyll and Mr. Hyde of Hippocampal Neuroinflammation. Biochemistry (Mosc) 86: 156–167. https://doi.org/10.1134/S0006297921020048
Buttgereit F, Burmester GR, Lipworth BJ (2005) Optimised glucocorticoid therapy: the sharpening of an old spear. Lancet 365: 801–803. https://doi.org/10.1016/S0140-6736(05)17989-6
Strehl C, Buttgereit F (2013) Optimized glucocorticoid therapy: teaching old drugs new tricks. Mol Cell Endocrinol 380: 32–40. https://doi.org/10.1016/j.mce.2013.01.026
Holmes MC, French KL, Seckl JR (1997) Dysregulation of diurnal rhythms of serotonin 5-HT2C and corticosteroid receptor gene expression in the hippocampus with food restriction and glucocorticoids. J Neurosci 17: 4056–4065. https://doi.org/10.1523/JNEUROSCI.17-11-04056.1997
Bush VL, Middlemiss DN, Marsden CA, Fone KC (2003) Implantation of a slow release corticosterone pellet induces long-term alterations in serotonergic neurochemistry in the rat brain. J Neuroendocrinol 15: 607–613. https://doi.org/10.1046/j.1365-2826.2003.01034.x
Mueller AD, Pollock MS, Lieblich SE, Epp JR, Galea LA, Mistlberger RE (2008) Sleep deprivation can inhibit adult hippocampal neurogenesis independent of adrenal stress hormones. Am J Physiol Regul Integr Comp Physiol 294: R1693–R1703. https://doi.org/10.1152/ajpregu.00858.2007
Coll AP, Challis BG, Lopez M, Piper S, Yeo GS, O’Rahilly S (2005) Proopiomelanocortin deficient mice are hypersensitive to the adverse metabolic effects of glucocorticoids. Diabetes 54: 2269–2276. https://doi.org/10.2337/diabetes.54.8.2269
Stone EA, Lin Y (2007) An anti-immobility effect of exogenous corticosterone in mice. Eur J Pharmacol 580: 135–142. https://doi.org/10.1016/j.ejphar.2007.10.045
Man MS, Young AH, lister-Williams RH (2002) Corticosterone modulation of somatodendritic 5-HT1A receptor function in mice. J Psychopharmacol 16: 245–252. https://doi.org/10.1177/026988110201600310
Yau SY, Li A, Zhang ED, Christie BR, Xu A, Lee TM, So KF (2014) Sustained running in rats administered corticosterone prevents the development of depressive behaviors and enhances hippocampal neurogenesis and synaptic plasticity without increasing neurotrophic factor levels. Cell Transplant 23: 481–492. https://doi.org/10.3727/096368914X678490
Nuber UA, Kriaucionis S, Roloff TC, Guy J, Selfridge J, Steinhoff C (2005) Up-regulation of glucocorticoid-regulated genes in a mouse model of Rett syndrome. Hum Mol Genet 14: 2247–2256. https://doi.org/10.1093/hmg/ddi229
Herrmann M, Henneicke H, Street J, Modzelewski J, Kalak R, Buttgereit F, Dunstan CR, Zhou H, Seibel MJ (2009) The challenge of continuous exogenous glucocorticoid administration in mice. Steroids 74: 245–249. https://doi.org/10.1016/j.steroids.2008.11.009
Claflin DI, Schmidt KD, Vallandingham ZD, Kraszpulski M, Hennessy MB (2017) Influence of postnatal glucocorticoids on hippocampal-dependent learning varies with elevation patterns and administration methods. Neurobiol Learn Mem143: 77–87. https://doi.org/10.1016/j.nlm.2017.05.010
Leal-Galicia P, Sánchez-Torres M, Meraz-Ríos M (2019) Cholesterol or Fat Rich Diets Accelerate Natural Age-Decline on Adult Hippocampal Neurogenesis and Have an Impact in Memory and Like-Anxiety Behavior. Advanc Biosci Biotechnol 10: 331–345. https://doi.org/10.4236/abb.2019.1010026
Herrmann M, Henneicke H, Street J, Modzelewski J, Kalak R, Buttgereit F, Dunstan CR, Zhou H, Seibel MJ (2009) The challenge of continuous exogenous glucocorticoid administration in mice. Steroids 74: 245–249. https://doi.org/10.1016/j.steroids.2008.11.009
Liu HH, Payne HR, Wang B, Brady ST (2006) Gender differences in response of hippocampus to chronic glucocorticoid stress: role of glutamate receptors. J Neurosci Res 83: 775–786. https://doi.org/10.1002/jnr.20782
Callaghan BL, Richardson R (2014) Early emergence of adult-like fear renewal in the developing rat after chronic corticosterone treatment of the dam or the pups. Behav Neurosci 128: 594–602. https://doi.org/10.1037/bne0000009
Claflin DI, Greenfield LR, Hennessy MB (2014) Modest elevation of corticosterone in preweanling rats impairs subsequent trace eyeblink conditioning during the juvenile period. Behav Brain Res 258: 19–26. https://doi.org/10.1016/j.bbr.2013.10.008
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


