Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 4, стр. 430-442
Роль L-аргинин-NO-системы эритроцитов при разных значениях парциального давления кислорода
Н. В. Акулич 1, *, В. В. Зинчук 2
1 Национальная антидопинговая лаборатория
Лесной, Беларусь
2 Гродненский государственный медицинский университет
Гродно, Беларусь
* E-mail: akulich_n@antidoping.by
Поступила в редакцию 24.12.2021
После доработки 26.01.2022
Принята к публикации 09.02.2022
- EDN: PQYBLK
- DOI: 10.31857/S0869813922040021
Аннотация
Проведены исследования по оценке L-аргинин-NO-системы эритроцитов при различных значениях парциального давления кислорода, которые моделировали в перчаточном боксе, замещая кислород азотом. Определение внутриклеточного NO проводили методом проточной цитометрии и спектрофлуориметрии с использованием диацетильного производного 4-амино-5-метиламино-2',7'-дифторфлуоресцеина. Площадь поверхности эритроцитов измеряли методом морфоденситометрии. Анализ кинетики внутриклеточного содержания NO в эритроцитах методом проточной цитометрии выявил феномен спонтанного роста флуоресценции NO-специфического внутриклеточного зонда, который блокировался предварительным введением ингибитора фермента NO-синтазы. Парциальное давление кислорода и экспозиция воздействия экспериментальных газовых смесей влияет на внутриклеточное содержание NO эритроцитов. Сродство гемоглобина к кислороду в условиях гипоксии зависит от активности фермента NO-синтазы, но не молсидомина. В функционировании эритроцитов при гипоксии принимает участие L-аргинин-NO-системы эритроцитов, изменений площади диффузионной поверхности красных кровяных телец не выявлено; применение молсидомина вызывало рост площади поверхности эритроцитов.
Гипоксия представляет собой не только универсальный патологический процесс, возникающий в результате недостаточного снабжения тканей кислородом или нарушения использования его тканями, но и является состоянием, сопровождающим процесс адаптации к условиям высокогорья, а также характерна для спортсменов при тренировочных нагрузках, т.е. является предметом изучения физиологии. Более того, признаки гипоксии отмечаются у здоровых людей в связи со специфическими условиями их профессиональной деятельности (шахтеры, летчики, пожарники и др.).
В большинстве работ, посвященных оценке влияния гипоксии, используются ее экспериментальные модели на уровне целого организма. Однако для изучения клеточных и/или молекулярных механизмов возникающих изменений необходимо проведение исследований на уровне отдельных клеток. В качестве оптимального объекта для изучения эффектов гипоксии in vitro могут быть выбраны эритроциты периферической крови млекопитающих, которые являются терминально дифференцированными клетками, основная функция которых – транспорт газов [1].
В изучении механизмов адаптации к гипоксическим состояниям в последнее время активно исследуется роль газотрансмиттера монооксида азота (NO), который обладает рядом уникальных физико-химических свойств. Так, в результате взаимодействия NO и гемоглобина происходит образование его различных форм, которые играют роль аллостерического регулятора функциональной активности гемопротеина [2]. Локализация NO-синтазы в эритроцитах остается предметом изучения до настоящего времени. Так, иммунологическими методами в эритроцитах человека был обнаружен белок, содержащий эпитопы NO-синтазы [3]. Однако имеющиеся данные [4] свидетельствуют об отсутствии изменений уровня нитритов и нитратов в цитозоле красных кровяных телец после добавления L-[15N2]-Arg. С другой стороны, в более поздней работе [5] показано, что NO-синтаза эндотелиоцитов и красных кровяных телец обеспечивают поддержание постоянства артериального давления. Как известно, в механизмах адаптации к изменяющимся условиям внутренней и внешней среды, ведущим к развитию гипоксии, важная роль принадлежит кислородтранспортной функции крови и, в частности, сродству гемоглобина к кислороду. Представляется важным выяснить роль L-аргинин-NO-системы эритроцитов в адаптации к гипоксии. В частности, требуется уточнить динамику образования как NO, так и связанных с ним различных типов гемоглобина, влияющих на сродство гемоглобина к кислороду. Исходя их этого, целью работы явилось изучение функционирования L-аргинин-NO-системы эритроцитов при различных значениях парциального давления кислорода.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводилось на базе Учреждения здравоохранения “Национальная антидопинговая лаборатория”. Участники исследования были подробно проинформированы о его целях и методах, ознакомлены с процедурами, рисками и после этого подписали информированное согласие на участие в нем. Исследование одобрено комитетом по этике Учреждения здравоохранения “Национальная антидопинговая лаборатория”. Забор крови добровольцев производился с использованием вакуумных систем с ЭДТА К2. Затем готовили образцы крови с гематокритом 5%, разводя цельную кровь физиологическим раствором (Sigma-Aldrich, pH 7.3) с сывороточным альбумином. Для создания различных значений содержания кислорода в атмосфере (1, 4, 7 и 12% O2) использовали перчаточный бокс, подключенный к генератору азота и баллону с углекислым газом (концентрация CO2 была постоянной и составляла 4.7–5.3%), в котором проводили исследования in vitro. Дополнительно планшетный спектрофлуориметр был укомплектован модулем поддержания концентрации газов (BioTek, Gas Controller), который в режиме реального времени автоматически поддерживал заданные значения газов (O2 и CO2).
Для оценки L-аргинин-NO-системы эритроцитов в суспензию клеток вносили молсидомин (IPOCHEM) в количестве 2 мM – 1-я группа (n = 16) и неселективный ингибитор фермента NO-синтазы L-NAME в количестве 4 мM (Sigma-Aldrich) – 2-я группа (n = 17). Контролем служила кровь без добавления донора NO или ингибитора фермента NO-синтазы (n = 16).
Для морфоденситометрического анализа фиксированных и окрашенных эозином и метиленовым синим препаратов создавали архив изображений не менее 400 эритроцитов с разных участков мазка. В исследовании применяли микроскоп Olympus BX-53 (Olympus) и монохроматический фильтр с длиной волны 540 нм. Микроскопический анализ изображения, применяемый в исследовании, позволяет количественно оценить денситометрические параметры красных кровяных телец. Для оценки площади поверхности эритроцитов применялись алгоритмы программного обеспечения “Диаморф-ЦИТО” (Диаморф).
Определения внутриклеточного NO проводили методом проточной цитометрии (FACS ARIA) и спектрофлуориметрии (Biotek, Synergy H1). Инкубирование проб осуществляли при температуре 37°С и постоянном автоматическом перемешивании.
Для гейтирования эритроцитов пробы крови окрашивались моноклональными антителами к линейному маркеру эритроцитов (гликофорину А, CD 235 a), для оценки NO использовали диацетильное производное 4-амино-5-метиламино-2',7'-дифторфлуоресцеина (DAF-FM DA) (Molecular Probes). Уровень внутриклеточного содержания NO коррелирует с флуоресценцией DAF-FM [6].
Расчет фракции оксигемоглобина суспензии эритроцитов производили по формуле [7]:
Проверку правильности произведенных измерений и подсчетов осуществляли при параллльном измерении спектров поглощения и оценки фракций гемоглобина на газоанализаторе ABL 800 Flex (Radiometer).
Для подготовки проб при проведении исследований на проточном цитометре использовали фосфатный буфер FACS Flow (BD Bioscience). Анализировали в каждой пробе не менее 40 000 клеток. При проведении кинетических исследований внутриклеточного содержания NO оценивалось более 400 000 эритроцитов. В одной из серий исследования в пробирки c пробой перед проведением анализа методом проточной цитометрии (n = 12) вносили 20 мкМ раствора Н2O2.
Полученные данные были проанализированы при помощи корреляционного и многофакторного дисперсионного анализа (факторами являлись концентрация кислорода и время инкубации проб крови) c применением программы для персонального компьютера Statisticа 10.0. Полученные значения представлены в виде среднего значения (Mean) и среднеквадратичного отклонения (SD). Достоверность дисперсионного анализа множественных сравнений оценивалась c использованием критерия Манна–Уитни.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На первом этапе были проведены кинетические исследования внутриклеточного содержания NO в условиях 20.9%-ного кислорода (атмосфера лабораторного помещения).
В группе контроля (рис. 1) отмечен незначительный прирост уровня флуоресценции DAF-FM к 30-й минуте наблюдения (p < 0.05). Применение L-NAME не оказывало влияния на уровень NO клеток: флуоресценция DAF-FM на протяжении всего эксперимента не изменялась. Внесение 20 мкМ раствора Н2O2 сопровождалось незначительным подъемом интенсивности флуоресценции к 14-й минуте наблюдения; к 30-й минуте значение интенсивности DAF-FM практически не отличалось от контрольных значений при использовании планшетного спектрофлуориметра. По данным проточной цитометрии прирост флуоресценции был более значим.
Рис. 1.
Кинетика флуоресценции DAF-FM при аппликации молсидомина и L-NAME к суспензии эритроцитов (Mean ± SD). * – наличие достоверных различий по отношению к контролю (p ≤ 0.05, Two-way ANOVA).
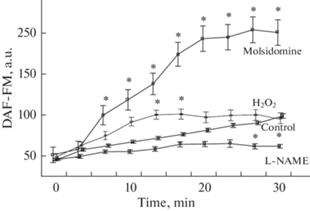
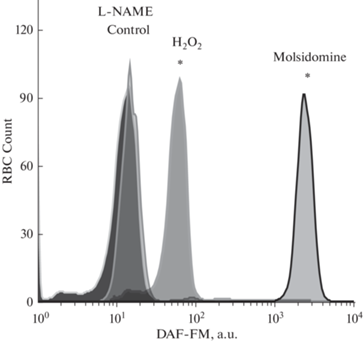
Молсидомин вызывал быстрый рост внутриклеточной флуоресценции DAF-FM, которая достигала максимума к 23-й мин наблюдения, затем до 30-й мин оставалась на этом уровне. Рост флуоресценции (рис. 2) при аппликации молсидомина (в большей степени) и 20 мкМ раствора Н2O2 (но не в других условиях эксперимента) сопровождался увеличением значения малоуглового рассеяния света, что коррелирует с размерами цитометрических объектов (эритроцитов) [8].
Рис. 2.
Интенсивность флуоресценции DAF-FM на 30-й мин наблюдения кинетических исследований при аппликации молсидомина, H2O2 и L-NAME к суспензии эритроцитов. * – наличие достоверных различий по отношению к контролю (p ≤ 0.05, Two-way ANOVA).
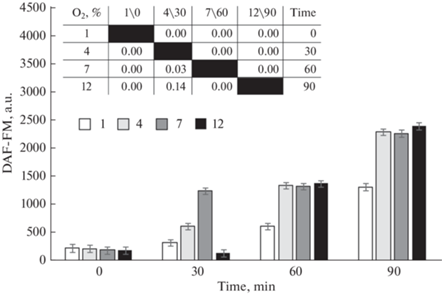
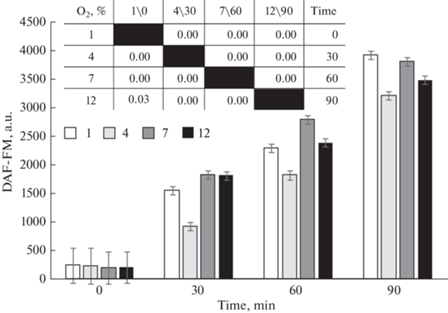
Анализ уровня NO суспензии эритроцитов, измеренный по интенсивности флуоресценции DAF-FM, без внесения доноров и ингибиторов NO (группа контроля) показал, что величина NO зависит как от содержания кислорода, так и от времени инкубации (рис. 3). Так, зафиксирован рост содержания NO, начиная с 30 мин инкубации. Концентрация кислорода по-разному влияла на содержание газотрансмиттера. В частности, инкубация крови в условиях 12%-ного содержания кислорода в перчаточном боксе сопровождалась достоверным ростом NO через 60 и 90 мин наблюдения. 30-минутная инкубация не вызывала изменений флуоресценции DAF-FM.
Рис. 3.
Интенсивность флуоресценции DAF-FM эритроцитов человека при различном содержании кислорода (Mean ± SD) и парные сравнения групп, различающихся концентрацией кислорода (1, 4, 7 и 12%) и временем инкубации (0, 30, 60 и 90 мин). 1-, 4-, 7- и 12%-ное содержание кислорода в модельной газовой смеси.
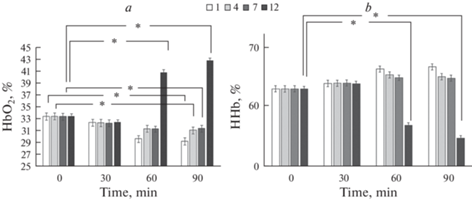
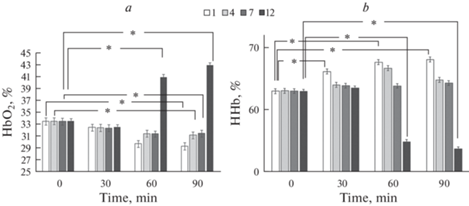
Анализ спектров поглощения крови показал (рис. 4), что при этом уровне содержания кислорода в атмосфере бокса (12%) только 60- и 90-минутная инкубация приводила к изменению фракций гемоглобина. Для HbO2 выросла с 32.4 ± 1.2 до 40.9 ± 1.6 и 42.2 ± 2.2% соответственно.
Рис. 4.
Фракция HbO2% (a) и HHb% (b) эритроцитов человека при различном содержании кислорода (Mean ± SD). * – наличие достоверных различий по отношению к контролю (p ≤ 0.05, Two-way ANOVA). 1-, 4-, 7- и 12%-ное содержание кислорода в модельной газовой смеси.
В группе контроля инкубация крови в условиях 7%-ного содержания кислорода в атмосфере привела практически к 10-кратному (с 201.4 ± 24.1 до 1235.6 ± 113.6 и 1323.0 ± 116.4 о. е.) повышению интенсивности флуоресценции DAF-FM эритроцитов через 30 и 60 мин и 20-кратному (2261.12 ± 197.0) – через 90 мин инкубации соответственно. Зарегистрированы изменения спектра поглощения крови, отражающие долю оксигемоглобина крови, на 90-й мин инкубации.
При 4%-ном содержании кислорода в эритроцитах группы контроля также зарегистрирован статистически значимый прирост содержания NO в клетках. Интенсивность DAF-FM эритроцитов на 30-й, 60-й и 90-й мин составляла 612.3 ± 34.4, 1330.3 ± 53.6 и 2288.8 ± 110.9 о. е. соответственно. На 90-й мин наблюдения выявлены изменения доли оксигемоглобина крови при 4%-ном содержании кислорода.
Наименьшее содержание O2 в газовой среде (1%) характеризовалось ростом (p < 0.05) NO эритроцитов (до 1309.8 ± 113.7) только через 90 мин наблюдения. Максимально низкое значение кислорода в исследовании вызывало снижение HbO2, рост дезоксигемоглобина в эритроцитах. Доля оксигемоглобина при 1%-ном содержании O2 в атмосфере бокса постепенно снижалась с 32.3 ± 0.5% до 29.2 ± 0.2% к 90-й мин наблюдения.
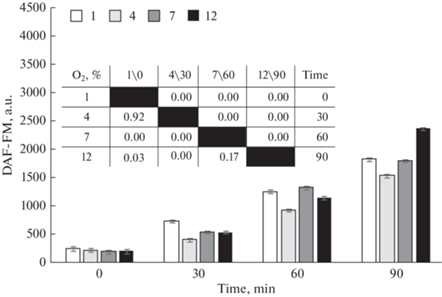
Донор NO молсидомин вызывал рост флуоресценции DAF-FM в зависимости от всех выбранных нами концентраций кислорода газовой среды (рис. 5). Следует отметить, что наибольший рост флуоресценции зонда отмечался при 1- и 7%-ных концентрациях O2 на 90-й мин наблюдения, а наименьший – при 4%-ном концентрации кислорода в газовой смеси.
Рис. 5.
Интенсивность флуоресценции DAF-FM эритроцитов человека при аппликации молсидомина (Mean ± SD) и парные сравнения групп, различающихся концентрацией кислорода (1, 4, 7 и 12%) и временем инкубации (0, 30, 60 и 90 мин). 1-, 4-, 7- и 12%-ное содержание кислорода в модельной газовой смеси.
К особенностям, выявленным в ходе наблюдения, следует отнести прямо пропорциональную зависимость флуоресценции DAF-FM от времени наблюдения, а также нелинейный характер зависимости интенсивности флуоресценции от концентрации кислорода в газовой смеси.
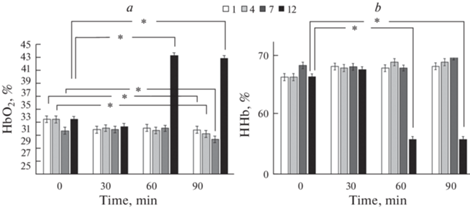
Анализ спектров поглощения крови показал (рис. 6), что только при 12%-ном содержании кислорода в атмосфере доля HbO2 вырастала до 42.9 ± 1.3 и 43.8 ± 0.6% соответственно к 60-й и 90-й мин инкубации. Минимальные содержания кислорода газовой смеси (1 и 4%) сопровождались снижением доли оксигемоглобина до 27.6 и 28.1% соответственно. Фракция дезоксигемоглобина при 1%-ном содержании кислорода возрастала на всем периоде наблюдения.
Рис. 6.
Фракции HbO2% (a) и HHb% (b) эритроцитов человека при аппликации молсидомина (Mean ± SD). * – наличие достоверных различий по отношению к контролю (p ≤ 0.05, Two-way ANOVA). 1-, 4-, 7- и 12%-ное содержание кислорода в модельной газовой смеси.
Добавление ингибитора NO L-NAME в пробы крови приводило к росту флуоресценции DAF-FM эритроцитов, которая в большей степени зависела от времени наблюдения, чем от инкубации (рис. 7). В абсолютных значениях интенсивность флуоресценции зонда не превышала значения, которые были зарегистрированы в контрольной группе за исключением проб, находившихся в условиях 1%-ного содержания кислорода в атмосфере. В последнем случае содержание NO составляло 736.5 ± 54.1, 1260.5 ± 129.3 и 1830.3 ± 92.8 о. е. на 30-, 60- и 90-й мин соответственно. Сопоставимые значения флуоресценции отмечались при моделировании гипоксии на уровне 7% кислорода газовой среды.
Рис. 7.
Интенсивность флуоресценции DAF-FM эритроцитов человека при аппликации L-NAME (Mean ± SD) и парные сравнения групп, различающихся концентрацией кислорода (1, 4, 7 и 12%) и временем инкубации (0, 30, 60 и 90 мин). 1-, 4-, 7- и 12%-ное содержание кислорода в модельной газовой смеси.
Спектральный анализ крови показал, что самые выраженные изменения спектров поглощения отмечались на 90-й мин наблюдения при блокировании фермента NO-синтазы эритроцитов (рис. 8). Так, при 7%-ной концентрации кислорода доля HbO2 снизилась до 30.3 ± 0.4%, а 12%-ное содержание кислорода приводило к росту фракции оксигемоглобина до 43.2 ± 0.7%. Следует отметить, что наибольшее значение оксигемоглобина было характерно для 60-минутной инкубации при наибольшем уровне кислорода модельной газовой смеси. Рост фракции оксигемоглобина сопровождался пропорциональным снижением фракции дезоксигемоглобина. В условиях 1%-ного содержания кислорода в атмосфере выявлены отличия в доле оксигемоглобина при аппликации L-NAME на 90-й мин наблюдения.
Рис. 8.
Фракция HbO2% (a) и HHb% (b) эритроцитов человека при аппликации L-NAME (Mean ± SD). * – наличие достоверных различий по отношению к контролю (p ≤ 0.05, Two-way ANOVA). 1-, 4-, 7- и 12%-ное содержание кислорода в модельной газовой смеси.
Непараметрический корреляционный анализ выявил наличие слабой отрицательной связи (–0.24, p < 0.05) между внутриклеточным содержанием NO в эритроцитах и фракцией оксигемоглобина цельной крови как в группе контроля, так и при применении доноров NO и ингибиторов NO-синтазы.
Площадь поверхности эритроцитов в условиях нормоксии (контроль по воздействию) составляла 134.5 ± 12.2 мкм2. Воздействие гипоксии практически не оказывало влияния на площадь диффузионной поверхности эритроцитов: все режимы гипоксии не сопровождались изменениями регистрируемых параметров поверхности красных кровяных телец (табл. 1).
Таблица 1.
Площадь поверхности эритроцитов при различном содержании кислорода (Mean ± SD)
| Группы | Время инкубации, мин | Содержание кислорода (%) | |||
|---|---|---|---|---|---|
| 1 | 4 | 7 | 12 | ||
| Контрольная группа | 0 | 134.5 ± 12.2 | |||
| 30 | 130.3 ± 22.4 | 134.9 ± 16.1 | 131.3 ± 35.0 | 133.8 ± 15.1 | |
| 60 | 134.7 ± 17.4 | 136.5 ± 11.4 | 131.3 ± 21.0 | 134.1 ± 19.4 | |
| 90 | 138.0 ± 15.3 | 135.9 ± 15.5 | 136.8 ± 18.5 | 136.9 ± 16.1 | |
| Молсидомин | 0 | 134.5±12.2 | |||
| 30 | 154.7 ± 14.5* | 163.2 ± 15.1* | 145.9 ± 12.3* | 146.3 ± 12.5* | |
| 60 | 145.2 ± 11.9* | 151.3 ± 17.8* | 154.3 ± 16.0* | 150.9 ± 12.8* | |
| 90 | 142.0 ± 8.4* | 146.0 ± 10.3* | 140.8 ± 15.8 | 144.1 ± 14.6* | |
| L-NAME | 0 | 134.5 ± 12.2 | |||
| 30 | 136.3 ± 21.4 | 138.3 ± 11.4 | 133.3 ± 11.5 | 129.6 ± 14.9 | |
| 60 | 141.3 ± 29.7 | 137.7 ± 14.0 | 136.3 ± 15.6 | 132.8 ± 11.5 | |
| 90 | 128.3 ± 17.6 | 139.0 ± 12.3 | 129.3 ± 17.4 | 134.6 ± 17.0 | |
Инкубирование суспензии эритроцитов с донором NO в условиях гипоксии сопровождалось ростом площади поверхности клеток при всех применяемых в исследовании концентрациях кислорода на протяжении всего периода наблюдения. Следует отметить, что для этого соединения типичным является быстрая реакция клеток на воздействие – самые выраженные реакции зарегистрированы спустя 30 мин после аппликации молсидомина. К окончанию периода наблюдения происходили процессы восстановления формы клеток, поскольку регистрировалось снижение площади поверхности эритроцитов после достижения ее максимума для каждой экспериментально создаваемой концентрации кислорода. Исходных значений площади поверхности клеток после применения донора NO достигнуто не было.
Аппликация L-NAME в условиях гипоксии характеризовалась ростом вариабельности площади поверхности клеток без изменений средних значений исследуемых параметров (p > 0.05). Необходимо отметить тенденцию к снижению площади поверхности эритроцитов на 90-й мин наблюдения.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Способность эритроцитов реагировать на изменение внутренней среды является важнейшим свойством красных кровяных телец. В свою очередь, на эту функцию способен оказывать влияние газотрансмиттер NO [9]. Реакции гемоглобина с NO будут различаться в зависимости от значений парциального напряжения кислорода [10], а образование, депонирование и элиминация NO-производных гемоглобина будут определять кислородтранспортную функцию крови [11].
В условиях нормоксии in vitro при кинетических исследованиях внутриклеточного содержания NO методом проточной цитометрии выявлен феномен спонтанного роста флуоресценции внутриклеточного зонда, который блокировался предварительным введением ингибитора фермента NO-синтазы. Такой характер изменений указывает на фоновую активность NO-синтезирующих ферментов в эритроцитах периферической крови, накоплении NO-производных гемоглобина в красных кровяных тельцах в условиях нормоксии. Последний вывод подтверждается значительным ростом флуоресценции внутриклеточного зонда при использовании молсидомина в условиях нормоксии in vitro.
Оценка флуоресценции DAF-FM эритроцитов в условиях гипоксии, проведенная на планшетном спектрофлуориметре, выявила зависимость флуоресценции DAF-FM и от содержания кислорода, и от времени инкубации. Последний фактор, согласно проведенному многофакторному дисперсионному анализу, вносил больший вклад в рост внутриклеточного содержания NO. Наиболее значительное аккумулирование NO в клетке в условиях 7- и 12%-ного содержания кислорода отражает особенности функционирования (возможно, способность к адаптации) L-аргинин-NO-системы эритроцитов. В работе [12] на основе многолетних исследований разработана концепция цикла оксида азота: L-аргинин → NO → ${{{\text{NO}}_{2}^{ - }} \mathord{\left/ {\vphantom {{{\text{NO}}_{2}^{ - }} {{\text{NO}}_{3}^{ - }}}} \right. \kern-0em} {{\text{NO}}_{3}^{ - }}}$, в пользу которой свидетельствуют данные об NO-синтазной и нитритредуктазной активности гемсодержащих белков млекопитающих. При этом, при участии кислорода и его активированных форм NO, являясь короткоживущим соединением, может превращаться в нитриты и нитраты. При этом как эндогенные, так и экзогенные нитриты и нитраты в свою очередь могут быть источником NO, а ионы NO2 восстанавливаются до NO при участии гемсодержащих белков, находящихся в дезоксиформе.
Концентрация кислорода выше 7%, используемая в исследовании, вызывала рост фракции оксигемоглобина. Вероятно, данные условия являются оптимальными для NO-синтезирующих ферментов эритроцитов. При моделировании экстремальных условий (1% кислорода в атмосфере) к 90-й мин наблюдения также регистрировался рост внутриклеточного содержания NO эритроцитов. При этом было выявлено снижение фракции оксигемоглобина на 10%. Тот факт, что увеличение внутриклеточной концентрации NO может происходить как при росте, так и при снижении фракции HbO2 в эритроцитах, может указывать на доминирование внутриклеточных механизмов образования и утилизации NO над кислородтранспортной функцией гемоглобина эритроцита. Относительную независимость этих процессов подтверждает выявленная нами слабая корреляционная связь между внутриклеточным содержанием NO в эритроцитах и фракцией оксигемоглобина цельной крови.
Аппликация донора NO при изучении функционирования L-аргинин-NO-системы эритроцитов в условиях различного парциального давления кислорода показала, что несмотря на значительный рост внутриклеточного NO (образование и депонирование NO-производных гемоглобина) и при 1%, и при 12% содержании кислорода в модельных газовых смесях при низком значении кислорода регистрировалось снижение фракции HbO2, а при 12% – значительный ее рост. Следовательно, молсидомин не оказывает влияние на сродство гемоглобина к кислороду в условиях гипоксии, а характер образования NO-производных гемоглобина при его введении определяется парциальным напряжением кислорода плазмы крови.
В отличие от молсидомина, введение неселективного ингибитора фермента NO-синтазы L-NAME оказало влияние на реакцию эритроцитов на гипоксию, особенно на условия, близкие к аноксии. Фракция оксигемоглобина при меньших значениях кислорода в модельных смесях (1 и 4%) была больше, чем при 7%-ном содержании кислорода в атмосфере перчаточного бокса. Выявленный феномен, вероятно, связан как с высокой активностью NO-синтазной системы эритроцитов при 7%-ном содержания кислорода, так и с участием в этих процессах фермента NO-синтазы.
В кровотоке эритроциты находятся в условиях с различными уровнями кислорода, который может достигать 10–13% O2 [13] в артериях, альвеолах легких и печени, 3–5% O2 в венозной крови, 0.5–7% O2 в костном мозге и головном мозге и до 1% O2 в хрящевой ткани [14]. Адаптация к гипоксии [15] является кислородзависимой, обеспечивается сенсорной и волюморецепторной функцией гемоглобина [16]. Наши исследования методом световой микроскопии показали, что функционирования L-аргинин-NO-системы эритроцитов в условиях низких значений парциального давления кислорода in vitro не включает в себя морфологических изменений клеток. Значимые изменения площади поверхности красных кровяных телец происходили только при аппликации молсидомина.
На основании проведенного исследования можно сделать следующие выводы:
1. Анализ кинетики внутриклеточного содержания NO в эритроцитах методом проточной цитометрии выявил феномен спонтанного роста флуоресценции NO-специфического внутриклеточного зонда, который блокировался предварительным введением ингибитора фермента NO-синтазы.
2. Парциальное давление кислорода и экспозиция воздействия гипо-/гипероксических экспериментальных газовых смесей влияет на внутриклеточное содержание NO эритроцитов: 12%-ное содержание кислорода и 90-минутная экспозиция вызывала наибольший рост внутриклеточного содержания NO. Рост NO в эритроцитах отмечался и при продолжительной (90 мин) гипоксии с уровнем кислорода близким к аноксии (1%).
3. Сродство гемоглобина к кислороду в условиях гипоксии зависит от активности фермента NO-синтазы, но не молсидомина. NO-синтазная система красных кровяных телец при гипоксии сохраняет свою активность.
4. Аппликация молсидомина на фоне применения гипо-/гипероксических экспериментальных газовых смесей сопровождалось ростом площади поверхности эритроцитов, введение ингибитора фермента NO-синтазы в этих экспериментальных условиях изменений площади диффузионной поверхности красных кровяных телец не вызывало.
Список литературы
Mikhael MR, Roshan T, Soe-Lin S, Apte S, Ponka P (2013) Nitrogen monoxide inhibits haem synthesis in mouse reticulocytes. Biochem J 451: 61–67. https://doi.org/10.1042/BJ20121649
Buehler PW, Abdu IA (2007) Oxidation of hemoglobin: mechanisms of control in vitro and in vivo. Transfus Alternat in Transfus Med 9: 204–212. https://doi.org/10.1111/j.1778-428X.2007.00081.x
Kleinbongard P, Schulz R, Rassaf T, Lauer T, Dejam A, Jax T, Kumara I, Gharini P, Kabanova S, Ozüyaman B, Schnürch HG, Gödecke A, Weber AA, Robenek M, Robenek H, Bloch W, Rösen P, Kelm M (2006) Red blood cells express a functional endothelial nitric oxide synthase. Blood 107: 2943–2951. https://doi.org/10.1182/blood-2005-10-3992
Böhmer A, Beckmann B, Sandmann J, Tsikas D (2012) Doubts concerning functional endothelial nitric oxide synthase in human erythrocytes. Blood 119: 1322–1323. https://doi.org/10.1182/blood-2011-11-393124
Leo F, Suvorava T, Heuser SK, Li J, LoBue A, Barbarino F, Piragine E, Schneckmann R, Hutzler B, Good ME, Fernandez BO, Vornholz L, Rogers S, Doctor A, Grandoch M, Stegbauer J, Weitzberg E, Feelisch M, Lundberg JO, Isakson BE, Kelm M, Cortese-Krott MM (2021) Red Blood Cell and Endothelial eNOS Independently Regulate Circulating Nitric Oxide Metabolites and Blood Pressure. Circulation 14: 870–889. https://doi.org/10.1161/CIRCULATIONAHA.120.049606
Li N, Sul JY, Haydon PG (2003) A calcium-induced calcium influx factor, nitric oxide, modulates the refilling of calcium stores in astrocytes. J Neurosci 23: 10302–10310. https://doi.org/10.1523/JNEUROSCI.23-32-10302.2003
Faber DJ, Aalders MC, Mik EG, Hooper BA, van Gemert MJ, van Leeuwen TG (2004) Oxygen saturation-dependent absorption and scattering of blood. Phys Rev Lett 93: 028102.https://doi.org/10.1103/PhysRevLett.93.028102
Briggs C (2009) Quality counts: new parameters in blood cell counting. Int J Lab Hematol 31: 277–297. https://doi.org/10.1111/j.1751-553X.2009.01160.x
Dybas J, Alcicek FC, Wajda A, Kaczmarska M, Zimna A, Bulat K, Blat A, Stepanenko T, Mohaissen T, Szczesny-Malysiak E, Perez-Guaita D, Wood BR, Marzec KM (2022) Trends in biomedical analysis of red blood cells – Raman spectroscopy against other spectroscopic, microscopic and classical techniques. TrAC Trends Analyt Chem 146: 116481.
Helms CC, Gladwin MT, Kim-Shapiro DB (2018) Erythrocytes and Vascular Function: Oxygen and Nitric Oxide. Front Physiol 9: 125. https://doi.org/10.3389/fphys.2018.00125
Grygorczyk R, Orlov SN (2017) Effects of Hypoxia on Erythrocyte Membrane Properties-Implications for Intravascular Hemolysis and Purinergic Control of Blood Flow. Front Physiol 8: 1110. https://doi.org/10.3389/fphys.2017.01110
Menshikova EB, Zenkov NK, Reutov VP (2000) Nitric oxide and NO-synthases in mammals in different functional states. Biochemistry (Mosc) 65(4): 409–426. PMID: 10810177
Hung SP, Ho JH, Shih Y-RV, Lo T, Lee OK (2012) Hypoxia promotes proliferation and osteogenic differentiation potentials of human mesenchymal stem cells. J Orthop Res 30: 260–266. https://doi.org/10.1002/jor.21517
Brennan MD, Rexius-Hall ML, Elgass LJ, Eddington DT (2014) Oxygen control with microfluidics. Lab Chip 14: 4305–4318. https://doi.org/10.1039/c4lc00853g
Zhao Y, Wang X, Noviana M, Hou M (2018) Nitric oxide in red blood cell adaptation to hypoxia. Acta Biochim Biophys Sinica 50: 621–634. https://doi.org/10.1093/abbs/gmy055
Barvitenko NN, Adragna NC, Weber RE (2005) Erythrocyte signal transduction pathways, their oxygenation dependence and functional significance. Cell Physiol Biochem 15: 1–18. https://doi.org/10.1159/000083634
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


