Российский физиологический журнал им. И.М. Сеченова, 2022, T. 108, № 4, стр. 399-413
Горизонты гепаринотерапии при COVID-19 и заболеваниях, связанных с пандемией
М. В. Кондашевская *
Научно-исследовательский институт морфологии человека им. акад. А.П. Авцына
Москва, Россия
* E-mail: marivladiko@mail.ru
Поступила в редакцию 27.12.2021
После доработки 08.02.2022
Принята к публикации 09.02.2022
- EDN: YXSXTI
- DOI: 10.31857/S0869813922040045
Аннотация
Заболевание, распространившееся по всему миру, вызываемое коронавирусом SARS-CoV-2 и названное COVID-19, первоначально считалось острым респираторным дистресс-синдромом (ОРДС). Затем было установлено, что это заболевание характеризуется несвойственными для многих остальных ОРДС тромбозами кровеносных сосудов. Применение в качестве антикоагулянта препаратов нефракционированного и/или низкомолекулярного гепарина значительно снизило смертность и тяжесть течения заболевания, так как гепарин является полифункциональным средством. В представленном обзоре обобщены сведения литературы о механизмах патогенеза SARS-CoV-2, охарактеризованы свойства гепарина, позволяющие ингибировать эти механизмы на любой стадии патологического процесса. Предложена гипотеза формирования порочного патогенетического круга при COVID-19, а также авторский подход к использованию гепарина в малых дозах, за рамками его антикоагулянтных свойств. Проведенный анализ большого спектра эффектов и механизмов действия гепарина поможет создать у заинтересованного читателя представление о современных возможностях применения этого лекарственного препарата.
Вирусы обширного семейства Coronaviridae – это респираторные РНК-вирусы, антропозоонозные инфекционные патогены, имеющие природные резервуары инфекции и образующие единые динамичные генофонды. Название “Coronaviridae” (коронавирусы) семейство этих вирусов получило благодаря крупным пепломерам (отросткам оболочки, окружающей вирион), напоминающим корону. Причиной современной пандемии является коронавирус SARS-CoV-2 (Severe Acute Respiratory Syndrome-Related Corona Virus 2), а вызываемое им заболевание, характеризующееся широким спектром проявлений: от малосимптомного до катастрофического, сопровождающегося полиорганной недостаточностью, было названо COVID-19 (Coronavirus Disease 2019, COVID-19).
Первоначально заболевание было признано острым респираторным дистресс-синдромом (ОРДС), для лечения которого начали применять противовирусные и противовоспалительные препараты. Однако вскоре стало ясно, что эффективность используемых лекарственных средств недостаточна, так как при COVID-19 у пациентов часто встречается большое число тромботических событий в различных органах и именно эти осложнения определяют катастрофические последствия заболевания [1]. По данным, опубликованным исследователями из г. Ухань (Китай), основными маркерами, ассоциированными с развитием тяжелого течения заболевания и возможного летального исхода, является высокий, непрерывно увеличивающийся в динамике наблюдения уровень D-димера, и продуктов деградации фибриногена [2].
Гиперкоагуляция – это достаточно необычное явление для симптомов, сопряженных с респираторными вирусными заболеваниями. В связи с появлением множества публикаций о тромбозах при COVID-19 в настоящее время многие клиницисты и исследователи рассматривают это заболевание как протромботическое. Однако до настоящего времени нет конкретной единой стратегии и эффективного целевого лечения COVID-19. Фактически в мире ведется эмпирический отбор национальных и международных протоколов лечения с комбинацией неспецифических посиндромных лекарств. Тем не менее, по данным Всемирной организации здравоохранения (ВОЗ), использование гепаринов у госпитализированных пациентов в критическом состоянии предпочтительнее других антикоагулянтов [3, 4]. Гепарин является одним из старейших натуральных терапевтических средств, хорошо зарекомендовавших себя в качестве антикоагулянта при тромбоэмболиях, острых инфарктах миокарда, в области гематологии, трансфузионной медицины, кардиохирургии и др. Несмотря на длительную историю изучения и применения в медицине, многие свойства гепарина еще малоизвестны и мало используются в клинической практике. Наблюдаемая у пациентов с COVID-19 гиперкоагуляция вызвала дебаты в сообществе врачей разных специальностей о терапевтической пригодности гепарина. Это объясняется тем, что многим врачам в основном хорошо известны побочные эффекты препаратов гепарина и малоизвестен весь спектр их терапевтических свойств, а также дозы и способы введения. Тем не менее, в разных странах клиницистам пришлось применять препараты гепарина, что снизило показатели D-димера, улучшило выживаемость пациентов и обусловило переход от патологического воспаления в эффективный иммунный ответ.
Цель данного обзора – ознакомить читателей с диапазоном обширных свойств гепарина, продемонстрировать его сильные стороны и ситуации, когда рамки его применения следовало бы расширить, особенно это касается современной ситуации пандемии COVID-19. В статье подчеркивается роль российских исследователей в изучении структуры молекулы гепарина и эффектов действия этого уникального биологически активного вещества.
СВОЙСТВА ЭНДОГЕННОГО ГЕПАРИНА, ИСПОЛЬЗУЕМОГО ДЛЯ ПОЛУЧЕНИЯ КОММЕРЧЕСКИХ ПРЕПАРАТОВ
Эра профилактики венозных тромбозов и эмболий гепарином началась в 1916 г. с открытия вещества, выделенного из клеток печени, обладающего антикоагулянтной активностью. Автором открытия был студент-медик Джей Маклин (Jay McLean), работавший на кафедре физиологии Университета Джона Хопкинса в Балтиморе под руководством знаменитого американского ученого – профессора Уильяма Хауэлла (William Howell) [5]. Впоследствии антикоагулянтное вещество было названо “гепарином”. Активное исследование и использование в клинике коммерческих препаратов началось после разработки натриевых и кальциевых солей гепарина [6]. В настоящее время коммерческие препараты гепарина получают из тканей легких крупного рогатого скота и из кишечника свиней.
Гепарин – гликозаминогликан, один из медиаторов тучных клеток, присутствующих во всех тканях и органах, но особенно богаты ими легкие и кишечник млекопитающих. Гепарин, выделяемый во внеклеточное пространство тучными клетками, в физиологических условиях не поступает в кровь, но используется локально, где выполняет в основном функции неспецифического адаптогена, защищая организм от токсинов, паразитов различной природы (в том числе от вирусов и бактерий), провоспалительных веществ, являясь активным полианионом и регулятором межклеточных взаимодействий [7]. Антикоагулянтные свойства гепарина становятся значимыми под воздействием любых внешних или внутренних факторов, приводящих к угрозе нарушения микроциркуляции, стаза, тромбоза и др. Уже на ранних стадиях этих процессов гепарин поступает в кровь, где предотвращает повреждение эндотелия сосудов путем связывания (комплексообразования) и инактивации биологически активных веществ, уменьшая адгезивность эндотелия, восстанавливая измененный электроотрицательный потенциал мембран эндотелиоцитов, тормозя активацию клеточных и плазменных факторов свертывания крови [7, 8]. Таким образом, эндогенный гепарин является полифункциональным биологически активным медиатором тучных клеток, тогда как антикоагулянтное действие является лишь одним из механизмов, с помощью которых гепарин предупреждает тромбоз и способствует восстановлению среды обитания окружающих клеток, обеспечивая им полноценную доставку трофических и энергетических веществ [7, 8].
Молекулярная масса молекул коммерческого нефракционированного гепарина (НФГ), выделяемого из тканей, колеблется от 3000 до 60 000 Дальтон. Как и в тучных клетках, молекулы НФГ – естественного биополимера полисахаридной природы, представляют собой линейную неразветвленную цепь, состоящую из повторяющихся дисахаридных звеньев уроновой кислоты GlcA или IdoA и глюкозамина GlcN, α-1-4-гликозидных связей. Высокая степень сульфатирования молекулы обеспечивает высокий отрицательный заряд и высокую степень связывания с другими биологически активными веществами, изменяя их свойства. В связи с большим сходством с эндогенным гепарином, НФГ обнаруживает полифункциональные качества [7, 8].
Низкомолекулярные гепарины (НМГ) представляют собой класс деполимеризованных различными способами производных НФГ, служащих для снижения побочных эффектов НФГ. Каждый тип НМГ обладает четко выраженным кумулятивным эффектом и фармакологическим профилем, поэтому сведения, полученные при изучении свойств одного НМГ, нельзя экстраполировать на другие [7–9].
Антикоагулянтные свойства НФГ и НМГ различны. НФГ способен связываться (образовывать комплекс) с антитромбином III (АТIII) и одновременно с тромбином (АТIII–НФГ–тромбин), ингибируя активность тромбина [10]. Как известно, тромбин катализирует превращение фибриногена в фибрин, трансформирующийся сначала в фибрин-мономер, затем фибрин-полимер, а после стабилизации, вместе с тромбоцитами превращается в тромб. Комплекс АТIII–НФГ–тромбин дезактивирует такие факторы свертывания, как IXa, Xa, XIa, XIIa. Одновременно НФГ способен связываться с кофактором гепарина II, что также нейтрализует тромбин. Однако эффект НФГ ослабляется (снижается биодоступность) из-за высокой способности связываться с биологически активными веществами разной природы: ферментами, гормонами, нуклеиновыми кислотами, алкалоидами и др. Кроме того, у НФГ имеется ряд побочных действий, которые частично нивелируются при укорочении молекулы [8, 9]. Считается, что преимуществами НМГ являются: более выраженная направленность анти-Ха эффекта, бóльшая биодоступность, и по ряду сведений меньшее число осложнений [9]. Преимуществами НФГ являются: относительно низкая стоимость препарата, отсутствие тератогенного и эмбриотоксического действий, а также наличие антидота (протамина сульфат). Протамина сульфат (ПС) является основанием и, связываясь с кислотными остатками гепарина, образует стабильный комплекс с НФГ. Одновременно ПС индуцирует разрушение комплекса АТIII–НФГ–тромбин, что приводит к снижению антикоагулянтной активности гепарина. Нейтрализация НФГ происходит в течение нескольких минут. Продолжительность действия ПС составляет около 2 ч (в зависимости от температуры тела). Сам ПС обладает незначительной антикоагулянтной активностью [9]. НМГ и НФГ наиболее часто вводятся внутримышечно и подкожно, однако доказана эффективность действия гепарина при интраназальном, интраректальном, ингаляционном введениях и наружно в виде мазей. Используется гепарин и в медицинских устройствах, например, для экстракорпоральной очистки крови [7–9, 11].
ИНГИБИРОВАНИЕ ГЕПАРИНОМ МЕХАНИЗМОВ ИНТЕРНАЛИЗАЦИИ ВИРУСА SARS-COV-2 В КЛЕТКИ ХОЗЯЕВ
В настоящее время известно, что SARS-CoV-2 использует тот же рецептор входа в клетку, что и многие другие вирусы – ангиотензин-превращающий фермент II (Angiotensin-Converting Enzyme 2, ACE2). Человеческая карбоксипептидаза ACE2 кодируется геном ACE2, расположенным на 22-й хромосоме [12]. ACE2 представляет собой трансмембранный белок I типа, имеющий внеклеточный N-гликозилированный N-концевой участок, на котором находится карбоксипептидазный сайт, а также короткий внутриклеточный С-концевой цитоплазматический хвост. N-концевой пептидазный домен является местом связи ACE2 с SARS-CoV. Также выделяют две формы белка ACE2: клеточную (связанную с мембраной) и циркулирующую (растворимую). Клеточная форма – это полноценный белок, синтезируемый в больших количествах пневмоцитами, энтероцитами тонкой кишки и другими клетками. Циркулирующая форма (у нее сохраняется N-концевой пептидазный участок) возникает после расщепления клеточной формы ACE2 металлопротеазой ADAM17, после чего она попадает в межклеточное пространство [12].
Установлено, что рецептор-опосредованное проникновение вируса зависит от наличия мембрано-связанной сериновой протеазы, продукта гена TMPRSS2. Определено, что для успешного входа в клетки хозяина вирусам SARS-CoV-2 необходимо наличие одновременно ACE2 и TMPRSS2. Показано, что вирус использует для связывания с ACE2 поверхностный спайковый гликопротеин (S), имеющий две субъединицы (S1 и S2). Субъединица S1 имеет N-концевой (NTD) и С-концевые домены (CTD1, CTD2 и CTD3). У вируса SARS-CoV-2 на CTD1 располагается рецептор-связывающий домен (receptor-binding domain, RBD), который взаимодействует с ACE2 на клеточной поверхности. Субъединица S2 запускает слияние вируса с мембраной клетки, что приводит к проникновению вируса внутрь (рис. 1). Расщепление S белка на стыке S1 и S2 осуществляется благодаря протеазам хозяина, таким как TMPRSS2 (рис. 1) [13, 14].
Рис. 1.
Схема соединения вируса SARS-CoV2 с клетками хозяина, используя рецепторы хозяина. Блокирование рецептор-связывающего домена (RBD) вируса гепарином.
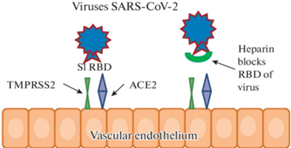
Такой путь интернализации характерен для многих вирусов. Достаточно давно известно, что противовирусные эффекты гепарина в отношении герпесвирусов (HSV-1), вирусов Зика (ZIKV) и других вирусов основаны именно на его способности к образованию комплексных соединений [15, 16]. Совсем недавно Partridge и соавт. (2021) установили, что НФГ способен на 80% ингибировать проникновение вируса SARS-CoV-2 в клетки хозяина, образуя конкурентное связывание, а именно, комплексные соединения с RBD доменами (рис. 1). Так же, как и во многих других случаях, противовирусное действие более выражено у НФГ, чем у НМГ [17].
Вирус SARS-CoV2, проникая в клетки хозяина, разрушает гликокаликс – сложный комплекс мембранно-прикрепленных протеогликанов, гликозаминогликановых цепей, гликопротеинов и адгезивных белков плазмы, выполняющих защитные функции в отношении клеточной мембраны. Гликокаликс обеспечивает избирательность транспорта веществ, принимает участие в образовании контактов между клетками, выполняет рецепторную и маркерную функции. В кровеносных сосудах гликокаликс располагается на внутренней поверхности эндотелия, отделяя его от крови и соседних клеток [7, 8]. У пациентов с COVID-19 нарушение слоя гликокаликса обусловливает разрушение клеточных мембран, что приводит к разрушительному нарастанию плотности скопления в циркуляции фосфолипопротеиновых частиц, обладающих значительной тромбогенной активностью (рис. 2). В доклинических исследованиях сообщалось, что нарушение слоя гликокаликса в микрососудах легких индуцируется активацией TNF-α-зависимой гепараназы, разрушающей гепарансульфат. Применение НФГ или НМГ защищает гликокаликс от деградации путем ингибирования активности гепараназы [18]. Поскольку активация гепараназы может повышать уровень экспрессии металлопротеиназ (в частности, MMP-2 и MMP-9), гепарин одновременно способен ослаблять наращивание концентрации этих эндопептидаз при COVID-19 [19].
КОАГУЛОПАТИЯ ПРИ COVID-19, МЕХАНИЗМЫ ДЕЙСТВИЯ ГЕПАРИНА
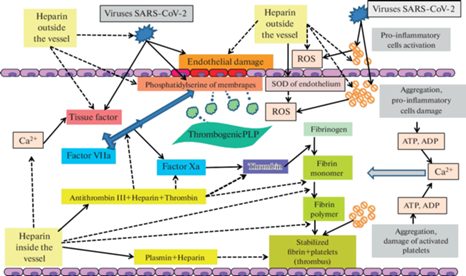
Проникновение вирусов SARS-CoV2 и их токсинов вызывает грубые повреждения эндотелия кровеносных сосудов и других клеток хозяина (рис. 2) [19]. Общеизвестно, что большую роль в сохранении антикоагулянтных свойств крови играет бислойная липидная мембрана эндотелия, при помощи которой поддерживается различие концентрации веществ в цитоплазме клетки и окружающей среде. Во всех случаях повреждения мембраны эндотелия, в том числе и при COVID-19, большое значение имеет пуринергическая передача тромбогенных сигналов, начинающаяся с высвобождения АТФ и АДФ из поврежденных, активированных клеток (рис. 2). Во внеклеточном пространстве происходит активация внеклеточных рецепторов АТФ и АДФ (таких как P2X7), что индуцирует сигнальные механизмы поступления ионов кальция (Са2+) в цитоплазму эндотелия сосудов из внеклеточных и внутриклеточных источников (рис. 2) [20]. Значительное повышение концентрации Са2+ в эндотелиальных клетках вызывает блокирование ферментных систем трансмембранных белков-переносчиков, транслоказ, участвующих в переносе фосфатидилсерина и фосфатидилэтаноламина с наружной стороны мембраны на внутреннюю. В результате происходит цепь событий, ведущая к разрыхлению мембраны и изменению структуры каркаса белков цитоскелета. При этом в кровоток могут отторгаться фосфолипопротеиновые частицы, обладающие тромбогенной активностью (рис. 2). На трансформированной клеточной поверхности отрицательно заряженные кислотные остатки фосфолипидов, при участии АТФ, АДФ и Са2+, активируют и образуют связь с витамин K-зависимыми факторами, постоянно находящимися в плазме крови. Ключевой фазой этих эффектов является усиление экспрессии тканевого фактора – белкового компонента, присутствующего на поверхности практически всех клеток организма млекопитающих и обладающего большой тромбогенной активностью при воздействии патогенных факторов (рис. 2) [20, 21].
Далеко не всем известно, что НФГ является регулятором эффектов АТФ, образуя с этим источником энергии комплексные соединения, обладающие антикоагулянтными и антитромботическими свойствами [22]. Вместе с тем гепарин является селективным ингибитором рецепторов инозитол-1,4,5-трифосфата, участвующего в процессе АТФ-зависимого потока Са2+ в клетки, и способен уже на начальной стадии активации ингибировать факторы свертывания, снижая уровень внутриклеточного Са2+ [23]. Следовательно, гепарин нормализует проницаемость и функции клеточных мембран. Возможность влияния гепарина на концентрацию ионов кальция обуславливает также эффекты его действия на иммунные процессы [7–9].
Наиболее известное всем свойство НФГ – это антикоагулянтная функция в качестве ингибитора факторов свертывания крови, осуществляемая через посредство естественных антикоагулянтов, присутствующих в организме животных и человека. Чрезвычайно важный и известный антикоагулянт – это серпин, антитромбин III, важнейший физиологический ингибитор тромбина. Его долгое время называли основным антикоагулянтом, так как антитромбин III способен ингибировать практически все протеазы свертывания крови, плазмин, трипсин, а также C1s компонент комплемента. Преобладает у антитромбина III антикоагулянтная активность в отношении тромбина, факторов Xa и XIa. Образование комплекса антитромбин III–гепарин–тромбин существенно увеличивает антикоагулянтное действие антитромбина III (в 1000–100 000 раз, рис. 2). Частично это объясняется тем, что после образования комплекса, гепарин диссоциирует из него и связывается с другой молекулой антитромбина III, генерируя множественные циклы инактивации фермента тромбина [10]. Это взаимодействие реализуется лишь в том случае, если молекула гепарина содержит не менее 18 сахаридных остатков. Важно отметить, что свойство НФГ и НМГ образовывать комплексы со многими биологически активными веществами было подробно изучено и охарактеризовано в 50–70-х гг. ХХ-го века российскими учеными под руководством профессора Б.А. Кудряшова. В частности, Кудряшовым и его сотрудниками был выделен и подробно изучен комплекс антитромбин III-гепарин-тромбин [10], тогда как за рубежом этот комплекс научились выделять и изучать позже [24, 25].
Остальные антикоагулянты, такие как: кофактор гепарина II, протеин z-зависимый протеазный ингибитор, ингибитор протеина С, нексин-1, ингибитор активатора плазминогена-1, ингибитор пути тканевого фактора, ингибитор внешнего пути образования протромбиназы (аннексин V), так же, как и антитромбин III, образуют комплексы с НФГ, что многократно усиливает их действие [9, 25].
Стоит отметить, что помимо образования фибрина, тромбин действует за пределами механизмов свертывания крови. В норме, при достижении в циркулирующей крови пороговой концентрации, тромбин взаимодействует с мембранным белком, рецептором неповрежденного эндотелия – тромбомодулином (CD141 или BDCA-3), комплекс тромбин-тромбомодулин активирует рефлекторную дугу противосвертывающей системы [26]. В результате этого, в норме тромбин индуцирует выброс тканевого активатора плазминогена из эндотелия, что стимулирует фибринолиз, предупреждающий возникновение в сосудистом русле стабилизированного фибрина. В системе фибринолиза определяются компоненты ферментативной и неферментативной природы. Последний, главным компонентом которого является гепарин, был открыт и изучен Б.А. Кудряшовым и его сотрудниками [10, 26].
В отличие от нормального состояния у пациентов с COVID-19, на фоне гиперкоагуляции наблюдается развитие глубокой депрессии системы фибринолиза. Интересно отметить, что далеко не все исследователи и клиницисты рассматривают возможность использования гепарина для нормализации системы фибринолиза, несмотря на то, что достаточно давно известна способность гепарина стимулировать генерацию плазмина путем связывания гепарина (НФГ и НМГ) с сайтами активаторов плазминогена как урокиназного (u-PA), так и тканевого (t-PA) типа. Эти эффекты гепарина способствуют уравновешиванию свертывающей, противосвертывающей и фибринолитической систем крови [9, 27, 28].
Кроме активизации ферментативного фибринолиза, гепарин, являясь основным компонентом неферментативной фибринолитической системы, обладает ярко выраженной антиполимеризационной и фибринолитической активностями в отношении фибрин-мономеров и нестабилизированных фибрин-полимеров (НФГ в большей мере, чем НМГ) (рис. 2) [9, 10, 26].
ВОСПАЛИТЕЛЬНО-ИММУННЫЙ ОТВЕТ ПРИ COVID-19 И ПРОТИВОВОСПАЛИТЕЛЬНЫЕ ЭФФЕКТЫ ГЕПАРИНА
В настоящее время хорошо известно, что свертывающая, противосвертывающая и фибринолитическая системы крови совместно с иммунной системой составляют единую защитную функциональную систему организма. Нарушение одной из них незамедлительно сказывается на состоянии других. Так, например, взаимодействие между опухолевой тканью, системой гемостаза и иммунной системой происходит по типу каскада взаимной активации, тем самым приводя к формированию порочного круга, результатом чего являются повреждение эндотелия, провоспалительный статус и тромбозы в сосудистом русле, т.е. развитие тромботической микроангиопатии. Показано, что посредниками в этом взаимодействии выступают цитокины [29].
Вероятно, аналогичные механизмы формируются при COVID-19, которые, индуцируя воспалительную реакцию, в тяжелых случаях, цитокиновый шторм, оказывают влияние на весь организм, а также прямое и опосредованное воздействие на центральную нервную систему [30, 31].
Традиционно, инициация воспалительной реакции приводит к неспецифической активации таких провоспалительных форменных элементов крови, как лейкоциты и тромбоциты, повышая их способность к миграции, адгезии и инфильтрации тканей. У человека большую часть лейкоцитов составляют нейтрофилы (40–70%). Помимо дегрануляции и фагоцитоза, активированные нейтрофилы высвобождают внеклеточные ловушки (сети), состоящие из внеклеточной ДНК, гистонов, биологически активных белков и активных форм кислорода. Появляется все больше свидетельств того, что нейтрофильные внеклеточные сети, образующиеся в большом количестве, играют решающую роль в патогенезе внутрисосудистого тромбоза и полиорганной недостаточности при COVID-19 (рис. 3) [32].
Рис. 3.
Схема изменений свертывающей системы крови при COVID-19. ROS – активные формы кислорода, PI – провоспалительные цитокины.
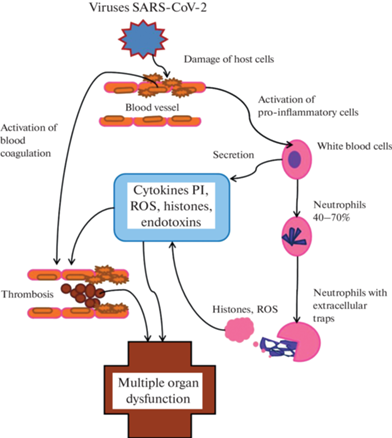
Важным аспектом воспалительного процесса при COVID-19 является оксидативный стресс, характеризующийся дисбалансом в генерации активных форм кислорода и ответных реакциях антиоксидантных систем [33]. Оксидативный стресс, проявляющийся значительным повышением концентрации активных форм кислорода, нарушает проницаемость гемато-тканевых барьеров, вносит решающий вклад в развитие патогенетических механизмов, так как при этом происходит разрушение окружающих клеток, повреждение ДНК, липидов, белков, нарушение функций различных факторов роста (рис. 3). Все это может быть причиной стимуляции секреции большого количества провоспалительных цитокинов, вплоть до цитокинового шторма. Так же, как и при сепсисе, при COVID-19, наряду с легкими, кишечник является мишенью вирусной инфекции. В результате нарушается проницаемость кишечной стенки и провоспалительный эндотоксин, продуцируемый резидентными грамотрицательными бактериями, попадает в системный кровоток. Бактериальная ДНК и эндотоксины были обнаружены практически у всех тяжелобольных COVID-19 [34, 35]. Эти триггеры воспалительного ответа еще сильнее активируют механизмы каскада коагуляции, задействуя путь тканевого фактора (рис. 3). Как было показано в экспериментах на мышах, посредством этого пути эндотоксин и фактор некроза опухоли (TNF-α) индуцируют выработку интерлейкина (IL-6) и других провоспалительных цитокинов, что сопровождается увеличением образования тромбина и фибрина (рис. 3). При этом введение НМГ нормализует состояние кишечного барьера и состояние противосвертывающей системы крови [36].
Основываясь на данных, приведенных выше, кратко можно охарактеризовать, каким образом могут помочь препараты гепарина при воспалительном ответе, связанном с COVID-19. Существует, по крайней мере, пять возможностей:
1) экспериментально и клинически доказано, что коммерческий гепарин НФГ и селективно десульфатированный гепарин (НФГ со сниженной антикоагулянтной активностью) способны ингибировать экспрессию основных провоспалительных цитокинов – IL-6, IL-8, IFNγ, тканевого фактора и компонента комплемента С3А [7–9];
2) показано, что НФГ и НМГ снижают концентрацию токсичных гистонов, появляющихся во внеклеточном пространстве в результате выброса нейтрофилами сетей (рис. 3). Для проявления этих свойств гепарину необходимо наличие сульфатированных групп, хотя бы в небольшом количестве [7–9, 32];
3) введение НФГ и НМГ ингибирует активацию провоспалительных клеток, снижает их способность к миграции, агрегации, адгезии, подавляет лейкоцитарную инфильтрацию тканей (рис. 2, 3) [7–9, 15];
4) НФГ проявляет антиоксидантные свойства, стимулируя экспрессию супероксиддисмутазы (СОД) различными клетками. СОД играет основную роль в антиоксидантной защите от активных форм кислорода (рис. 2, 3) [7–9];
5) НФГ и НМГ обусловливают уменьшение эндотоксин-стимулированной экспрессии генов, что способствует восстановлению эндотелиального барьера кишечника [34, 35].
СТРЕССОРНЫЕ ЗАБОЛЕВАНИЯ, СВЯЗАННЫЕ С ПАНДЕМИЕЙ COVID-19, АНТИСТРЕССОРНЫЙ ЭФФЕКТ ГЕПАРИНА
Эпидемии, подобные COVID-19, всегда имеют массу негативных последствий. Психологические эффекты социальной изоляции, влияние постоянного эмоционального напряжения, сопряженного с необходимостью соблюдения непрерывной повышенной бдительности в отношении соблюдения правил профилактической медицины, связаны с неблагоприятным влияниям на психическое здоровье населения. Все это обусловило появление в 2020 г. многочисленных данных, свидетельствующих о том, что при пандемии COVID-19 у населения многих стран значительно повысилась частота развития симптомов выраженного стресса, тревоги и депрессии даже у не переболевших людей [37]. Поэтому во многих странах у населения обнаружился высокий процент симптоматики посттравматического стрессового расстройства (ПТСР). Таким образом, существует необходимость психологического и медикаментозного вмешательства для противодействия краткосрочным и долгосрочным психопатологическим последствиям пандемии COVID-19.
ПТСР расценивается как серьезное мультисистемное заболевание, характеризующееся нарушением психологической адаптации, сопровождающееся соматическими заболеваниями. В наших экспериментальных работах было зарегистрировано индуцированное ПТСР снижение уровня циркулирующего кортикостерона, дистрофические изменения в печени и надпочечниках, нарушение состояния гематологического гомеостаза (гиперкоагуляция). Установлено, что курсовое внутримышечное введение НФГ в очень малых дозах (ниже терапевтических, 64 МЕ/кг) после формирования ПТСР, обусловило успешную адаптацию, нормализацию поведенческих и морфофункциональных нарушений надпочечников и печени [38]. Последнее играет большую роль, так как восстановление структуры печени, в которой синтезируется большинство факторов систем крови, коррелировало с нормализацией состояния свертывающей и противосвертывающей систем. Восстановление морфофункционального состояния надпочечников способствовало возвращению к норме уровня кортикостерона. Оптимизация поведенческого и психоэмоционального состояния после введения гепарина, вероятнее всего, объясняется его способностью проходить через гематоэнцефалический барьер, улучшать текучесть крови, участвовать в регуляции рецепторов нейромедиаторов. Как установлено ранее, НФГ и НМГ образуют комплексы с нейромедиаторами (АКТГ) и гормонами стресса (адреналин, кортизол у людей, кортикостерон у лабораторных грызунов), изменяя их уровень в крови и внося вклад в адаптационные процессы [38, 39]. Полученные результаты могут послужить обоснованием для расширения клинического применения гепарина в малых дозах с целью предупреждения и лечения психосоматической патологии при ПТСР, обусловленной различными причинами, в том числе и COVID-19.
ПОБОЧНЫЕ ЭФФЕКТЫ ГЕПАРИНОТЕРАПИИ
Подобно многим другим препаратам, гепарин (НФГ и НМГ) обладает побочными действиями. При этом, многие клиницисты не обнаруживают разницы по частоте осложнений между НФГ и НМГ. Поскольку клинические преимущества и проблемы безопасности существуют бок о бок, следует сосредоточить усилия на максимальном терапевтическом эффекте при минимизации побочных эффектов гепарина.
Наиболее частым и очевидным потенциальным осложнением гепаринотерапии (особенно НФГ) является кровотечение. На втором месте по частоте возникновения потенциальных осложнений стоит гепарин-индуцированная тромбоцитопения. Остальные потенциальные осложнения, такие как остеопороз, кожные реакции, эозинофилия, алопеция, дисфункция печени, острая гепариновая “анафилаксия” и гипоальдостеронизм возникают довольно редко. Частота возникновения осложнений гепаринотерапии одинакова у мужчин и у женщин, возраст не является фактором риска [9].
Наиболее важными причинами осложнений гепаринотерапии являются следующие: 1) большая доза вводимого гепарина (более 500 МЕ/сутки); 2) значительная продолжительность введения (более 2 недель); 3) сочетание лекарственных препаратов и сопутствующих заболеваний; 4) индивидуальные особенности. Наиболее часто кровотечения наблюдаются у больных, страдающих хроническим алкоголизмом, а также при совместном назначении гепарина и аспирина [7–9].
РАЗРАБОТКА НОВЫХ ГЕПАРИНОПОДОБНЫХ ПРЕПАРАТОВ
В настоящее время коммерческие препараты НФГ для клинического применения получают из биологического сырья. Такой способ получения гепарина не исключает возможности вирусной контаминации, контаминации прионами и др. В связи с этим, а также с целью минимизации побочных эффектов гепарина, перспективным направлением является разработка способов получения гепарина в промышленных масштабах из растительных источников. Предварительные результаты, полученные российскими учеными – учениками Б.А. Кудряшова, указывают на высокую эффективность гепариноподобных антикоагулянтов растительного происхождения. Из корней пиона Paeonia anomala был выделен антикоагулянт, сходный по действию с НФГ, но лишенный его побочных эффектов. Установлено, что при введении в кровоток лабораторным грызунам, этот гепариноид оказывает действие на все фазы процесса свертывания крови, вызывает гуморальную реакцию выделения из сосудистого эндотелия тканевого активатора плазминогена, обладает фибриндеполимеризационным эффектом. Обнаружено, что растительный гепариноид, аналогично НФГ, способен образовывать комплексы с биологически активными веществами. Полученные данные обосновывают целесообразность и необходимость дальнейшего исследования полученного растительного гепариноида [40].
ЗАКЛЮЧЕНИЕ
В качестве антикоагулянтов в клинике применяют как нефракционированные (НФГ), так и низкомолекулярные (НМГ) разновидности гепарина. Наиболее часто используются внутримышечный и подкожный пути введения гепарина. Наименьшее число нежелательных побочных эффектов обнаруживается при введении малых доз гепарина и ингаляционном способе применения. Лечение препаратами НФГ и НМГ следует проводить под контролем показателей гемостаза. Как и все лекарственные препараты, гепарин обладает рядом отрицательных побочных действий, число которых снижается с уменьшением вводимой дозы, длительности лечения, длины и степени сульфатирования молекулы.
В связи с пандемией COVID-19, гепарин привлекает внимание клиницистов, фармакологов, физиологов и биологов как полифункциональное средство, регулирующее многие биохимические и физиологические процессы в организме человека за счет образования комплексных соединений со многими биологически активными веществами. Как и эндогенный гепарин, экзогенный гепарин может покидать одни комплексные соединения и образовывать другие, изменяя свойства и содержание большинства ростовых факторов, цитокинов, хемокинов, АТФ, АДФ, уровня ионов кальция и др. Степень изменения веществ под действием гепарина зависит от его сродства, свойств молекулы гепарина, концентрации обоих компонентов и состояния окружающей среды. В конечном счете, эффекты гепарина создают условия для нормализации функции тканей и органов, обусловливают антистрессорный эффект при остром стрессе и посттравматическом стрессовом расстройстве.
Согласно современным методическим рекомендациям, назначение НФГ или НМГ показано всем госпитализированным пациентам с COVID-19. Доказанных преимуществ какого-либо одного НМГ по сравнению с другими выявлено не было. Применение гепарина во многих клиниках мира способствует росту выживаемости и улучшению состояния больных, у которых при гепаринотерапии происходит переход патологического воспаления в эффективный иммунный ответ.
Список литературы
Ahmed S, Zimba O, Gasparyan AY (2020) Thrombosis in Coronavirus disease 2019 (COVID-19) through the prism of Virchow’s triad. Clin Rheumatol 39(9): 2529–2543. https://doi.org/10.1007/s10067-020-05275-1
Huang H, Zhang M, Chen C, Zhang H, Wei Y, Tian J, Shang J, Deng Y, Du A, Dai H (2020) Clinical features of patients infected with 2019 novel corona-virus in Wuhan, China. Lancet 395(10223): 497–506.
Sholzberg M, Tang GH, Negri E, Rahhal H, Kreuziger LB, Pompilio CE, James P, Fralick M, AlHamzah M, Alomran F, Tseng E, Lim G, Lillicrap D, Carrier M, Áinle FN, Beckett A, da Costa BR, Thorpe K, Middeldorp S, Lee A, Cushman M, Jüni P (2021) Coagulopathy of hospitalised COVID-19: A Pragmatic Randomised Controlled Trial of Therapeutic Anticoagulation versus Standard Care as a Rapid Response to the COVID-19 Pandemic (RAPID COVID COAG – RAPID Trial): A structured summary of a study protocol for a randomised controlled trial. Trials 22(1): 202. https://doi.org/10.1186/s13063-021-05076-0
World Health Organization (2020) Clinical management of COVID-19. https://www.who.int/publications/i/item/clinical-management-of COVID-19
McLean J (1959) The discovery of heparin. Circulation 19(1): 75–78. https://doi.org/10.1161/01.cir.19.1.75
Handin RI (2016) The history of antithrombotic therapy: the discovery of heparin, the vitamin K antagonists, and the utility of aspirin. Hematol Oncol Clin North Am 30(5): 987–993. https://doi.org/10.1016/j.hoc.2016.06.002
Кондашевская МВ (2019) Экосистема тучных клеток – ключевой полифункциональный компонент организма животных и человека. Обзор. М. Группа МДВ. ISBN 978-5906748-08-9 К 64. [Kondashevskaya MV (2019) The ecosystem of mast cells is a key multifunctional component of the body of animals and humans. Review. M. Group MDV. ISBN 978-5906748-08-9 К 64. (In Russ)].
Кондашевская МВ (2021) Гепарин тучных клеток – новые сведения о старом компоненте (обзор). Вестник РАМН 76(2): 149–158. [Kondashevskaya MV (2021) Mast cell heparin – new information on the old component. Review. Bull Russ Acad Med Sci 76 (2): 149–158. (In Russ)]. https://doi.org/10.15690/vramn1284
Кондашевская МВ (2010) Современные представления о роли гепарина в гемостазе и регуляции ферментативной и гормональной активности (обзор). Вестник РАМН 7: 35–43. [Kondashevskaya MV (2010) Modern ideas about the role of heparin in hemostasis and regulation of enzymatic and hormonal activity (review). Bull Russ Acad Med Sci 76 (2): 149–158. (In Russ)].
Kudrjashov BA, Pastorova VE, Lyapina LA (1983) Anticoagulating and non-enzymatic fibrinolytic activities of heparin-antithrombin III and antithrombin III-heparin-thrombin complexes in vitro and in vivo. Folia Haematol Int Mag Klin Morphol Blutforsch 110(5): 731–742.
Aláez-Versón CR, Lantero E, Fernàndez-Busquets X (2017) Heparin: new life for an old drug. Nanomedicine (Lond) 12(14): 1727–1744. https://doi.org/10.2217/nnm-2017-0127
Tipnis SR, Hooper NM, Hyde R, Karran E, Christie G, Turner AJ (2000) A human homolog of angiotensinconverting enzyme. Cloning and functional expression as a captopril-insensitive carboxypeptidase. J Biol Chem 275(43): 33238–3243. https://doi.org/10.1074/jbc.M002615200
Шатунова ПО, Быков АС, Свитич ОА, Зверев ВВ (2020) Ангиотензинпревращающий фермент 2. Подходы к патогенетической терапии COVID-19. Журн микробиол эпидемиол и иммунобиол 97(4): 339-345. [Shatunova PO, AS Bykov, OA Svitich, VV Zverev (2020) Angiotensin-converting enzyme 2. Approaches to pathogenetic therapy of COVID-19. J Microbiol Epidemiol and Immunobiol 97(4): 339–349. (In Russ)]. https://doi.org/10.36233/0372-9311-2020-97-4-6
Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, Schiergens TS, Herrler G, Wu NH, Nitsche A, Müller MA, Drosten C, Pöhlmann S (2020) SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell 181: 271–280. https://doi.org/10.1016/j.cell.2020.02.052
Belen-Apak FB, Sarialioglu F (2020) The old but new: Can unfractioned heparin and low molecular weight heparins inhibit proteolytic activation and cellular internalization of SARS-CoV2 by inhibition of host cell proteases? Med Hypotheses 20(142): 109743. https://doi.org/10.1016/j.mehy.2020.109743
Tan CW, Sam IC, Chong WL, Lee VS, Chan YF (2017) Polysulfonatesuramin inhibits Zika virus infection. Antiviral Res 143: 186–194. https://doi.org/10.1016/j.antiviral.2017.04.017
Partridge LJ, Urwin L, Nicklin MJH, James DC, Green LR, Monk PN (2021) ACE2-independent interaction of SARS-CoV-2 spike protein with human epithelial cells is inhibited by unfractionated heparin. Cells 10(6): 1419. https://doi.org/10.3390/cells10061419
Schmidt EP, Yang Y, Janssen WJ, Gandjeva A, Perez MJ, Barthel L, Zemans RL, Bowman JC, Koyanagi DE, Yunt ZX, Smith LP, Cheng SS, Overdier KH, Thompson KR, Geraci MW, Douglas IS, Pearse DB, Tuder RM (2012) The pulmonary endothelial glycocalyx regulates neutrophil adhesion and lung injury during experimental sepsis. Nat Med 18: 1217–1223. https://doi.org/10.1038/nm.2843
Ackermann M, Verleden SE, Kuehnel M, Haverich A, Welte T, Laenger F, Vanstapel A, Werlein C, Stark H, Tzankov A, Li WW, Li VW, Mentzer SJ, Jonigk D (2020) Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med 383(2): 120–128. https://doi.org/10.1056/NEJMoa2015432
Kanthi Y, Knight JS, Zuo Y, Pinsky DJ (2020) New (re)purpose for an old drug: purinergic modulation may extinguish the COVID-19 thromboinflammatory firestorm. JCI Insight 5(14): e140971. https://doi.org/10.1172/jci.insight.140971
Vojacek JF (2017) Should we replace the terms intrinsic and extrinsic coagulation pathways with tissue factor pathway? Clin Appl Thromb Hemost 23(8): 922–927. https://doi.org/10.1177/1076029616673733
Obergan TYu, Lyapina LA, PastorovaVE (2007) Antithrombotic activity of heparin-ATP complex. Bull Exp Biol Med. 143(3): 299–301. https://doi.org/10.1007/s10517-007-0094-y
Ghosh TK, Eis PS, Mullaney JM, Ebert CL, Gill DL (1988) Competitive, reversible, and potent antagonism of inositol 1,4,5-trisphosphate-activated calcium release by heparin. J Biol Chem 263(23): 11075–11079.
Pletcher CH, Cunningham MT, Nelsestuen GL (1986) Molecular weight analysis of antithrombin III-heparin and antithrombin III-thrombin-heparin complexes. J Biol Chem 261(9): 4143–4147.
Meyer D, Tsakiris DA, Marbet GA (1989) Thrombin-antithrombin III complexes as a measure of effective heparin treatment? Schweiz Med Wochenschr 119(39): 1352–1354.
Kudrjashov BA, Liapina LA, Uljanov AM (1978) Complex fibrinogen-heparin (FH) and fibrinogen degradation products (FDP) in blood of rats after intravenous injection of thrombin. Thromb Res 13(3): 397–407.
Ji H-L, Zhao R, Matalon S, Matthay MA (2020) Elevated plasmin(ogen) as a common risk factor for COVID-19 susceptibility Physiol Rev 100(3): 1065–1075. https://doi.org/10.1152/physrev.00013.2020
Whyte CS, Morrow GB, Mitchell JL, Chowdary P, Mutch NJ (2020) Fibrinolytic abnormalities in acute respiratory distress syndrome (ARDS) and versatility of thrombolytic drugs to treat COVID-19. J Thromb Haemost 18(7): 1548–1555. https://doi.org/10.1111/jth.14872
Antoniak S (2018) The coagulation system in host defense. Res Pract Thromb Haemost 2(3): 549–557. https://doi.org/10.1002/rth2.12109
Ong WY, Go ML, Wang DY, Cheah IK, Halliwell B (2021) Effects of antimalarial drugs on neuroinflammation-potential use for treatment of COVID-19-related neurologic complications. Mol Neurobiol 58(1): 106–117. https://doi.org/10.1007/s12035-020-02093-z
Сомова ЛМ, Коцюрбий ЕА, Дробот ЕИ, Ляпун ИН, Щелканов МЮ (2021) Клинико-морфологические проявления дисфункции иммунной системы при новой коронавирусной инфекции COVID-19. Клин эксп морфол 10(1):11–20. [Somova LM, Kotsyurbiy EA, Drobot EI, Lyapun IN, Shchelkanov MYu (2021) Clinical and morphological manifestations of immune system dysfunction in new coronavirus infection (COVID-19). Clin Exp Morphology 10(1):11–20 (In Russ.)]https://doi.org/10.31088/CEM2021.10.1.11-20
Hogwood J, Pitchford S, Mulloy B, Page C, Gray E (2020) Heparin and non-anticoagulant heparin attenuate histone-induced inflammatory responses in whole blood. PLoS One 15(5): e0233644. https://doi.org/10.1371/journal.pone.0233644
Fernandes IG, de Brito CA, Dos Reis VMS, Sato MN, Pereira NZ (2020) SARS-CoV-2 and other respiratory viruses: what does oxidative stress have to do with it? Oxid Med Cell Longev 2020: 8844280. https://doi.org/10.1155/2020/8844280
Onishi JC, Häggblom MM, Shapses SA (2020) Can dietary fatty acids affect the COVID-19 infection outcome in vulnerable populations? mBio 11(4e): 01723–20. https://doi.org/10.1128/mBio.01723-20
Assimakopoulos SF, Mastronikolis S, DE Lastic AL, Aretha D, Papageorgiou D, Chalkidi T, Oikonomou I, Triantos C, Mouzaki A, Marangos M (2021) Intestinal Barrier Biomarker ZO1 and Endotoxin Are Increased in Blood of Patients With COVID-19-associated Pneumonia. In Vivo 35(4): 2483–2488. https://doi.org/10.21873/invivo.12528
Li LF, Liu YY, Lin SW, Chang CH, Chen NH, Hung CY, Lee CS (2020) Low-Molecular-Weight Heparin Reduces Ventilation-Induced Lung Injury through Hypoxia Inducible Factor-1α in a Murine Endotoxemia Model. Int J Mol Sci 21(9): 3097. https://doi.org/10.3390/ijms21093097
Domínguez-Salas S, Gómez-Salgado J, Andrés-Villas M, Díaz-Milanés D, Romero-Martín M, Ruiz-Frutos C (2020) Psycho-Emotional Approach to the Psychological Distress Related to the COVID-19 Pandemic in Spain: A Cross-Sectional Observational Study. Healthcare (Basel) 8(3): E190. https://doi.org/10.3390/healthcare8030190
Kondashevskaya MV (2018) Experimental evaluation of the effects of low-dose heparin on the behavior and morphofunctional status of the liver in Wistar rats with posttraumatic stress disorders. Bull Exp Biol Med 164(10): 490–494.
Kudriashov BA, Shapiro FB, Lomovskaia EG, L-iapina LA (1975) The role of adrenaline and ACTH in the process of complex heparin compound formation in the blood during imobilization stress. Probl Endokrinol (Mosk) 21(5): 54–59.
Lyapina LA, Kondashevskaya MV, Ziadetdinova GA, Uspenskaya MS (2000) Comparative study of anticoagulants from various extracts of Paeonia anomala. Izv Akad Nauk Ser Biol (3): 345–349.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова