Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 1, стр. 3-17
Эволюционное приобретение мультифункциональности гликолитическими ферментами
О. П. Шатова 1, 4, *, П. В. Шегай 2, А. А. Заболотнева 1, А. В. Шестопалов 1, 3, А. Д. Каприн 2, 4
1 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
Москва, Россия
2 Национальный медицинский исследовательский центр радиологии
Министерства здравоохранения Российской Федерации
Москва, Россия
3 Национальный медицинский исследовательский центр Детской гематологии,
онкологии и иммунологии им. Дмитрия Рогачева Министерства здравоохранения
Российской Федерации
Москва, Россия
4 Российский университет дружбы народов
Москва, Россия
* E-mail: shatova.op@gmail.com
Поступила в редакцию 23.08.2022
После доработки 02.11.2022
Принята к публикации 05.11.2022
- EDN: IZOBOX
- DOI: 10.31857/S0869813923010119
Аннотация
Решение вопроса о происхождении жизни на Земле невозможно без понимания того, как возникли химические, функциональные и регуляторные принципы, определяющие клеточный метаболизм, каким образом клетки приобрели свойства, определяющие их эволюцию, и как биологические системы функционируют и развиваются. Настоящий обзор посвящен рассмотрению многогранности функций гликолитических ферментов, экспрессия которых значительно повышена в некоторых типах клеток, например, клетках, обладающих стволовыми свойствами, или клетках злокачественных опухолей. Практически для всех ферментов гликолиза были установлены некаталитические функции, которые необходимы для поддержания высокой скорости пролиферации клеток, их активной миграции и формирования стволового фенотипа. Гликолитические ферменты возникли очень рано в процессе эволюции. Поскольку геномы древних форм жизни имели ограниченное число генов для кодирования всего множества необходимых функций, ферменты гликолиза или продукты катализируемых ими реакций можно было использовать в качестве древних регуляторов межклеточной и внутриклеточной коммуникации. Впоследствии многофункциональность основных метаболических ферментов стала использоваться опухолевыми клетками для обеспечения их выживания и роста. В настоящем обзоре мы обсуждаем некоторые некаталитические функции гликолитических ферментов, а также возможное эволюционное значение приобретения такой мультифункциональности.
Гликолиз является универсальным и самым древним метаболическим процессом [1]. Однако гликолитические ферменты не являются консервативными по последовательности между царствами [2]. Следовательно, реконструкция на основе последовательности не может сказать, возникали ли различные ферменты гликолиза в процессе эволюции de novo, параллельно или уже после появления LUCA (Last Universal Common Ancestor) [2]. Более того, пока невозможным является представление всего пути эволюции метаболизма и понимание, каким образом компартментализовались соответствующие белки в стройный путь окисления глюкозы [2]. Было выдвинуто предположение, что эволюционно древний метаболизм глюкозы обеспечивался изменениями рН [1]. Также недавние исследования показывают, что концентрация ионов Fe2+ в водах океана в архейскую эру могла повышаться до миллимолярных значений [1, 2]. Следовательно, для протекания гликолиза в клетках было достаточно Fe(II), а ионы Fe2+, вероятно, могли проходить через ранние мембранные структуры, которые были менее герметичными по сравнению с современными мембранами [1]. Кроме того, можно предположить, что в растворе богатом железом фосфорсодержащие производные сахаров неизбежно будут подвергаться реакциям гликолиза и пентозофосфатного пути (ПФП). Следовательно, промежуточные продукты гликолиза и ПФП образуют неферментативную сеть взаимопревращений, которая топологически напоминает пути центрального метаболизма. Однако не менее важным – и именно в этом неферментативный гликолиз и ПФП отличались от других неферментативных процессов, которые ранее ассоциировались с происхождением метаболизма, – является то, что сеть соответствует дарвиновскому требованию: для того, чтобы обеспечить избирательное преимущество в любом эволюционном процессе, метаболические пути должны образовывать единое целое, что обеспечивается протеканием всех реакций гликолиза в одних и тех же условиях [2].
Согласно теории репримитивизации злокачественно трансформированные клетки в ходе своего формирования возвращаются к более примитивному наследственному фенотипу [3]. Принимая во внимание эту теорию, следует отметить, что опухолевые клетки и их микроокружение находятся в условиях кислого рН [4] и обогащаются двухвалентным железом [5]. При этом многочисленные исследователи подчеркивают, что именно ацидоз обеспечивает перепрограммирование метаболизма в опухолевых клетках [4]. Существуют данные эволюционных биологов, которые подтверждают, что эволюционно древние гликолиз и ПФП происходили неферментативно [1]. Однако сложно ответить, возможно ли неферментативное окисление глюкозы в опухолевых клетках или нет. Различные исследования демонстрируют, что в опухоли происходит гиперэкспрессия [6] и гиперактивация ферментов гликолиза [7] и ПФП [8]. При этом именно гликолитическое окисление глюкозы обеспечивает энергией быстрорастущие ткани, а также тоти-, уни- и плюрипотентные клетки. Более того, в процессе эволюции многоклеточные организмы стали использовать гликолитические ферменты не только как катализаторы соответствующих реакций, но и “добавили“ им работу “по совместительству“ [9]. Установлено, что мультифункциональность ферментов гликолиза очень сильно зависит от их компартментализации [10 ] . Кроме того, белки-ферменты гликолиза являются сигнальными молекулами, равно как и их продукты/субстраты [11, 12], выполняющие важнейшую регуляторную роль в жизни клетки [9].
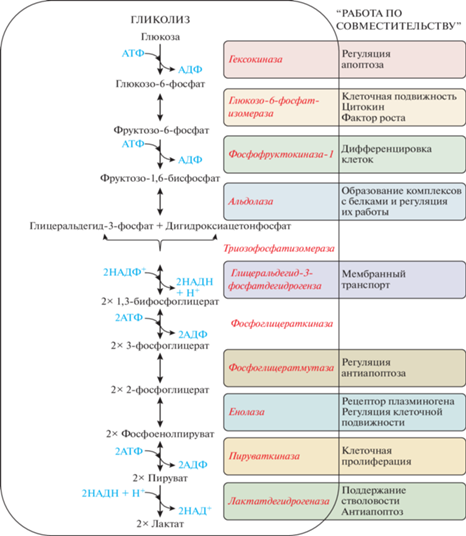
Безусловно, интенсификация гликолиза – это самая характерная черта в метаболическом перепрограммировании, происходящем при опухолевом росте [13]. Также установлено, что чем больше опухолевых стволовых клеток (ОСК) в ткани опухоли, тем выше экспрессия ферментов гликолиза [14], что подчеркивает роль гликолиза в формировании стволового фенотипа ОСК. На данном этапе остается неизученным, как регулируется компартментализация и соответственно мультифункциональность гликолитических ферментов, а также существуют ли какие-либо аллостерические эффекторы “включения“ и “выключения“ работы гликолитических ферментов “по совместительству“. Также остается неизвестным, на каком этапе эволюции гликолитические ферменты приобрели дополнительные функции. Удивительным примером феномена “Gain of Function (GoF)” (дословно: добавление функции) для белков, которые работают “по совместительству” является то, что 25% дополнительных функций в базе данных многозадачных белков (MultitaskProtDB-II) ассоциированы с вирулентной активностью патогенов. Более того, канонические функции таких белков, как правило, связаны с ключевыми высококонсервативными клеточными процессами, а их “подрабатывающие” функции часто необходимы для индукции белков ремоделирования внеклеточного матрикса (ВКМ). Ферменты гликолиза также являются факторами вирулентности многих патогенов и паразитов [15, 16]. В настоящее время установлено, что гликолитические ферменты участвуют в регуляции транскрипции (гексокиназа-II, лактатдегидрогеназа А, глицеральдегид-3-фосфатдегидрогеназа, енолаза-1); в регуляции апоптоза (глюкокиназа и глицеральдегид-3-фосфатдегидрогеназа); в стимуляции клеточной подвижности (глюкозо-6-фосфатизомераза) [17, 18].
В настоящем обзоре мы постарались представить различные некаталитические функции гликолитических ферментов и оценить эволюционное значение приобретения такой мультифункциональности.
1. ГЕКСОКИНАЗА ПРИНИМАЕТ УЧАСТИЕ В АПОПТОЗЕ
Первый фермент гликолитического превращения глюкозы – гексокиназа (ГК) – представлена изоферментом ГК2 и более чем в 50% случаев имеет митохондриальную локализацию в опухолевых клетках. Митохондриальная форма этого фермента принимает участие в реализации программы апоптоза [19]. ГК2 экспрессируется в основном в эмбриональных тканях, а также в жировой и мышечных тканях и почти не представлена в других тканях. Важно отметить, что данный изофермент ГК гиперэкспрессирован в опухолях самых различных локализаций [20]. Более того, было установлено, что подавление экспрессии ГК2 приводит к снижению пролиферации опухолевых клеток в моделях ксенотрансплантантов [20].
Также было показано, что ингибирование фосфорилирования протеинкиназы В (Akt) в фоторецепторах приводит к перемещению митохондриальной ГК2 в цитоплазму, повышению активности каспаз и снижению жизнеспособности клеток. Интересно, что для фоторецепторов характерен эффект Варбурга в отличие от других терминально дифференцированных нейронов. Три фермента являются ключевыми для осуществления данного эффекта (аэробного гликолиза): ГК2, пируваткиназа мышечного изофермента 2 (ПKM2) и лактатдегидрогеназа A (ЛДГ-A) [21]. Так, ГК-2 обычно находится в митохондриях и связана с потенциал-зависимым анионным каналом (VDAC), где она получает предпочтительный доступ к АТФ для фосфорилирования глюкозы. Будучи связанным с VDAC, ГК2 может также предотвращать связывание проапоптотических факторов с митохондриями и открытие митохондриальной переходной поры проницаемости (mPTP), которая блокирует высвобождение цитохрома с [22]. Было показано, что Akt модулирует способность ГK2 связываться с VDAC посредством его прямого фосфорилирования [23]. Установлено, что палочки-фоторецепторы, лишенные ГК2, активируют ГК1. Интересно, что ГК2-дефицитные фоторецепторы более восприимчивы к острому дефициту питательных веществ в экспериментальной модели отслойки сетчатки, а ГК2 важна для сохранения фоторецепторов во время старения [21].
2. ГЛЮКОЗО-6-ФОСФАТИЗОМЕРАЗА РЕГУЛИРУЕТ КЛЕТОЧНУЮ ПОДВИЖНОСТЬ
Второй фермент гликолиза, превращающий глюкозо-6-фосфат во фруктозо-6-фосфат – фосфоглюкоизомераза (глюкозо-6-фосфатизомераза, Г6ФИ) также выполняет “по совместительству” ряд важных функций. Этот белок известен как аутокринный фактор подвижности (AMF), нейролейкин, нейротрофный фактор роста, фактор зрелости, определяющий дифференцировку человеческих миелоидных клеток и способность опухолевых клеток к метастазированию [18, 24–26]. У онкологических больных в крови существенно возрастает активность этого фермента гликолиза (пути Эмбдена–Меергофа), позволяющего использовать показатель активности этого фермента (цитокина) как раннего маркера наличия в организме злокачественной опухоли [27]. Интересно, что Г6ФИ обладает и антиапоптотическими свойствами [27]. Выраженность последних – характерный признак злокачественных опухолей. Высокая активность Г6ФИ обеспечивает выживаемость, но не пролиферацию эмбриональных спинальных и чувствительных нейронов [18]. Доказано, что точечные мутации этого фермента связаны с развитием олигофрении [17]. Г6ФИ также является фактором созревания: стимулирует созревание моноцитов, индуцирующее секрецию иммуноглобулинов, влияет на дифференцировку остеобластов, провоцирует артриты у мышей [17]. Обращает внимание тот факт, что специфический ингибитор ферментативной активности – манноза-6-фосфат – ингибирует и цитокиновые функции этого фермента (регуляцию подвижности клеток, ингибирование апоптоза, пролиферацию и т.п.) [17].
Г6ФИ действует как цитокин и фактор роста в самых разнообразных внеклеточных процессах [28]. AMF/Г6ФИ представляет собой многофункциональный цитокин, который проявляет активность, подобную полифункциональному фактору роста, и действующий через уникальный семиспиральный гликопротеиновый рецептор 78 кДа (гликопротеин 78, gp78) (рецептор фактора аутокринной подвижности, AMFR) [29]. Многие исследования показали, что AMF обладает не только аутокринными эффектами, стимулируя подвижность продуцирующих AMF опухолевых клеток, но также выступает в роли паракринного фактора, воздействующего на эндотелиальные клетки вен. Так, AMF индуцирует ангиогенез за счет стимуляции подвижности клеток и повышения экспрессии рецепторов фактора роста эндотелия сосудов (VEGFR) [30]. Гиперэкспрессия AMF/Г6ФИ и AMFR была обнаружена во многих злокачественных новообразованиях и связана с прогрессированием опухолей, их метастазированием и ангиогенезом [31].
3. ФОСФОФРУКТОКИНАЗА-1 РЕГУЛИРУЕТ АКТИВНОСТЬ ТРАНСКРИПЦИОННЫХ ФАКТОРОВ
Фосфофруктокиназа 1 (ФФК-1) катализирует третью реакцию гликолиза и является вторым регуляторным ферментом после гексокиназы. ФФК-1 лимитирует скорость окисления глюкозы и выполняет “по совместительству” антиоксидантную функцию [32]. Примечательно, что не только сами гликолитические ферменты, но и продукты их реакций, такие как, например, пируват и НАДН, также могут выполнять антиоксидантную функцию – улучшать защиту клеток от активных форм кислорода (АФК), как было показано на культуре клеток нейробластомы [33]. Существуют литературные данные, что пируват является сигнальной молекулой – предотвращает аэробную деградацию индуцируемого гипоксией фактора 1α (HIF-1α) и усиливает экспрессию генов, активируемых HIF1-α, включая эритропоэтин, эндотелиальный фактор роста, глюкозный транспортер 3-го типа (ГЛЮТ-3) и альдолазу-А [34].
Кроме того, было показано, что ФФК-1 связывает кофакторы транскрипции TEAD (Transcriptional enhanced associate domain), что способствует их взаимодействию с факторами транскрипции YAP/TAZ в клеточных линиях рака молочной железы человека. YAP/TAZ являются ключевыми транскрипционными факторами, регулирующими пролиферацию опухолевых клеток и агрессивность опухолей; следовательно, их активация приводит к транскрипции генов, способствующих опухолевой прогрессии [35].
В клетках многоклеточных организмов гликолитические белки не просто диффузно распределены в цитозоле: существуют регуляторные механизмы, организующие гликолитические белки in vivo. Предполагаемая организация гликолитических белков in vivo может иметь важные последствия для субклеточной регуляции этого метаболического пути и его ферментативной активности [36]. Так, ФФК-1 диффузно локализована в цитозоле клеток; при гипоксии и, как следствие, энергетическом стрессе фермент может динамически перемещаться с образованием биомолекулярных конденсатов. При возвращении в нормоксические условия ФФК-1 вновь диспергируется в цитозоле. Установлено, что конденсаты ФФК-1 обладают жидкостными свойствами и что их молекулярная динамика, в том числе вязкость и биофизические свойства, изменяются при длительных гипоксических состояниях. Также установлено, что ФФК-1 и альдолаза-1 взаимодействуют, рекрутируя друг друга в конденсаты, что указывает на событие самоассоциации, которое запускает петлю прямой связи для рекрутирования гликолитических белков в конденсаты [36].
4. АЛЬДОЛАЗА ОБРАЗУЕТ КОМПЛЕКСЫ С РАЗЛИЧНЫМИ БЕЛКАМИ И РЕГУЛИРУЕТ ЭПИТЕЛИАЛЬНО-МЕЗЕНХИМАЛЬНЫЙ ПЕРЕХОД
Главной особенностью работы альдолазы “по совместительству” является ее способность связываться с широким спектром различных по функциям белков. Например, в клетках некоторых млекопитающих альдолаза может вносить вклад в формирование внутриклеточного цитоскелета, например, взаимодействуя с F-актином и Н+-АТФазой вакуолярного типа (V-АТФаза) или путем ингибирования зависимой от белка синдрома Вискотта–Олдрича (WASP) полимеризации актина [37]. У дрожжей Saccharomyces cerevisiae альдолаза помогает контролировать транскрипцию, направленную РНК-полимеразой III, посредством физического взаимодействия с ней [38]. Также альдолаза необходима для регуляции эндоцитоза, которая осуществляется путем связывания альдолазы с внутриклеточным транспортным белком, сортирующим нексин 9 (SNX9) [39]. Есть работы, показывающие, что альдолаза взаимодействует с фосфолипазой D2, гепарином и γ-тубулином [37], но функциональная роль этих взаимодействий пока неизвестна.
Одной из важных функций альдолазы является ее способность служить датчиком доступности глюкозы. Было обнаружено, что при низкой внутриклеточной концентрации субстрата альдолазы (фруктозо-1,6-дифосфата), данный гликолитический фермент взаимодействует с V-АТФазой. Это способствует активации AMФ-активируемой протеинкиназы (AMPK), и именно этот белок затем стимулирует выработку АТФ за счет повышения активности или экспрессии белков, участвующих в катаболических путях [40]. В опухолевых клетках альдолаза может способствовать активации ДНК-зависимой протеинкиназы (ДНК-ПК) путем связывания с ее каталитической субъединицей. В свою очередь ДНК-ПК фосфорилирует белок-супрессор опухолевого роста p53, повышая его активность [41]. Альдолаза также может активировать онкогенный сигнальный путь Wingless/Int-1 (Wnt) в клетках млекопитающих путем подавления элиминации сигнальной молекулы β-катенина [42]. С другой стороны, альдолаза может влиять на эпителиально-мезенхимальный переход (ЭМП) за счет снижения экспрессии E-кадгерина и β-катенина и одновременного повышения уровня фибронектина и виментина, что способствует злокачественной трансформации клеток [42].
Кроме того, альдолаза-А может [43] действовать как онкоген при раке мочевого пузыря, регулируя передачу сигналов через путь “E-кадгерин–эпидермальный фактор роста (EGFR)”, что приводит к метастазированию. Таким образом, у альдолазы имеются как проонкогенные (посредством передачи сигналов Wnt/E-кадгерин-EGFR), так и антионкогенные (через активацию p53) функции при опухолях различной локализации.
5. ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТДЕГИДРОГЕНАЗА ПРИНИМАЕТ УЧАСТИЕ В МЕМБРАННОМ ТРАНСПОРТЕ
Глицеральдегид-3-фосфатдегидрогеназа (ГА3ФДГ) катализирует пятую реакцию гликолиза – окисление глицеральдегид-3-фосфата. Этот фермент обладает множеством различных активностей, не связанных с участием в гликолизе. Например, доказано, что ГА3ФДГ имеет урацил-ДНК-гликозилазную активность [44, 45]. Более того, роль, которую выполняет этот белок, зависит от его состояния (растворенный или фиксированный на мембране) и локализации (в цитоплазме или в ядре клетки) [46]. Этот фермент участвует в слиянии мембран, образовании микротрубочек, построении теломер [47]; имеет киназную активность, осуществляет экспорт РНК из клеточных ядер, участвует в репликации и репарации, апоптозе, в развитии возраст-зависимых нейродегенеративных заболеваний и, в конечном счете, в злокачественной трансформации клеток [47, 48]. Важно, что этот фермент является одной из наиболее чувствительных мишеней для оксида азота (NO) [46, 48]. Каждый из вышеперечисленных жизненно важных внутриклеточных процессов требует включения ГА3ФДГ в серию мультиферментных комплексов, при этом фермент сохраняет свою структуру. Интересно, что ГА3ФДГ стехиометрически и специфически взаимодействует с мышечной и сердечной изоформами ЛДГ. Комплекс этих ферментов становится малорастворимым. Взаимодействия этих ферментов могут влиять на баланс НАД+/НАДН и на весь гликолитический путь окисления глюкозы [49]. Кроме того, установлено, что данный фермент является фактором патогенности и вирулентности [16].
6. ФОСФОГЛИЦЕРАТМУТАЗА ВОВЛЕЧЕНА В ИНГИБИРОВАНИЕ АПОПТОЗА
Установлено, что фосфоглицератмутаза-1 (ФГМ-1) гиперэкспрессируется в глиобластомах, где увеличивает эффективность пути ответа на повреждение ДНК (DDR) за счет цитоплазматического связывания фосфатазы WIP1 (протеинфосфатаза 2C дельта), тем самым предотвращая ее ядерную транслокацию и последующее дефосфорилирование сигнального пути ATM (белок с мутацией атаксии-телеангиэктазии). Подавление экспрессии ФГМ-1 в клетках глиомы снижает образование γ-H2AX (фосфорилированной формы Н2А), увеличивает апоптоз и снижает клоногенность после облучения и лечения темозоломидом [50].
7. ЕНОЛАЗА ЯВЛЯЕТСЯ РЕЦЕПТОРОМ ПЛАЗМИНОГЕНА
Структура фермента, катализирующего девятую реакцию гликолиза – енолазы-α (фосфопируватгидратазы), определяется геном ENO1. Альтернативная трансляция этого гена приводит к образованию Myc-связывающего белка-1 (Myc-binding protein 1, MBP1), не участвующего в гликолизе, но подавляющего экспрессию протоонкогена c-Myc [51]. Установлено, что енолаза-α способствует подвижности и инвазивности опухолевых клеток за счет неферментативной белковой функции связывания плазминогена и образования плазмина [52]. Было показано, что воздействие эпидермального фактора роста (EGF) и липополисахарида (LPS), способствует экспрессии енолазы-α [52]. Енолаза-α экспрессируется на поверхности нескольких типов клеток, где она действует как рецептор плазминогена, концентрируя протеолитическую активность плазмина на клеточной поверхности [52], таким образом, енолаза-α вовлечена в ремоделирование ВКМ и индукцию ангиогенеза и опухолевого роста [6]. Более того, было установлено, что в злокачественных опухолях енолаза гиперэкспрессирована или гиперактивирована [6]. Енолаза-α, один из важнейших ферментов гликолитического пути, представляет собой многофункциональный белок с онкогенными свойствами: он способствует пролиферации, миграции и инвазии опухолевых клеток, что приводит к ускоренному прогрессированию различных опухолей [6].
8. ПИРУВАТКИНАЗА ОТВЕЧАЕТ ЗА ПРОЛИФЕРАЦИЮ
Пируваткиназа (ПК) катализирует десятую реакцию гликолиза и необратимо превращает фосфоенолпируват в пируват: это третья регуляторная реакция процесса. Кроме ферментативной функции, этот белок внутри ядра регулирует процесс пролиферации [53]. В опухолевых клетках, особенно в метастатических, активность ПК повышена, а также повышено соотношение активностей ПК к ФФК-1 [54].
Изоформа М2 (ПКМ2) экспрессируется в клетках и тканях с высокой скоростью пролиферации, включая эмбриональные и опухолевые клетки [55]. Было показано, что ПКМ2 может существовать в димерной и тетрамерной формах: димерная ПКМ2 проявляет протеинкиназную активность (фосфоенолпируват используется в качестве донора фосфата), тогда как тетрамер ПКМ2 катализирует пируваткиназную реакцию гликолиза. Именно экспрессия димерной изоформы (а значит протеинкиназная активность фермента) способствует клеточной пролиферации [56]. Во время канцерогенеза ПКМ2 действует как важный фактор для поддержания фенотипа ОСК благодаря своей способности взаимодействовать с октамер-связывающим фактором транскрипции 4 (Oct-4) и усиливать его трансактивацию [56]. Известно, что белок Oct-4 является важным фактором в поддержании плюрипотентности эмбриональных стволовых клеток. Кроме того, в различных работах было показано, что ядерная изоформа ПКМ2 взаимодействует с HIF-1α, что способствует повышению экспрессии его генов-мишеней (например, генов, кодирующих глюкозный транспортер 1 типа (ГЛЮТ-1) и ЛДГ-А) и обеспечивает метаболическое перепрограммирование в опухолях [56].
9. ЛАКТАТДЕГИДРОГЕНАЗА ОБЕСПЕЧИВАЕТ ПОДДЕРЖАНИЕ СТВОЛОВОГО ФЕНОТИПА КЛЕТОК И ИНГИБИРУЕТ АПОПТОЗ
В литературе есть косвенные указания на возможность работы “по совместительству” и последнего ключевого фермента гликолиза – лактатдегидрогеназы. Многочисленные исследования показывают, что ЛДГ-A (изоформа фермента, преимущественно катализирующая превращение пирувата в лактат) имеет аберрантно высокий уровень экспрессии при многих опухолевых заболевания и зачастую является маркером неблагоприятного прогноза течения заболевания [57]. Существует несколько объяснений молекулярных механизмов действия ЛДГ-A, обеспечивающих деление и выживание опухолевых клеток. Во-первых, роль ЛДГ-A заключается в обеспечении злокачественных клеток достаточным количеством энергии. Хорошо известен эффект Варбурга, представляющий собой значительную интенсификацию гликолиза и образование лактата в клетках злокачественных опухолей как в условиях гипоксии, так и нормоксии [58, 59]. Известно, что в нормоксических условиях скорость пролиферации клеток снижалась после подавления ЛДГ-A, а в условиях гипоксии (0.5% кислорода) также серьезно нарушался рост опухолевых клеток с дефицитом ЛДГ-A: опухолевые клетки со сниженной активностью ЛДГ-A не могли поддерживать высокие уровни АТФ, что, вероятно, способствовало замедлению пролиферации клеток в нормоксических или гипоксических условиях. Во-вторых, ЛДГ-A участвует в поддержании стволовых свойств опухолевых клеток. Экспрессия ЛДГ-A в значительной степени связана с экспрессией Oct-4, который играет важную роль в самообновлении эмбриональных стволовых клеток. При этом нокдаун ЛДГ-A может снижать экспрессию Oct-4 и онкогенные свойства клеток in vitro и in vivo [59].
Кроме того, ЛДГ-A косвенно способствует выживанию опухоли, защищая ее от повреждения АФК, а также ЛДГ-A может напрямую ингибировать апоптоз. Иммуногистохимическое исследование меланомы, проведенное Zhuang и соавт. [59], показало, что экспрессия ЛДГ-A сильно коррелирует с экспрессией антиапоптотических белков Mcl-1 и Bcl-XL, а нокдаун ЛДГ-A увеличивает расщепление поли-(АДФ-рибоза)-полимеразы (PARP) и снижает экспрессию Х-сцепленного ингибитора белка апоптоза (XIAP), Bcl-2 и Bcl-XL, что приводило к снижению онкогенности линии клеток поджелудочной железы BxPC-3 [60]. Было также обнаружено, что в ксенотрансплантатах клеточных линий рака молочной железы нокаут ЛДГ-A повышает уровни Bcl-2-ассоциированного белка X (Bax), PARP, каспазы-9, цитоплазматического цитохрома C и супероксидного аниона, в то время как экспрессия Bcl-2 и потенциал митохондриальной мембраны были снижены [61 ] . Наконец, гиперэкспрессия ЛДГ-A также может способствовать росту опухоли, предотвращая некроз в условиях гипоксии. Lewis и соавт. [62] указали, что опухоли, гиперэкспрессирующие ЛДГ-A и Rcl, имеют небольшую область некроза по сравнению с опухолями, гиперкспрессирующими Rcl и VEGF. Это указывает на то, что повышенная экспрессия ЛДГ-A защищает центральные опухолевые клетки от некроза, вызванного гипоксией. ЛДГ-A существенно влияет на инвазию и миграцию злокачественных клеток посредством регуляции ключевых участников этих клеточных процессов, например, вызывая деградацию ВКМ посредством стимуляции продукции металлопротеиназы-2 (MMP-2), способствуя метастатическому васкулогенезу путем активации VEGF и ингибируя адгезию клеток за счет подавления экспрессии Е-кадгерина. Кроме того, активация ЭМТ также лежит в основе вклада ЛДГ-A в метастазирование злокачественных опухолей [63]. Так, недавно было обнаружено, что нокдаун ЛДГ-A предотвращает инвазию опухолевых клеток, что сопровождается снижением экспрессии Snail, N-кадгерина, фибронектина и виментина, но повышением экспрессии E-кадгерина при раке мочевого пузыря [63]. Различные исследования показали, что ЛДГ-A может регулировать и ангиогенез опухоли [64]. Регуляция ангиогенеза с помощью ЛДГ-A в основном зависит от продукции лактата [65, 66]. Подкисление микроокружения способствует продукции интерлейкина-8 (IL-8) и VEGF, а поглощение лактата сосудистыми эндотелиальными клетками запускает фосфорилирование/деградацию IκBα, активирует ядерный фактор-каппа B (NF-κB), способствует экспрессии IL-8 и впоследствии ускоряет ангиогенез и рост опухоли [67]. Лактат является одной из наиболее древних и важнейшей сигнальной молекулой, обеспечивающей функционирование клеток как в норме, так и при различных патологиях, включая злокачественные опухоли [66]. Действие лактата опосредовано специфическими рецепторами GPR81, активация которых приводит к индукции репарации ДНК, стимуляции ангиогенеза, подавлению воспаления, синтезу и секреции ряда цитокинов, и многим другим эффектам [66].
На наш взгляд, описанные выше результаты свидетельствуют о том, что факторами промоции канцерогенеза являются именно наличие в клетке функционально активной ЛДГ (которая обладает мультифункциональностью и выступает в качестве регулятора транскрипции многих генов [68]) и высокий внутриклеточный уровень продукта ЛДГ – лактата, важнейшего метаболита с сигнальной функцией [66].
ЗАКЛЮЧЕНИЕ
Явление белковой мультифункциональности широко распространено среди представителей всех царств живой природы и характерно, в том числе, для очень древних организмов – бактерий и архей. Геномы древних прокариот имели ограниченную способность кодировать все разнообразие функций, необходимых для взаимодействия с окружающей средой и другими организмами. Поэтому по мере изменения условий среды и усложнения организмов, ее населяющих, требовались новые посредники в такой коммуникации. Гликолиз является универсальным и ключевым метаболическим процессом для всех живых организмов. Поскольку гликолитические ферменты возникли очень рано в процессе эволюции, когда репертуар белков и небелковых сигнальных молекул был намного меньше современного, представляется возможным, что ферменты гликолиза как универсальные молекулы стали использоваться для межклеточной и внутриклеточной коммуникации. Например, многие инфекционные бактерии [69, 70] или паразиты [71] используют гликолитические ферменты в качестве факторов вирулентности или инструментов для адгезии, инвазии, модуляции гемостатической и иммунной систем, стимулирования ангиогенеза или получения нутриентов от клеток хозяина [16].
Другим преимуществом гликолитических ферментов является их локализация в цитозоле: это позволяет им взаимодействовать со многими другими молекулами, получать химические модификации или быть рекрутированными для транспорта в другие клеточные компартменты или экспорта в межклеточный матрикс [72]. Таким образом, ферменты гликолиза стали очень удобной точкой приложения действия сил эволюции, направленных на сохранение злокачественно трансформированных клеток. Тот факт, что неканонические функции гликолитических ферментов особенно ярко выражены в опухолевых клетках, указывает на исключительную роль этих ферментов в процессе канцерогенеза [73]. Более того, метаболическое перепрограммирование, реализуемое опухолевыми клетками, может быть направлено на “переключение” функций гликолитических ферментов с целью обеспечения прогрессивного опухолевого роста.
В этой связи можно посмотреть под другим углом на значение эффекта Варбурга, наблюдаемого во многих опухолях и проявляющегося в интенсификации гликолиза и гиперэкспрессии гликолитических ферментов [66]. Повышенная продукция лактата, а также закисление микроокружения и другие метаболические изменения, происходящие во время роста опухоли [66] и являющиеся результатом реализации эффекта Варбурга, возможно, необходимы для создания таких условий, в которых происходит функциональная “трансформация” гликолитических ферментов. Изменение их функций и локализации способствует индукции собственной экспрессии, а также приобретению опухолевыми клетками фенотипа стволовых клеток, стимуляции пролиферации злокачественных клеток, их инвазии, миграции и устойчивости к терапевтическим агентам. Так, ГК-2, Г6ФИ и ГА3ФДГ подавляют апоптоз, Г6ФИ стимулирует подвижность опухолевых клеток и ангиогенез, ФФК-1 защищает от АФК и предотвращает аэробную деградацию HIF-1α, альдолаза активирует путь AMPK, ГА3ФДГ принимает участие в построении теломер, енолаза-α способствует подвижности и инвазивности опухолевых клеток за счет функции связывания плазминогена и образования плазмина, ПК и ЛДГ способствуют пролиферации опухолевых клеток и их миграции (рис. 1).
Список литературы
Ralser M (2018) An appeal to magic? The discovery of a non-enzymatic metabolism and its role in the origins of life. Biochem J 475(16): 2577–2592. https://doi.org/10.1042/BCJ20160866
Bräsen C, Esser D, Rauch B, Siebers B (2014) Carbohydrate metabolism in archaea: Current insights into unusual enzymes and pathways and their regulation. Microbiol Mol Biol Rev 78(1): 89–175. https://doi.org/10.1128/MMBR.00041-13
Chen H, Lin F, Xing K, He X (2015) The reverse evolution from multicellularity to unicellularity during carcinogenesis. Nat Commun 6: 6367. https://doi.org/10.1038/ncomms7367
Corbet C, Pinto A, Martherus R, Santiago de Jesus JP, Polet F, Feron O (2016) Acidosis Drives the Reprogramming of Fatty Acid Metabolism in Cancer Cells through Changes in Mitochondrial and Histone Acetylation. Cell Metab 24 (2): 311–323. https://doi.org/10.1016/j.cmet.2016.07.003
Toyokuni S, Yanatori I, Kong Y, Zheng H, Motooka Y, Jiang L (2020) Ferroptosis at the crossroads of infection, aging and cancer. Cancer Sci 111(8): 2665–2671. https://doi.org/10.1111/cas.14496
Huang CK, Sun Y, Lv L, Ping Y (2022) ENO1 and Cancer. Mol Ther Oncolytics 24: 288–298. https://doi.org/10.1016/j.omto.2021.12.026
Cerella C, Dicato M, Diederich M (2014) Modulatory roles of glycolytic enzymes in cell death. Biochem Pharmacol 92: 22–30. https://doi.org/10.1016/j.bcp.2014.07.005
Munemoto M, Mukaisho K ichi, Miyashita T, Oyama K, Haba Y, Okamoto K, Kinoshita J, Ninomiya I, Fushida S, Taniura N, Sugihara H, Fujimura T (2019) Roles of the hexosamine biosynthetic pathway and pentose phosphate pathway in bile acid-induced cancer development. Cancer Sci 110: 2408–2420. https://doi.org/10.1111/cas.14105
Kim JW, Dang CV (2005) Multifaceted roles of glycolytic enzymes. Trends Biochem Sci 30 (3): 142–150. https://doi.org/10.1016/j.tibs.2005.01.005
Jang SR, Xuan Z, Lagoy RC, Jawerth LM, Gonzalez IJ, Singh M, Prashad S, Kim HS, Patel A, Albrecht DR, Hyman AA, Colón-Ramos DA (2021) Phosphofructokinase relocalizes into subcellular compartments with liquid-like properties in vivo. Biophys J 120 (7): 1170–1186. https://doi.org/10.1016/j.bpj.2020.08.002
Mu X, Shi W, Xu Y, Xu C, Zhao T, Geng B, Yang J, Pan J, Hu S, Zhang C, Zhang J, Wang C, Shen J, Che Y, Liu Z, Lv Y, Wen H, You Q (2018) Tumor-derived lactate induces M2 macrophage polarization via the activation of the ERK/STAT3 signaling pathway in breast cancer. Cell Cycle 17(4): 428–438. https://doi.org/10.1080/15384101.2018.1444305
Shatova O, Khomutov E, Zynkovich I, Skorobogatova Z, Bogaturova O (2009) Does lactate have an impact on enzyme activity? Eur J Cancer Sup 7: 1046. https://doi.org/10.1016/s1359-6349(09)70339-8
Yang H, Zhong JT, Zhou SH, Han HM (2019) Review roles of GLUT-1 and HK-II expression in the biological behavior of head and neck cancer. Oncotarget 10(32): 3066–30833. https://doi.org/10.18632/oncotarget.24684
Sancho P, Barneda D, Heeschen C (2016) Hallmarks of cancer stem cell metabolism. Br J Cancer 114(12): 1305–1312. https://doi.org/10.1038/bjc.2016.152
Kopeckova M, Pavkova I, Stulik J (2020) Diverse Localization and Protein Binding Abilities of Glyceraldehyde-3-Phosphate Dehydrogenase in Pathogenic Bacteria: The Key to its Multifunctionality? Front Cell Infect Microbiol 10: 89. https://doi.org/10.3389/fcimb.2020.00089
Franco-Serrano L, Sánchez-Redondo D, Nájar-García A, Hernández S, Amela I, Perez-Pons JA, Piñol J, Mozo-Villarias A, Cedano J, Querol E (2021) Pathogen moonlighting proteins: From ancestral key metabolic enzymes to virulence factors. Microorganisms 9(6): 1300. https://doi.org/10.3390/microorganisms9061300
Yanagawa T, Funasaka T, Tsutsumi S, Watanabe H, Raz A (2004) Novel roles of the autocrine motility factor/phosphoglucose isomerase in tumor malignancy. Endocr Relat Cancer 11(4): 749–759. https://doi.org/10.1677/erc.1.00811
Yanagawa T, Watanabe H, Takeuchi T, Fujimoto S, Kurihara H, Takagishi K (2004) Overexpression of autocrine motility factor in metastatic tumor cells: Possible association with augmented expression of KIF3A and GDI-β. Lab Invest 84(4): 513–522. https://doi.org/10.1038/labinvest.3700057
Bustamante E, Pedersen PL (1977) High aerobic glycolysis of rat hepatoma cells in culture: Role of mitochondrial hexokinase. Proc Natl Acad Sci USA 74(9): 3735–3739. https://doi.org/10.1073/pnas.74.9.3735
Wang W, Liu Z, Zhao L, Sun J, He Q, Yan W, Lu Z, Wang A (2017) Hexokinase 2 enhances the metastatic potential of tongue squamous cell carcinoma via the SOD2-H2O2 pathway. Oncotarget 8 (2): 3344–3354. https://doi.org/10.18632/oncotarget.13763
Weh E, Lutrzykowska Z, Smith A, Hager H, Pawar M, Wubben TJ, Besirli CG (2020) Hexokinase 2 is dispensable for photoreceptor development but is required for survival during aging and outer retinal stress. Cell Death Dis 11(6): 422. https://doi.org/10.1038/s41419-020-2638-2
Majewski N, Nogueira V, Bhaskar P, Coy PE, Skeen JE, Gottlob K, Chandel NS, Thompson CB, Robey RB, Hay N (2004) Hexokinase-mitochondria interaction mediated by Akt is required to inhibit apoptosis in the presence or absence of Bax and Bak. Mol Cell 16(5): 819–830. https://doi.org/10.1016/j.molcel.2004.11.014
Rajala A, Gupta VK, Anderson RE, Rajala RVS (2013) Light activation of the insulin receptor regulates mitochondrial hexokinase. A possible mechanism of retinal neuroprotection. Mitochondrion 13(6): 566–576. https://doi.org/10.1016/j.mito.2013.08.005
Masumura S, Hashimoto M, Hashimoto Y, SatŌ T, Kihara I, Watanabe Y (1982) Glycolytic activity of rat aorta after exercise. Eur J Appl Physiol Occup Physiol 48(2): 157–161. https://doi.org/10.1007/BF00422977
Osthus RC, Shim H, Kim S, Li Q, Reddy R, Mukherjee M, Xu Y, Wonsey D, Lee LA, Dang CV. (2000) Deregulation of glucose transporter 1 and glycolytic gene expression by c-Myc. J Biol Chem 275(29): 21797–21800. https://doi.org/10.1074/jbc.C000023200
Sato J, Yanagawa T, Dobashi Y, Yamaji T, Takagishi K, Watanabe H (2008) Prognostic significance of 18F-FDG uptake in primary osteosarcoma after but not before chemotherapy: A possible association with autocrine motility factor/phosphoglucose isomerase expression. Clin Exp Metastasis 25(4): 427–435. https://doi.org/10.1007/s10585-008-9147-5
Chiao JW, Xu W, Yang YM, Kancherla R, Seiter K, Ahmed T, Mittelman A (1999) Regulation of growth and apoptosis of breast cancer cells by a 54 kDa lymphokine. Int J Oncol 15(4): 835–838. https://doi.org/10.3892/ijo.15.4.835
Zong M, Lu T, Fan S, Zhang H, Gong R, Sun L, Fu Z, Fan L (2015) Glucose-6-phosphate isomerase promotes the proliferation and inhibits the apoptosis in fibroblast-like synoviocytes in rheumatoid arthritis. Arthritis Res Ther 17(1): 100. https://doi.org/10.1186/s13075-015-0619-0
Shimizu K, Tani M, Watanabe H, Nagamachi Y, Niinaka Y, Shiroishi T, Ohwada S, Raz A, Yokota J (1999) The autocrine motility factor receptor gene encodes a novel type of seven transmembrane protein. FEBS Lett 456(2): 295–300. https://doi.org/10.1016/S0014-5793(99)00966-7
Funasaka T, Haga A, Raz A, Nagase H (2001) Tumor autocrine motility factor is an angiogenic factor that stimulates endothelial cell motility. Biochem Biophys Res Commun 285(1): 118–128. https://doi.org/10.1006/bbrc.2001.5135
Kaynak K, Kara M, Oz B, Akgoz B, Sar M, Raz A (2005) Autocrine motility factor receptor expression implies an unfavourable prognosis in resected stage I pulmonary adenocarcinomas. Acta Chir Belg 105(4): 378–382. https://doi.org/10.1080/00015458.2005.11679740
Mazzio E, Soliman KFA (2003) The role of glycolysis and gluconeogenesis in the cytoprotection of neuroblastoma cells against 1-methyl 4-phenylpyridinium ion toxicity. Neurotoxicology 24(1): 137–147. https://doi.org/10.1016/S0161-813X(02)00110-9
Mazzio EA, Soliman KFA (2003) Cytoprotection of pyruvic acid and reduced β-nicotinamide adenine dinucleotide against hydrogen peroxide toxicity in neuroblastoma cells. Neurochem Res 28(5): 733–741. https://doi.org/10.1023/A:1022813817743
Forbes RA, Verma A (2002) Hypoxia-inducible factor 1 activation by aerobic glycolysis implicates the Warburg effect in carcinogenesis. J Biol Chem 277(26): 23111–23115. https://doi.org/10.1074/jbc.M202487200
Enzo E, Santinon G, Pocaterra A, Aragona M, Bresolin S, Forcato M, Grifoni D, Pession A, Zanconato F, Guzzo G, Bicciato S, Dupont S (2015) Aerobic glycolysis tunes YAP/TAZ transcriptional activity. EMBO J 34(10): 1349–1370. https://doi.org/10.15252/embj.201490379
Zecchin A, Stapor PC, Goveia J, Carmeliet P (2015) Metabolic pathway compartmentalization: An underappreciated opportunity? Curr Opin Biotechnol 34: 73–81. https://doi.org/10.1016/j.copbio.2014.11.022
Pirovich DB, Da’dara AA, Skelly PJ (2021) Multifunctional Fructose 1,6-Bisphosphate Aldolase as a Therapeutic Target. Front Mol Biosci 8: 719678. https://doi.org/10.3389/fmolb.2021.719678
Cieśla M, Mierzejewska J, Adamczyk M, Farrants AKÖ, Boguta M (2014) Fructose bisphosphate aldolase is involved in the control of RNA polymerase III-directed transcription. Biochim Biophys Acta Mol Cell Res 1843(6): 11103–11110. https://doi.org/10.1016/j.bbamcr.2014.02.007
Rangarajan ES, Park H, Fortin E, Sygusch J, Izard T (2010) Mechanism of aldolase control of sorting nexin 9 function in endocytosis. J Biol Chem 285(16):11983–11990. https://doi.org/10.1074/jbc.M109.092049
Li M, Zhang CS, Zong Y, Feng JW, Ma T, Hu M, Lin Z, Li X, Xie C, Wu Y, Jiang D, Li Y, Zhang C, Tian X, Wang W, Yang Y, Chen J, Cui J, Wu YQ, Chen X, Liu QF, Wu J, Lin SY, Ye Z, Liu Y, Piao HL, Yu L, Zhou Z, Xie XS, Hardie DG, Lin SC (2019) Transient Receptor Potential V Channels Are Essential for Glucose Sensing by Aldolase and AMPK. Cell Metab 30(3): 508–524.e12. https://doi.org/10.1016/j.cmet.2019.05.018
Ma D, Chen X, Zhang PY, Zhang H, Wei LJ, Hu S, Tang JZ, Zhou MT, Xie C, Ou R, Xu Y, Tang KF (2018) Upregulation of the ALDOA/DNA-PK/p53 pathway by dietary restriction suppresses tumor growth. Oncogene 37(8): 1041–1048. https://doi.org/10.1038/onc.2017.398
Caspi M, Perry G, Skalka N, Meisel S, Firsow A, Amit M, Rosin-Arbesfeld R (2014) Aldolase positively regulates of the canonical Wnt signaling pathway. Mol Cancer 13: 164. https://doi.org/10.1186/1476-4598-13-164
Li J, Wang F, Gao H, Huang S, Cai F, Sun J (2019) ALDOLASE A regulates invasion of bladder cancer cells via E-cadherin-EGFR signaling. J Cell Biochem 120(8): 13694–13705. https://doi.org/10.1002/jcb.28642
Giegé P, Heazlewood JL, Roessner-Tunali U, Harvey Millar A, Fernie AR, Leaver CJ, Sweetlove LJ (2003) Enzymes of glycolysis are functionally associated with the mitochondrion in arabidopsis cells. Plant Cell 15(9): 2140–2151. https://doi.org/10.1105/tpc.012500
Wang X, Sirover MA, Anderson LE (1999) Pea chloroplast glyceraldehyde-3-phosphate dehydrogenase has uracil glycosylase activity. Arch Biochem Biophys 367(2): 348–353. https://doi.org/10.1006/abbi.1999.1261
Mazzola JL, Sirover MA (2002) Alteration of nuclear glyceraldehyde-3-phosphate dehydrogenase structure in Huntington’s disease fibroblasts. Mol Brain Res 100: 95–101. https://doi.org/10.1016/S0169-328X(02)00160-2
Sirover MA (2005) New nuclear functions of the glycolytic protein, glyceraldehyde-3-phosphate dehydrogenase, in mammalian cells. J Cell Biochem 95: 45–52. https://doi.org/10.1002/jcb.20399
Sirover MA (1999) New insights into an old protein: The functional diversity of mammalian glyceraldehyde-3-phosphate dehydrogenase. Biochim Biophysi Acta – Protein Struct Mol Enzymol 1432(2): 159–184. https://doi.org/10.1016/s0167-4838(99)00119-3
Svedružić ŽM, Spivey HO (2006) Interaction between mammalian glyceraldehyde-3-phosphate dehydrogenase and L-lactate dehydrogenase from heart and muscle. Proteins: Structure, Function and Genetics 63(3): 501–511. https://doi.org/10.1002/prot.20862
Ohba S, Johannessen TCA, Chatla K, Yang X, Pieper RO, Mukherjee J (2020) Phosphoglycerate Mutase 1 Activates DNA Damage Repair via Regulation of WIP1 Activity. Cell Rep 31(2): 107518. https://doi.org/10.1016/j.celrep.2020.03.082
Subramanian A, Miller DM (2000) Structural analysis of α-enolase: Mapping the functional domains involved in down-regulation of the c-myc protooncogene. J Biol Chem 275(8): 5958–5965. https://doi.org/10.1074/jbc.275.8.5958
Perconti G, Maranto C, Romancino DP, Rubino P, Feo S, Bongiovanni A, Giallongo A (2017) Pro-invasive stimuli and the interacting protein Hsp70 favour the route of alpha-enolase to the cell surface. Sci Rep 7(1): 3841. https://doi.org/10.1038/s41598-017-04185-8
Hoshino A, Hirst JA, Fujii H (2007) Regulation of cell proliferation by interleukin-3-induced nuclear translocation of pyruvate kinase. J Biol Chem 282(24): 11706–11711. https://doi.org/10.1074/jbc.M700094200
Newsholme EA, Board M (1991) Application of metabolic-control logic to fuel utilization and its significance in tumor cells. Adv Enzyme Regul 31: 225–246. https://doi.org/10.1016/0065-2571(91)90015-E
Harris RA, Fenton AW (2019) A critical review of the role of M 2 PYK in the Warburg effect. Biochim Biophys Acta Rev Cancer 1871(2): 225–239. https://doi.org/10.1016/j.bbcan.2019.01.004
Lee J, Kim HK, Han YM, Kim J (2008) Pyruvate kinase isozyme type M2 (PKM2) interacts and cooperates with Oct-4 in regulating transcription. Int J Biochem Cell Biol 40(5): 1043–1054. https://doi.org/10.1016/j.biocel.2007.11.009
Urbańska K, Orzechowski A (2019) Unappreciated role of LDHA and LDHB to control apoptosis and autophagy in tumor cells. Int J Mol Sci 20(9): 2085. https://doi.org/10.3390/ijms20092085
Brooks GA (2018) The Science and Translation of Lactate Shuttle Theory. Cell Metab 27(4): 757–785. https://doi.org/10.1016/j.cmet.2018.03.008
Zhang Y, Zhang X, Wang X, Gan L, Yu G, Chen Y, Liu K, Li P, Pan J, Wang J, Qin S (2012) Inhibition of LDH-A by lentivirus-mediated small interfering RNA suppresses intestinal-type gastric cancer tumorigenicity through the downregulation of Oct4. Cancer Lett 321(1): 45–54. https://doi.org/10.1016/j.canlet.2012.03.013
Rong Y, Wu W, Ni X, Kuang T, Jin D, Wang D, Lou W (2013) Lactate dehydrogenase A is overexpressed in pancreatic cancer and promotes the growth of pancreatic cancer cells. Tumor Biol 34(3): 1523–1530. https://doi.org/10.1007/s13277-013-0679-1
Wang ZY, Loo TY, Shen JG, Wang N, Wang DM, Yang DP, Mo SL, Guan XY, Chen JP (2012) LDH-A silencing suppresses breast cancer tumorigenicity through induction of oxidative stress mediated mitochondrial pathway apoptosis. Breast Cancer Res Treat 131(3): 791–800. https://doi.org/10.1007/s10549-011-1466-6
Lewis BC, Prescott JE, Campbell SE, Shim H, Orlowski RZ, Dang CV (2000) Tumor induction by the c-Myc target genes rcl and lactate dehydrogenase A. Cancer Res 60(21): 6178–6183.
Jiang F, Ma S, Xue Y, Hou J, Zhang Y (2016) LDH-A promotes malignant progression via activation of epithelial-to-mesenchymal transition and conferring stemness in muscle-invasive bladder cancer. Biochem Biophys Res Commun 469(4): 985–992. https://doi.org/10.1016/j.bbrc.2015.12.078
Lin H, Muramatsu R, Maedera N, Tsunematsu H, Hamaguchi M, Koyama Y, Kuroda M, Ono K, Sawada M, Yamashita T (2018) Extracellular Lactate Dehydrogenase A Release From Damaged Neurons Drives Central Nervous System Angiogenesis. EBioMed 27: 71–85. https://doi.org/10.1016/j.ebiom.2017.10.033
Graziano F, Ruzzo A, Giacomini E, Ricciardi T, Aprile G, Loupakis F, Lorenzini P, Ongaro E, Zoratto F, Catalano V, Sarti D, Rulli E, Cremolini C, de Nictolis M, de Maglio G, Falcone A, Fiorentini G, Magnani M (2017) Glycolysis gene expression analysis and selective metabolic advantage in the clinical progression of colorectal cancer. Pharmacogenomics J 17(3): 258–264. https://doi.org/10.1038/tpj.2016.13
Shegay PV, Zabolotneva AA, Shatova OP, Shestopalov AV, Kaprin AD (2022) Evolutionary View on Lactate-Dependent Mechanisms of Maintaining Cancer Cell Stemness and Reprimitivization. Cancers (Basel) 14: 4552. https://doi.org/10.3390/cancers14194552
Shi Q, Le X, Wang B, Abbruzzese JL, Xiong Q, He Y, Xie K (2001) Regulation of vascular endothelial growth factor expression by acidosis in human cancer cells. Oncogene 20(28): 3751–3756. https://doi.org/10.1038/sj.onc.1204500
Liu Y, Guo JZ, Liu Y, Wang K, Ding W, Wang H, Liu X, Zhou S, Lu XC, Yang H bin, Xu C, Gao W, Zhou L, Wang YP, Hu W, Wei Y, Huang C, Lei QY (2018) Nuclear lactate dehydrogenase A senses ROS to produce α-hydroxybutyrate for HPV-induced cervical tumor growth. Nat Commun 9(1): 4429. https://doi.org/10.1038/s41467-018-06841-7
Hemmadi V, Biswas M (2021) An overview of moonlighting proteins in Staphylococcus aureus infection. Arch Microbiol 203(2): 481–498. https://doi.org/10.1007/s00203-020-02071-y
Henderson B (2014) An overview of protein moonlighting in bacterial infection. Biochem Soc Trans 42(6): 1720–1727. https://doi.org/10.1042/BST20140236
Gómez-Arreaza A, Acosta H, Quiñones W, Concepción JL, Michels PAM, Avilán L (2014) Extracellular functions of glycolytic enzymes of parasites: Unpredicted use of ancient proteins. Mol Biochem Parasitol 193(2): 75–81.
Gancedo C, Flores C-L (2008) Moonlighting Proteins in Yeasts. Microbiol Mol Biol Rev 72(1): 197–210. https://doi.org/10.1128/mmbr.00036-07
Chang YC, Yang YC, Tien CP, Yang CJ, Hsiao M (2018) Roles of Aldolase Family Genes in Human Cancers and Diseases. Trends Endocrinol Metabol 29(8): 549–559. https://doi.org/10.1016/j.tem.2018.05.003
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова