Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 12, стр. 1883-1897
Распределение белков GABARAP и β-III-тубулина в неокортексе крыс в неонатальный период после воздействия перинатальной гипоксии
Л. И. Хожай *
Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: astarta0505@mail.ru
Поступила в редакцию 17.08.2023
После доработки 28.10.2023
Принята к публикации 30.10.2023
- EDN: CDVMJR
- DOI: 10.31857/S086981392312004X
Аннотация
Проведено исследование распределения белка внутриклеточного транспорта GABARAP, ассоциированного с GABAА-рецептором, и изоформы белка цитоскелета β-III-тубулина в слоях соматосенсорной области неокортекса в неонатальный период у крыс линии Wistar после воздействия гипоксии. В работе использована модель недоношенной беременности человека. Для выявления GABARAP и β-III-тубулина применяли иммуногистохимические методы исследования. Воздействие гипоксии осуществляли на 2-е сутки после рождения в специальной камере с содержанием кислорода в дыхательной смеси 7.8%. Исследование неокортекса проводили на 5- и 10-е сутки. Показано, что у контрольных животных к концу неонатального периода (П10) содержание GABARAP (по плотности окрашивания продукта иммунной реакции) существенно повышается: в верхних слоях II–III в 2, а в глубоких IV–VI в 4 раза по сравнению с более ранним сроком развития (П5). Cодержание β-III-тубулина в слоях коры распределяется равномерно. У животных, переживших воздействие гипоксии в неонатальный период, выявлено значительное увеличение содержания GABARAP и β-III-тубулина в верхних слоях неокортекса. Эти изменения происходят на фоне существенного снижения содержания подтипа GABAА-рецептора (данные получены ранее). GABARAP и β-III-тубулин, а также GABAА-рецептор, входят в состав комплекса элементов, опосредующих в неокортексе трансмиссию GABA. Гипоксия вызывает изменение содержания этих белков в коре головного мозга, которое может приводить к нарушению тормозных эффектов GABA.
ВВЕДЕНИЕ
GABARAP (GABAA receptor-associated protein), белок ассоциированный с GABAA-рецептором, принадлежит к семейству белков, обеспечивающих процессы белкового внутриклеточного транспорта, играет важную роль в транспорте GABAA-рецепторов и участвует в формировании пула рецепторов к GABA (ɣ-аминомасляная кислота) [1, 2]. В головном мозге млекопитающих и человека GABAA является основным рецептором к GABA при тормозной синаптической нейропередаче [3]. Он имеет пентамерную структуру, образованную комбинацией субъединиц 2α1, 2β2 и 1γ2 [4], при этом установлено, что GABARAP взаимодействует только с субъединицей γ2 [1, 5]. Во время транспорта GABAA-рецепторов ассоциированный с ним белок GABARAP обеспечивает связь между GABAA-рецепторами и цитоскелетом. С одной стороны, GABARAP, связываясь с внутриклеточным доменом субъединицы γ2, соединяется с GABAA-рецепторами [1, 2], а с другой, связываясь с β-III-тубулином, взаимодействует с микротрубочками цитоскелета нейронов [1, 6, 7]. Установлено, что внутриклеточный транспорт GABAA-рецепторов является ключевым компонентом процесса, регулирующего пластичность тормозных синапсов и, как результат, трансмиссию GABA [8]. Есть известные основания считать, что для эффективной тормозной нейропередачи и коммуникации нейронов между собой критически необходимым является формирование кластеров рецепторов к GABA на постсинаптической мембране [9]. Образование кластеров рецепторов осуществляется как при участии GABARAP, так и других адаптерных белков, например, гефирина, который является важным элементом, закрепляющим GABAA-рецепторы на плазматической мембране нейронов, связываясь при этом и с GABARAP, и микротрубочками [5]. В результате ряда проведенных исследований для GABARAP была определена ведущая роль в доставке GABAA-рецепторов к поверхности клетки и обратно в цитоплазму, организации рецепторов в кластеры и регулировании плотности расположения рецепторов на поверхности нейрона [8, 9]. При всей важности роли, которую выполняет белок GABARAP в процессах внутриклеточного транспорта, особенно в регуляции функции тормозных синапсов, в настоящее время почти ничего не известно о его содержании в неокортексе в неонатальный период (особый период в развитии млекопитающих и человека, когда происходит созревание ЦНС и становление межнейронных связей).
Внутриклеточный транспорт рецепторов и формирование кластеров на постсинаптической мембране являются весьма сложными процессами, требующими координации взаимодействия множества белков, в том числе белков самого цитоскелета, среди которых одним из основных является тубулин. Гетеродимеры тубулина, организованные в линейные протофиламенты, связываясь латерально, образуют полые цилиндрические полимеры (микротрубочки) шириной ~25 нм. [10]. Белки микротрубочек образуют динамический компонент цитоскелета и играют ключевую роль в процессах внутриклеточного везикулярного транспорта белков, подвижности клеток, миграции, митоза [10]. Наблюдения показали, что при ряде нейральных патологий, онкологических заболеваний экспрессия белков микротрубочек существенно нарушается. Поэтому до настоящего времени остается большой интерес к изучению синтеза белков цитоскелета и состояния микротрубочек, являющихся одной из важных мишеней при фармакологической терапии [11]. Вместе с тем в существующей литературе крайне мало сведений о содержании как GABARAP, так и β‑III-тубулина, белков, входящих в комплекс элементов, опосредующих функцию торможения в ЦНС, в неокортексе в условиях гипоксии в неонатальный период. То обстоятельство, что клиническая статистикa ежегодно регистрирует значительное число случаев перинатальной гипоксии у новорожденных во время родов, является причиной всестороннего исследования ее последствий.
В связи с этим целью данной работы было изучить содержание и распределение белка GABARAP, ассоциированного с GABAA-рецептором, и изоформы β-III-тубулина, основного белка цитоскелета, в слоях неокортекса крыс, переживших воздействие гипоксии в неонатальный период.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на лабораторных крысах линии Wistar, полученных из ЦКП “Биоколлекция Института физиологии им. И.П. Павлова РАН” (Санкт-Петербург). Беременные самки крыс содержались на базе вивария Института при температуре 22–24°С, цикле освещения 12 ч день/ночь и свободном доступе к воде и еде. После рождения потомства исследование проводилось на новорожденных крысах в неонатальный период развития (в возрасте с 2-х по 10-е постнатальные сутки). В работе была использована модель недоношенной беременности человека, включающая общую гипоксию новорожденных крыс. Считается, что развитие мозга крыс на 1–2-е постнатальные сутки соответствует степени развития мозга преждевременно родившихся детей у человека (примерно 29–30-я неделя беременности) [12]. Условия этой модели позволяют получить повреждения мозга, наблюдаемые у недоношенных новорожденных детей при преждевременных родах, как правило, имеющих недоразвитие респираторной системы и отсюда респираторную дисфункцию. Модель, с одной стороны, исключает смертность животных, а с другой, воспроизводит широкий спектр нарушений развития разных отделов головного мозга, возникающих при асфиксии у недоношенных детей человека [12]. В работе исследовали соматосенсорную область неокортекса.
Воздействие гипоксии осуществляли на 2-е неонатальные сутки. Новорожденных крыс помещали на 1 ч в камеру с проточной газовой смесью, содержащей 7.8% кислорода, 0.4% углекислого газа и 91.8% азота, при температуре 21.5—23.0°С и нормальном давлении (760 мм рт. ст.). Исследование неокортекса проводили в неонатальный период (период новорожденности) на 5-е (П5) и 10-е (П10) постнатальные сутки. Использовали 2 группы животных: 1) экспериментальную группу, включающую крыс на П5 и П10 (n = 8 в каждом случае), подвергавшихся воздействию гипоксии и 2) контрольную группу, включающую интактных крыс того же возраста на П5 и П10 (n = 8 в каждом случае).
Иммуногистохимические методы. У новорожденных крыс мозг извлекали и обрабатывали по общепринятой методике: фиксировали в цинк-этанолформальдегиде на фосфатно-солевом буфере (рН 7.4), обезвоживали, заливали в парафин и готовили фронтальные серийные срезы толщиной 5–6 мкм на уровне брегмы –0.60–0.40 мм (по стереотаксическому атласу координатных таблиц мозга крыс в возрасте П5–П10 [13]. Срезы помещали на предметные стекла Super frost plus gold (Menzel-Glasser, Германия). Иммуногистохимическое выявление белка GABARAP проводили с использованием первичных кроличьих моноклональных антител (recombinant anti-GABARAP antibody клон [EPR4805], ab109299; Abcam, Великобритания) в разведении 1:100. После проведения процедуры демаскирования белков в цитратном буфере (рН 6.1) (Dako, Дания) в течение 25 мин срезы инкубировали в первичных антителах при температуре 4°С в течение 16 ч. В качестве вторичных антител использовали Goat anti-rabbit IgG H&L (HRP, ab6721; Abcam, Великобритания). Срезы помещали во вторичные антитела на 30 мин при комнатной температуре. Для визуализации продукта реакции использовали хромоген DAB+ (Dako, Дания). Специфичность иммунной реакции проверяли при помощи негативного контроля (без первичных антител). Иммуногистохимическое выявление β-III-тубулина проводили с использованием первичных кроличьих моноклональных антител к β-III-тубулину (аnti-beta-III-Tubulin antibody клон [EP1569Y], ab52623; Abcam, Великобритания) в разведении 1 : 50. После проведения процедуры демаскирования белков в цитратном буфере (рН 6.1) (Dako, Дания) в течение 30 мин, срезы инкубировали в первичных антителах при температуре 4°С в течение 18 ч. В качестве вторичных антител использовали Goat anti-rabbit IgG H&L (HRP, ab6721; Abcam, Великобритания). Срезы помещали во вторичные антитела на 40 мин при комнатной температуре. Для визуализации продукта реакции использовали хромоген DAB+ (Dako, Дания). Специфичность иммунной реакции проверяли при помощи негативного контроля (без первичных антител). Общий морфологический анализ проводили на срезах мозга, окрашенных по Нисслю по общепринятой методике. Срезы заключали в синтетическую среду Permaunt (Thermo Scientific, США).
Статистическая оценка результатов. При проведении иммуногистохимической реакции все процедуры были стандартизированы и осуществлялись одновременно для гистологических срезов мозга, полученных от контрольных и подопытных животных обеих возрастных групп. Материал анализировали на цифровых изображениях фронтальных серийных срезов, полученных при помощи светового микроскопа Leica DME и цифровой камеры Leica EC3 (Leica, Германия). Оценку плотности окрашивания продукта иммунной реакции осуществляли при помощи системы анализа изображений, включающей световой микроскоп Olympus CX31 (Япония), цветную цифровую камеру Video/Zavr Standart VZ-C31Sr и программное обеспечение (для денситометрии) Видеозавр Мультиметр 2.3 (ООО АТМ-практика, Санкт-Петербург). Анализ плотности окрашивания продукта иммунной реакции проводили при увеличении объектива микроскопа ×60. Цифровые изображения срезов мозга контрольных и экспериментальных животных были получены при одинаковых параметрах освещения, насыщенности цвета и контраста. Для оценки плотности окрашивания продукта иммунной реакции выделяли участки окрашенной цитоплазмы клеток, участки окрашенных проксимальных отделов отростков, крупных гранул в нейропиле, которые считаются терминальными синаптическими структурами [14]. Количественный анализ данных осуществляли на цифровых изображениях, полученных с 15 гистологических срезов мозга животных каждой исследуемой группы, при этом на каждом срезе изучали по 7–10 участков в каждом из слоев II–VI неокортекса. Обработанные данные, выраженные в усл. ед. D (плотность окраски продукта иммунной реакции), представлены как средние значения и стандартная ошибка среднего (M ± SEM). Для сравнения полученных результатов между разными группами животных использовали t-критерий Стьюдента и oneway ANOVA (Statistica 8.0, Statsoft Inc. США), различия считали статистически достоверными при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Распределение белка GABARAP в неокортексе крыс на 5-е неонатальные сутки в контроле и после воздействия гипоксии
У контрольных животных на П5 в неокортексе в верхних слоях II–III нейроны небольшого размера, образующие эти слои, в своем большинстве имеют либо полностью гомогенно иммуноокрашенную цитоплазму, либо ее часть. Кроме того, присутствуют иммунопозитивные гранулы, расположенные вокруг ядра, в перинуклеарном пространстве и на периферии клетки ближе к поверхности клетки (рис. 1a, b).
Рис. 1.
Соматосенсорная область неокортекса крысы (верхние слои II–III) на П5 (а) и П10 (c, f); увеличенные фрагменты отдельных нейронов и отростков (b, d, e, g). Иммуногистохимическая реакция на выявление GABARAP. (a), (c) – повышение плотности окрашивания продукта иммунной реакции в неокортексе у контрольных животных во время неонатального периода (от П5 до П10) в цитоплазме нейронов (длинные стрелки) и отростках (короткие стрелки); (f) – значительное повышение плотности окрашивания продукта иммунной реакции в нейронах (длинные стрелки) на П10 после воздействия перинатальной гипоксии. Увел. ок. ×100.
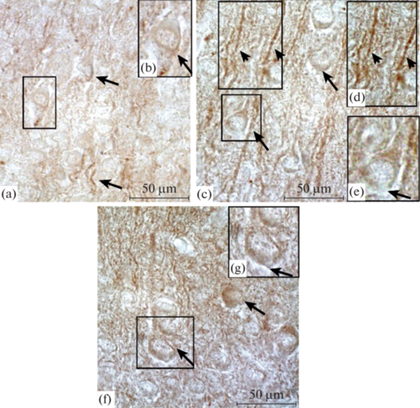
Плотность окрашивания продукта реакции на GABARAP в цитоплазме равна 0.160 ± 0.06 (табл. 1). В нейропиле присутствует сеть тонких терминалей и крупных отростков, имеющих варикозные расширения. Продукт иммунной реакции выявляется в проксимальных отделах отростков, плотность его окрашивания значительно превышает значение в цитоплазме нейронов (табл. 1). В глубоких слоях IV–VI в цитоплазме нейронов присутствуют иммуноокрашенные гранулы, расположенные или в перинуклеарном пространстве, или на периферии цитоплазмы клетки. Плотность окрашивания продукта иммунной реакции на GABARAP здесь ниже, чем в цитоплазме нейронов верхних слоев (табл. 1).
Таблица 1.
Показатели оптической плотности (D) продукта иммунной реакции при выявлении белка GABARAP в слоях соматосенсорной области неокортекса крыс на 5-е и 10-е неонатальные сутки в контроле и после воздействия гипоксии (в у. е.)
| Cлои | D ( у. е.) | |||
|---|---|---|---|---|
| отростки | П5 (контроль) |
П10 (контроль) |
П5 (гипоксия) |
П10 (гипоксия) |
| II–III | 0.160 ± 0.06 | 0.307 ± 0.07 | 0.177 ± 0.05 | 0.886 ± 0.06 * |
| Отростки (II–III) | 0.271 ± 0.04 | 0.361 ± 0.05 | 0.252 ± 0.06 | 0.259 ± 0.07* |
| IV–VI | 0.125 ± 0.09 | 0.492 ± 0.06 | 0.431 ± 0.08* | 0.458 ± 0.04 |
| Отростки(IV–VI) | 0.289 ± 0.07 | 0.388 ± 0.05 | 0.346 ± 0.06* | 0.473 ± 0.08* |
В нейропиле видна тонкая сеть терминальных отростков и крупные отростки, в которых также присутствует окрашенный продукт иммунной реакции. На поверхности отростков определяются иммуноположительные гранулы. Плотность продукта иммунной реакции на GABARAP в отростках нейронов глубоких слоев почти соответствует таковой в отростках верхних слоев, при этом оказывается значительно выше, чем в цитоплазме нейронов (табл. 1). После воздействия гипоксии в верхних слоях II–III цитоплазма нейронов имеет меньший объем, чем в контроле, и представляет собой ободок, окружающий ядро, в котором видны иммунопозитивные гранулы, располагающиеся вокруг ядра. Плотность иммунного окрашивания продукта реакции на GABARAP почти не изменяется по сравнению с контролем (табл. 1). В нейропиле, как и у контрольных животных, присутствуют отростки и сеть тонких терминалей. В отростках выявляется продукт иммунной реакции с плотностью окрашивания, соответствующей контрольному значению (табл. 1). Иммунопозитивные гранулы на отростках присутствуют, но их меньше, чем в контроле. В глубоких слоях IV–VI цитоплазма нейронов также представлена небольшим объемом и также содержит гранулы, локализующиеся вокруг ядра. В цитоплазме нейронов плотность иммунного окрашивания продукта реакции на GABARAP значительно превышает таковую в контроле (табл. 1). В нейропиле крупные отростки имеют варикозные расширения, иммунопозитивных гранул на поверхности отростков меньше, чем в контроле. При этом плотность иммунного окрашивания продукта реакции на GABARAP в отростках нейронов глубоких слоев существенно превышает контрольное значение (табл. 1). Таким образом, у контрольных животных на П5 в верхних слоях II–III содержание GABARAP (по плотности окрашивания продукта реакции) выше, чем в глубоких слоях IV–VI. В отростках всех слоев неокортекса содержание GABARAP почти в 2 раза выше, чем в цитоплазме нейронов. У животных, переживших перинатальную гипоксию, в верхних слоях II–III содержание GABARAP почти не изменяется по сравнению с контролем, однако в глубоких слоях оно значительно повышается: в цитоплазме нейронов в 3.4 раза, а в отростках в 1.2 раза.
Распределение белка GABARAP в неокортексе крыс на 10-е неонатальные сутки в контроле и после воздействия гипоксии
У контрольных животных на П10 в неокортексе в верхних слоях II–III в цитоплазме нейронов иммуноположительные гранулы локализуются в перинуклеарном пространстве, вокруг ядра, либо по всей цитоплазме. Плотность окрашивания продукта реакции была значительно выше, чем на П5 (табл. 1). В нейропиле видна сеть тонких терминалей и крупные отростки с гранулами на поверхности (рис. 1с, d, e). Плотность окрашивания продукта реакции на GABARAP в отростках также выше, чем на П5 (табл. 1). В цитоплазме нейронов глубоких слоев IV–VI локализация иммуноположительных структур такая же. Плотность окрашивания продукта реакции на GABARAP значительно повышается (почти в 4 раза) (табл. 1). В нейропиле проксимальные части крупных отростков и гранулы также иммуноположительны, плотность окрашивания продукта реакции также выше, чем на П5 (табл. 1). После воздействия гипоксии к концу неонатального периода (П10) в верхних слоях II–III цитоплазма нейронов содержит иммуноположительные гранулы, локализующиеся в перинуклеарном пространстве и на периферии клеток. Здесь плотность окрашивания продукта реакции на GABARAP по сравнению с контролем повышается значительно (табл. 1) (рис. 1f, g). В нейропиле плотность окрашивания продукта реакции в крупных отростках по сравнению с контролем снижается (табл. 1). В глубоких слоях IV–VI в цитоплазме нейронов локализация продукта иммунной реакции на GABARAP аналогичная, однако плотность его окрашивания несколько снижается (табл. 1). В нейропиле в крупных отростках и иммунопозитивных гранулах плотность окрашивания продукта иммунной реакции на GABARAP выше, чем в контроле (табл. 1). Таким образом, к концу неонатального периода у контрольных животных как в верхних, так и в глубоких слоях в цитоплазме нейронов и в отростках содержание GABARAP (по плотности окрашивания продукта реакции) возрастает (почти в 2 и 4; 1.3 и 1.3 раза соответственно) по сравнению с таковым на более раннем сроке (П5). После воздействия гипоксии к концу неонатального периода в цитоплазме нейронов верхних слоев содержание GABARAP значительно увеличивается (в 3 раза) по сравнению с контролем. При этом в глубоких слоях в цитоплазме нейронов оно почти не изменяется.
Распределение β-III-тубулина в неокортексе крыс на 5-е неонатальные сутки в контроле и после воздействия гипоксии
У контрольных животных на П5 во всех слоях неокортекса цитоплазма нейронов иммуноположительна на β-III-тубулин. Она имеет практически равномерное окрашивание, однако на периферии часто встречаются более интенсивно иммуноокрашенные гранулы. При этом плотность окрашивания продукта иммунной реакции на β-III-тубулин в слоях II–III ниже, чем в IV–VI (табл. 2). После воздействия гипоксии в верхних слоях II–I II цитоплазма нейронов гомогенна, а плотность окрашивания продукта иммунной реакции на β-III-тубулин существенно повышается по сравнению с контролем (в 1.3 раза) (рис. 2a, b).
Таблица 2.
Показатели оптической плотности (D) продукта иммунной реакции при выявлении белка β-III-тубулина в слоях соматосенсорной области неокортекса крыс на 5-е и 10-е неонатальные сутки в контроле и после воздействия гипоксии (в у. е.)
| Cлои | D ( у. е.) | |||
|---|---|---|---|---|
| П5 (контроль) |
П10 (контроль) |
П5 (гипоксия) |
П10 (гипоксия) |
|
| II–III | 0.156 ± 0.08 | 0.148 ± 0.07 | 0.198 ± 0.04* | 0.179 ± 0.05* |
| IV–VI | 0.332 ± 0.04 | 0.150 ± 0.05 | 0.162 ± 0.06 | 0.137 ± 0.08 |
Рис. 2.
Соматосенсорная область неокортекса крысы (верхние слои II–III) на П5 (a), (b) и П10 (c), (d). Иммуногистохимическая реакция на выявление β-III-тубулина. (а), (с) – контроль; (b), (d) – повышение плотности окрашивания продукта иммунной реакции на β-III-тубулин в цитоплазме нейронов (стрелки) после воздействия перинатальной гипоксии. Увел. ок. ×100.
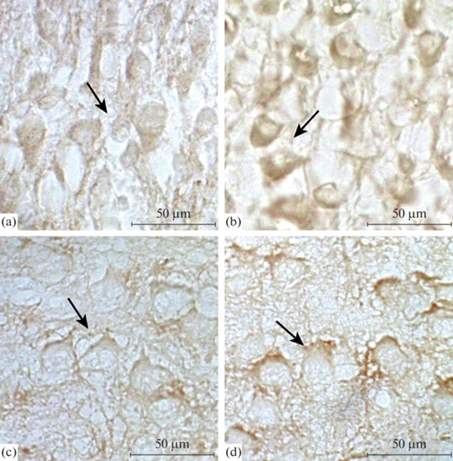
В глубоких слоях IV–VI цитоплазма нейронов может быть окрашена неодинаково: только ее часть, или окрашена полностью, но в ней присутствуют мелкие темные гранулы. Плотность окрашивания продукта иммунной реакции на β-III-тубулин здесь ниже (в 2 раза), чем в контроле (табл. 2).
Распределение β-III-тубулина в неокортексе крыс на 10-е неонатальные сутки в контроле и после воздействия гипоксии
У контрольных животных на П10 в неокортексе в верхних слоях II–III цитоплазма нейронов практически полностью иммуноокрашена, окраску имеют и отростки, на которых локализуются иммуноположительные гранулы. Плотность окрашивания продукта иммунной реакции на β-III-тубулин соответствует таковой на П5, а в глубоких слоях IV–VI она в 2 раза ниже, чем на П5 (табл. 2). После воздействия гипоксии в верхних слоях II–III цитоплазма нейронов и отростков иммуноокрашена равномерно. Плотность окрашивания продукта иммунной реакции на β-III-тубулин в верхних слоях существенно выше, чем в контроле (табл. 2) (рис. 2c, d).
В глубоких слоях IV–VI плотность окрашивания продукта иммунной реакции не изменяется и примерно соответствует контрольному значению (табл. 2). Таким образом, у контрольных животных на П5 в цитоплазме нейронов верхних слоев содержание β-III-тубулина (по плотности окрашивания продукта иммунной реакции) в 2 раза меньше, чем в глубоких. К концу неонатального периода (П10) в глубоких слоях содержание β-III-тубулина снижается в 2 раза и, таким образом, становится одинаковым во всех слоях неокортекса. После воздействия гипоксии в верхних слоях неокортекса содержание β-III-тубулина к П5 повышается в 1.3 раза по сравнению с контролем и остается повышенным до конца неонатального периода. При этом в глубоких слоях содержание β-III-тубулина не изменяется и соответствует контрольному значению.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты проведенного исследования показали, что в неонатальный период у контрольных животных в слоях неокортекса GABARAP белок, ассоциированный с GABAА-рецептором, имеет особенности в распределении. На П5 в верхних слоях II–III содержание GABARAP (по плотности окрашивания продукта иммунной реакции) было выше, чем в глубоких IV–VI. Следует отметить, что формирование верхних и глубоких слоев в неокортексе происходит неодновременно. У грызунов после рождения миграция молодых нейронов в верхние слои неокортекса продолжается и заканчивается только к П7. Нейроны глубоких слоев к этому времени достигают более высокой степени дифференцировки [15 ] . Можно предположить, что на этом сроке неонатального периода разное содержание белка GABARAP в верхних слоях (образующихся позже) и глубоких слоях (образующихся раньше) имеет место из-за различной степени развития нейронов и протекания в них внутриклеточных процессов, связанных с созреванием нейронов, развитием эндоплазматического ретикулума, ростом отростков и формированием нейропиля [15–17 ].
В недавней нашей работе, проведенной в аналогичных экспериментальных условиях, при исследовании распределения подтипа GABAАα1-рецептора, в комплекс субъединиц которого входит как α1, так и γ2, было показано, что в верхних слоях содержание этого подтипа GABAАα1-рецептора также было выше, чем в глубоких [18], что согласуется с выше высказанным предположением.
Выявлено, что у контрольных животных к концу неонатального периода (П10) содержание белка GABARAP (по плотности окрашивания продукта иммунной реакции) во всех слоях неокортекса, как в цитоплазме нейронов, так и в отростках значительно увеличивается: в цитоплазме нейронов верхних слоев II–III почти в 2 раза, в глубоких – в 4 раза, а в отростках – в 1.3. Имеющиеся факты свидетельствуют о том, что к концу неонатального периода (П10) в глубоких слоях неокортекса содержание подтипа GABAАα1-рецептора также существенно увеличивается [18].
Повышение содержания белка GABARAP и подтипа GABAАα1-рецептора [18] в слоях на П10 совпадает с началом активного синаптогенеза и развития нейропиля [15–17 ]. Таким образом, в продолжении неонатального периода у контрольных крыс содержание внутриклеточного транспортного белка GABARAP увеличивается одновременно с повышением содержания этого подтипа GABAА--рецептора, этот факт косвенно согласуется с утверждением, что в нейронах неокортекса содержание GABARAP коррелирует с содержанием подтипа GABAА-рецептора. Аналогичные данные были получены при исследовании нейронов гиппокампа. Повышение уровня экспрессии GABARAP приводило в увеличению количества GABAA-рецепторов, обнаруживаемых на плазматической мембране нейронов [7].
Результаты показали, что воздействие перинатальной гипоксии вызывает существенное повышение содержания белка GABARAP в глубоких слоях (на П5): в цитоплазме нейронов – в 3.4 раза, а в отростках – в 1.2 раза. К концу неонатального периода (П10) воздействие гипоксии приводило к значительному увеличению содержания GABARAP в верхних слоях: в цитоплазме нейронов – в 3 раза, а в отростках – в 1.4 по сравнению с контролем. Что касается содержания подтипа GABAАα1-рецептора, то после воздействия гипоксии на исследованных постнатальных сроках (П5 и П10) во всех слоях неокортекса оно постепенно снижается (в 2.4 раза) [18]. Существенное повышение содержания белка GABARAP в неокортексе и снижение содержания GABAАα1-рецептора после воздействия гипоксии [18] дает основание предполагать, что в неонатальный период GABARAP может выполнять и другие функции.
Известно, что GABARAP принадлежит к семейству белков, которые участвуют в различных процессах внутриклеточного белкового транспорта, в том числе в процессах аутофагии, характеризующейся деградацией и утилизацией собственного материала клетки при помощи лизосомного аппарата. Это сложный процесс, включающий деятельность большого количества адаптерных белков, в результате которого происходит формирование аутофагосомы, необходимой для утилизации и рециркуляции агрегированных белков и поврежденных органелл, образующихся при воздействии гипоксии, белковом голодании, эндоплазматическом стрессе [19, 20]. Считают, что аутофагия играет важную роль в метаболизме клеток млекопитающих и человека и необходима для нормальной физиологии нейронов и их выживания. Так, показано, что присутствие в цитоплазме поврежденных органелл и белков снижает функциональную активность нейронов. Например, локальный биогенез аутофагосом происходит вблизи синапсов как у поверхности клеточной мембраны нейронов, так и в отростках, при этом выявлено, что биогенез аутофагосом связан с состоянием нейронов [21–26]. Нарушение процессов аутофагии вблизи синапсов приводит к накоплению поврежденных белков и органелл и, как результат, к дисфункции синапсов, а впоследствии и к нейродегенеративным заболеваниям, включая болезнь Паркинсона [25, 27–29]. С другой стороны, аутофагия может действовать как адаптивный механизм, обеспечивающий выживание и продление жизни клеток в условиях гипоксического или метаболического стресса за счет использования клеточных материалов в качестве питательных веществ. У млекопитающих существует ряд белков, участвующих в формировании, внутриклеточном транспорте и слиянии аутофагосом и лизосом, среди которых присутствуют GABARAP, GABARAPL1, GABARAPL2 [30]. В данной работе существенное повышение содержания GABARAP в неокортексе после воздействия перинатальной гипоксии может быть вызвано активацией процессов аутофагии в ответ на появление поврежденных органелл и эндоплазматического ретикулума. Более того, наличие непосредственной, а также и отсроченной гибели нейронов после воздействия перинатальной гипоксии свидетельствует о значительных повреждениях клеточных структур [31, 32].
Что касается внутриклеточной локализация белка GABARAP, то результаты работы показали, что GABARAP иммуноцитохимически выявляется во внутриклеточном перинуклеарном кольце, в цитоплазме и на периферии цитоплазмы у клеточной мембраны. Эти места локализации совпадают с таковыми, выявленными в исследовании, проведенном с использованием флуоресцентной метки для GABARAP, а также GABARAP был обнаружен точечно в меченных GAD65 синаптических контактах на поверхности нейронов [7].
Высокий уровень экспрессии GABARAP был зарегистрирован в нейронах гиппокампа [33]. Здесь обнаружена колокализация GABARAP и субъединицы γ2 GABAA-рецептора, локализующихся преимущественно в перинуклеарной области цитоплазмы и в проксимальных областях дендритов [7, 33]. Электронно-микроскопическое исследование показало, что GABARAP присутствует на мембранах цистерн аппарата Гольджи [34], что в общем согласуется с перинуклеарным паттерном его локализации в цитоплазме нейронов [7]. В проведенном исследовании окрашивание продукта иммунной реакции на GABARAP также было выявлено в проксимальных отделах дендритов нейронов и точечное иммунное окрашивание на поверхности отростков. Эти места локализации GABARAP совпадают с таковыми, обнаруженными другими авторами [7]. В ряде работ исследователями были установлены определенные функции, выполняемые GABARAP в ЦНС, это – доставка GABAA-рецепторов к поверхности клетки и обратно, организация их в кластеры на постсинаптической мембране и, таким образом, регулирование плотности рецепторов на поверхности нейронов. При этом формирование кластеров GABAA-рецепторов, как полагают, способствует быстрой синаптической нейропередаче [5, 8]. Однако происходит ли увеличение синтеза GABARAP при формировании кластеров рецепторов, ровно как и сами механизмы, опосредующие образование кластеров, в настоящее время до конца не ясно [6].
Существует утверждение, что GABARAP, β-III-тубулин и GABAA-рецепторы входят в состав одного функционального комплекса. GABARAP связывается с белком цитоскелета – β-III-тубулином, образующим микротрубочки, и с актиновыми микрофиламентами [1], то есть предполагают, что цитоскелет также участвует в переносе, закреплении и образовании кластеров GABAA-рецепторов, при этом считают, что в этих процессах GABARAP выполняет функцию линкерного белка [6].
Результаты проведенного исследования показали, что у контрольных животных содержание β-III-тубулина в разных слоях неокортекса в течение неонатального периода изменяется. На П5 в цитоплазме нейронов верхних слоев II–III содержание β-III-тубулина в 2 раза ниже, чем в глубоких. К концу неонатального периода (П10) в верхних слоях II - III содержание β-III-тубулина не изменяется, в глубоких слоях IV–VI снижается в 2 раза и, таким образом, к концу неонатального периода β-III-тубулин во всех слоях неокортекса распределяется равномерно.
β-III-тубулин, начиная со стадий раннего нейрогенеза, высоко экспрессируется в развивающейся центральной нервной системе. Было выявлено, что микротрубочки, содержащие β-III-тубулин, с которым взаимодействует GABARAP, более динамичны, чем те, которые образованы другими изоформами β-тубулина, и их количество изменяется в зависимости от степени дифференцировки или состояния нейронов [35].
Было показано, что у крыс и мышей экспрессия β-III-тубулина повышается в периоды созревания нейронов и роста аксонов, а затем, по мере их созревания, постепенно снижается [36–38].
Вероятно, у контрольных животных на П5 повышенное содержание β-III-тубулина в глубоких слоях IV–VI связано с активными процессами роста нейронов, развития аксонов и нейропиля. В верхних слоях II–III, образовавшихся позже, процессы созревания нейронов, вероятно, отстают по времени от таковых, происходящих в глубоких слоях.
Результаты работы показали, что воздействие гипоксии приводит к повышению содержания β-III-тубулина в верхних слоях II - III неокортекса на П5, которое сохраняется таковым до конца неонатального периода, при этом в глубоких слоях содержание β-III-тубулина не изменяется и соответствует контрольному значению. В существующей литературе имеются весьма противоречивые данные по поводу экспрессии β-III-тубулина при воздействии гипоксии и нейральной патологии. В исследовании, проведенном на грызунах, было показано, что воздействие гипоксии приводило к существенному снижению белков нейрофиламентов, однако количество β-III-тубулина не изменялось [39]. В другой работе после воздействия хронической гипоксии в префронтальной коре крыс было выявлено значительное снижение содержания β-III-тубулина [40].
При исследовании экспрессии β-III-тубулина у крыс в модели хронической эпилепсии и в образцах височной области коры у пациентов с височной эпилепсией, было обнаружено увеличение экспрессии β-III-тубулина. На модели эпилептических приступов, индуцированных киндлингом, наблюдали увеличение экспрессии GABAA-рецепторов и снижение экспрессии β-III-тубулина, а у крыс на модели спонтанно-рецидивирующих эпилептических приступов, наоборот, было выявлено повышение экспрессии β-III-тубулина, сопровождающееся снижением экспрессии GABAA-рецепторов, при этом была выявлена связь между эндогенным β-III-тубулином, белком GABARAP и GABAA-рецепторами в мозге животных с эпилепсией [35]. Ранее выявленное нами снижение содержания GABAA-рецепторов во всех слоях неокортекса после воздействия перинатальной гипоксии [18] сочетается с повышением содержания β-III-тубулина, что согласуется с данными, полученными в модельных экспериментах спонтанно-рецидивирующей эпилепсии [35].
Вероятно, для прояснения вопроса о реакции процесса синтеза β-III-тубулина в ответ на воздействие повреждающих факторов необходимы дополнительные исследования. Таким образом, результаты проведенной работы выявили новые факты распределения белка внутриклеточного транспорта GABARAP, ассоциированного с GABAА-рецепторами, и изоформы белка цитоскелета β-III-тубулина в слоях неокортекса в период раннего онтогенеза. У контрольных животных к концу неонатального периода содержание GABARAP в слоях неокортекса существенно повышается и коррелирует с содержанием подтипа GABAА-рецептора [18]- При этом содержание β-III-тубулина в слоях коры к концу неонатального периода распределяется равномерно.
Воздействие гипоксии в неонатальный период изменяет содержание элементов функционального комплекса (GABARAP, β-III-тубулина и подтипа GABAА-рецептора), опосредующих в неокортексе трансмиссию GABA, нарушение которой может быть причиной энцефалопатий, возникающих у детей, перенесших асфиксию во время преждевременных родов.
Список литературы
Wang H, Bedford FK, Brandon NJ, Moss SJ, Olsen RW (1999) GABA(A)-receptor-associated protein links GABA(A) receptors and the cytoskeleton. Nature 397 (6714): 69–72. https://doi.org/10.1038/16264
Nymann-Andersen J, Wang H, Chen L, Kittler J., Moss SJ, Olsen RW (2002) Subunit specificity and interaction domain between GABAA receptor-associated protein (GABARAP) and GABAA receptors. J Neurochem 80: 815–823.
Macdonald RL, Olsen RW (1994) GABAA receptor channels. Annu Rev Neurosci 17: 569–602. https://doi.org/10.1146/annurev.ne.17.030194.003033
McKernan RM, Whiting PJ (1996) Which GABAA-receptor subtypes really occur in the brain? Trends Neurosci 19: 139–143. https://doi.org/10.1016/s0166-2236(96)80023-3
Kneussel M, Haverkamp D, Fuhrmann JC, Wang H, Wassle H, Olsen RW, Betz H (2000) The gamma-aminobutyric acid type A receptor (GABAAR)-associated protein GABARAP interacts with gephyrin but is not involved in receptor anchoring at the synapse. Proc Nat Acad Sci U S A 97 (15): 8594–8599. https://doi.org/10.1073/pnas.97.15.8594
Wang H, Olsen RW (2000) Binding of the GABA(A) receptor-associated protein (GABARAP) to microtubules and microfilaments suggests involvement of the cytoskeleton in GABARAPGABA(A) receptor interaction. J Neurochem 75(2): 644–655. https://doi.org/10.1046/j.1471-4159.2000.0750644.x
Leil TA, Chen Z-W, Chang C-SS, Olsen RW (2004) GABAA receptor-associated protein traffics GABAA receptors to the plasma membrane in neurons. J Neurosci 24(50): 11429–11438. https://doi.org/10.1523/JNEUROSCI.3355-04.2004
Coyle JE, Nikolov DB (2003) GABARAP: lessons for synaptogenesis. Neuroscientist 9: 205–216. https://doi.org/10.1177/1073858403009003013
Kneussel M, Betz H (2000) Clustering of inhibitory neurotransmitter receptors at developing postsynaptic sites: the membrane activation model. Trends Neurosci 23(9): 429–435. https://doi.org/10.1016/s0166-2236(00)01627-1
Amos LA (2000) Focusing-in on microtubules. Curr Opin in Structural Biol 10(2): 236–224. https://doi.org/10.1016/S0959-440X(00)00070
La Regina G, Coluccia A, Naccarato V, Silvestri R (2019) Towards modern anticancer agents that interact with tubulin. Eur J Pharm Sci 131: 58–68. https://doi.org/10.1016/j.ejps.2019.01.028
Otellin VA, Khozhai LI, Shishko TT, Vershinina EA (2021) Nucleolar ultrastructure in neurons of the rat neocortical sensorimotor area during the neonatal period after perinatal hypoxia and its pharmacological correction. J Evol Biochem Phisiol 57: 1251–1256. https://doi.org/10.1134/S0022093021060053
Khazipov R, Zaynutdinova D, Ogievetsky E, Valeeva G, Mitrukhina O, Manent J-B, Represa A (2015) Atlas of the postnatal rat brain in stereotaxic coordinates. Front Neuroanat 9: 161. https://doi.org/10.3389/fnana.2015.00161
Guthmann A, Fritschy JM, Ottersen OP, Torp R, Herbert H (1998) GABA, GABA transporters, GABAA-receptor subunits and GAD mRNAs in the rat parabrachial and Kolliker-Fuse nuclei. J Comp Neurol 400(2): 229–243.
Marin-Padilla M (1992) Ontogenesis of the pyramidal cell of the mammalian neocortex and developmental cytoarchitectonics: a unifying theory. J Comp Neurol 321: 223–240. https://doi.org/10.1002/cne.903210205
Ignacio MP, Kimm EJ, Kageyama GH, Yu J, Robertson RT (1995) Postnatal migration of neurons and formation of laminae in rat cerebral cortex. Anat Embryol (Berl) 191: 89–100. https://doi.org/10.1007/BF00186782
Hou J, Eriksen N, Pakkenberg B (2011) The temporal pattern of postnatal neurogenesis found in the neocortex of the Gottingen minipig brain. Neuroscience 195: 176–179. https://doi.org/10.1016/j.neuroscience.2011.08.025
Хожай ЛИ (2023) Влияние перинатальной гипоксии (асфиксии) на распределение субъединицы α1 GABAA-рецептора в неокортексе новорожденных крыс. Цитология 65: 32–41. [Khozhai LI (2023) Effect of perinatal hypoxia (asphixia) on the distribution of the α1 GABAA-receptor subunit in the neocortex of newborn rats. Cytology 65: 32–41. (In Russ)]. https://doi.org/10.31857/S004137712305005X
Lee Y-H, Kim J, Park K, Lee M-S (2019) β-cell autophagy: mechanism and role in β-cell dysfunction. Mol Metab 27: 92–103. https://doi.org/10.1016/j.molmet.2019.06.014
Kong F-J, Wu J-H, Sun S-Y, Zhou J-Q (2017) The endoplasmic reticulum stress/autophagy pathway is involved in cholesterol-induced pancreatic β-cell injury. Scient Rep 7: 44746. https://doi.org/10.1038/srep44746
Tehran DA, Kuijpers M, Haucke V (2018) Presynaptic endocytic factors in autophagy and neurodegeneration. Curr Opin Neurobiol 48: 153–159. https://doi.org/10.1016/j.conb.2017.12.018
Kulkarni A, Chen J, Maday S (2018) Neuronal autophagy and intercellular regulation of homeostasis in the brain. Curr Opin Neurobiol 51: 29–36. https://doi.org/10.1016/j.conb.2018.02.008
Liang Y, Sigrist S (2018) Autophagy and proteostasis in the control of synapse aging and disease. Curr Opin Neurobiol 48: 113–121. https://doi.org/10.1016/j.conb.2017.12.006
Stavoe AKH, Holzbaur ELF (2019) Axonal autophagy: Mini-review for autophagy in the CNS. Neurosci Lett 697: 17–23. https://doi.org/10.1016/j.neulet.2018.03.025
Katsumata K, Nishiyama J, Inoue T, Mizushima N, Takeda J, Yuzaki M (2010) Dynein- and activity-dependent retrograde transport of autophagosomes in neuronal axons. Autophagy 6: 378–385. https://doi.org/10.4161/auto.6.3.11262
Hill SE, Kauffman KJ, Krout M, Richmond JE, Melia TJ, Colon-Ramos DA (2019) Maturation and clearance of autophagosomes in neurons depends on a specific cysteine protease isoform, ATG-4.2. Devel Cell 49: 251–266. https://doi.org/10.1016/j.devcel.2019.02.013
Maday S, Wallace KE, Holzbaur EL (2012) Autophagosomes initiate distally and mature during transport toward the cell soma in primary neurons. J Cell Biol 196: 407–417. https://doi.org/10.1083/jcb.201106120
Zavodszky E, Seaman MN, Moreau K, Jimenez-Sanchez M, Breusegem SY, Harbour ME, Rubinsztein DC (2014) Mutation in VPS35 associated with Parkinson’s disease impairs WASH complex association and inhibits autophagy. Nat Commun 5: 3828. https://doi.org/10.1038/ncomms4828
Hoffmann S, Orlando M, Andrzejak E, Bruns C, Trimbuch T, Rosenmund C, Garner CC, Ackermann F (2019) Light-Activated ROS Production Induces Synaptic Autophagy. J Neurosci 39: 2163–2183. https://doi.org/10.1523/JNEUROSCI.1317-18.2019
Joachim J, Tooze SA (2018) Control of GABARAP-mediated autophagy by the Golgi complex, centrosome and centriolar satellites. Biol Cell 110: 1–5. https://doi.org/10.1111/boc.201700046
Otellin VA, Khozhai LI, Vataeva LA (2012) Effect of hypoxia in early perinatal ontogenesis on behavior and structural characteristics of the rat brain J Evol Biochem Physiol 48: 467–473.
Отеллин ВА, Хожай ЛИ, Ватаева ЛА, Шишко ТТ (2011) Отдаленные последствия воздействия гипоксии в перинатальный период развития на структурно-функциональные характеристики мозга у крыс. Рос физиол журн им ИМ Сеченова 97: 1092–1100. [Otellin VA, Khozhai LI, Vataeva LA, Shishko TT (2011) Long-term effects of exposure to hypoxia in perinatal development on structural and functional characteristics of the brain in rats. Russ J Physiol 97: 1092–1100. (In Russ)].
Okazaki N, Yan J, Yuasa S, Ueno T, Kominami E, Masuho Y, Koga H, Muramatsu M (2000) Interaction of the Unc-51-like kinase and microtubule-associated protein light chain 3 related proteins in the brain: possible role of vesicular transport in axonal elongation. Mol Brain Res 85(1–2): 1–12. https://doi.org/10.1016/S0169-328X(00)00218
Kittler JT, Rostaing P, Schiavo G, Fritschy JM, Olsen R, Triller A, Moss SJ (2001) The subcellular distribution of GABARAP and its ability to interact with NSF suggest a role for this protein in the intracellular transport of GABA(A) receptors. Mol Cell Neurosci 18(1): 13–25. https://doi.org/10.1006/mcne.2001.1005
Xu X, Shangguan Y, Lu S, Wang W, Du C, Xiao F, Hu Y., Luo J, Wang L, He C, Yang Y, Zhang Y, Lu X, Yang Q, Wang X (2017) Tubulin β-III modulates seizure activity in epilepsy. J Pathology 242 (3): 297–308. https://doi.org/10.1002/path.4903
Jiang Y Q, Oblinger M M (1992) Differential Regulation of β III and Other Tubulin Genes during Peripheral and central Neuron Development. J Cell Sci 103 (Pt 3): 643–651. https://doi.org/10.1242/jcs.103.3.643
Latremoliere A, Cheng L, DeLisle M, Wu C, Chew S, Hutchinson EB, Sheridan A, Alexandre C, Latremoliere F, Sheu S-H, Golidy S, Omura T, Huebner EA, Fan Y, Whitman MC, Nguyen E, Hermawan C, Pierpaoli C, Tischfield MA, Clifford J, Woolf CJ, Engle EC (2018) Neuronal-specific TUBB3 us not required for normal neuronal function but is essential for timely axon regeneration. Cell Rep 24 (7): 1865–1879. https://doi.org/10.1016/j.celrep.2018.07.029
Hausrat TJ, Radwitz J, Lombino FL, Breiden P, Kneussel M (2021) Alpha- and β-tubulin isotypes are differentially expressed during brain development. Develop Neurobiol 81(3): 333–350. https://doi.org/10.1002/dneu.22745
Mink RB, Johnston JA (2000) Changes in brain neurofilament and beta-tubulin proteins after cerebral hypoxia-ischemia in rabbits. Pathobiology 68 (1): 43–52. https://doi.org/10.1159/000028114
Shen Y, Yu L-C (2008) Potential protection of curcumin against hypoxia-induced decreases in beta-III tubulin content in rat prefrontal cortical neurons. Neurochem Res 33: 2112–2117. https://doi.org/10.1007/s11064-008-9720-y
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


