Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 5, стр. 689-700
Модулирующий эффект фрагмента лептина 116–122 на тестикулярный стероидогенез у самцов крыс
А. А. Бахтюков 1, *, И. А. Лебедев 1, В. С. Кузнецова 1, К. В. Деркач 1, А. О. Шпаков 1
1 Институт эволюционной физиологии и биохимии
им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: bahtyukov@gmail.com
Поступила в редакцию 23.03.2023
После доработки 20.04.2023
Принята к публикации 20.04.2023
- EDN: XQFQGU
- DOI: 10.31857/S0869813923050023
Аннотация
Адипокин лептин играет важную роль в регуляции репродуктивной системы. Он стимулирует активность гипоталамо-гипофизарно-гонадной оси, опосредованно действуя на нейроны, секретирующие гонадолиберин (GnRH), и модулирует стероидогенную функцию семенников посредством связывания с лептиновыми рецепторами в клетках Лейдига. Фрагмент лептина 116–122 (ФЛ), включающий основные рецептор-связывающие детерминанты этого адипокина, нормализует метаболические показатели у животных с диета-индуцированным ожирением. Однако его способность влиять на стероидогенную функцию семенников, в том числе посредством взаимодействия с GnRH-нейронами гипоталамуса, не изучена. Целью работы было изучить эффекты однократного и трехдневного интраназального введения ФЛ (200 мкг/крысу) на уровень тестостерона в крови и экспрессию стероидогенных генов в семенниках у половозрелых самцов крыс Вистар, а также оценить стероидогенную активность ФЛ в условиях стимуляции синтеза тестостерона хорионическим гонадотропином человека (ХГЧ, 15 МЕ/крысу, п/к) и при обработке животных ингибитором гонадной оси – антагонистом GnRH-рецептора цетрореликсом (75 мкг/кг, п/к). Показано, что ФЛ повышает уровень тестостерона в крови при однократном введении, а при трехдневном введении усиливает стероидогенный эффект ХГЧ. ФЛ и ХГЧ повышали экспрессию гена Star, кодирующего ключевой регуляторный белок стероидогенеза StAR. Введение цетрореликса снижало уровень тестостерона и экспрессию Star, а также компенсаторно усиливало экспрессию гена рецептора лютеинизирующего гормона. В условиях обработки GnRH-антагонистом потенцирующее влияние ФЛ на ХГЧ-индуцированную стимуляцию уровня тестостерона и экспрессии Star не было выявлено. Таким образом, ФЛ способен стимулировать стероидогенез в семенниках крыс и потенцировать стероидогенные эффекты ХГЧ. Поскольку его эффекты подавляются в присутствии GnRH-антагониста, то имеются основания считать, что действие ФЛ реализуется за счет стимуляции гипоталамических GnRH-нейронов.
Стероидогенный статус и сперматогенез у мужчин зависят от функционирования гипоталамо-гипофизарно-тестикулярной (ГГТ) оси. Декапептид гонадолиберин (GnRH), рилизинг-фактор лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов, экспрессируемый GnRH-продуцирующими нейронами гипоталамуса, стимулирует секрецию ЛГ и ФСГ аденогипофизом. Повышение уровня ЛГ в крови приводит к повышению продукции тестостерона, основного мужского полового гормона, клетками Лейдига семенников. Среди регуляторов тестикулярного стероидогенеза особое место занимают адипокины, гормоноподобные вещества, продуцируемые жировой тканью. Имеются данные об участии в регуляции функций репродуктивной системы таких адипокинов, как лептин, адипонектин, висфатин, апелин, резистин [1, 2].
В настоящее время наиболее обстоятельно изучено влияние на ГГТ ось анорексигенного гормона лептина [2]. Показано, что лептин может напрямую или опосредованно воздействовать на гипоталамические, гипофизарные и периферические звенья ГГТ оси, оказывая на них в основном стимулирующее влияние [3]. В то же время установлено, что в условиях метаболических расстройств длительное повышение уровня лептина в крови, ведущее к развитию лептиновой резистентности, наряду с такими факторами, как высокий уровень провоспалительных цитокинов, инсулиновая резистентность и гипергликемия, может негативно влиять на секрецию GnRH, гонадотропинов и тестостерона, что является одной из причин андрогенной недостаточности и снижения мужской фертильности [4]. В свою очередь, пониженный уровень лептина в крови подростков может значительно замедлить наступление пубертатного периода, что обусловлено ослаблением лептиновой сигнализации в различных звеньях ГГТ оси [5].
Способность лептина влиять на активность различных звеньев ГГТ оси обусловлена присутствием в них функционально активных рецепторов лептина (ObRb) и других компонентов лептинового сигнального каскада [3]. До сих пор нет единого мнения о том, какое из звеньев ГГТ оси в наибольшей степени опосредует регуляторные эффекты лептина на репродуктивную систему. В соответствии с превалирующей в настоящее время концепцией, основной вклад в это вносит стимулирующее воздействие лептина на GnRH-продуцирующие нейроны, которое опосредуется через активацию кисспептин(KND)- и про-опиомеланокортин(POMC/CART)-экспрессирующих нейронов и ингибирование нейропептид Y/агути-подобный пептид(NPY/AgRP)-экспрессирующих нейронов в гипоталамусе [6]. Необходимо отметить, что эти эффекты реализуются при воздействии на гипоталамические нейроны нормальных физиологических концентраций лептина, которые вызывают стимуляцию секреции GnRH, и это приводит к повышению секреции ЛГ и ФСГ гонадотрофами гипофиза и активации тестикулярного стероидогенеза. В семенниках, где также присутствуют ObRb-рецепторы, лептин оказывает на тестикулярный стероидогенез разнонаправленные эффекты. В физиологических концентрациях он его усиливает, в то время как в условиях дефицита лептина или, напротив, в условиях длительной гиперлептинемии, ассоциированной с лептиновой резистентностью, лептиновые каскады в семенниках ослабляются [2]. Поскольку поиск регуляторов тестикулярного стероидогенеза на основе лептина и его аналогов представляет большой интерес для современной эндокринологии и андрологии, актуальной задачей представляется как изучение их влияния на стероидогенный статус, так и поиск основных мишеней их действия среди компонентов ГГТ оси. Имеются данные о том, что N-концевой фрагмент лептина 116–122 (ФЛ), соответствующий его участку, ответственному за связывание с рецептором и его активацию, может быть использован в качестве регулятора лептиновых сигнальных путей вместо полноразмерной молекулы адипокина [7, 8]. Показан анорексигенный эффект этого ФЛ на метаболические показатели у мышей с генетически-обусловленным и диета-индуцированным ожирением, что выражалось в снижении уровня глюкозы в крови, а также в уменьшении массы тела и потребления корма [9, 10]. Однако данные о влиянии ФЛ на активность компонентов ГГТ оси и стероидогенный статус, а также о возможных механизмах такого влияния в литературе отсутствуют.
Целью настоящей работы было изучить влияние однократного и трехдневного интраназального введения ФЛ, миристоил-Ser-Cys-Ser-D-Leu-Pro-Gln-Thr-амида, на уровень тестостерона в крови и экспрессию генов, ответственных за тестикулярный стероидогенез, у самцов крыс, в том числе в условиях подавления секреции гонадотропинов с помощью антагониста рецептора GnRH цетрореликса и стимуляции тестикулярного стероидогенеза с помощью хорионического гонадотропина человека (ХГЧ).
МЕТОДЫ ИССЛЕДОВАНИЯ
Схема эксперимента. Для экспериментов использовали половозрелых самцов крыс линии Вистар в возрасте 5 мес., содержащихся в стандартных условиях вивария со свободным доступом к воде и корму. Животные были разделены на 8 групп (в каждой n = 6). Фрагмент лептина, миристоил-Ser-Cys-Ser-D-Leu-Pro-Gln-Thr-амид (“Atagenix Laboratories”, КНР) растворяли в физиологическом растворе и вводили крысам из групп “ФЛ” и “ФЛ + ХГЧ”, “АНТ + ФЛ” и “АНТ + ФЛ + ХГЧ” интраназально в дозе 200 мкг/крысу в течение трех дней, ежедневно в 11:00. Антагонист рецептора GnRH, цетрореликса ацетат (Cetrorelix acetate) (Xingtai Yuanao Technology Co, КНР) растворяли в физиологическом растворе и вводили крысам из групп “АНТ”, “АНТ + ФЛ”, “АНТ + ХГЧ”, “АНТ + ФЛ + ХГЧ” подкожно в дозе 75 мг/кг в течение трех дней, ежедневно в 11:00. Крысам из групп “ФЛ + ХГЧ”, “ХГЧ”, “АНТ + ХГЧ” и “АНТ + ФЛ + ХГЧ” в последний день эксперимента подкожно вводили ХГЧ (“Московский эндокринный завод”, Россия) в дозе 15 МЕ/крысу в 12:30 (через 90 мин после введения ФЛ). Животные из группы “Контроль” получали физиологический раствор вместо препарата. У животных из всех групп оценивали базовый уровень тестостерона в крови, для чего у них забирали кровь из хвостовой вены в нулевой день эксперимента в 10:00, 12:00, 14:00 и 16:00 (под местным наркозом с использованием 2–4%-ного раствора лидокаина), чтобы рассчитать интегрированные значения концентрации гормона, учитывающие динамику его изменения в течение эксперимента. Эти данные использовали для равномерного распределения самцов по группам в соответствии с их андрогенным статусом. В первый день введения ФЛ у крыс из групп “ФЛ” и “ФЛ + ХГЧ” забирали кровь в 10:00 (за час до введения), в 12:00 (через 60 мин) и 14:00 (через 180 мин), чтобы оценить эффект однократного введения препарата на уровень тестостерона. На третий день введения ФЛ у крыс забирали кровь до введения ФЛ и/или цетрореликса (в 10:00), через 90 мин после введения ФЛ и/или цетрореликса, через 90 и 180 мин после введения ХГЧ. Кроме того, у всех самцов были оценены метаболические показатели до начала и в третий день эксперимента. Для определения уровня глюкозы использовали глюкометр и тест-полоски “One-Touch Select Ultra” (“LifeScan”, США). Также были получены образцы плазмы крови для определения уровня общего холестерина с помощью набора “Холестерин-1-Ольвекс (013.001)” (“Ольвекс”, Россия) и уровня триглицеридов с помощью набора “Триглицериды-1-Ольвекс (017.001)” (“Ольвекс”, Россия). Вслед за последним забором крови животные подвергались общей анестезии с помощью хлоральгидрата (400 мг/кг), после чего их декапитировали, извлекали ткани семенников и хранили их при –80°C до проведения экспериментов по оценке экспрессии генов.
Определение уровня тестостерона с помощью иммуноферментного анализа. Уровень тестостерона в образцах плазмы крови самцов крыс определяли с помощью твердофазного иммуноферментного анализа, используя наборы “ИФА-Тестостерон” (“Алкор-Био”, Россия).
Оценка генной экспрессии. Для анализа экспрессии генов из тканей семенников выделяли тотальную РНК с помощью реагента “ExtractRNA” (“Евроген”, Россия), затем получали кДНК с помощью реакции обратной транскрипции, используя набор “MMLV RT Kit” (“Евроген”, Россия). ПЦР в реальном времени осуществляли с помощью амплификатора “Applied Biosystems® 7500 Real-Time PCR System” (“Life Technologies, Thermo Fisher Scientific Inc.”, США) в инкубационной смеси, содержащей кДНК, 0.4 мкМ прямого и обратного специфичных праймеров, реагент “qPCR-HS SYBR + Low ROX” (“Евроген”, Россия). Для исследований использовали последовательности комплементарных кДНК прямого и обратного праймеров для генов крысы Star, Cyp11a1, Lhr, кодирующих белки StAR, цитохром P450scc и рецептор ЛГ, а также Actb (β-актин) в качестве референсного гена (табл. 1) [11].
Таблица 1.
Последовательность использованных в работе прямого и обратного праймеров к генам крысы
| Название гена | Прямая последовательность праймера | Обратная последовательность праймера |
|---|---|---|
| Lhr | CTGCGCTGTCCTGGCC | CGACCTCATTAAGTCCCCTGAA |
| Star | AAGGCTGGAAGAAGGAAAGC | CACCTGGCACCACCTTACTT |
| Cyp11a1 | TATTCCGCTTTGCCTTTGAG | CACGATCTCCTCCAACATCC |
| Actb | CTGGCACCACACCTTCTACA | AGGTCTCAAACATGATCTGGGT |
Статистическая обработка результатов. Статистическую обработку данных по определению уровня тестостерона в крови проводили с помощью двухфакторного дисперсионного анализа с апостериорным критерием Тьюки для попарного сравнения. Для статистической обработки данных по оценке генной экспрессии использовали однофакторный дисперсионный анализ с апостериорным критерием Тьюки для попарного сравнения. Для статистической обработки данных по определению массы тела крыс, а также уровней глюкозы, общего холестерина и триглицеридов использовали парный тест Стьюдента. Все статистические анализы проводили с использованием программы GraphPad Prism 8 (версия 8.0.1).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Характеристика метаболических показателей у самцов крыс при их обработке интраназально вводимым ФЛ
Трехдневное введение ФЛ самцам крыс не вызывало значимых изменений массы тела животных, а также уровней глюкозы, триглицеридов и общего холестерина в крови (табл. 2).
Таблица 2.
Эффекты трехдневного интраназального введения фрагмента лептина 116–122, миристоил-Ser-Cys-Ser-D-Leu-Pro-Gln-Thr-амида, на массу тела и уровни глюкозы, общего холестерина и триглицеридов в крови самцов крыс
| Масса тела, г | Глюкоза, мМ | Триглицериды, мМ | Общий холестерин, мМ | |
|---|---|---|---|---|
| До введения ФЛ | 380 ± 10 | 5.7 ± 0.2 | 0.89 ± 0.08 | 3.67 ± 0.17 |
| После трехдневного введения ФЛ | 379 ± 12 | 5.6 ± 0.3 | 0.74 ± 0.07 | 3.47 ± 0.25 |
Влияние интраназального введения ФЛ на уровень тестостерона в крови в норме, а также при обработке животных антагонистом GnRH-рецептора и хорионическим гонадотропином человека
Однократное интраназальное введение ФЛ приводило к повышению уровня тестостерона в крови крыс на 99% через 60 мин после введения препарата (рис. 1). При этом уровень гормона оставался повышенным и через 180 мин, превосходя базовый уровень на 61%. Трехдневное введение ФЛ не вызывало значимых изменений уровня тестостерона в крови в течение всего исследованного периода (60–270 мин) (рис. 2a). Однократное подкожное введение ХГЧ в дозе 15 МЕ/крысу приводило к повышению уровня тестостерона на 243% через 180 мин после введения. Введение ХГЧ крысам, которые в течение трех дней интраназально получали ФЛ, приводило к более выраженному повышению уровня тестостерона, чем у интактных животных. Через 90 мин после введения ХГЧ (180 мин после введения ФЛ) уровень тестостерона был выше базовых значений на 340%, через 180 мин – на 773%. Тем самым, трехдневное введение ФЛ в значительной степени потенцировало стимулирующий эффект ХГЧ на продукцию тестостерона в сравнении с интактными животными, и эффект потенцирования составил 62 и 221% через 180 и 270 мин соответственно (рис. 2a).
Рис. 1.
Уровни тестостерона в крови крыс до и после однократного интраназального введения фрагмента лептина 116–122, миристоил-Ser-Cys-Ser-D-Leu-Pro-Gln-Thr-амида. В нулевой день эксперимента образцы крови из хвостовой вены крыс забирали в 10:00, 12:00 и 14:00 час (day 0). В день эксперимента фрагмент лептина (ФЛ) вводили животным интраназально в 11:00, образцы крови забирали в 10:00 (до введения) и через 60 и 180 мин после введения ФЛ (LF). * – отличия от точки “0 min” статистически значимы при p < 0.05, M ± SEM, n = 12.
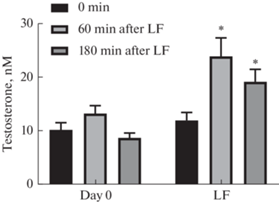
Рис. 2.
Влияние трехдневного введения фрагмента лептина 116–122 и (или) антагониста рецептора GnRH, а также однократного введения ХГЧ на уровень тестостерона в крови самцов крыс. (a) – Изменение уровня тестостерона в крови у крыс, которые в течение трех дней получали интраназально вводимый ФЛ и затем были однократно обработаны ХГЧ. ФЛ вводили интраназально в суточной дозе 200 мкг/крысу (LF и LF+hCG – группы “ФЛ” и “ФЛ + ХГЧ”), ХГЧ вводили однократно, подкожно, в дозе 15 МЕ/крысу (hCG и LF + hCG – группы “ХГЧ” и “ФЛ + ХГЧ”). (b) – Изменение уровня тестостерона у крыс, которых в течение трех дней обрабатывали цетрореликсом и ФЛ и однократно ХГЧ. Цетрореликс вводили подкожно в суточной дозе 75 мкг/кг. ФЛ вводили группам ANT + LF и ANT + LF + hCG (группы “АНТ + ФЛ” и “АНТ + ФЛ + ХГЧ”), как описано выше. ХГЧ вводили как описано выше (ANT + hCG и ANT + LF + hCG – группы “АНТ + ХГЧ” и “АНТ + ФЛ + ХГЧ”). Образцы крови для изучения уровня тестостерона были взяты из хвостовой вены крыс на третий день обработки ФЛ и (или) цетрореликсом до введения обоих препаратов (1), через 90 мин после введения ФЛ и(или) цетрореликса (2), через 180 мин после введения ФЛ и(или) цетрореликса и через 90 мин после введения ХГЧ (3), через 270 мин после введения ФЛ и(или) цетрореликса и через 180 мин после введения ХГЧ (4). * – отличия от базового уровня тестостерона (точка 1) при внутригрупповом сравнении, ** – отличия от временной точки 180 мин после обработки ФЛ и (или) цетрореликсом или через 90 мин после введения ХГЧ (точка 3) при внутригрупповом сравнении, # – отличия от аналогичной временной точки в группе “Контроль” статистически значимы при p < 0.05, M ± SEM, n = 6.
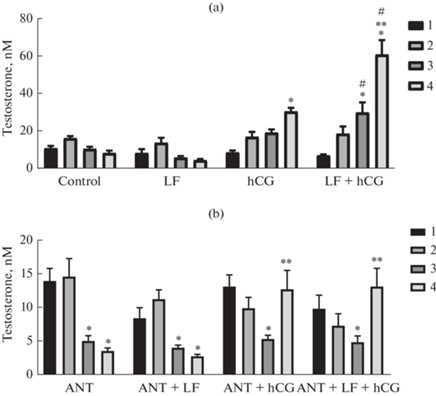
Трехдневное введение антагониста рецептора GnRH цетрореликса приводило к значительному снижению уровня тестостерона. На третий день эксперимента через 180 и 270 мин после введения цетрореликса уровень гормона составил 36 и 25% от его базовых значений (рис. 2b). В условиях обработки животных интраназально вводимым ФЛ ингибирующие эффекты цетрореликса сохранялись, на что указывало снижение уровня тестостерона до 48 и 32% от его базовых значений через 180 и 270 мин после введения препаратов. На третий день эксперимента уровень тестостерона в группах “АНТ + ХГЧ” и “АНТ + ФЛ + ХГЧ” был снижен через 90 мин и нормализовался через 180 мин после введения ХГЧ (270 мин после введения цетролерикса и ФЛ соответственно) (рис. 2b). Введение ФЛ не приводило к ослаблению ингибирующего эффекта цетрореликса на стероидогенез и существенно не влияло на стероидогенный эффект ХГЧ (рис. 2b).
Влияние трехдневного введения фрагмента лептина на экспрессию генов стероидогенеза в семенниках в норме и в условиях обработки антагонистом рецептора GnRH и ХГЧ
Исследовали экспрессию тестикулярных генов, кодирующих рецептор лютеинизирующего гормона (Lhr), белок StaR (Star) опосредующий скорость-лимитирующую стадию стероидогенеза (транспорт холестерина в митохондрии), и фермент цитохром P450scc (Cyp11a1), катализирующий первую реакцию превращения холестерина в тестостерон. Изучение генной экспрессии в тканях семенников показало, что на третий день через 270 мин после введения ФЛ экспрессия генов Lhr, Star и Cyp11a1 существенно не менялась. В группе “ХГЧ” через 180 мин после однократной инъекции гонадотропина повышение экспрессии генов Lhr, Star и Cyp11a1 было значимым в сравнении с контрольной группой и составило 172, 168 и 74% соответственно. Для генов Star и Cyp11a1 значимыми были различия и с группой “ФЛ”. Трехдневное введение ФЛ не приводило к усилению стимулирующего эффекта ХГЧ на экспрессию генов Lhr, Star и Cyp11a1 (рис. 3a).
Рис. 3.
Изменение экспрессии генов Lhr, Star и Cyp11a1 в ткани семенников крыс после введения фрагмента лептина 116–122, антагониста рецептора GnRH или ХГЧ. Ткани семенников были взяты на третий день эксперимента через 270 мин после введения ФЛ и(или) цетрореликса и через 180 мин после введения ХГЧ. (a) – Изменение генной экспрессии в семенниках крыс в условиях трехдневного интраназального введения ФЛ, а также однократной стимуляции ХГЧ. ФЛ вводили интраназально в течение трех дней в суточной дозе 200 мкг/крысу (LF и LF + hCG – группы “ФЛ” и “ФЛ + ХГЧ”), ХГЧ вводили однократно, подкожно, в дозе 15 МЕ/крысу (hCG и LF + hCG – группы “ХГЧ” и “ФЛ + ХГЧ”). Сравнение проводили с группой “Контроль” (Control), получавшей только физиологический раствор. (b) – Изменение генной экспрессии в семенниках крыс, которых в течение трех дней обрабатывали антагонистом рецептора GnRH цетрореликсом и ФЛ, а также однократно вводили ХГЧ. Цетрореликс вводили подкожно в суточной дозе 75 мкг/кг, ФЛ (ANT + LF и ANT + LF + hCG – группы “АНТ + ФЛ” и “АНТ + ФЛ + ХГЧ”) и ХГЧ (ANT + hCG и ANT + LF + hCG – группы “АНТ + ХГЧ” и “АНТ + ФЛ + ХГЧ”) вводили, как описано выше. * – отличия от группы “Контроль” (Control), # – отличия от группы “ФЛ” (LF), ** – отличия от группы “АНТ + ХГЧ” (ANT + hCG) статистически значимы при p < 0.05, M ± SEM, n = 6.
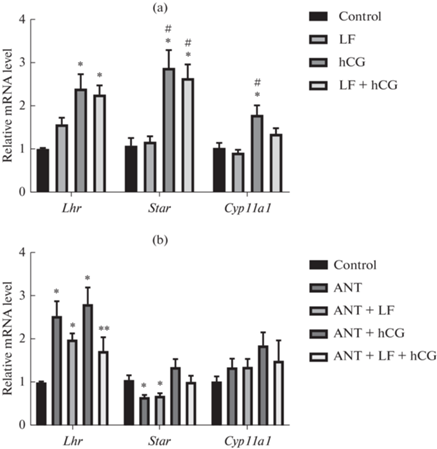
Трехдневное введение цетрореликса значимо снижало экспрессию гена Star в группах “АНТ” и “АНТ + ФЛ” до 62 и 65% от соответствующих значений в контрольной группе (рис. 3b). Введение ХГЧ восстанавливало экспрессию гена Star до контрольных значений в группах “АНТ + ХГЧ” и “АНТ + ФЛ + ХГЧ”. При этом трехдневная обработка ФЛ не оказывала значимого влияния на эффекты цетрореликса и ХГЧ на экспрессию гена Star. В группах “АНТ”, “АНТ + ФЛ” и “АНТ + ХГЧ” отмечали повышение экспрессии гена Lhr на 138, 83 и 183% соответственно. При этом в группе “АНТ + ФЛ + ХГЧ” экспрессия Lhr была на 64% снижена относительно группы “АНТ + ХГЧ”. В группах, обработанных цетрореликсом, не было обнаружено существенных изменений экспрессии гена Cyp11a1, но наблюдалась тенденция к ее усилению (рис. 3b).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Взаимосвязь энергетического метаболизма и функциональной активности репродуктивной системы в последние годы активно изучается. Одним из важных регуляторов гипоталамо-гипофизарно-гонадной оси является адипокин лептин, действующий на клетки-мишени через рецепторы ObRb. Будучи анорексигенным фактором, лептин снижает потребление пищи организмом, влияя на энергетический гомеостаз и опосредованно регулируя широкий спектр физиологических и биохимических процессов в организме [3].
Несмотря на доказанный терапевтический эффект полноразмерного лептина, в том числе при его дефиците в условиях липодистрофии, применение этого адипокина в клинике крайне ограничено, что обусловлено быстрой деградацией лептина в кровотоке и тканях, а также тем, что длительное его использование приводит к развитию лептиновой резистентности, что снижает фармакологическую эффективность лептиновой терапии. Альтернативой являются укороченные аналоги лептина, наиболее перспективным из которых является фрагмент 116–122 MA-[D-Leu4]-OB3. Продемонстрированы его анорексигенные эффекты у ob/ob- и db/db-мышей с нарушенным лептиновым сигналингом, а также у мышей с диета-индуцированным ожирением [9, 10]. По данным литературы, исследованный нами ФЛ способен ослаблять потребление пищи, нормализовать толерантность к глюкозе и снижать массу тела при ожирении [8]. В данном исследовании нами были использованы самцы крыс без метаболических нарушений (табл. 2). Трехдневное интраназальное введение ФЛ не влияло на основные метаболические показатели у крыс, такие как масса тела, уровни глюкозы, общего холестерина и триглицеридов в крови, что, по всей видимости, связано с нормальным метаболическим статусом животных, а также с краткосрочностью их обработки ФЛ. В описанных выше работах объектами исследования были мыши с признаками явных метаболических расстройств (ожирение, дислипидемия, нарушенная толерантность к глюкозе). Наряду с этим продолжительность лечения составила 14 дней при использовании суточной дозы 20–100 мг/кг (п/ор), в то время как в нашем эксперименте крысы получали ФЛ в суточной дозе 200 мкг/крысу в течение всего трех дней.
Для оценки влияния ФЛ на компоненты ГГТ оси нами был выбран интраназальный способ введения. При подобном способе введения ФЛ быстро проникает через гематоэнцефалический барьер (ГЭБ) в гипоталамическую область, что позволяет ему действовать непосредственно на гипоталамические компоненты лептиновой сигнальной системы [12]. По данным литературы ФЛ хорошо проникает через ГЭБ, при этом концентрация препарата в плазме крови имеет два пика: через 10 и 60 мин. Исследователи предполагают, что первый пик связан с быстрым всасыванием миристинилированного пептида через слизистую оболочку носа, в то время как второй – с более медленным проникновением в кровь в ротоглотке [7]. Считается, что биодоступность препарата при интраназальном введении выше, чем при пероральном и разных способах парентерального введения [7]. Основываясь на этих данных и наших предварительных результатах, нами была разработана стратегия изучения эффективности влияния ФЛ на уровень тестостерона в крови и стероидогенез в семенниках самцов крыс.
Нами впервые показано, что при однократном интраназальном введении ФЛ стимулирует продукцию тестостерона, и максимальный эффект наблюдается уже через 60 мин после его введения (рис. 1). Этот максимум по времени хорошо совпадает со скоростью проникновения ФЛ через ГЭБ в гипоталамус [7]. При этом трехдневное введение препарата не приводило к изменениям уровня тестостерона в крови, что может быть связано с затуханием краткосрочных стероидогенных эффектов ФЛ на тестикулярный стероидогенез при многократном введении. Из данных литературы хорошо известно, что лептин может реализовать свои эффекты через опосредованную стимуляцию гипоталамических GnRH-продуцирующих нейронов и, тем самым, регулировать и модулировать стероидогенез в семенниках [3]. Использование ХГЧ, стимулятора тестикулярного стероидогенеза, позволяет изучить мишени и механизмы регуляторных эффектов ФЛ на активность ГГТ оси.
Ранее нами было показано, что метформин, широко известный антидиабетический препарат, способен усиливать эффекты однократно вводимого ХГЧ, взятого в относительно низкой дозе [11, 13, 14]. В рамках настоящего исследования мы изучили способность обработки крыс интраназально вводимым ФЛ потенцировать стероидогенные эффекты ХГЧ, также взятого в относительно низкой дозе – 15 МЕ/крысу. Мы показали, что трехдневная обработка крыс с помощью ФЛ вызывает значительное усиление эффекта ХГЧ через 90 и 180 мин после введения гонадотропина в сравнении с группой, получавшей только ХГЧ (рис. 2a). Регуляция синтеза тестостерона в клетках Лейдига семенников осуществляется через активацию эндогенными гонадотропинами рецептора ЛГ, что ведет к стимуляции активности белка StAR, транспортирующего холестерин из цитоплазмы в митохондрии к месту начала синтеза тестостерона, и цитохрома P450scc, который катализирует превращение холестерина в прегненолон. Синтезированный в этой реакции прегненолон затем диффундирует в эндоплазматическую сеть и в серии последовательных реакций превращается в тестостерон [15]. Тем самым гены, кодирующие рецептор ЛГ (Lhr), белок StAR (Star) и цитохром P450scc (Cyp11a1), являются ключевыми компонентами системы стероидогенеза. Нами показано, что обработка самцов крыс с помощью ХГЧ приводит к повышению экспрессии генов Lhr и Cyp11a1 в семенниках (рис. 3a). В то же время необходимо отметить, что значимых различий в уровне мРНК для генов Lhr и Cyp11a1 между группами “ХГЧ” и “ФЛ + ХГЧ” выявлено не было, что говорит об отсутствии заметных эффектов ФЛ на их экспрессию.
Способность лептина и его фрагмента влиять на тестикулярный стероидогенез и уровень тестостерона в крови обусловлена присутствием рецепторов лептина и нижележащих компонентов лептинового сигналинга (трансдукторные IRS-белки, нерецепторная тирозинкиназа JAK2, Akt-киназа, транскрипционные факторы STAT3/5) как в гипоталамических нейронах, так и в гонадотропах гипофиза и клетках Лейдига семенников [3]. Общепринято, что определяющую роль в регуляции ГГТ оси играют гипоталамические эффекты лептина [1, 3]. Однако данные о механизмах и мишенях влияния ФЛ на эту ось, в том числе информация о вовлечении в это влияние гипоталамических механизмов отсутствует. Для доказательства гипоталамических механизмов действия ФЛ нами было исследовано влияние антагониста GnRH-рецептора цетрореликса на стероидогенные эффекты ФЛ. При этом цетрореликс вводили в течение трех дней как отдельно, так и совместно с ФЛ и ХГЧ. Сам цетрореликс ожидаемо снижал уровень тестостерона в крови (рис. 2b) и экспрессию гена Star, играющего ключевую роль в регуляции тестикулярного стероидогенеза (рис. 3b). При этом мы наблюдали компенсаторное повышение экспрессии гена Lhr в семенниках, что может быть связано с необходимостью повысить плотность рецепторов ЛГ на плазматической мембране клеток Лейдига в условиях дефицита ЛГ, вызванного введением цетрореликса [16]. Далее самцам крыс, получавшим в течение трех дней цетрореликс, и животным, которые, помимо этого, интраназально получали ФЛ, на третий день однократно вводили ХГЧ в дозе 15 МЕ/крысу. В ответ на ХГЧ, через 180 мин после введения гормона было продемонстрировано восстановление до контрольных значений уровня тестостерона, сниженного при обработке цетрореликсом (рис. 2b), но потенцирования стероидогенного эффекта ХГЧ в группе с обработкой ФЛ (“АНТ + ФЛ + ХГЧ”) в этом случае выявлено не было. В группе “АНТ + ФЛ + ХГЧ” не было выявлено заметного эффекта ФЛ на стимуляцию гонадотропином экспрессии гена Star (рис. 3b). Таким образом, сделан вывод, что на фоне ингибирования ГГТ оси цетрореликсом ФЛ утрачивает способность усиливать стероидогенные эффекты ХГЧ, и это может указывать на то, что основной мишенью ФЛ, как и в случае полноразмерного лептина, являются компоненты лептиновой системы в гипоталамусе.
Таким образом, нами впервые показано, что ФЛ при однократном (но не трехдневном) интраназальном введении самцам крыс повышает у них уровень тестостерона в крови. При этом трехдневное введение ФЛ потенцирует эффекты ХГЧ, агониста рецептора ЛГ, на уровень тестостерона, хотя стимулирующие эффекты гонадотропина на экспрессию генов Star и Lhr, играющих ключевую роль в регуляции тестикулярного стероидогенеза, в присутствии ФЛ не меняются. Подавление стимулирующих эффектов GnRH на секреторную активность гонадотрофов гипофиза с помощью цетрореликса, антагониста GnRH-рецепторов, приводило к снижению уровня тестостерона в крови, а также к снижению экспрессии гена Star и компенсаторному повышению экспрессии гена Lhr в семенниках крыс. В условиях подавления ГГТ оси цетрореликсом, ФЛ не оказывал существенного влияния на стероидогенные эффекты ХГЧ, и это может свидетельствовать в пользу того, что мишенью действия ФЛ являются гипоталамические нейроны. В этой связи важно отметить высокую доступность гипоталамических структур при интраназальном способе введения ФЛ. Дальнейшие исследования фармакологической активности и механизмов действия ФЛ 116–122, миристоил-Ser-Cys-Ser-D-Leu-Pro-Gln-Thr-амида, как на мужскую, так и на женскую репродуктивную систему необходимы как для более глубокого понимания функций лептиновой сигнальной системы в контроле репродукции, так и для создания новых лекарственных средств для стимуляции репродуктивных функций и лечения бесплодия.
Список литературы
Kawwass JF, Summer R, Kallen CB (2015) Direct effects of leptin and adiponectin on peripheral reproductive tissues: a critical review. Mol Hum Reprod 21(8): 617–632. https://doi.org/10.1093/molehr/gav025
Nieuwenhuis D, Pujol-Gualdo N, Arnoldussen IAC, Kiliaan AJ (2020) Adipokines: A gear shift in puberty. Obes Rev (6): e13005. https://doi.org/10.1111/obr.13005
Childs GV, Odle AK, MacNicol MC, MacNicol AM (2021) The importance of leptin to reproduction. Endocrinology 162(2): bqaa204. https://doi.org/10.1210/endocr/bqaa204
Leisegang K, Sengupta P, Agarwal A, Henkel R (2021) Obesity and male infertility: Mechanisms and management. Andrologia 53(1): e13617. https://doi.org/10.1111/and.13617
Huang A, Roth CL (2021) The link between obesity and puberty: what is new? Curr Opin Pediatr 33(4): 449–457. https://doi.org/10.1097/MOP.0000000000001035
Obradovic M, Sudar-Milovanovic E, Soskic S, Essack M, Arya S, Stewart AJ, Gojobori T, Isenovic ER (2021) Leptin and obesity: role and clinical implication. Front Endocrinol (Lausanne) 12: 585887. https://doi.org/10.3389/fendo.2021.585887
Novakovic ZM, Leinung MC, Lee DW, Grasso P (2009) Intranasal administration of mouse [D-Leu-4]OB3, a synthetic peptide amide with leptin-like activity, enhances total uptake and bioavailability in Swiss Webster mice when compared to intraperitoneal, subcutaneous, and intramuscular delivery systems. Regul Pept 154(1–3): 107–111. https://doi.org/10.1016/j.regpep.2009.01.002
Novakovic ZM, Leinung MC, Grasso P (2013) [D-Leu-4]-OB3, an orally bioavailable leptin-related synthetic peptide insulin sensitizer: a study comparing the efficacies of [D-Leu-4]-OB3 and metformin on energy balance and glycemic regulation in insulin-deficient male Swiss Webster mice. Peptides 43: 167–173. https://doi.org/10.1016/j.peptides.2013.02.023
Leinung MC, Grasso P (2012) [D-Leu-4]-OB3, a synthetic peptide amide with leptin-like activity, augments the effects of orally delivered exenatide and pramlintide acetate on energy balance and glycemic control in insulin-resistant male C57BLK/6-m db/db mice. Regul Pept 179(1–3): 33–38. https://doi.org/10.1016/j.regpep.2012.08.006
Wang A, Anderson BM, Novakovic ZM, Grasso P (2018) [D-Leu-4]-OB3 and MA-[D-Leu-4]-OB3, small molecule synthetic peptide leptin mimetics, improve glycemic control in diet-induced obese (DIO) mice. Peptides 101: 51–59. https://doi.org/10.1016/j.peptides.2017.12.012
Bakhtyukov AA, Derkach KV, Sorokoumov VN, Stepochkina AM, Romanova IV, Morina IY, Zakharova IO, Bayunova LV, Shpakov AO (2022) The effects of separate and combined treatment of male rats with type 2 diabetes with metformin and orthosteric and allosteric agonists of luteinizing hormone receptor on steroidogenesis and spermatogenesis. Int J Mol Sci 23(1): 198. https://doi.org/10.3390/ijms23010198
Anderson BM, Jacobson L, Novakovic ZM, Grasso P (2017) Oral delivery of [D-Leu-4]-OB3 and MA-[D-Leu-4]-OB3, synthetic peptide leptin mimetics: Immunofluorescent localization in the mouse hypothalamus. Brain Res 1664: 1–8. https://doi.org/10.1016/j.brainres.2017.03.020
Derkach KV, Bakhtyukov AA, Morina IY, Romanova IV, Bayunova LV, Shpakov AO (2022) Comparative study of the restoring effect of metformin, gonadotropin, and allosteric agonist of luteinizing hormone receptor on spermatogenesis in male rats with streptozotocin-induced type 2 diabetes mellitus. Bull Exp Biol Med 172(4): 435–440. https://doi.org/10.1007/s10517-022-05409-2
Derkach KV, Bakhtyukov AA, Bayunova LV, Zorina II, Shpakov AO (2020) Normalization of testicular steroidogenesis and spermatogenesis in male rats with type 2 diabetes mellitus under the conditions of metformin therapy. Dokl Biol Sci 493(1): 110–113. https://doi.org/10.1134/S0012496620040031
Zirkin BR, Papadopoulos V (2018) Leydig cells: formation, function, and regulation. Biol Reprod 99(1): 101–111. https://doi.org/10.1093/biolre/ioy059
Reissmann T, Schally AV, Bouchard P, Riethmiiller H, Engel J (2000) The LHRH antagonist cetrorelix: a review. Hum Reprod Update 6(4): 322–331. https://doi.org/10.1093/humupd/6.4.322
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


