Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 5, стр. 656-672
Влияние вида вскармливания на таксономический состав кишечного микробиома и уровни трефоиловых факторов у детей и подростков
А. В. Шестопалов 1, 2, 3, И. М. Колесникова 1, *, Д. В. Савчук 4, 5, Е. Д. Теплякова 4, В. А. Шин 4, Т. В. Григорьева 6, Ю. Л. Набока 4, А. М. Гапонов 2, 7, С. А. Румянцев 1, 2
1 Российский национальный исследовательский
медицинский университет им. Н.И. Пирогова
Москва, Россия
2 ООО “Центр молекулярного здоровья”
Москва, Россия
3 Национальный медицинский исследовательский центр детской гематологии,
онкологии и иммунологии им. Дмитрия Рогачева
Москва, Россия
4 Ростовский государственный медицинский университет
Ростов-на-Дону, Россия
5 Детская городская больница № 1
Ростов-на-Дону, Россия
6 Казанский (Приволжский) федеральный университет
Казань, Россия
7 НИИ общей реаниматологии им. В.А. Неговского
Москва, Россия
* E-mail: ir.max.kolesnikova@gmail.com
Поступила в редакцию 05.03.2023
После доработки 07.04.2023
Принята к публикации 12.04.2023
- EDN: XRFVGC
- DOI: 10.31857/S0869813923050096
Аннотация
Изменения в кишечном микробиоме признаются важным компонентом развития ожирения как у взрослых, так и у детей. Одним из значимых факторов формирования кишечной микробиоты в период новорожденности является вид вскармливания, который может оказывать и пролонгированный эффект на микробное сообщество. Кроме того, грудное молоко способствует формированию толерантности к микробиоте кишечника мукозального барьера, одним из компонентов которого являются трефоиловые факторы (TFF2 и TFF3). Целью работы стало изучение состава кишечной микробиоты и содержания трефоиловых факторов в крови у детей и подростков с ожирением в зависимости от типа вскармливания на первом году жизни. Обследовано 93 ребенка без ожирения (Группа 1) и 92 с ожирением (Группа 2). Проводилось исследование уровня TFF2 и TFF3 в сыворотке крови, а также определение таксономического состава микробиома кала методом метагеномного секвенирования гена 16S рРНК. В целом состав кишечной микробиоты у Группы 1 и 2 был схож. Однако для Группы 2 была характерна меньшая представленность [Prevotella], Epulopiscium и Haemophilus и большая – Clostridium и Catenibacterium. Ни ожирение, ни вид вскармливания на первом году жизни не оказали влияния на сывороточную концентрацию TFF2 и TFF3. При этом вид вскармливания оказывает пролонгированное влияние на кишечную микробиоту, причем у детей Группы 2 такое влияние было менее выражено. В Группе 1 естественный тип вскармливания на первом году жизни привел к формированию у детей полной толерантности мукозального барьера к микробиому, чего не происходило при смешанном и искусственном вскармливании. В Группе 2 большая часть ассоциаций “TFF–кишечный микробиом” носила положительный характер, что указывает на неблагоприятное взаимодействие кишечной стенки и микробиома. Таким образом, тип вскармливания представляется слабым, но значимым фактором формирования кишечного микробиома у детей и подростков, который также оказывает влияние на становление толерантности мукозального барьера к кишечной флоре.
ВВЕДЕНИЕ
На сегодняшний день ожирение в детском возрасте является одной из серьезных проблем здравоохранения, носит глобальный характер и затрагивает как развивающиеся, так и развитые страны [1]. Несмотря на то, что известно достаточно много причин и факторов, способствующих развитию ожирения, поиск новых взаимосвязей, в том числе влияние микробиоты кишечника, является перспективным направлением научных исследований [2]. При этом большинство исследований фокусируют свое внимание на изменениях таксономического состава микробиома на уровне филумов. Вместе с тем более подробное исследование микробиома на уровне семейств и родов позволит получить детальную информацию о закономерностях изменений микробного сообщества.
В последнее время человеческий организм рассматривают как метаболическую химеру (суперорганизм, холоорганизм), в котором кишечная микробиота является важнейшим “метаболическим органом” [3]. Поэтому очевидно, что изменение таксономического состава микробного сообщества кишечника приведет к изменению метаболической активности микробиоты и соответственно всего “суперорганизма” [4]. Важным компонентом в формировании системы “суперорганизма” является слизистая оболочка кишечника, барьерные и иммунные механизмы которой обеспечивают симбиотическое взаимодействие макроорганизма с микробиотой.
Одним из компонентов мукозального барьера являются трефоиловые факторы (trefoil factors, TFFs), которые представляют собой группу пептидов, синтезирующихся и выделяющихся эпителием слизистых оболочек [5]. Была обнаружена взаимосвязь между уровнем экспрессии TFFs и заболеваниями желудочно-кишечного и урогенитального трактов [6, 7]. В частности, содержание TFFs взаимосвязано с уровнями лептина и грелина у детей с эрозивным гастродуоденитом [8].
На процесс формирования “суперорганизма” значительное влияние оказывает вскармливание грудным молоком в период новорожденности. Грудное молоко является не только источником микробиоты с высоким разнообразием, но и создает среду для формирования нормального микробного сообщества кишечника [9]. В формировании таксономического состава микробиома кишечника новорожденных значительную роль играют компоненты грудного молока, такие как олигосахариды, иммунные факторы, бактерии и бактериальные метаболиты, нутриенты [10]. Учитывая, что олигосахариды и секреторный иммуноглобулин А грудного молока обеспечивают формирование периферической толерантности к микробному сообществу [10, 11], то вероятно, тип вскармливания влияет и на выработку факторов мукозального барьера, в том числе трефоиловых пептидов. При этом вскармливание оказывает очень длительный эффект, вплоть до подросткового возраста, что было показано на примере микробиоты ротовой полости [12].
Таким образом, детальное исследование микробного сообщества и трефоиловых факторов у детей с ожирением представляет особый интерес.
Целью настоящей работы стала характеристика особенностей состава микробиоты толстого кишечника на уровне семейств и родов, а также содержания трефоиловых факторов в крови детей и подростков с ожирением в зависимости от типа вскармливания на первом году жизни.
МЕТОДЫ ИССЛЕДОВАНИЯ
Проведено проспективное одномоментное исследование на базе Детской городской больницы № 1, г. Ростов-на-Дону; ООО “Центр Молекулярного Здоровья”, г. Москва; Казанского (Приволжского) федерального университета и Российского национального исследовательского университета им. Н.И. Пирогова в период 2019–2020 гг. Были обследованы 185 детей от 10 до 18 лет, средний возраст которых составил 13.1 ± 4.1 лет. Критерии включения: подписанное родителями добровольное информированное согласие и отсутствие приема анти-, про- и пребиотических препаратов за 3 мес. до включения в исследование. Критерии исключения: тяжелые соматические заболевания (хроническая сердечная недостаточность, хроническая печеночная недостаточность, хроническая почечная недостаточность), любые заболевания желудочно-кишечного тракта, а также все острые патологии. На основании клинических рекомендаций “Ожирение у детей” [13] у 92 детей было диагностировано ожирение I–III степени. Таким образом, были сформированы две клинические группы: Группа 1, состоящая из 93 детей без ожирения, и Группа 2, включавшая 92 ребенка с ожирением. В обеих группах обязательно учитывался тип вскармливания на первом году жизни. Характеристика исследуемых групп приведена в табл. 1.
Таблица 1.
Характеристика обследуемых групп
| Показатель | Группа 1 | Группа 2 |
|---|---|---|
| Пол, ♂/♀ | 60.2%/39.8% | 47.8%/52.2% |
| Возраст, лет | 13.0 [11.0–15.0] | 13.0 [11.0–15.0] |
| Индекс массы тела, кг/м2 | 20.2 [19.4–21.1] | 27.0 [25.8–28.7]* |
| Естественное вскармливание | 19 (20.4%) | 28 (30.4%) |
| Смешанное вскармливание | 40 (43.0%) | 51 (55.4%) |
| Искусственное вскармливание | 34 (36.6%) | 13 (14.1%)* |
У всех обследуемых было проведено изучение анамнеза, жалоб на момент обращения, общеклинический осмотр и отбор образцов кала и крови. В сыворотке крови проводилось определение содержания трефоиловых факторов 2-го и 3-го типов (TFF2 и TFF3 соответственно) методом иммуноферментного анализа с использованием коммерческих наборов Cloud-Clone Corp (США).
Метагеномный анализ сообщества кишечника осуществляли на базе Междисциплинарного центра коллективного пользования Казанского федерального университета. ДНК из образцов кала выделяли с использованием набора QIAamp DNA stool mini kit (QIAGEN GmbH, Германия). Секвенирование вариабельного участка v3–v4 гена 16S рРНК проводили на платформе MiSeq (Illumina, Inc., США). Полученные последовательности генов 16S рРНК были проанализированы с помощью программы QIIME v.1.9.1 (Knight and Caporaso labs., США) с использованием референсной базы данных Greengenes v.13.8 (Second Genome, Inc., США) с 97.0%-ным порогом сходства между последовательностями. Относительная представленность бактериальных таксонов в общем пуле ридов указана в долях (от 0 до 1), которые были рассчитаны на основе количества картированных ридов для каждого таксона. В последующий статистический анализ были включены идентифицированные семейства и роды, выделенные у 25.0% и более детей хотя бы одной из исследуемых групп.
Статистическая обработка данных проводилась при помощи программы MedCalc (MedCalc Software Ltd, Бельгия). Полученные массивы данных были проверены на нормальность распределения с использованием критерия Шапиро–Уилка. Преимущественно полученные данные не подчинялись нормальному распределению, в связи с чем для их описания были использованы медианы [25; 75 перцентили]. Для сравнения содержания трефоиловых факторов и долей отдельных таксонов между исследуемыми группами использовался непараметрический критерий Манна–Уитни. Сравнение трех подгрупп (в зависимости от типа вскармливания) выполняли с использованием теста Крускала–Уоллиса, а в случае его положительного результата (р < 0.05) проводился апостериорный тест по Коноверу. Кроме того, сравнивали частоту выделения ДНК отдельных таксонов из образцов кала методом Хи-квадрат анализа. Выявление взаимосвязи между долями таксонов кишечного микробиома и содержания трефоиловых факторов в сыворотке проводилось с расчетом коэффициента корреляции Спирмена (rs). Коэффициенты корреляции принимались во внимания, если они по модулю были более 0.3 (умеренный уровень связи по шкале Чэддока) при уровне значимости р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В микробном сообществе кишечника детей и подростков была идентифицирована ДНК, принадлежащая к 83 семействам и 142 родам. При этом ДНК лишь 35 семейств и 50 родов выделялась более чем у 25.0% детей Группы 1 и/или Группы 2. Однако на долю исследуемых 35 семейств приходилось 0.919 [0.893; 0.934] у Группы 1 и 0.928 [0.897; 0.949] у Группы 2, что указывает на полноту описания микробного сообщества. Основными семействами кишечного микробиома у детей обеих групп были Lachnospiraceae, Ruminococcaceae, Bacteroidaceae и Prevotellaceae, суммарно на долю которых в Группе 1 приходилось 0.721 [0.643; 0.722] и 0.708 [0.634; 0.780] в Группе 2 (рис. 1).
Рис. 1.
Таксономический состав кишечного микробиома на уровне филумов и их основных семейств. Actin – Actinomycetaceae; Bifid – Bifidobacteriaceae; [Barn] – [Barnesiellaceae]; Porph – Porphyromonadaceae; Rik – Rikenellaceae; Prev – Prevotellaceae; Bact – Bacteroidaceae; Erys – Erysipelotrichaceae; Veill – Veillonellaceae; Rum – Ruminococcaceae; Lach – Lachnospiraceae.
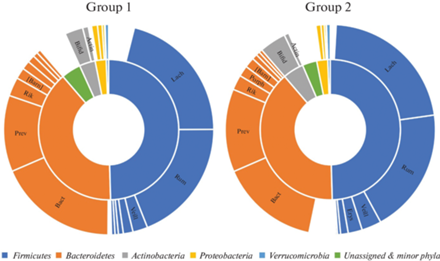
В целом таксономический состав кишечного микробиома был схож у детей исследуемых групп. Однако сравнение долевого содержания семейств и родов у здоровых детей и детей с ожирением были выявлены статистически значимые изменения в содержании ряда семейств и родов (табл. 2).
Таблица 2.
Изменения в содержании отдельных таксонов кишечного микробиома у детей исследуемых групп
| Филумы | Группа 1 | Группа 2 | |||
|---|---|---|---|---|---|
| Семейства | % | Доля (×103) | % | Доля (×103) | |
| Bacteroides | [Odoribacteraceae] | 100 | 5.00 [3.00; 9.00] | 98.9 | 4.00 [2.00; 7.00]* |
| Firmicutes | Clostridiaceae | 98,9 | 5.00 [3.00; 10.00] | 98.8 | 8.00 [5.00; 13.00]* |
| Proteobacteria | Pasteurellaceae | 67.7 | 0.14 [0.00; 0.50] | 48,9* | 0.00 [0.00; 0.38]* |
| Роды | % | Доля (×103) | % | Доля (×103) | |
| Bacteroides | [Prevotella] | 31.2 | 0.00 [0.00; 0.07] | 18.5* | 0.00 [0.00; 0.00]* |
| Firmicutes | Clostridium | 96.8 | 1.80 [1.10; 2.90] | 96.7 | 2.40 [1.60; 4.60]* |
| Epulopiscium | 29.0 | 0.00 [0.00; 0.07] | 5.4* | 0.00 [0.00; 0.00]* | |
| Catenibacterium | 16.1 | 0.00 [0.00; 0.00] | 30.4* | 0.00 [0.00; 2.40]* | |
| Proteobacteria | Haemophilus | 66.7 | 0.14 [0.00; 0.44] | 47.8* | 0.00 [0.00; 0.36]* |
Большинство выявленных различий демонстрировали снижение доли отдельных таксонов в микробной популяции у детей с ожирением. Снижение родов [Prevotella] (семейство [Paraprevotellaceae]), Epulopiscium (семейство Lachnospiraceae) и Haemophilus (семейство Pasteurellaceae) было результатом более редкого выявления ДНК данных таксонов в образцах от детей Группы 2. Подобное может быть следствием меньшего разнообразия кишечного микробиома, характерного для детей с ожирением [14]. При этом у детей Группы 2 чаще выделялась ДНК Catenibacterium (семейство Erysipelotrichaceae) из образцов кала. У детей с ожирением также была повышена доля, приходящаяся на семейство Clostridiaceae и его род Clostridium. Было показано, что Clostridium позитивно взаимосвязано с высокими уровнями липидов сыворотки, мочевой кислоты, артериального давления, объемом талии и индексом массы тела у взрослых [15]. Следует отметить, что в исследование были включены только здоровые дети без признаков метаболических нарушений. Возможно, выявленное у детей повышение Clostridium является одним из первых “маркеров” перерождения микробной флоры, характерное для метаболических нарушений [16].
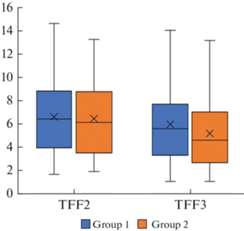
Анализ содержания трефоиловых факторов у детей и подростков исследуемых групп показал, что ожирение у них не сопровождается изменением сывороточного TFF2, однако у таких пациентов присутствовала тенденция к снижению TTF3 в сыворотке крови (p = 0.10) (рис. 2).
Известно, что TFF2 синтезируется слизистой оболочкой желудка и 12-перстной кишки [17]. Он стабилизирует муциновый слой, вступая во взаимодействие с муцином Muc6 и повышая его вязкость, тем самым обеспечивая эффективную защиту от соляной кислоты желудочного сока [17, 18]. TFF3 синтезируется преимущественно бокаловидными клетками толстого кишечника, но также и слизистой бронхов и урогенитального тракта, слюнными, поджелудочной и щитовидной железами, макрофагами и лимфоидной тканью. Он взаимодействует с иммуноглобулин-G-связывающим белком (IgG-Fc-binding protein, FCGBP), и комплекс TFF3–FCGBP принимает участие в мукозальном иммунном барьере, обеспечивая связывание и клиренс различных микроорганизмов [19]. Оба пептида способны связываться с хеморецепторами CXCR4 и CXCR7, активируя хемотаксис, играют роль в регуляции пролиферации и апоптоза клеток, реституции слизистых оболочек, в ангиогенезе и являются частью хронического воспалительного ответа [5].
Отмеченная нами тенденция к снижению уровня TFF3 в сыворотке крови на первый взгляд не согласуется с результатами исследований, демонстрирующими повышение TFF3 при метаболическом синдроме, сахарном диабете II типа и его осложнениях [20]. Кроме того, было показано, что инсулин и глюкоза усиливают экспрессию TFF3 [21]. Учитывая, что у обследуемых нами детей с ожирением отсутствовали гипергликемия, метаболический синдром, почечные и печеночные нарушения, становится понятным отсутствие повышения концентрации TFF3 в сыворотке.
De Giorgio и соавт. показали, что у мышей, нокаутированных по гену tff2, отмечается более низкий уровень лептина в сыворотке и повышенная транскрипция Агути-подобного белка в гипоталамусе [22]. Эти животные характеризовались повышенными аппетитом, расходом энергии и фекальной экскрецией триглицеридов, локомоторной активностью, были устойчивы к индуцированному диетой ожирению, что проявлялось меньшей прибавкой в массе тела и сниженным отложением жира [22]. Напротив, животные, нокаутированные по гену tff3 характеризуются повышенной чувствительностью к развитию колита и определенным двигательным дефицитом. Если предположить, что сниженный уровень TFF3 в сыворотке крови у детей и подростков с ожирением является результатом низкой конститутивной экспрессии гена tff3 у этих детей, то данный факт можно расценивать как элемент их наследственной предрасположенности к ожирению.
Несмотря на схожее содержание трефоиловых факторов у детей в обеих группах, у детей с ожирением наблюдались изменения во взаимоотношениях “TFFs–таксоны кишечной микробиоты” (табл. 3). У здоровых детей отсутствовали значимые ассоциации “TFF2–кишечная микробиота”, тогда как при ожирении у детей была отмечена негативная корреляция с долей, приходящейся на семейство Cerasicoccaceae.
Таблица 3.
Корреляционные взаимосвязи между содержанием трефоиловых факторов в сыворотке и отдельными семействами и родами кишечной микробиоты
| Группа 1 | Группа 2 | |
|---|---|---|
| TFF2 | Не выявлено значимых корреляций (rs ≥ 0.3, p ≤ 0.05) | Cerasicoccaceae (rs = –0.466, p = 0.038, n = 20) |
| TFF3 | Clostridiaceae (rs = –0.326, p = 0.002, n = 92) Cerasicoccaceae (rs = –0.426, p = 0.034, n = 25) Christensenella (rs = –0.459, p = 0.032, n = 22) |
Coprobacillus (rs = 0.521, p = 0.027, n = 18) Slackia (rs = 0.442, p = 0.027, n = 25) |
Интересно также, что выявленные у здоровых детей и подростков взаимосвязи таксонов кишечного микробиома с TFF3 носили негативный характер. При ожирении, напротив, все выявленные корреляции между TFF3 и кишечным микробиомом носили позитивный характер. С чем связано изменение знака во взаимоотношении “TFF3–кишечный микробиом” у Группы 2 неясно, но, возможно, это отражает негативные изменения в мукозальном барьере у детей с ожирением [23]. Негативная ассоциация Christensenella с уровнем TFF3 согласуется с данными Hiippala и соавт., показавшими, что содержание TFF3 в кале отрицательно коррелирует с представленностью Christensenellaceae [24].
Была проанализирована взаимосвязь типа вскармливания и таксономического состава кишечного микробиома у обследуемых групп. Примечательно, что характер вскармливания в грудном возрасте оказал пролонгированный эффект на микробиоту кишечника (на уровне родов и семейств) детей и подростков с нормальной массой тела и с ожирением. У здоровых детей из Группы 1 вид вскармливания в грудном возрасте, не затронув основные доминантные семейства и роды, оказал влияние на содержание минорных таксономических групп (табл. 4). Достаточно неожиданным фактом является значительное число различий между искусственным и смешанным вскармливанием, а естественный тип вскармливания занимал в большинстве случаев “промежуточное” положение между смешанным и искусственным.
Таблица 4.
Выявленные различия в содержании отдельных таксонов у детей Группы 1 в зависимости от типа вскармливания в первый год жизни
| Таксоны | Естественное вскармливание (n = 19) | Смешанное вскармливание (n = 40) | Искусственное вскармливание (n = 34) | H1 | |||
|---|---|---|---|---|---|---|---|
| Семейства | % | Доля (×103) | % | Доля (×103) | % | Доля (×103) | |
| Christensenellaceae | 78.9 | 0.64 [0.09; 1.95] | 82.5 | 0.94* [0.11; 4.20] | 67.6 | 0.21* [0.00; 1.87] | 6.03 |
| Methanobacteriaceae | 36.8 | 0.00 [0.00; 0.14] | 47.5 | 0.00* [0.00; 1.34] | 14.7 | 0.00* [0.00; 0.00] | 7.40 |
| Pasteurellaceae | 63.2 | 0.07 [0.00; 1.33] | 52.5 | 0.07* [0.00; 0.22] | 57.9 | 0.35* [0.07; 0.74] | 11.75 |
| Verrucomicrobiaceae | 57.9 | 0.42 [0.00; 2.04] | 60.0 | 0.93* [0.00; 10.70] | 38.2 | 0.00* [0.00; 0.29] | 6.14 |
| Роды | % | Доля (×103) | % | Доля (×103) | % | Доля (×103) | |
| Butyricimonas | 94.7 | 2.43 [0.98; 4.77] | 97.5 | 2.73 [1.50; 4.55] | 79.4 | 1.48† [0.29; 2.42] | 11.73 |
| Methanobrevibacter | 36.8 | 0.00 [0.00; 0.14] | 45.0 | 0.00 [0.00; 1.28] | 8.8 | 0.00† [0.00; 0.00] | 8.24 |
| Veillonella | 73.7 | 0.07 [0.02; 0.34] | 40.0 | 0.00† [0.00; 0.21] | 73.5 | 0.14 [0.00; 0.63] | 8.54 |
| [Eubacterium] | 68.4 | 0.14† [0.00; 0.37] | 72.5 | 0.32 [0.00; 8.15] | 82.4 | 0.63 [0.14; 4.90] | 6.22 |
| Haemophilus | 63.5 | 0.07 [0.00; 1.30] | 52.5 | 0.07* [0.00; 0.22] | 85.3 | 0.34* [0.07; 0.66] | 10.19 |
| Akkermansia | 57.9 | 0.42 [0.00; 2.04] | 60.0 | 0.93* [0.00; 10.70] | 38.2 | 0.00* [0.00; 0.29] | 6.14 |
Примечание. % – частота выделения ДНК таксона из образцов; 1 – H-критерий Краскела–Уоллиса; * – различия в доле данного таксона, обнаружены между отмеченными типами вскармливания (р ≤ 0.05); † – доля таксона при отмеченном типе вскармливания отличается его долей при двух других типах вскармливания (р ≤ 0.05).
Группа детей с естественным вскармливанием отличалась от остальных групп только значимо меньшим содержанием [Eubacterium], принадлежащего к семейству Erysipelotrichaceae. Было показано, что высокие уровни Erysipelotrichaceae характерны для лиц с ожирением и ассоциированы с дислипидемией [25]. Кроме того, [Eubacterium] biforme отрицательно коррелирует с уровнем физической активности у здоровых взрослых [26]. Таким образом, меньшее содержание [Eubacterium] можно рассматривать как потенциально благоприятный фактор, снижающий риск развития ожирения у детей после естественного вскармливания.
У детей и подростков без ожирения, находившихся на первом году жизни на смешанном типе вскармливания, наблюдалось критическое снижение Veillonella в кишечном микробиоме. Значение этого явления однозначно трактовать не представляется возможным, так как, с одной стороны, была показана высокая представленность этого рода у взрослых с ожирением [26], а с другой – его увеличение после длительной физической нагрузки и положительная ассоциация с выносливостью спортсмена [27].
Искусственный тип вскармливания приводил к меньшей “заселяемости” желудочно-кишечного тракта представителями Butyricimonas и практически полному отсутствию Methanobacteriaceae (Methanobrevibacter). Содержание Butyricimonas также может оказывать влияние на метаболический профиль, поскольку Lee и соавт. показали, что пребиотическое применение B. virosa способствует снижению массы тела, уровня глюкозы и резистентности к инсулину [28]. При этом уменьшение представителей домена Archaea – Methanobacteriaceae (Methanobrevibacter) после искусственного вскармливания может играть протективную роль в развитии ожирения, так как было показано, что метан-продуцирующие археи способствуют ожирению у мышей [29].
Также у детей после искусственного вскармливания наблюдалось большое содержание Pasteurellaceae (Haemophilus) по сравнению с детьми, имеющими смешанный тип вскармливания в анамнезе. Было показано, что обилие Haemophilus в кишечнике детей негативно коррелирует с уровнем инсулина и индексом инсулинорезистентности HOMA-IR у детей с тяжелым ожирением [30]. Таким образом, бо́льшее обилие Haemophilus и меньшее – Methanobacteriaceae (Methanobrevibacter) как результат искусственного вскармливания может рассматриваться в качестве факторов, потенциально снижающих риск развития ожирения у таких детей.
У здоровых детей и подростков, находившихся на первом году жизни на искусственном типе вскармливания, наблюдалось снижение Christensenellaceae, Verrucomicrobiaceae (Akkermansia) и Butyricimonas в сравнении с группой смешанного вскармливания, что потенциально можно рассматривать как факторы, повышающие риск развития ожирения. Было показано, что обилие Christensenellaceae в кишечнике положительно взаимосвязано с меньшим объемом висцеральной жировой ткани, благоприятным метаболическим профилем и обратно пропорционально индексу массы тела [31, 32]. Представитель рода Akkermansia – A. muciniphila на сегодняшний день признается одним из основных таксонов кишечной флоры, участвующим в регуляции углеводного и липидного обменов, иммунного ответа, чье содержание негативно ассоциировано с индексом массы тела [33]. Выявленные изменения могут обусловить большую подверженность детей после искусственного вскармливания к развитию ожирения и метаболических нарушений [34].
У детей и подростков с ожирением влияние типа вскармливания в грудном возрасте также оказывало влияние на таксономический состав микробиома (табл. 5). Однако количество таксонов, которые различались у детей Группы 2 в зависимости от типа вскармливания, было меньше, чем в Группе 1. Такое различие понятно, так как у таких детей присутствует более “свежий” и актуальный фактор, влияющий на кишечный микробиом, – ожирение.
Таблица 5.
Выявленные различия в долях отдельных таксонов у Группы 2 в зависимости от типа вскармливания в первый год жизни
| Таксоны | Естественное вскармливание (n = 28) | Смешанное вскармливание (n = 51) | Искусственное вскармливание (n = 13) | H1 | |||
|---|---|---|---|---|---|---|---|
| Семейства | % | Доля (×103) | % | Доля (×103) | % | Доля (×103) | |
| Turicibacteraceae | 53.6 | 0.07 [0.00; 0.27] | 78.4 | 0.22† [0.07; 1.02] | 38.5 | 0.00 [0.00; 0.91] | 6.72 |
| Christensenellaceae | 67.9 | 0.21† [0.00; 1.64] | 74.5 | 1.29 [0.02; 3.69] | 92.3 | 1.34 [0.14; 4.25] | 6.33 |
| Alcaligenaceae | 100 | 8.80† [4.08; 14.20] | 96.1 | 3.78 [2.19; 7.46] | 100 | 2.89 [1.82; 8.74] | 9.13 |
| Роды | % | Доля (×103) | % | Доля (×103) | % | Доля (×103) | |
| Turicibacter | 53.6 | 0.07 [0.00; 0.27] | 78.4 | 0.22† [0.07; 1.02] | 38.5 | 0.00 [0.00; 0.91] | 6.72 |
| Anaerotruncus | 25.0 | 0.00† [0.00; 0.04] | 47.1 | 0.00 [0.00; 0.14] | 53.9 | 0.07 [0.00; 0.16] | 4.80 |
| Sutterella | 100 | 8.43† [3.97; 13.70] | 94.1 | 3.51 [2.01; 7.24] | 100 | 2.82 [1.82; 8.74] | 9.29 |
В настоящее время активно обсуждается возможное влияние грудного вскармливания на развитие ожирения у детей, и есть основания полагать, что такой тип вскармливания (при условии отсутствия избытка белка в грудном молоке) представляет собой фактор, потенциально способный снижать риск развития ожирения у детей [35].
У детей с ожирением, которые находились в первый год жизни на естественном вскармливании, было отмечено снижение Christensenellaceae и Anaerotruncus и, напротив, увеличение Alcaligenaceae (Sutterella). Учитывая, что обилие кишечных Christensenellaceae взаимосвязано с меньшим объемом висцеральной жировой ткани и более низкими значениями индекса массы тела [31, 32], их недостаточное содержание в кишечнике после естественного вскармливания можно рассматривать как фактор риска развития ожирения у детей и подростков. Недавно было показано, что содержание Anaerotruncus в кишечнике обратно пропорционально индексу массы тела [36]. Полученные нами данные показывают, что недостаточная обсемененность кишечника представителями данного таксона после грудного вскармливания может рассматриваться как фактор риска развития ожирения в детском и подростковом возрасте.
Интересным также выглядит в 2.5 раза большая представленность представителей рода Sutterella семейства Alcaligenaceae у детей с ожирением, которые в младенчестве находились на естественном вскармливании. Было показано, что Sutterella обладает легкой провоспалительной активностью в желудочно-кишечном тракте [37], с другой стороны, ряд работ демонстрируют положительное влияние этого таксона на метаболизм глюкозы [38].
Особенностью детей с ожирением после смешанного вскармливания в грудном возрасте было больше содержание семейства Turicibacteraceae и его рода Turicibacter. Обращает внимание, что его частота выявления из образцов кала детей после смешанного вскармливания была в 1.5 раза выше, чем после естественного вскармливания, и почти в 2 раза выше, чем после искусственного. Создается впечатление, что дополнительные питательные компоненты при смешанном вскармливании и последующее избыточное потребление калорий, приведшее к развитию ожирения, способствовали закреплению Turicibacter в кишечном микробиоме.
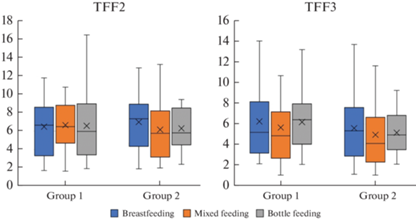
Тип вскармливания не оказал статистически значимого влияния на уровень трефоиловых пептидов в сыворотке крови ни у здоровых детей и подростков, ни у детей с ожирением (рис. 3).
Рис. 3.
Содержание трефоиловых факторов в сыворотке у исследуемых групп при различных типах вскармливания в первый год жизни, нг/мл.
Однако изменился спектр корреляций уровня трефоиловых пептидов с содержанием в микробиоме отдельных семейств и родов (табл. 6).
Таблица 6.
Выявленные корреляционные взаимосвязи между содержанием трефоиловых факторов в сыворотке и отдельными семействами и родами кишечной микробиоты у исследуемых групп при различных типах вскармливания
| Группа 1 | Группа 2 | |
|---|---|---|
| Естественное вскармливание | ||
| n = 19 | n = 28 | |
| TFF2 | Не выявлено значимых корреляций (rs ≥ 0.3 при p ≤ 0.05) | Mogibacteriaceae (rs = –0.471, p = 0.027, n = 22) Prevotellaceae (rs = –0.402, p = 0.047, n = 25) Prevotella (rs = –0.402, p = 0.047, n = 25) Bifidobacteriaceae (rs = 0.370. p = 0.053, n = 28) Bifidobacterium (rs = 0.370. p = 0.053, n = 28) Clostridium (rs = 0.578, p = 0.002, n = 27) |
| TFF3 | Не выявлено значимых корреляций (rs ≥ 0.3 при p ≤ 0.05) | Oxalobacter (rs = –0.857, p = 0.014, n = 7) |
| Смешанное вскармливание | ||
| n = 40 | n = 51 | |
| TFF2 | S24-7 (rs = 0.406, p = 0.055, n = 23) Odoribacter (rs = –0.361, p = 0.026, n = 38) |
Не выявлено значимых корреляций (rs ≥ 0.3 при p ≤ 0.05) |
| TFF3 | Barnesiellaceae (rs = –0.456, p = 0.004, n = 39) Clostridiaceae (rs = –0.407, p = 0.009, n = 40) SMB53 (rs = –0.394, p = 0.038, n = 28) Odoribacteraceae (rs = –0.343, p = 0.031, n = 40) Victivallaceae (rs = –0.457, p = 0.057, n = 18) Pasteurellaceae (rs = 0.491, p = 0.024, n = 21) S24-7 (rs = 0.401, p = 0.058, n = 23) Haemophilus (rs = 0.491, p = 0.024, n = 21) |
Rikenellaceae (rs = 0.324, p = 0.020, n = 51) Streptococcaceae (rs = 0.320, p = 0.025, n = 49) Streptococcus (rs = 0.322, p = 0.0242, n = 49) Slackia (rs = 0.662, p = 0.010, n = 14) Coprobacillus (rs=0.700, p = 0.017, n = 11) |
| Искусственное вскармливание | ||
| n = 34 | n = 13 | |
| TFF2 | Coprobacillus (rs = 0.661, p = 0.038, n = 10) | Anaerotruncus (rs = 0.750, p = 0.052, n = 7) |
| TFF3 | Clostridiaceae (rs = –0.353, p = 0.044, n = 33) Turicibacteraceae (rs = –0.395, p = 0.051, n = 25) Turicibacter (rs = –0.395, p = 0.051, n = 25) |
Lachnospira (rs = 0.629, p = 0.028, n = 12) |
У детей без ожирения после естественного вскармливания отсутствовали взаимосвязи “кишечный микробиом–TFF”, что может указывать на сформировавшуюся толерантность мукозального барьера желудочно-кишечного тракта к микробной флоре. Вероятно, поступающие с грудным молоком многочисленные противовоспалительные пептиды [39] предотвращают иммунный ответ на микробную контаминацию и формируют толерантность кишечной стенки как в верхних, так и нижних отделах желудочно-кишечного тракта.
При этом у детей и подростков без ожирения со смешанным и искусственным вскармливанием в анамнезе появляются единичные ассоциации “TFF2–таксоны кишечного микробиома”, что может указывать на определенное снижение толерантности мукозального иммунитета к отдельным представителям микробного сообщества. Интересно, что у детей Группы 1, в анамнезе которых был смешанный тип вскармливания, присутствовала негативная взаимосвязь TFF2 и Odoribacter. Учитывая, что синтез TFF2 стимулируется провоспалительными цитокинами, появление подобной взаимосвязи может быть следствием противовоспалительного действия Odoribacter splanchnicus на кишечную стенку [40–42]. Также у детей после смешанного вскармливания наблюдалась положительная корреляция с обилием S24-7 (Muribaculaceae). Представители данного семейства являются основными потребителями муцинов [43], что может объяснить появление позитивной ассоциации с TFF2 – стабилизатором муцинового слоя.
Также смешанный и искусственный типы вскармливания, по-видимому, не приводят к формированию полной толерантности в нижних отделах желудочно-кишечного тракта и связаны с появлением взаимосвязи “TFF3–кишечный микробиом”. Следует отметить, что в основном такие связи носили негативный характер, это указывает на протективное действие кишечной флоры на мукозальный барьер.
Обращает на себя внимание, что у детей и подростков с ожирением с естественным типом вскармливания в анамнезе, напротив, наблюдались многочисленные корреляции TFF2 с таксонами кишечной флоры, носящие как положительный, так и отрицательный характер.
С одной стороны, возможно предполагать, что у этих детей изначально после естественного вскармливания сформировались физиологические толерантные взаимоотношения между микрофлорой верхних отделов желудочно-кишечного тракта и мукозальной системой желудка и тонкой кишки. Однако в процессе развития ожирения избыток высококалорийной пищи вызвал синдром избыточного бактериального роста, развивающийся у 72.4% детей с ожирением [44], и тонкий кишечник контаминировала флора, к которой в процессе грудного вскармливания толерантность не была сформирована.
Возможен второй сценарий, при котором в силу различных причин естественное вскармливание не привело к формированию толерантности. К таким причинам могут относиться перенесенные кишечные инфекции, особенности пищевого поведения матери и химического состава грудного молока – дефицит в нем фукоолигосахаридов, секреторных иммуноглобулинов или избыток белка, который не только способствует развитию ожирения [35], но и оказывает заметное влияние на микробиом кишечника [45].
У детей с ожирением, имеющих в анамнезе смешанный и искусственный типы вскармливания, выявленные взаимосвязи “TFF3–кишечный микробиом” носили позитивный характер. Подобные взаимоотношения могут свидетельствовать о потенциально неблагоприятном взаимодействии кишечной микрофлоры с мукозальным барьером толстой кишки.
ЗАКЛЮЧЕНИЕ
В целом, таксономический состав кишечной микробиоты детей и подростков с ожирением схож с детьми без ожирения. Однако для детей с ожирением характерна меньшая представленность таких минорных родов, как [Prevotella], Epulopiscium и Haemophilus и большая – Clostridium и Catenibacterium.
Нами не обнаружено изменений в содержании трефоиловых пептидов у детей и подростков с ожирением. Подобное наблюдение может указывать на то, что детское ожирение без метаболических нарушений не сопровождается нарушениями мукозальных барьеров желудочно-кишечного тракта.
Тип вскармливания не оказывал значимого влияния на содержание трефоиловых факторов у здоровых детей и подростков вне зависимости от наличия или отсутствия ожирения. Однако вид вскармливания оказывает пролонгированное влияние на кишечную микробиоту вплоть до подросткового возраста. У детей и подростков без ожирения с искусственным вскармливанием в анамнезе специфические изменения таксономического состава микрофлоры кишечника потенциально способны повышать риск развития ожирения. При этом у детей и подростков с ожирением тип вскармливания продемонстрировал меньшее влияние на кишечный микробиом, по-видимому, вследствие наличия у них более актуального влияющего фактора – ожирения.
Естественный тип вскармливания у детей с нормальной массой тела приводил к формированию полной толерантности мукозального барьера к микробной флоре, на что указывает отсутствие ассоциаций “кишечный микробиом–трефоиловые пептиды”. При этом для детей, имеющих смешанный или искусственный типы вскармливания в анамнезе, подобные взаимосвязи были характерны. У детей без ожирения отсутствие связи “кишечный микробиом–трефоиловые пептиды”, очевидно, указывает на протективное действие кишечной флоры в отношении мукозального барьера. На фоне ожирения у детей большая часть выявленных корреляционных связей “TFF–кишечный микробиом”, напротив, носила положительный характер, что свидетельствует о неблагоприятном взаимодействии кишечной стенки и бактериальной флоры.
Таким образом, тип вскармливания представляется слабым, но значимым фактором формирования кишечного микробиома у детей и подростков, который также оказывает влияние на становление толерантности мукозального барьера к кишечной флоре.
Список литературы
Lobstein T, Jackson-Leach R, Moodie ML, Hall KD, Gortmaker SL, Swinburn BA, James WPT, Wang Y, McPherson K (2015) Child and adolescent obesity: part of a bigger picture. Lancet (London, England) 385: 2510–2520. https://doi.org/10.1016/S0140-6736(14)61746-3
Singer-Englar T, Barlow G, Mathur R (2019) Obesity, diabetes, and the gut microbiome: an updated review. Expert Rev Gastroenterol Hepatol 13: 3–15. https://doi.org/10.1080/17474124.2019.1543023
Clarke G, Stilling RM, Kennedy PJ, Stanton C, Cryan JF, Dinan TG (2014) Minireview: Gut microbiota: the neglected endocrine organ. Mol Endocrinol 28: 1221–1238. https://doi.org/10.1210/me.2014-1108
Шестопалов АВ, Шатова ОП, Комарова ЕФ, Румянцев СА (2020) Особенности метаболического сопряжения в системе “СУПЕРОРГАНИЗМА” (хозяин–микробиота). Крымск журн экспер клин мед 10: 95–103. [Shestopalov AV, Shatova OP, Komarova EF, Rumyantsev SA (2020) Features of metabolic coupling in the “SUPERORGANISM” system (host–microbiota) Krymsk J Exper Klin Med 10: 95–103. (In Russ)]. https://doi.org/10.37279/2224-6444-2020-10-2-95-103
Шестопалов АВ, Дворников АС, Борисенко ОВ, Тутельян АВ (2019) Трефоиловые факторы – новые маркеры мукозального барьера желудочно-кишечного тракта. Инфекция и иммунитет 9: 39–46. [Shestopalov AV, Dvornikov AS, Borisenko OV, Tutelyan AV (2019) Trefoil factors – new markers of gastrointestinal mucosal barrier. Infekciya i immunitet 9: 39–46. (In Russ)]. https://doi.org/10.15789/2220-7619-2019-1-39-46
Шестопалов АВ, Трофименко ОВ, Шестопалова МА (2012) Уровень трефоиловых пептидов (TFF-1 и TFF-2) у детей с хроническими гастродуоденитами. Фундамент исследов 10: 363–366. [Shestopalov AV, Trofimenko OV, Shestopalova MA (2012) Level trefoil peptides (TFF-1 and TFF-2) in children with chronic gastroduodenitis. Fundament Issledovan 10: 363–366. (In Russ)].
Шестопалов АВ, Мирошниченко ЮА, Рымашевский АН (2013) Содержание муцинов (MUC 5 AC, MUC 6) и трефоилового пептида-3 (TFF-3) в эндометрии и цервико-вагинальном секрете у женщин с физиологической беременностью. Фундамент исследов 12: 104–106. [Shestopalov AV, Miroshnichenko YA, Rymashevskiy AN (2013) The concentration of mucin (MUC 5 ac, MUC 6) and trefoil peptide-3 (TFF-3) in the endometrium and cervico-vaginal secretions of women with physiological pregnancy. Fundament Issledovan 12: 104–106. (In Russ)].
Шестопалов АВ, Румянцев СА, Шестопалова МА, Сапрыкина ЕА, Шумилов ПВ (2014) Влияние H. pylori на уровень трефоиловых факторов и адипокинов у детей с гастродуоденитами. Педиатрия. Журн им ГН Сперанского 93: 6–10. [Shestopalov AV, Rumyantsev SA, Shestopalova MA, Saprykina EA, Shumilov PV (2014) Effect of H. pylori on the level of trefoil factors and adipokines in children with gastroduodenitis. Pediatriya. Zhurn im GN Speranskogo 93: 6–10. (In Russ)].
Ford SL, Lohmann P, Preidis GA, Gordon PS, O’Donnell A, Hagan J, Venkatachalam A, Balderas M, Luna RA, Hair AB (2019) Improved feeding tolerance and growth are linked to increased gut microbial community diversity in very-low-birth-weight infants fed mother’s own milk compared with donor breast milk. Am J Clin Nutr 109: 1088–1097. https://doi.org/10.1093/ajcn/nqz006
Le Doare K, Holder B, Bassett A, Pannaraj PS (2018) Mother’s Milk: A Purposeful Contribution to the Development of the Infant Microbiota and Immunity. Front Immunol 9: 361. https://doi.org/10.3389/fimmu.2018.00361
Donald K, Petersen C, Turvey SE, Finlay BB, Azad MB (2022) Secretory IgA: Linking microbes, maternal health, and infant health through human milk. Cell Host Microbe 30: 650–659. https://doi.org/10.1016/j.chom.2022.02.005
Eshriqui I, Viljakainen HT, Ferreira SRG, Raju SC, Weiderpass E, Figueiredo RAO (2020) Breastfeeding may have a long-term effect on oral microbiota: results from the Fin-HIT cohort. Int Breastfeed J 15: 42. https://doi.org/10.1186/s13006-020-00285-w
Peterkova VA, Bezlepkina OB, Bolotova NV, Bogova EA, Vasyukova OV, Girsh YV, Kiyaev AV, Kostrova IB, Malievskiy OA, Mikhailova EG, Okorokov PL, Petryaykina EE, Taranushenko TE, Khramova EB (2021) Clinical guidelines “Obesity in children”. Probl Endocrinol 67: 67–83. https://doi.org/https://doi.org/10.14341/probl12802
Chen X, Sun H, Jiang F, Shen Y, Li X, Hu X, Shen X, Wei P (2020) Alteration of the gut microbiota associated with childhood obesity by 16S rRNA gene sequencing. Peer J 8: e8317. https://doi.org/10.7717/peerj.8317
Zeng Q, Li D, He Y, Li Y, Yang Z, Zhao X, Liu Y, Wang Y, Sun J, Feng X, Wang F, Chen J, Zheng Y, Yang Y, Sun X, Xu X, Wang D, Kenney T, Jiang Y, Gu H, Li Y, Zhou K, Li S, Dai W (2019) Discrepant gut microbiota markers for the classification of obesity-related metabolic abnormalities. Sci Rep 9: 13424. https://doi.org/10.1038/s41598-019-49462-w
Гапонов АМ, Волкова НИ, Ганенко ЛА, Набока ЮЛ, Маркелова МИ, Синягина МН, Харченко АМ, Хуснутдинова ДР, Румянцев СА, Тутельян АВ, Макаров ВВ, Юдин СМ, Шестопалов АВ (2021) Особенности микробиома толстой кишки у пациентов с ожирением при его различных фенотипах (оригинальная статья). Журн микробиол, эпидемиол и иммунобиол 98: 44–155. [Gaponov AM, Volkova NI, Ganenko LA, Naboka YL, Markelova MI, Sinyagina MN, Kharchenko AM, Khusnutdinova DR, Rumyantsev SA, Tutelyan AV, Makarov VV, Yudin SM, Shestopalov AV (2021) Features of the colon microbiome in obese patients with its various phenotypes (original article). Zhurn microbiol, epidemiol and immunobiol 98: 44–155. https://doi.org/10.36233/0372-9311-66
Heuer F, Stürmer R, Heuer J, Kalinski T, Lemke A, Meyer F, Hoffmann W (2019) Different Forms of TFF2, A Lectin of the Human Gastric Mucus Barrier: In Vitro Binding Studies. Int J Mol Sci 20(23): 5871. https://doi.org/10.3390/ijms20235871
Hoffmann W (2015) TFF2, a MUC6-binding lectin stabilizing the gastric mucus barrier and more (Review). Int J Oncol 47: 806–816. https://doi.org/10.3892/ijo.2015.3090
Hoffmann W (2020) Trefoil Factor Family (TFF) Peptides and Their Diverse Molecular Functions in Mucus Barrier Protection and More: Changing the Paradigm. Int J Mol Sci 21(12): 4535. https://doi.org/10.3390/ijms21124535
Yang Y, Lin Z, Lin Q, Bei W, Guo J (2022) Pathological and therapeutic roles of bioactive peptide trefoil factor 3 in diverse diseases: recent progress and perspective. Cell Death Dis 13: 62. https://doi.org/10.1038/s41419-022-04504-6
Roa JB, Tortolero GS, Gonzalez E (2013) Trefoil factor 3 (TFF3) expression is regulated by insulin and glucose. J Heal Sci 3: 1–12. https://doi.org/10.17532/jhsci.2013.26
De Giorgio MR, Yoshioka M, Riedl I, Moreault O, Cherizol R-G, Shah AA, Blin N, Richard D, St-Amand J (2013) Trefoil factor family member 2 (Tff2) KO mice are protected from high-fat diet-induced obesity. Obesity (Silver Spring) 21: 1389–1395. https://doi.org/10.1002/oby.20165
Paone P, Cani PD (2020) Mucus barrier, mucins and gut microbiota: the expected slimy partners? Gut 69: 2232–2243. https://doi.org/10.1136/gutjnl-2020-322260
Heitkemper MM, Cain KC, Shulman RJ, Burr RL, Ko C, Hollister EB, Callen N, Zia J, Han CJ, Jarrett ME (2018) Stool and urine trefoil factor 3 levels: associations with symptoms, intestinal permeability, and microbial diversity in irritable bowel syndrome. Benef Microbes 9: 345–355. https://doi.org/10.3920/BM2017.0059
Kaakoush NO (2015) Insights into the Role of Erysipelotrichaceae in the Human Host. Front Cell Infect Microbiol 5: 84. https://doi.org/10.3389/fcimb.2015.00084
Palmas V, Pisanu S, Madau V, Casula E, Deledda A, Cusano R, Uva P, Vascellari S, Loviselli A, Manzin A, Velluzzi F (2021) Gut microbiota markers associated with obesity and overweight in Italian adults. Sci Rep 11: 5532. https://doi.org/10.1038/s41598-021-84928-w
Scheiman J, Luber JM, Chavkin TA, MacDonald T, Tung A, Pham L-D, Wibowo MC, Wurth RC, Punthambaker S, Tierney BT, Yang Z, Hattab MW, Avila-Pacheco J, Clish CB, Lessard S, Church GM, Kostic AD (2019) Meta-omics analysis of elite athletes identifies a performance-enhancing microbe that functions via lactate metabolism. Nat Med 25: 1104–1109. https://doi.org/10.1038/s41591-019-0485-4
Lee H, An J, Kim J, Choi D, Song Y, Lee C-K, Kong H, Kim SB, Kim K (2022) A Novel Bacterium, Butyricimonas virosa, Preventing HFD-Induced Diabetes and Metabolic Disorders in Mice via GLP-1 Receptor. Front Microbiol 13: 858192. https://doi.org/10.3389/fmicb.2022.858192
Conway de Macario E, Macario AJL (2009) Methanogenic archaea in health and disease: a novel paradigm of microbial pathogenesis. Int J Med Microbiol 299: 99–108. https://doi.org/10.1016/j.ijmm.2008.06.011
Yuan X, Zhang Y, Lin X, Yang X, Chen R (2023) Association of gut microbiota and glucose metabolism in children with disparate degrees of adiposity. Pediatr Obes 18(4): e13009. https://doi.org/10.1111/ijpo.13009
Waters JL, Ley RE (2019) The human gut bacteria Christensenellaceae are widespread, heritable, and associated with health. BMC Biol 17: 83. https://doi.org/10.1186/s12915-019-0699-4
Tavella T, Rampelli S, Guidarelli G, Bazzocchi A, Gasperini C, Pujos-Guillot E, Comte B, Barone M, Biagi E, Candela M, Nicoletti C, Kadi F, Battista G, Salvioli S, O’Toole PW, Franceschi C, Brigidi P, Turroni S, Santoro A (2021) Elevated gut microbiome abundance of Christensenellaceae, Porphyromonadaceae and Rikenellaceae is associated with reduced visceral adipose tissue and healthier metabolic profile in Italian elderly. Gut Microbes 13: 1–19. https://doi.org/10.1080/19490976.2021.1880221
Xu Y, Wang N, Tan HY, Li S, Zhang C, Feng Y (2020) Function of Akkermansia muciniphila in Obesity: Interactions With Lipid Metabolism, Immune Response and Gut Systems. Front Microbiol 11: 1–12. https://doi.org/10.3389/fmicb.2020.00219
Yan J, Liu L, Zhu Y, Huang G, Wang PP (2014) The association between breastfeeding and childhood obesity: a meta-analysis. BMC Public Health 14: 1267. https://doi.org/10.1186/1471-2458-14-1267
Verduci E, Giannì ML, Vizzari G, Vizzuso S, Cerasani J, Mosca F, Zuccotti GV (2021) The Triad Mother-Breast Milk-Infant as Predictor of Future Health: A Narrative Review. Nutrients 13(2): 486. https://doi.org/10.3390/nu13020486
Lv Y, Qin X, Jia H, Chen S, Sun W, Wang X (2019) The association between gut microbiota composition and BMI in Chinese male college students, as analysed by next-generation sequencing. Br J Nutr 122: 986–995. https://doi.org/10.1017/S0007114519001909
Hiippala K, Kainulainen V, Kalliomäki M, Arkkila P, Satokari R (2016) Mucosal Prevalence and Interactions with the Epithelium Indicate Commensalism of Sutterella spp. Front Microbiol 7: 1706. https://doi.org/10.3389/fmicb.2016.01706
Wang C, Zhang H, Liu H, Zhang H, Bao Y, Di J, Hu C (2020) The genus Sutterella is a potential contributor to glucose metabolism improvement after Roux-en-Y gastric bypass surgery in T2D. Diabetes Res Clin Pract 162: 108116. https://doi.org/10.1016/j.diabres.2020.108116
Chatterton DEW, Nguyen DN, Bering SB, Sangild PT (2013) Anti-inflammatory mechanisms of bioactive milk proteins in the intestine of newborns. Int J Biochem Cell Biol 45: 1730–1747. https://doi.org/10.1016/j.biocel.2013.04.028
Hiippala K, Barreto G, Burrello C, Diaz-Basabe A, Suutarinen M, Kainulainen V, Bowers JR, Lemmer D, Engelthaler DM, Eklund KK, Facciotti F, Satokari R (2020) Novel Odoribacter splanchnicus Strain and Its Outer Membrane Vesicles Exert Immunoregulatory Effects in vitro. Front Microbiol 11: 575455. https://doi.org/10.3389/fmicb.2020.575455
Hoffmann W (2021) Trefoil Factor Family (TFF) Peptides and Their Links to Inflammation: A Re-evaluation and New Medical Perspectives. Int J Mol Sci 22(9): 4909. https://doi.org/10.3390/ijms22094909
Lima SF, Gogokhia L, Viladomiu M, Chou L, Putzel G, Jin W-B, Pires S, Guo C-J, Gerardin Y, Crawford CV, Jacob V, Scherl E, Brown S-E, Hambor J, Longman RS (2022) Transferable Immunoglobulin A-Coated Odoribacter splanchnicus in Responders to Fecal Microbiota Transplantation for Ulcerative Colitis Limits Colonic Inflammation. Gastroenterology 162: 166–178. https://doi.org/10.1053/j.gastro.2021.09.061
Pereira FC, Wasmund K, Cobankovic I, Jehmlich N, Herbold CW, Lee KS, Sziranyi B, Vesely C, Decker T, Stocker R, Warth B, von Bergen M, Wagner M, Berry D (2020) Rational design of a microbial consortium of mucosal sugar utilizers reduces Clostridiodes difficile colonization. Nat Commun 11: 5104. https://doi.org/10.1038/s41467-020-18928-1
Налетов АВ, Пушкарук ВВ (2022) Состояние кишечной микробиоты у детей с ожирением. Child Med North-West 10: 70–74. [Nalyotov AV, Pushkaruk VV (2022) The state of the intestinal microbiota in obese children. Child Med North-West 10: 70–74. (In Russ)].
Dong TS, Luu K, Lagishetty V, Sedighian F, Woo S-L, Dreskin BW, Katzka W, Chang C, Zhou Y, Arias-Jayo N, Yang J, Ahdoot A, Li Z, Pisegna JR, Jacobs JP (2020) A High Protein Calorie Restriction Diet Alters the Gut Microbiome in Obesity. Nutrients 12(10): 3221. https://doi.org/10.3390/nu12103221
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова