Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 5, стр. 629-642
Восстановление функциональной активности КАТФ-каналов пиальных артерий после ишемии/реперфузии с помощью клеточной терапии
И. Б. Соколова 1, *, О. П. Горшкова 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: SokolovaIB@infran.ru
Поступила в редакцию 22.09.2022
После доработки 28.03.2023
Принята к публикации 28.03.2023
- EDN: XRSONB
- DOI: 10.31857/S0869813923050114
Аннотация
Цель работы – выяснить эффективность внутривенной трансплантации мезенхимных стволовых клеток человека (МСКч), проведенной на 7-е сут после ишемии/реперфузии (И/Р) головного мозга, для восстановления функциональной активности КАТФ-каналов церебральных артерий. С помощью установки для прижизненной визуализации пиальных сосудов исследовали реакцию артерий на воздействие блокатора КАТФ-каналов глибенкламида (GB), активатора этих же каналов пинацидила (PI), ацетилхолина (ACh), и AСh на фоне действия GB (ACh/GB) через 14 и 21 сут после И/Р головного мозга (12-минутная окклюзия обеих сонных артерий с управляемой гипотензией) и внутривенной трансплантации МСКч, проведенной на 7-е сут после ишемического воздействия. Установлено, что на 14-е сут после И/Р число сузившихся артерий на GB уменьшилось в 1.5–1.8 раза по сравнению с ложнооперированными крысами. К 21-м сут после И/Р констрикторная реакция полностью восстановилась кроме артерий диаметром более 40 мкм. В группе клеточной терапии констрикторная реакция на GB была полностью восстановлена до уровня ложнооперированных крыс у артерий диаметром менее 40 мкм уже к 14-м сут после И/Р; у более крупных сосудов не восстановилась до 21-х сут. Число дилатаций на ACh/GB по сравнению с чистым AСh у ложнооперированных крыс понижено в 1.6–1.8 раза на 14-е сут и в 1.6–6.6 раза на 21-е сут. У И/Р животных на 14-е сут число дилатаций на ACh/GB по сравнению с чистым AСh статистически значимо повышено у артерий диаметром более 20 мкм в 1.5–1.7 раза, а через 21 сут у артерий диаметром более 40 мкм в 1.2 раза. После введения МСКч GB блокировал AСh-опосредованную дилатацию у артерий диаметром менее 40 мкм и на 14-е, и на 21-е сут после И/Р. У сосудов диаметром более 40 мкм функциональная активность КАТФ-каналов не восстановилась до 21 сут. Делается заключение, что И/Р коры головного мозга крыс снижает вклад КАТФ-каналов в поддержание базального тонуса пиальных артерий и практически полностью выключает данные каналы из формирования AСh-опосредованной дилатации на протяжении 21 сут постишемического периода. Внутривенная трансплантация МСКч, проведенная на 7-е сут после И/Р, приводит к восстановлению участия КАТФ-каналов гладкомышечных клеток в поддержании базального тонуса и осуществлении AСh-опосредованной дилатации пиальных артерий диаметром менее 40 мкм уже через 14 сут после перенесенной И/Р.
ВВЕДЕНИЕ
Ишемия/реперфузия (И/Р) головного мозга приводит к развитию эндотелиальной дисфункции в церебральных артериях [1] и ухудшению эндотелий-зависимой вазодилатации [2]. Один из основных каскадов эндотелий-зависимой вазодилатации: NO (оксид азота) → cGMP (циклический гуанозин монофосфат) → протеинкиназа G (PKG). PKG активирует кальций-активируемые калиевые каналы и КАТФ-каналы, что приводит к гиперполяризации гладкомышечных клеток, их расслаблению и дилатации артерий [3]. Ухудшение способности церебральных артерий к расширению может быть вызвано повреждением КАТФ-каналов, экспрессируемых как в сосудистых эндотелиальных, так и гладкомышечных клетках [4, 5]. В последние годы КАТФ-каналы рассматриваются в качестве мишеней терапевтического воздействия, направленного на сохранение нейронов и кардиомиоцитов после И/Р [6, 7]. Восстановление функциональной активности КАТФ-каналов церебральных сосудов после ишемического повреждения с помощью клеточной терапии – мало разработанный, но очень перспективный метод. В многочисленных работах было доказано, что трансплантация мезенхимных стволовых клеток (МСК) подавляет тканевое воспаление [8, 9], окислительный стресс [10, 11] после И/Р головного мозга, активирует ангиогенез в ишемизированной ткани и оказывает протекторное воздействие на мозговые структуры [12, 13]. Применительно к практическому использованию клеточной терапии нужно разработать методики трансплантации, удаленные от события транзиторной ишемии или другого повреждения головного мозга, для того чтобы подготовить клеточный материал. Процедура разморозки МСК, помещенных заранее на хранение в криобанк, и наращивания определенной клеточной массы требует не менее 7 сут [14]. В литературе имеются данные о повышении проницаемости гематоэнцефалического барьера в течение первых 7 сут после И/Р [15], что в этот отрезок постишемического периода позволяет МСК после венозной трансплантации мигрировать в головной мозг [16].
Цель исследования – выяснить эффективность внутривенного введения мезенхимных стволовых клеток человека (МСКч), проведенного на 7-е сут после И/Р, для восстановления функциональной активности КАТФ-каналов церебральных артерий.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа проведена на животных из ЦКП “Биоколлекция Института физиологии им. И.П. Павлова РАН для исследования интегративных механизмов деятельности нервной и висцеральных систем” (Санкт-Петербург).
Животные. Эксперименты проведены на крысах-самцах Wistar (n = 68). Животных содержали в стандартных условиях вивария при естественном освещении и свободном доступе к воде и пище.
Ишемия/реперфузия. Для воспроизведения глобальной ишемии мозга использовали технику окклюзии двух сосудов с управляемой гипотензией, известную в англоязычной литературе как “2-vessel occlusion + hypotention model”, с авторскими модификациями [17]. У наркотизированных хлоралгидратом (внутрибрюшинно, 43 мг/100 г массы тела) крыс производили пережатие обеих сонных артерий на 12 мин с одновременной управляемой гипотензией (снижение и строгое поддержание артериального давления (АД) на уровне 45 ± 2 мм рт. ст. путем забора/реинфузии крови в гепаринизированный шприц). Прямое измерение среднего АД производили через катетер в бедренной артерии, соединенный с датчиком DTXPlusTM (Argon Critical Care Systems, Сингапур), подключенным к компьютеру, работающему с оригинальной программой визуализации значений АД, разработанной в нашей лаборатории. Расчет среднего АД в реальном времени производился программой по классической формуле:
По окончании периода ишемии производили полную реинфузию забранной крови. После ушивания операционных ран и выхода из наркоза (на подогреваемых столиках) животных возвращали в клетки обычного содержания.
МСК и их трансплантация. Для внутривенной трансплантации использовали МСК человека, полученные от одного донора. Выделение МСК из костного мозга, их культивирование и фенотипирование проводили в ООО “Транс-Технологии” по стандартным, общепринятым методикам с минимальными изменениями [18]. В частности, для культивирования МСКч использовали питательную среду α-МЕМ (Hyclone, Новая Зеландия), с добавлением 20% сыворотки крови эмбрионов коров (Gibco, США) и 100 мкг/мл пенициллина/стрептомицина (Gibco, США). Фенотипирование МСКч проводили методом проточной цитофлуориметрии на проточном цитофлуориметре FACSscan (Beckton Dickinson, США). МСКч окрашивали с помощью антител против позитивных маркеров CD90, CD105, CD44, CD73 и антител против негативных маркеров CD45, CD34, CD14, CD11b, HLA-DR и 7AAD (Beckton Dickinson, США). Для трансплантации использовали МСКч на 2–3 пассажах. Внутривенная трансплантация была проведена на 7-е сут после И/Р головного мозга. Каждому животному было введено 5 млн МСКч в 30 мкл культуральной среды.
Все последующие хирургические и экспериментальные действия были проведены на наркотизированных (золетил (20 мг/кг, внутрибрюшинно), Virbac, Франция) крысах; эвтаназия проведена путем введения увеличенной дозы золетила.
Группы животных представлены в табл. 1 . Группа 1: контрольная группа – ложнооперированные (ЛО) крысы Вистар, которые подвергались оперативному вмешательству, но без проведения И/Р. Исследования функциональной активности КАТФ-каналов пиальных артерий у данной и всех последующих групп на отдельных подгруппах животных (острые опыты) были проведены через 14 и 21 сут после хирургического воздействия. Группа 2: крысы Вистар, которым была проведена И/Р головного мозга. Группа 3: крысы Вистар, которым была проведена И/Р головного мозга и на 7-е сут внутривенно введены МСКч.
Таблица 1.
Группы экспериментальных животных
| Группа | Воздействие | 14-е сутки после И/Р | 21-е сутки после И/Р | ||
|---|---|---|---|---|---|
| масса (г) | АД (мм рт. ст.) | масса (г) | АД (мм рт. ст.) | ||
| 1 | Ложноопери-рованные крысы (n = 19) | 303 ± 13 | 133 ± 5 | 330 ± 12 | 135 ± 2 |
| 2 | Крысы после И/Р (n = 17) | 256 ± 5 | 133 ± 5 | 318 ± 4 | 124 ± 4 |
| 3 | Крысы после И/Р и трансплантации МСКч (n = 20) | 340 ± 4 | 128 ± 4 | 337 ± 8 | 132 ± 3 |
Визуализация и мониторинг микрососудистой сети. Для проведения прижизненного исследования реакций пиальных артерий в теменной области черепа животного высверливали отверстие (S ≈ 1 см2). Твердую мозговую оболочку в пределах отверстия удаляли, тем самым открывая поле для дальнейшего исследования. Поверхность мозга непрерывно орошали раствором Кребса (pH 7.4), температура которого составляла 37°C. На протяжении всего эксперимента контролировали среднее АД, показатели которого в течение всего эксперимента оставались примерно на одном уровне. Температуру тела животных в течение всего опыта поддерживали на уровне 38°C. Визуализацию пиальных артерий проводили с помощью оригинальной установки, включающей в себя стереоскопический микроскоп MC-2ZOOM (“Микромед”, Россия), цветную камеру – видеоокуляр для микроскопа DCM-510 (Scopetek, Китай) и персональный компьютер. На статических изображениях с помощью компьютерной программы для цитофотометрии “Photo M” (авторская разработка Черниговского, http://www.t_lambda.chat.ru) измеряли диаметры пиальных артериальных сосудов. В ходе эксперимента у каждого животного было исследовано от 40 до 120 пиальных артерий. Все исследованные пиальные артерии были разбиты на группы: более 40 мкм, 20–40 мкм, менее 20 мкм. Исследования реактивности сосудов были проведены через 14 и 21 сут после И/Р головного мозга. Диаметр артерий фиксировали в стандартных условиях при непрерывном орошении поверхности мозга раствором Кребса и при орошении мозга раствором ацетилхолина (AСh) (10–7 М, 8 мин) (Sigma-Aldrich, США), блокатором КАТФ-каналов раствором глибенкламида (GB) (Glybenclamide, Sigma-Aldrich, 10 мкМ, 10 мин), в растворе диметилсульфоксида (DMSO, Sigma-Aldrich, США) или активатором КАТФ-каналов раствором пинацидила (Pinacidil monohydrate, Sigma-Aldrich, 200 мкМ, в растворе DMSO, 5 мин). Концентрация DMSO в применяемом растворе глибенкламида (GB) и пинацидила (PI) не превышала 0.1%. Ранее проведенные исследования показали, что DMSO в такой концентрации не оказывает влияния на тонус церебральных артерий [19]. Исследование реакции сосудов на воздействие AСh проводили в отсутствие и на фоне блокады КАТФ-каналов (предварительное орошение поверхности мозга раствором GB в течение 10 мин с последующим добавлением AСh в раствор блокатора). Фоновую реакцию на воздействие AСh в каждой группе анализировали по всему массиву сосудов и принимали за 100%. Проверка по критерию Краскела–Уоллеса показала отсутствие значимых различий между отдельными животными в фоновых реакциях на воздействие AСh внутри каждой из исследованных групп. Относительно этого уровня оценивали изменение диаметра пиальных артерий при воздействии AСh на фоне блокатора КАТФ-каналов GB.
О результатах воздействия судили по количеству расширившихся или сузившихся артерий. Изменение числа сосудов, расширившихся/сузившихся в ответ на воздействие, выражали в процентах относительно общего числа исследованных сосудов в группе. Реакцию (ΔД) оценивали как разность между значениями диаметра после (Д2) и до (Д1) воздействия Ach, отнесенную к диаметру сосуда Д1 перед воздействием, %:
Считали, что реакция на воздействие отсутствует, если изменения диаметра не превышали 5.0 ± 0.5%. Это значение, как мы предварительно установили, регистрируется в покое в отсутствие каких-либо воздействий. Данные по каждой группе сосудов, полученные на разных животных, усреднялись для отдельной экспериментальной группы крыс и использовались для статистических сравнений.
Статистическая оценка данных. Математическая обработка полученных данных проведена с использованием пакета статистических программ Microsoft Excel 2003 и программы InStat 3.02 (“GraphPad Software Inc.”, США). Данные представлены в виде среднего арифметического значения и его ошибки. Проверка экспериментальных данных на нормальное распределение проведена с использованием критерия Колмогорова–Смирнова. Сравнение средних данных независимых выборок при нормальном характере распределения вариант в совокупности данных (выборке) рассчитывали при помощи дисперсионного анализа с последующим попарным сравнением групп согласно критерию Тьюки. При распределении вариант в выборке, отличном от нормального, при сравнении групп применяли критерий Краскела–Уоллиса с последующим попарным сравнением групп согласно U-критерию Манна–Уитни. Достоверным уровнем отличий считали вероятность не менее 95% (р < 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ культуры МСКч методом проточной цитофлуориметрии показал, что она состояла на 99.7% из CD90+, CD73+, CD105+, CD44+-клеток (собственно МСК), на 0.3% CD45+, CD34+-клеток (клетки гемопоэтического ряда) и на 0.5% из CD14+, CD11b+, HLA-DR+. 7AAD+-клеток (нежизнеспособных) было не более 0.9–1%.
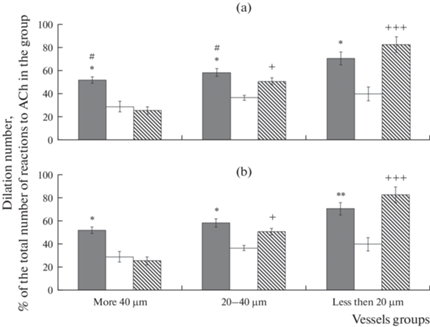
На рис. 1 представлена дилататорная реакция пиальных артерий в ответ на воздействие ACh. Через 14 сут после И/Р (группа № 2) число расширившихся на ACh артерий всех исследованных диаметров было в среднем в 1.8 раза меньше, чем у ЛО (рис. 1a). В группе № 3 (введение МСКч на 7-е сут после И/Р) через 14 сут после И/Р число ACh-опосредованных дилатаций артерий диаметром более 20 мкм было в 1.2–1.5 раза меньше, чем в группе ЛО. У артерий диаметром менее 20 мкм число дилатаций достоверно не отличалось от такового у ЛО. По сравнению с группой № 2 у артерий диаметром 20–40 мкм число дилатаций было в 1.4 раза больше. Через 21 сут в группе № 2 число вызванных ACh дилатаций было меньше в 1.2–1.8 раза по сравнению с ЛО крысами (рис. 1b). В группе № 3 дилататорная реакция на ACh пиальных артерий всех исследованных диаметров не отличалась от реакций у ЛО животных (рис. 1b).
Рис. 1.
Дилататорная реакция пиальных артерий различных диаметров на воздействие ACh. (a) – 14-е сут после И/Р, (b) – 21-е сут после И/Р. Темная заливка – ЛО крысы, светлая заливка – крысы, перенесшие И/Р, косая штриховка – крысы, перенесшие ишемию, которым на 7-е сут после И/Р была проведена внутривенная трансплантация МСКч. По горизонтали – группы сосудов, по вертикали – число сосудов, расширившихся в ответ на воздействие ACh, % от общего числа реакций на ACh в группе. * – изменения значимы по сравнению с соответствующими значениями у животных, перенесших И/Р; # – изменения значимы по сравнению с соответствующими значениями у крыс после И/Р, которым на 7-е сут после И/Р была проведена внутривенная трансплантация МСКч; + – изменения значимы у крыс после И/Р, которым на 7-е сут после И/Р была проведена внутривенная трансплантация МСКч по сравнению с соответствующими значениями у крыс после И/Р без клеточной терапии (*, #, +р < 0.05, ** р < 0.01, +++р < 0.001, критерий Тьюки).
Констрикторная реакция пиальных артерий разного диаметра на воздействие глибенкламидом (GB) представлена на рис. 2. У ЛО животных на действие GB уменьшением диаметра ответило 57.3 ± 6.4% мелких артерий и около 46% пиальных артерий диаметром более 20 мкм. В этой группе не было выявлено статистически значимой разницы в реактивности пиальных артерий внутри одного калибра (более 40 мкм, 20–40 мкм, менее 20 мкм) на разных сроках послеоперационного периода, поэтому для сравнения с другими экспериментальными группами представлены усредненные данные по всем результатам в течение эксперимента с 14-ти до 21-х сут.
Рис. 2.
Число пиальных артерий, ответивших констрикцией на воздействие глибенкламида. (a) – 14-е сут после И/Р, (b) – 21-е сут после И/Р. Темная заливка – ЛО крысы, светлая заливка – крысы, перенесшие И/Р, косая штриховка – крысы, перенесшие ишемию, которым на 7-е сут после И/Р была проведена внутривенная трансплантация МСКч. По горизонтали – группы сосудов, по вертикали – число сосудов, сузившихся в ответ на воздействие GB, % от общего числа реакций на GB в группе. * – изменения значимы по сравнению с соответствующими значениями у животных, перенесших И/Р; # – изменения значимы по сравнению с соответствующими значениями у крыс после И/Р, которым на 7-е сут после И/Р была проведена внутривенная трансплантация МСКч (*, #р < 0.05, ** р < 0.01, критерий Тьюки).
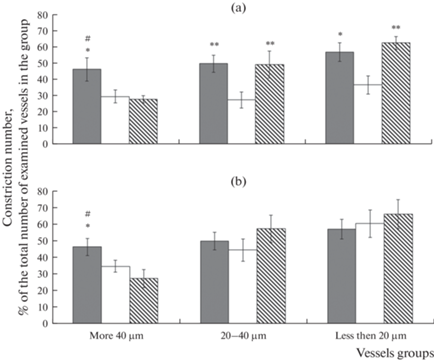
Через 14 сут после И/Р у крыс из группы № 2 на воздействие GB сужением ответило в 1.5–1.8 раза меньше пиальных артерий по сравнению с ЛО группой (рис. 2а). В группе № 3 число сузившихся артерий диаметром более 40 мкм было в среднем в 1.7 раза меньше, чем в группе № 1 (т.е. столько же, сколько у крыс из группы № 2); артерии диаметром менее 40 мкм реагировали на GB так же, как сосуды у ЛО животных. Через 21 сут после И/Р у крыс из группы № 2 и 3 число сузившихся артерий диаметром более 40 мкм под влиянием GB было в 1.3–1.6 раза меньше, чем у ЛО крыс. У артерий меньшего диаметра не наблюдали статистически значимой разницы в констрикторной реакции на GB во всех экспериментальных группах (рис. 2b).
Дилататорная реакция пиальных артерий разного диаметра у ЛО крыс на воздействие пинацидила (PI) представлена на рис. 3 в виде усредненных данных по всем результатам в течение эксперимента с 14-ти до 21-х сут (объяснения см. выше). На воздействие PI расширением ответило 82 ± 4.9% пиальных артерий диаметром менее 20 мкм. Число расширившихся артерий более крупных диаметров составило около 60%.
Рис. 3.
Число пиальных артерий, ответивших дилатацией на воздействие пинацидила. (a) – 14 сут после И/Р, (b) – 21 сут после И/Р. Темная заливка – ЛО крысы, светлая заливка – крысы, перенесшие И/Р, косая штриховка – крысы, перенесшие ишемию, которым на 7-е сут после И/Р была проведена внутривенная трансплантация МСКч. По горизонтали – группы сосудов, по вертикали – число сосудов, расширившихся в ответ на воздействие PI, % от общего числа реакций на PI в группе. * – изменения значимы по сравнению с соответствующими значениями у животных, перенесших И/Р; # – изменения значимы по сравнению с соответствующими значениями у крыс после И/Р, которым на 7-е сут после И/Р была проведена внутривенная трансплантация МСКч (*, #р < 0.05, **, ##р < 0.01, *** р < 0.001, U-критерий Манна–Уитни).
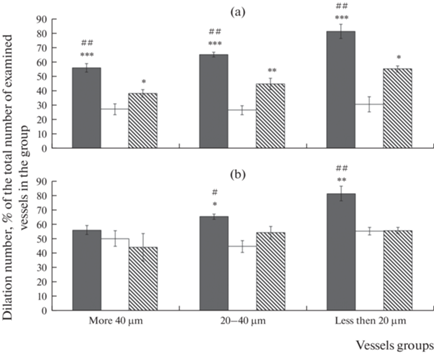
Через 14 сут после И/Р головного мозга у крыс из группы № 2 число дилатаций на PI было в 2–2.6 раза меньше, чем в ЛО группе (рис. 3а). У крыс, которым на 7-е сут после И/Р были введены МСКч, расширением ответило в 1.4–1.5 раз меньше, чем в ЛО группе. При этом число дилатаций было выше, чем у крыс из группы № 2 в 1.4 раза (артерии диаметром более 40 мкм), в 1.7 раза (артерии диаметром 20–40 мкм), в 1.8 раза (артерии диаметром менее 20 мкм). Через 21 сут после И/Р у артерий диаметром более 40 мкм не было выявлено статистически значимой разницы по числу дилатаций на PI во всех экспериментальных группах (рис. 3b). Число расширившихся артерий диаметром 20–40 мкм у крыс из группы № 2 было меньше, чем в группах № 1 и 3 в 1.2–1.5 раза. Число дилатаций у артерий менее 20 мкм группах № 2 и 3 было ниже примерно в 1.5 раза по сравнению с ЛО.
Функциональную активность КАТФ-каналов пиальных артерий оценивали сравнением числа дилататорных реакций на воздействие ACh и AСh на фоне GB (ACh/GB) (рис. 4). У ЛО животных GB подавлял дилататорную реакцию на ACh: на действие ACh/GB расширением ответило в 1.6–1.8 раза меньше пиальных артерий, чем на чистый ACh.
Рис. 4.
Число пиальных артерий, ответивших дилатацией на воздействие ацетилхолина на фоне введения глибенкламида. (а) – 14 сут после И/Р, (b) – 21 сут после И/Р. Темная заливка – ЛО крысы, светлая заливка – крысы, перенесшие ишемию, косая штриховка – крысы, перенесшие ишемию, которым на 7-е сут после И/Р была проведена внутривенная трансплантация МСКч. Линия – дилататорная реакция сосудов в группе на введение ACh без применения GB, принятая за 100%. По горизонтали – группы сосудов, по вертикали – число сосудов, расширившихся в ответ на воздействие ACh, % от общего числа реакций на ACh в группе. * – изменения значимы по сравнению с реакцией на ACh без применения GB; # – изменения значимы по сравнению с соответствующими значениями у ЛО крыс (*, #р < 0.05, **, ##р < 0.01, критерий Тьюки).
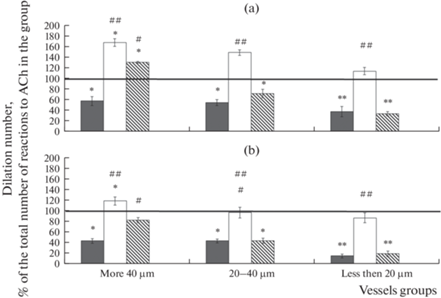
Через 14 сут после И/Р головного мозга у крыс из группы № 2 число расширившихся пиальных артерий с исходным диаметром более 20 мкм на воздействие ACh/GB было больше, чем на ACh в 1.5–1.7 раза, а у артерий с диаметром менее 20 мкм примерно одинаковым (рис. 4a). У крыс, которым на 7-е сут после И/Р были трансплантированы МСКч, число дилатаций на ACh/GB было больше, чем на чистый ACh у сосудов диаметром более 40 мкм. Число дилатаций на действие ACh/GB у артерий диаметром 20–40 мкм было меньше в 1.4 раза, чем на чистый ACh; у артерий диаметром менее 20 мкм – в 2.9 раза. Через 21 сут после И/Р у крыс из группы № 2 число расширившихся пиальных артерий диаметром более 40 мкм на воздействие ACh/GB было выше, чем на чистый ACh примерно в 1.2 раза; диаметром менее 40 мкм – одинаковым. В группе клеточной терапии артерии диаметром более 40 мкм реагировали одинаково на ACh и ACh/GB. У сосудов меньшего диаметра GB подавлял дилататорную реакцию на ACh в той же степени, что и у ЛО крыс (рис. 4b).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
И/Р приводит к угнетению ACh-опосредованной дилатации пиальных артериальных сосудов, которое сохраняется на протяжении 21-го дня после восстановления кровотока (рис. 1). Развитие сосудистой дисфункции после ишемии и последующей реперфузии может быть связано с нарушением активности ионных каналов. Важным механизмом, обеспечивающим вазодилатацию мозговых сосудов, является активация АТФ-чувствительных калиевых каналов [4]. После И/Р головного мозга усиливается выработка активных форм кислорода и азота, включая супероксид и оксид азота (NO), которые могут быстро реагировать с образованием пероксинитрита (ONOO−). С одной стороны, пероксинитрит и другие радикалы могут активировать КАТФ-каналы и кальций-чувствительные калиевые каналы большой проводимости, что, в свою очередь, приводит к гиперполяризации клеточной мембраны, расслаблению гладкомышечных клеток и увеличению диаметра артерий [20]. С другой стороны, они могут окислять и нитрозилировать сульфгидрильные группы в составе молекул КАТФ-каналов и соответственно понижать их функциональную активность [21]. Восстановление функции КАТФ-каналов – одно из основных направлений коррекции церебральной циркуляции после И/Р, поскольку эти каналы играют значимую роль в регуляции базального тонуса и реактивности артерий [22]. Активация КАТФ-каналов приводит к снижению внутриклеточной концентрации Ca2+, гиперполяризации клеточной мембраны, расслаблению гладкомышечных клеток и увеличению диаметра артерий. Напротив, ингибирование КАТФ-каналов сопровождается входом Ca2+ в гладкомышечные клетки через кальциевые каналы, высвобождению Ca2+ из внутриклеточных депо, деполяризации мембраны гладкомышечных клеток, уменьшению диаметра артерий и увеличению сосудистого сопротивления [23].
В представленной работе мы показали, что И/Р головного мозга существенно влияет на функциональную активность КАТФ-каналов. Через 14 сут после И/Р уменьшение диаметра в ответ на введение блокатора КАТФ-каналов наблюдается только у 30% пиальных артерий (рис. 2а), тогда как у контрольных животных этот показатель составляет в среднем 60%. Уменьшение числа сузившихся на воздействие GB артерий после И/Р может быть связано со снижением плотности КАТФ-каналов в гладкомышечных клетках. Косвенным доказательством этому может служить тот факт, что применение в наших экспериментах активатора КАТФ-каналов пинацидила (PI) через 14 сут после И/Р привело к расширению в среднем тоже только 30% пиальных артерий. Эти данные позволяют предположить, что для поддержания базального артериального тонуса на 14-е сут после И/Р практически все КАТФ-каналы находятся в активном состоянии, т.е. отсутствует резерв для контроля реактивности артерий при эндогенном/экзогенном воздействии (рис. 3а). Участие КАТФ-каналов в формировании базального сосудистого тонуса пиальных артерий восстанавливается к 21-м суткам после И/Р (исключая самые крупные артерии диаметром более 40 мкм) (рис. 2b). Далее мы продемонстрировали, что внутривенная трансплантация МСКч, проведенная на 7-е сут после И/Р, привела к восстановлению роли КАТФ-каналов в поддержании тонуса сосудистой стенки на 14-е сут после И/Р для пиальных артерий диаметром менее 40 мкм (рис. 2а). В более крупных артериях восстановления не произошло. Через 14 сут после ишемического воздействия в ответ на воздействие GB сужалось только около 30% сосудов, так же, как и у животных, перенесших И/Р без клеточной терапии. При этом на воздействие PI расширением ответило в среднем 40–60% пиальных артерий, что подтверждает структурную целостность КАТФ-каналов (рис. 3а). К 21-м суткам после И/Р в группе клеточной терапии у пиальных артерий диаметром более 40 мкм участие КАТФ-каналов в поддержании базального тонуса сосудистой стенки также не восстановилось (рис. 2b).
После И/Р головного мозга изменяется вклад КАТФ-каналов в осуществлении ACh-опосредованной дилатации. У животных из группы № 2 в наших экспериментах блокада КАТФ-каналов не уменьшала число дилатаций на ACh ни на 14-е, ни на 21-е сут после И/Р (рис. 4). Через 14 сут после И/Р введение GB увеличивало число ACh-опосредованных дилатаций пиальных артерий всех исследованных диаметров. Мы можем предположить, что после И/Р GB не уменьшает, а, напротив, усиливает калиевый ток, что, вероятно, и является причиной повышения числа дилатаций на ACh/Gb по сравнению с чистым AСh. Увеличение тока катионов К+ проходит через SUR1-TRPM4-каналы, которых нет в сосудах головного мозга в обычном состоянии, но они активируются при различных патологических состояниях, в частности при гипоксии. В литературе есть данные, что GB препятствует открытию SUR1-TRPM4-каналов, но не влияет на уже открытые каналы [24]. Также причиной извращения дилататорной реакции на ACh на фоне введения GB может быть то, что эффективность блокаторов КАТФ-каналов зависит от внутриклеточного уровня Mg-АДФ, который значительно возрастает при ишемии и гипоксии [25]. Через 21 сут после И/Р число дилатаций на ACh на фоне блокады КАТФ-каналов достоверно не изменялось (рис. 3), это может свидетельствовать о том, что в этот отрезок постишемического периода КАТФ-каналы практически не участвуют в осуществлении ACh-опосредованной дилататорной реакции пиальных артерий. В группе клеточной терапии снижение роли КАТФ-каналов в ACh-опосредованной дилатации отмечалось только у артерий диаметром более 40 мкм. У артерий меньшего диаметра уже к 14-м суткам после И/Р блокирование КАТФ-каналов снижало ACh-опосредованную дилатацию в той же мере, что и у ЛО крыс. В последние годы показано, что МСК могут предотвращать гибель эндотелиальных клеток, поддерживая функциональную активность сигнальных путей, регулирующих клеточный цикл [26]. В литературе представлены данные о том, что в условиях ишемии в головном мозге может происходить передача неповрежденных митохондрий от трансплантированных МСК в эндотелиальные клетки сосудистой стенки, тем самым улучшая их функционирование [27]. Как известно, митохондриальные КАТФ-каналы также участвуют в формировании вазодилататорной реакции [28]. Следовательно, это еще один выявленный механизм влияния МСК на реактивность артериальных сосудов, который вполне может реализоваться в условиях И/Р головного мозга.
Также мы можем предположить, что после трансплантации МСКч, проведенной на 7-е сут после И/Р, в ткани ишемизированной области имела место активация ангиогенеза. Согласно литературным данным, МСК секретируют факторы, способствующие неоваскуляризации ткани: фактор роста фибробластов 2 (FGF-2), фактор роста эндотелия сосудов (VEGF), трансформирующий ростовой фактор (TGFβ), интерлейкины IL-6, IL-8, ангиогенин, фактор роста гепатоцитов (HGF), тромбоцитарный фактор роста (PDGF BB) [12, 13]. Показано, что после внутривенной трансплантации МСК в ишемизированной тканевой зоне головного мозга наблюдали повышение уровня VEGF и фактора, индуцируемого гипоксией (HIF-1α) [29]. HIF-1α стимулирует в ишемизированной ткани повышение экспрессии генов, обеспечивающих адаптацию клеток к гипоксии, регулирующих сосудистый тонус, клеточную пролиферацию и апоптоз [30]. В литературе представлены экспериментальные данные, показывающие увеличение плотности церебральной сосудистой сети в 1.5–2 раза через 7 сут после введения МСК [27, 31]. В нашей работе с помощью МСКч функция КАТФ-каналов быстрее всего восстанавливалась у самых мелких артерий диаметром менее 20 мкм, которые могут быть не нативными, а вновь образованными сосудами. С другой стороны, нельзя исключать и протекторное воздействие МСКч на клетки сосудистой стенки. Как уже говорилось выше, МСК могут уменьшать негативное воздействие воспаления и окислительного стресса непосредственно в стенке сосудов, сохраняя тем самым жизнеспособность эндотелиальных и гладкомышечных клеток [32, 33]. За счет протекторного воздействия МСКч, скорее всего, восстанавливалась функция КАТФ-каналов в сосудах диаметром 20–40 мкм.
Итак, внутривенная трансплантация МСКч, проведенная на 7-е сут после И/Р, позволила полностью восстановить участие КАТФ-каналов в поддержании базального тонуса и их функциональную активность у пиальных артерий диаметром менее 40 мкм, т.е. именно в том участке церебральной сосудистой сети, который принимает основное участие в кислородном транспорте между кровью и тканью [34].
ЗАКЛЮЧЕНИЕ
И/Р коры головного мозга крыс снижает вклад КАТФ-каналов в поддержании базального тонуса пиальных артерий и практически полностью выключает данные каналы из формирования AСh-опосредованной дилатации на протяжении 21 сут постишемического периода. Внутривенная трансплантация МСКч, проведенная на 7-е сут после И/Р, приводит к восстановлению вклада КАТФ-каналов ГМК в поддержание базального тонуса и осуществление AСh-опосредованной дилатации пиальных артерий диаметром менее 40 мкм уже через 14 сут после перенесенной И/Р.
Список литературы
Gong S, Ma H, Zheng F, Huang J, Zhang Y, Yu B, Li F, Kou J (2021) Inhibiting YAP in endothelial cells from entering the nucleus attenuates blood-brain barrier damage during ischemia-reperfusion injury. Front Pharmacol 26(12): 777680. https://doi.org/10.3389/fphar.2021.777680
Chen Y-J, Chen C, Li M-Y, Li Q-Q, Zhang X-J, Huang R, Zhu X-W, Bai C-Y, Liu-Yi Zhang, Peng P-H, Yang W-M (2021) Scutellarin reduces cerebral ischemia reperfusion injury involving in vascular endothelium protection and PKG signal. Nat Prod Bioprospect 11(6): 659–670. https://doi.org/10.1007/s13659-021-00322-z
Ferdous A, Janta RA, Arpa RN, Afroze M, Khan M, Moniruzzaman M (2020) The leaves of Bougainvillea spectabilis suppressed inflammation and nociception in vivo through the modulation of glutamatergic, cGMP, and ATP-sensitive K+ channel pathways. J Ethnopharmacol 28(261): 113148. https://doi.org/10.1016/j.jep.2020.113148
Tykocki NR, Boerman EM, Jackson WF (2017) Smooth muscle ion channels and regulation of vascular tone in resistance. Arteries and Arterioles. Compr Physiol 7(2): 485–581. https://doi.org/10.1002/cphy.c160011
Syed AU, Koide M, Brayden JE, Wellman GC (2019) Tonic regulation of middle meningeal artery diameter by ATP-sensitive potassium channels. J Cereb Blood Flow Metab 39(4): 670–679. https://doi.org/10.1177/0271678X17749392
Ning K, Jiang L, Hu T, Wang X, Liu A, Bao Y (2020) ATP-sensitive potassium channels mediate the cardioprotective effect of Panax notoginseng Saponins against myocardial ischaemia-reperfusion injury and inflammatory reaction. Biomed Res Int 2020: 3039184. https://doi.org/10.1155/2020/3039184
Maqoud F, Scala R, Hoxha M, Zappacosta B, Tricarico D (2022) ATP-sensitive potassium channel subunits in neuroinflammation: novel drug targets in neurodegenerative disorders. CNS Neurol Disord Drug Targets 21(2): 130–149. https://doi.org/10.2174/1871527320666210119095626
Shi Y, Wang Y, Li Q, Liu K, Hou J, Shao C, Ying Wang Y (2018) Immunoregulatory mechanisms of mesenchymal stem and stromal cells in inflammatory diseases. Nat Rev Nephrol 14(8): 493–507. https://doi.org/10.1038/s41581-018-0023-5
Lin Q-M, Tang X-H, Lin S-R, Chen B-D, Feng Chen F (2020) Bone marrow-derived mesenchymal stem cell transplantation attenuates overexpression of inflammatory mediators in rat brain after cardiopulmonary resuscitation. Neural Regen Res 15(2): 324–331. https://doi.org/10.4103/1673-5374.265563
Liu Y, Zhao Y, Min Y, Guo K, Chen Y, Huang Z, Long C (2022) Effects and mechanisms of bone marrow mesenchymal stem cell transplantation for treatment of ischemic stroke in hypertensive rats. Int J Stem Cells 15(2): 217–226. https://doi.org/10.15283/ijsc21136
Xiao X, Xu M, Yu H, Wang L, Li X, Rak J, Wang S, Zhao RC (2021) Mesenchymal stem cell-derived small extracellular vesicles mitigate oxidative stress-induced senescence in endothelial cells via regulation of miR-146a/Src. Signal Transduct Target Ther 6(1): 54. https://doi.org/10.1038/s41392-021-00765-3
Sheikh A, Yano S, Mitaki S, Haque MDA, Yamaguchi S, Nagai A (2019) A mesenchymal stem cells line (B10) increases angiogenesise in rat MCAO model. Exp Neurol 311: 182. https://doi.org/10.1016/j.expneurol.2018.10.001
Dong H-J, Peng D, Luo Y, Liu R, Yin H-J, Lei Wang L, Hong Sha H, Meng H-P, Ping W, Shang C (2022) The hope for Pandora’s Box: mesenchymal stem cells for promoting angiogenesis in stroke and traumatic brain injury. Signal Transduct Target Ther 6(1): 354. https://doi.org/10.1038/s41392-021-00765-3
Egger D, Lavrentieva A, Kugelmeier P, Cornelia Kasper C (2021) Physiologic isolation and expansion of human mesenchymal stem/stromal cells for manufacturing of cell-based therapy products. Eng Life Sci 22(3–4): 361–372. https://doi.org/10.1002/elsc.202100097
Kangussu LM, Almeida-Santos AF, Fernandes L, Alenina N, Bader M, Santos R, Massensini A, Campagnole-Santos J (2023) Transgenic rat with overproduction of ubiquitous angiotensin-(1–7) presents neuroprotection in a model of ischemia and reperfusion. Brain Res Bull 192: 184–191. https://doi.org/10.1016/j.brainresbull.2022.11.017
Lee SH, Choung JS, Kim JM, Kim H, Kim MY (2023) Distribution of embryonic stem cell-derived mesenchymal stem cells after intravenous infusion in hypoxic-ischemic encephalopathy. Life (Basel) 13(1): 227. https://doi.org/10.3390/life13010227
Lensman M, Korzhevskii DE, Mourovets VO, Kostkin VB, Izvarina N, Perasso L, Gandolfo C, Otellin VA, Polenov SA, Balestrino M (2006). Intracerebroventricular administration of creatine protects against damage by global cerebral ischemia in rat. Brain Res 1114(1): 187–194. https://doi.org/10.1016/j.brainres.2006.06.103
Mushahary D, Spittler A, Kasper C, Weber V, Charwat V (2018) Isolation, cultivation, and characterization of human mesenchymal stem cells expand. Cytometry A 93(1): 19–31. https://doi.org/10.1002/cyto.a.23242
Soltani N, Mohammadi E, Allahtavakoli M, Shamsizadeh A, Roohbakhsh A, Haghparast A (2016) Effects of dimethyl sulfoxid on neuronal response characteristics in deep layers of rat barrel cortex. Basic Clin Neurosci 7(3): 213–220. https://doi.org/10.15412/J.BCN.03070306
Sancho M, Fletcher J, Welsh DG (2022) Inward rectifier potassium channels: membrane lipid-dependent mechanosensitive gates in brain vascular cells. Front Cardiovasc Med 9: 869481. https://doi.org/10.3389/fcvm.2022.869481
Zeidner G, Sadja R, Reuveny E (2001) Redox-dependent gating of G protein-coupled inwardly rectifying K+ channels. J Biol Chem 276(38): 35564–35570. https://doi.org/10.1074/jbc.M105189200
Syed AU, Koide M, Brayden JE, Wellman G (2019) Tonic regulation of middle meningeal artery diameter by ATP-sensitive potassium channels. Journal of Cerebral Blood Flow and Metabolism 39(4): 670–679. https://doi.org/10.1177/0271678X17749392
Jackson WF (2021) Myogenic tone in peripheral resistance arteries and arterioles: The Pressure Is On! Front Physiol 12: 699517. https://doi.org/10.3389/fphys.2021.699517
Jha RM, Rani A, Desai SM, Raikwar S, Mihaljevic S, Munoz-Casabella A, Kochanek PM, Catapano J, Winkler E, Citerio G, Hemphill JC, Kimberly WT, Narayan R, Sahuquillo J, Sheth KN, Simard JM (2021) Sulfonylurea receptor 1 in central nervous system injury: an updated review. Int J Mol Sci 22(21): 11899. https://doi.org/10.3390/ijms222111899
Sancho M, Fletcher J, Welsh DG (2022) Inward rectifier potassium channels: membrane lipid-dependent mechanosensitive gates in brain vascular cells. Front Cardiovasc Med 9: 869481. https://doi.org/10.3389/fcvm.2022.869481
Kang P, Ying C, Chen Y, Ford AL, An H, Lee J-M (2022) Oxygen metabolic stress and white matter injury in patients with cerebral small vessel disease. Stroke 53(5): 1570–1579. https://doi.org/10.1161/STROKEAHA.121.035674
Liu K, Guo L, Zhou Z, Pan M, Yan C (2019) Mesenchymal stem cells transfer mitochondria into cerebral microvasculature and promote recovery from ischemic stroke. Microvasc Res 123: 74–80. https://doi.org/10.1016/j.mvr.2019.01.001
Busija DW, Katakam PV (2014) Mitochondrial mechanisms in cerebral vascular control: shared signaling pathways with preconditioning. J Vasc Res 51(3): 175–189. https://doi.org/10.1159/000360765
Xu W, Xu R, Li Z, Wang Y, Hu R (2019) Hypoxia changes chemotaxis behaviour of mesenchymal stem cells via HIF-1α signaling. J Cell Mol Med 23(3): 1899–1907. https://doi.org/10.1111/jcmm.14091
Han Y, Yang J, Fang J, Zhou Y, Candi E, Wang J, Hua D, Shao C, Yufang Shi Y (2022) The secretion profile of mesenchymal stem cells and potential applications in treating human diseases. Signal Transduct Target Ther 7(1): 92. https://doi.org/10.1038/s41392-022-00932-0
Guo Y, Peng Y, Zeng H, Gao Chen G (2021) Progress in mesenchymal stem cell therapy for ischemic stroke. Stem Cells Int 2021: 9923566. https://doi.org/. eCollection 2021https://doi.org/10.1155/2021/9923566
Gao Y, Chen H, Cang X, Chen H, Di Y, Qi J, Cai H, Luo K, Jin S (2022) Transplanted hair follicle mesenchymal stem cells alleviated small intestinal ischemia-reperfusion injury via intrinsic and paracrine mechanisms in a rat model. Front Cell Dev Biol 10: 1016597. https://doi.org/10.3389/fcell.2022.1016597
Korkmaz-Icöz S, Zhou P, Guo Y, Loganathan S, Brlecic P, Radovits T, Sayour AA, Ruppert M, Veres G, Karck M, Szabó G (2021) Mesenchymal stem cell-derived conditioned medium protects vascular grafts of brain-dead rats against in vitro ischemia/reperfusion injury. Stem Cell Res Ther 12(1): 144. https://doi.org/10.1186/s13287-021-02166-3
Liu Y, Chen J, Liang H, Cai Y, Li X, Yan L, Zhou L, Shan L, Wang H (2022) Human umbilical cord-derived mesenchymal stem cells not only ameliorate blood glucose but also protect vascular endothelium from diabetic damage through a paracrine mechanism mediated by MAPK/ERK signaling. Stem Cell Res Ther 13(1): 258. https://doi.org/10.1186/s13287-022-02927-8
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


