Российский физиологический журнал им. И.М. Сеченова, 2023, T. 109, № 9, стр. 1261-1272
Влияние гормонов нейрогипофиза на экскрецию белков почками
Т. А. Каравашкина 1, Е. В. Балботкина 1, Т. В. Ковалева 1, А. В. Кутина 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: kutina_anna@mail.ru
Поступила в редакцию 14.08.2023
После доработки 23.08.2023
Принята к публикации 24.08.2023
- EDN: OTNDTY
- DOI: 10.31857/S0869813923090066
Аннотация
Вазопрессин (ВП) – один из основных факторов, влияющих на внутриклубочковую гемодинамику, фильтрационное давление и состояние мезангиальных клеток и способствующих прогрессированию протеинурии. Цель работы – изучение действия гормонов нейрогипофиза (ВП и окситоцин) на экскрецию белков почками. Эксперименты выполнены на крысах линии Вистар, здоровых и с микроальбуминурией, вызванной минимальными повреждениями гломерулярного фильтра. Микроальбуминурию моделировали введением метилового эфира D-нитроаргинина (D-NAME, 50 мг/кг, внутрибрюшинно). ВП (0.05 и 1.5 нмоль/кг) и окситоцин (0.15 нмоль/кг) вводили крысам внутримышечно, V2-антагонист (15 нмоль/кг) и V1a-антагонист (20 нмоль/кг) – внутрибрюшинно. Для снижения уровня эндогенного ВП животных напаивали водой (10 мл/кг), собирали мочу в течение 2 ч, анализировали уровень общего белка, альбумина, β2-микроглобулина и иммуноглобулина G (IgG). У здоровых крыс ВП в дозе 0.05 нмоль/кг и окситоцин не повлияли на экскрецию альбумина, а ВП в дозе 1.5 нмоль/кг спровоцировал микроальбуминурию. На модели нарушения свойств гломерулярного фильтра, вызванного введением D-NAME, ВП в дозе 0.05 нмоль/кг и окситоцин привели к нормализации экскреции альбумина, а ВП в дозе 1.5 нмоль/кг вызвал выраженную протеинурию (экскреция альбумина возросла в 100 раз, IgG – в 10 раз). Блокада V2-рецепторов усугубила потерю белка, вызванную D-NAME и ВП (1.5 нмоль/кг), а блокада V1a-рецепторов ее предотвратила. Таким образом, ВП при высокой концентрации в крови усиливает фильтрацию белков в почке. Этот эффект опосредован V1a-рецепторами и, в зависимости от барьерных свойств гломерулярного фильтра, приводит к развитию микроальбуминурии или выраженной протеинурии. Окситоцин и ВП в дозе, при которой он преимущественно активирует V2-рецепторы, оказывают антипротеинурическое действие. Выявленные эффекты нейрогипофизарных гормонов на экскрецию альбумина открывают новые перспективные терапевтические мишени для коррекции гломерулярных дисфункций.
ВВЕДЕНИЕ
Гломерулярный фильтр является эффективным барьером, предотвращающим потерю белков плазмы крови почками. Различные нарушения структуры гликокаликса эндотелия или гломерулярной базальной мембраны, дисфункции подоцитов и мезангиальных клеток, а также изменения почечной гемодинамики (повышение внутриклубочкового давления, гиперфильтрация) снижают барьерные свойства почечного фильтра и приводят к повышению экскреции белков с мочой (от микроальбуминурии до протеинурии нефротического уровня) [1, 2]. Показано, что уровень экскреции альбумина является прогностическим маркером прогрессирования почечной патологии при сахарном диабете, метаболическом синдроме, артериальной гипертензии и др. [3, 4]. При этом в качестве основного фактора, способствующего развитию микроальбуминурии, рассматривается повышенный уровень гормона нейрогипофиза вазопрессина (ВП) [5]. Продемонстрировано, что у крыс с генетическим дефектом синтеза ВП (линия Brattleboro) при стрептозотоциновом сахарном диабете существенно меньше альбуминурия и скорость прогрессирования диабетической нефропатии по сравнению с крысами линии Long-Evans [6]. Аналогичные данные были получены в отношении прогрессирования протеинурии при хронической почечной недостаточности [7]. Выявлен повышенный уровень ВП в крови у пациентов с сахарным диабетом и 1-го и 2-го типа [8]. Доминирует гипотеза, что действие гормона на экскрецию альбумина опосредовано V2-рецепторами, так как у здоровых животных и добровольцев агонист V2-рецепторов (десмопрессин) способствует микроальбуминурии, а селективный антагонист V2-рецепторов препятствует повышению альбуминурии у крыс со стрептозотоциновым сахарным диабетом [8]. В наших работах ранее было показано, что у здоровых крыс аналоги ВП с антидиуретической активностью снижают экскрецию белка с мочой, в то время как протеинурия и микроальбуминурия возрастают при действии аналогов ВП с выраженной V1a-активностью [9]. Таким образом, вопрос о механизме действия ВП на фильтрацию альбумина и прогрессирование альбуминурии остается открытым и нуждается в отдельном детальном исследовании, а влияние второго гормона нейрогипофиза, окситоцина (ОТ), на протеинурию ранее не изучалось.
Цель работы – изучение влияния гормонов нейрогипофиза на экскрецию белков почками. В задачи входило исследование эффектов ВП и ОТ на выведение общего белка, альбумина, β2-микроглобулина и иммуноглобулина G почками у здоровых животных, а также на модели микроальбуминурии.
МЕТОДЫ ИССЛЕДОВАНИЯ
В исследовании были использованы аутбредные крысы Вистар в возрасте 2–4 мес., популяция которых поддерживается в виварии Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН. Эксперименты выполнены на самках крыс, так как у самцов в норме в моче более высокий и вариабельный уровень белка внепочечного происхождения (спермальные и простатические белки) [10]. В виварии животные получали воду и сухой гранулированный полнорационный корм ad libitum. В связи с необходимостью проведения экспериментов натощак, крыс лишали корма за 10 ч до опыта при сохранении свободного доступа к воде. Массу тела животных регистрировали в утренние часы – в день рандомизации и в каждый из дней проведения экспериментов для расчета объемов введения препаратов. Перед экспериментами все животные были адаптированы к экспериментальным процедурам и клеткам для сбора мочи. После опытов со сбором мочи животных возвращали обратно в клетки вивария и повторно использовали не ранее, чем через неделю.
ВП (Sigma-Aldrich, США) и ОТ (Sigma-Aldrich, США) вводили крысам внутримышечно. Дозы гормонов были подобраны ранее [11]: введение ВП в дозе 0.05 нмоль/кг вызывает антидиуретический эффект (активирует преимущественно V2-рецепторы), а в дозе 1.5 нмоль/кг – приводит к повышению уровня гормона в крови, соответствующему таковому при сильном обезвоживании или гиперосмии, и обеспечивающему активацию как V2, так и V1a-подтипов вазопрессиновых рецепторов. ОТ в дозе 0.15 нмоль/кг оказывает специфическое действие, опосредуемое окситоциновыми рецепторами, но не влияет на рецепторы ВП [12]. Антагонисты V1a-рецепторов (Pmp1-Tyr(Me)2-вазопрессин, Bachem, Швейцария, 20 нмоль/кг) и V2-рецепторов (Pmp1-D-Ile2-Ile4-вазопрессин, Bachem, Швейцария, 15 нмоль/кг) вводили внутрибрюшинно одновременно с ВП. Непосредственно перед введением гормонов нейрогипофиза животных напаивали водой (10 мл/кг, ВН) через резиновый зонд для снижения уровня эндогенного ВП и стандартизации условий водного баланса у экспериментальных животных. Микроальбуминурию у крыс моделировали внутрибрюшинным введением D-NAME (50 мг/кг) в 1 мл/кг деионизованной воды за 15 мин до основного воздействия [13].
На здоровых животных были выполнены следующие серии опытов: 1) интактный контроль (n = 10), 2) ВН (n = 10), 3) ВН + ОТ (n = 10), 4) ВН + ВП в дозе 0.05 нмоль/кг (n = 10), 5) ВН + ВП в дозе 1.5 нмоль/кг (n = 10). На крысах с D-NAME-индуцированной микроальбуминурией проведены эксперименты: 6) ВН (n = 10), 7) ВН + ОТ (n = 10), 8) ВН + ВП в дозе 1.5 нмоль/кг (n = 10), 9) ВН + ВП в дозе 1.5 нмоль/кг + антагонист V1a-рецепторов (n = 10), 10) ВН + ВП в дозе 1.5 нмоль/кг + + антагонист V2-рецепторов (n = 10). Дизайн экспериментов представлен на рис. 1.
Рис. 1.
Дизайн экспериментов. OT – окситоцин, VP – вазопрессин, V1a/V2-ant – антагонисты V1a или V2-рецепторов, WL – напаивание крыс водой (10 мл/кг, ВН), номера в кружочках (1–10) – серии экспериментов.
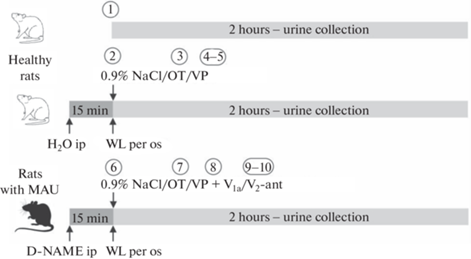
Крыс помещали в индивидуальные клетки для сбора мочи в течение 2 ч. Аликвоты проб для дальнейших анализов на отдельные белки замораживали и хранили при –80°С. Концентрацию альбумина, β2-микроглобулина и иммуноглобулина G измеряли иммуноферментным методом с помощью наборов (Cloud-Clone, КНР) с использованием ридера для микропланшет ELx808 (Bio-Tek Instruments, США). Общий белок мочи определяли с помощью пирогаллолового реактива, концентрацию креатинина – кинетическим методом по реакции Яффе на автоматическим биохимическом анализаторе XL-200 (Erba Lahema, Чехия).
Диурез, экскрецию общего белка, альбумина, β2-микроглобулина, иммуноглобулина G рассчитывали по стандартным формулам и нормировали на кг массы тела животных. Определяли отношение концентрации альбумина в пробах мочи к содержанию креатинина (альбумин-креатининовое соотношение в мг/г). Обработку и анализ данных проводили в программе Microsoft 365 Excel и с помощью библиотек Pandas и Scipy для Python. Данные представлены в виде медианы и квартилей Me (Q1; Q3). Проверку нормальности распределения осуществляли по критерию Шапиро–Уилка. При соответствии нормальному распределению для сравнения групп использовали t-критерий Уэлча, при несоответствии – критерий Манна–Уитни. При множественных сравнениях вводили поправку Бонферрони. Различия считали статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
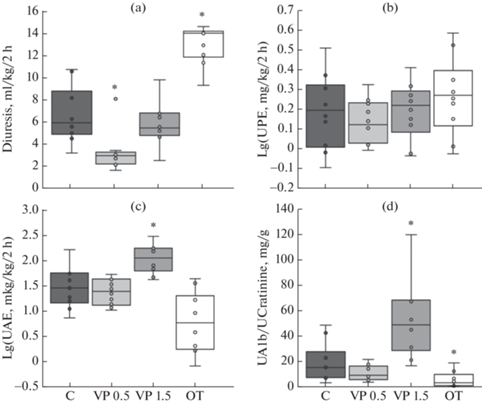
ВП в дозе 0.05 нмоль/кг вызвал снижение диуреза по сравнению с контрольной группой, в дозе 1.5 нмоль/кг не оказал существенного влияния на мочеотделение, а ОТ повысил диурез (рис. 2a). Экскреция общего белка при действии гормонов нейрогипофиза существенно не изменилась (рис. 2b). Анализ альбумина мочи выявил рост его экскреции (рис. 2c) и повышение альбумин-креатининового соотношения (рис. 2d) до уровня микроальбуминурии (диапазон 30–300 мг/г) у крыс после инъекции ВП в дозе 1.5 нмоль/кг. ОТ и ВП в дозе 0.05 моль/кг не оказали влияния на выведение альбумина почками (рис. 2c, d).
Рис. 2.
Диурез (a), экскреция общего белка (b) и альбумина (c), альбумин-креатининовое соотношение в моче (d) у здоровых крыс после введения гормонов нейрогипофиза. Всех крыс напаивали водой в объеме 10 мл/кг. VP 0.05 и VP 1.5 – вазопрессин в дозах 0.05 и 1.5 нмоль/кг, OT – окситоцин, C – контроль (1 мл/кг 0.9%-ного раствора NaCl). * – значимость различий с контролем (p < 0.05, критерий Манна–Уитни (a, d) или t-критерий Уэлча (b, c) с поправками Бонферрони на 3 сравнения).
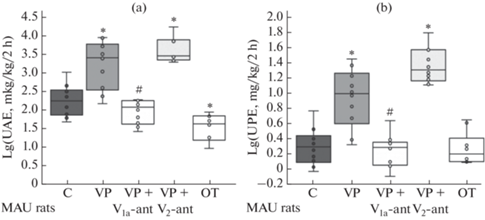
У крыс после внутрибрюшинной инъекции D-NAME (50 мг/кг) альбумин-креатининовое соотношение находилось на уровне, соответствующем микроальбуминурии, при нормальном уровне экскреции общего белка (табл. 1). Введение этим крысам ВП в дозе 1.5 нмоль/кг вызвало появление выраженной альбуминурии (рис. 3a) и протеинурии (рис. 3b, табл. 1), альбумин-креатининовое соотношение возросло в 70 раз по сравнению со здоровыми животными, уровень диуреза при этом не изменился (табл. 1). Введение ОТ крысам с D-NAME-индуцированной микроальбуминурией снизило экскрецию альбумина почками (рис. 3a) до нормальных значений.
Таблица 1.
Диурез и экскреция белка почками при действии гормонов нейрогипофиза у крыс с микроальбуминурией, индуцированной D-NAME
| Серия | Объем мочи, мл/кг |
Экскреция общего белка с мочой, мг/кг |
Альбумин-креатининовое соотношение, мг/г |
|---|---|---|---|
| ВН | 12.7 (10.7; 16.6) | 2.0 (1.3; 2.6) | 78 (51; 132) |
| ВН + ОТ | 16.5 (14.1; 20.5) | 1.6 (1.3; 2.2) | 18 (7; 25) |
| ВН + ВП | 10.4 (9.3; 11.6) | 9.8 (5.2; 15.6)* | 1034 (203; 1756)* |
| ВН + ВП + V1a-антагонист |
3.5 (4.1; 6.2)*, & | 1.9 (1.2; 2.2)& | 41 (25; 54)& |
| ВН + ВП + V2-антагонист |
17.0 (13.8; 18.7)& | 20.1 (15.4; 34.3)* | 1563 (944; 3062)* |
Всех крыс напаивали водой в объеме 10 мл/кг (ВН). ВП вводили в дозе 1.5 нмоль/кг. Все показатели приведены за 2 ч эксперимента. Величины указаны в виде Me (Q1; Q3), n = 10 во всех группах. Значимость различий (p < 0.05, критерий Манна–Уитни с поправкой Бонферрони на 10 сравнений): * – с группой “ВН”, & – с группой “ВН + ВП”.
Рис. 3.
Влияние ВП, антагонистов вазопрессиновых рецепторов и ОТ на экскрецию альбумина (a) и общего белка (b) у крыс с микроальбуминурией. Всех крыс напаивали водой в объеме 10 мл/кг. VP – вазопрессин в дозе 1.5 нмоль/кг, V1a/V2-ant – антагонисты V1a или V2-рецепторов, OT – окситоцин, C – контроль (1 мл/кг 0.9%-ного раствора NaCl). Значимость различий (p < 0.05, t-критерий Уэлча с поправкой Бонферрони на 10 сравнений): * – с группой “C” (крысы с микроальбуминурией (MAU rats), не получавшими гормоны нейрогипофиза), # – с группой “VP”.
Рост экскреции альбумина при действии ВП у крыс, получивших D-NAME, сопровождался повышением выведения высокомолекулярного белка иммуноглобулина G (табл. 2). Экскреция β2-микроглобулина (табл. 2) увеличилась в меньшей степени, что указывает на клубочковый характер протеинурии.
Таблица 2.
Селективность протеинурии при действии ВП у здоровых крыс и у крыс с микроальбуминурией
| Серия | Экскреция альбумина, мкг/кг |
Экскреция иммуноглобулина G, мкг/кг |
Экскреция β2-микроглобулина, мкг/кг |
|---|---|---|---|
| Опыты на здоровых крысах | |||
| ВН | 30 (17; 53) | 0.9 (0.8; 1.0) | 2.0 (1.2; 2.9) |
| ВН + ВП | 122 (74; 176)* | 1.4 (0.8; 1.8) | 8.0 (7.4; 11.6)* |
| Опыты на крысах с микроальбуминурией, индуцированной D-NAME | |||
| ВН | 181 (88; 298)& | 2.7 (2.0; 3.6)& | 7.0 (5.0; 8.9)& |
| ВН + ВП | 2543 (563; 4610)* | 27.3 (21.0; 72.7)* | 17.7 (15.1; 20.1)* |
| ВН + ВП + V1a-антагонист |
121 (49; 176)& | 1.8 (1.1; 2.5)& | 5.1 (2.6; 6.2)& |
Всех крыс напаивали водой в объеме 10 мл/кг (ВН). ВП вводили в дозе 1.5 нмоль/кг. Все показатели приведены за 2 ч эксперимента. Величины указаны в виде Me (Q1; Q3), n = 10 во всех группах. Значимость различий (p < 0.05, критерий Манна–Уитни, в серии опытов на крысах с микроальбуминурией введена поправка Бонферрони на 3 сравнения): * – с соответствующей группой “ВН”, & – с группой крыс “ВН + ВП” с микроальбуминурией.
Для анализа механизма действия ВП на экскрецию белка были использованы селективные антагонисты вазопрессиновых рецепторов. V1a-антагонист снизил экскрецию альбумина (рис. 3a, табл. 2) и альбумин-креатининовое соотношение (табл. 1) до уровня микроальбуминурии, устранил протеинурию (рис. 3b) и нормализовал экскрецию иммуноглобулина G и β2-микроглобулина почками (табл. 2) при действии ВП у крыс с предварительным введением D-NAME. V2-антагонист такого эффекта не оказал, он существенно не повлиял на потерю альбумина (рис. 3a) и величину протеинурии (рис. 3b). Таким образом, у здоровых крыс ВП провоцирует появление микроальбуминурии, а у крыс с D-NAME-индуцированной микроальбуминурией резко усиливает потерю альбумина с мочой и приводит к развитию протеинурии. Этот эффект опосредуется V1a-рецепторами.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ВП высвобождается из нейрогипофиза главным образом в ответ на повышение осмоляльности плазмы и уменьшение объема крови [14]. ВП оказывает антидиуретическое, сосудосуживающее и тромбоцитарно-агрегирующее действие, влияет на глюконеогенез и гликогенолиз в печени, высвобождение инсулина и глюкагона поджелудочной железой и адренокортикотропного гормона передней долей гипофиза [15, 16]. ВП в последние годы рассматривается как важный независимый фактор риска прогрессирования почечной недостаточности и протеинурии при различных заболеваниях [17, 18]. В нескольких крупных когортных проспективных исследованиях (DESIR во Франции (n = 5047), MDCS-CC в Швеции (n = 3 643), PREVEND в Нидерландах (n = 7684)) показана связь между уровнем потребления воды в сутки, уровнем ВП в крови (оцениваемого по концентрации копептина) и развитием хронической болезни почек в общей популяции [15, 16, 19]. Данные этих исследований свидетельствуют о том, что субоптимальное потребление жидкости сопровождается патофизиологически значимым высвобождением ВП, что, в свою очередь, может способствовать развитию ряда клинических расстройств: метаболический синдром с абдоминальным ожирением, сахарный диабет 2-го типа, гипертензия, микроальбуминурия, хроническая болезнь почек, заболевания коронарных сосудов и т.д. При этом микроальбуминурия может быть, по крайней мере частично, напрямую зависима от ВП, а не опосредована другими связанными с ним кардиометаболическими факторами риска [15]. В то же время экспериментальное клиническое исследование с увеличением на 1–1.5 л суточного потребления воды в течение года не выявило существенных различий альбуминурии и скорости снижения функции почек с группой пациентов, потреблявших обычное количество жидкости (около 2 л в сутки) [20].
Изучение изменений фильтрации альбумина по его экскреции имеет существенные ограничения, связанные с тем, что альбумин реабсорбируется в проксимальном канальце, экскретируется лишь небольшая часть профильтровавшегося белка. Поэтому данные, полученные на здоровых животных или на моделях патологий, осложняющихся микроальбуминурией, бывает сложно интерпретировать. В данном исследовании влияние ОТ, ВП и антагонистов его рецепторов на величину протеинурии и альбуминурии изучено на модели микроальбуминурии, вызванной введением D-NAME, который нейтрализует отрицательные заряды в структурах гломерулярного фильтра и снижает его барьерные свойства [13]. В этих условиях детектировать изменения фильтрации альбумина проще, и изменения в структурах клубочков у отдельных животных более единообразны, чем на моделях патологий, например, сахарного диабета. В работе показано, что активация V1a-рецепторов ВП способствует протеинурии, а блокада этого подтипа рецепторов предотвращает потерю белка у крыс с D-NAME-индуцированной микроальбуминурией. Эффект ВП при активации V2-рецепторов, напротив, оказался протективным, как и влияние ОТ. Это хорошо согласуется с приведенными выше данными о влиянии уровня потребления жидкости и прогрессированием почечной патологии. Низкие концентрации ВП в нашем исследовании действительно не усугубляют протеинурию. Кроме того, ранее было показано, что питье воды способствует усилению секреции ОТ [21]. А при длительном недостаточном потреблении воды, приводящему к гипервазопрессинемии, уровень гормона, вероятно, достаточно высок для того, чтобы активировать V1a-рецепторы. Интересно, что при длительной гипервазопрессинемии при сахарном диабете выявлено снижение экспрессии V1a-рецепторов, но не V2-рецепторов, в почках [22], что может быть проявлением компенсаторных реакций. Имеются данные, свидетельствующие о том, что активация V1a-рецепторов может способствовать повреждению клубочков, индуцируя сокращение мезангиальных клеток и вазоконстрикцию эфферентных артериол, а это, в свою очередь, увеличивает капиллярное давление в клубочках [23, 24]. В ряде работ выявлен ренопротекторный эффект блокады вазопрессиновых V1a-рецепторов: снижение альбуминурии у пациентов с инсулин-независимым сахарным диабетом [25], снижение протеинурии у спонтанно гипертензивных крыс с частичной нефрэктомией и солевой нагрузкой [26] и при адриамициновой нефропатии [27]. При хронической болезни почек у крыс показана эффективность монотерапии V1/V2-антагонистом и комбинации с ингибиторами ангиотензин-превращающего фермента или антагонистами рецепторов ангиотензина II в отношении протеинурии [28]. С другой стороны, у крыс со стрептозотоцин-индуцированным сахарным диабетом показана эффективность антагониста V2-рецепторов, который препятствовал прогрессированию альбуминурии в течение 9 недель наблюдения [29]. В работах этого коллектива [6–8, 30] также выявлено протеинурическое действие агониста V2-рецепторов, десмопрессина, у крыс и человека. Однако V2-рецепторы или их мРНК не были обнаружены в гломерулах или почечных проксимальных канальцах [31]. V2-рецепторы представлены во всех отделах собирательных трубок и, в меньшей степени, в тонком отделе и толстом восходящем отделе петли Генле [31]. Предполагается опосредованное действие десмопрессина на фильтрацию белка через изменение уровня системного артериального давления (эндотелиальные V2-рецепторы могут опосредовать дилатацию внепочечных сосудов [32]) и активности ренин-ангиотензиновой системы [30]. Еще один предполагаемый механизм – опосредованное V2-рецепторами ингибирование канальцево-клубочковой обратной связи в результате снижения концентрации соли в плотном пятне, что приводит к повышению внутриклубочкового капиллярного давления и, в конечном итоге, к повреждению гломерул [28]. Выявленное в нашем исследовании усиление потери белка при действии ВП, вероятно, обусловлено непосредственным вовлечением почечных V1a-рецепторов. Этот подтип рецепторов широко представлен в почках: методом полимеразной цепной реакции мРНК V1a-рецептора выявляются в значительном количестве в клубочках, в собирательных трубках и дуговых артериях [31], в меньшем количестве – в проксимальных извитых и прямых канальцах, тонком отделе и толстом восходящем отделе петли Генле. Также показано, что V1-рецепторы присутствуют на гломерулярных мезангиальных клетках, а в культуре эти клетки отвечают на ВП сокращением и повышением синтеза простагландинов [24].
Известно влияние ОТ на почечную гемодинамику, экскрецию воды и электролитов (рост натрийуреза). При этом ОТ оказывает констрикторное влияние на гладкомышечные клетки сосудов и мезангиальные клетки только в высоких дозах, и эффект обусловлен стимуляцией V1a-рецепторов [24, 33]. Исследований влияния ОТ на прогрессирование почечной патологии у человека не проводилось. На животных ранее было показано, что ОТ защищает крыс от цисплатин-индуцированной нефропатии [34]. Механизм защиты авторы связывают, по крайней мере частично, с антиоксидантным действием гормона. Возможно, что ОТ действует непосредственно на уровне клубочков. Показано, что рецептор к ОТ выявляется в корковом веществе почки методом авторадиографии [35], преимущественно в области macula densa [36], но его функциональная роль там не изучена. Выявлено усиление продукции цГМФ в почке при действии ОТ [37]. Антипротеинурическое действие ОТ нами было выявлено впервые и его механизм нуждается в отдельном изучении.
Таким образом, ВП при высокой концентрации в крови усиливает фильтрацию белков в почке, этот эффект опосредован V1a-рецепторами и, в зависимости от барьерных свойств гломерулярного фильтра, приводит к развитию микроальбуминурии или выраженной протеинурии. ОТ и ВП в дозе, при которой он преимущественно активирует V2-рецепторы, оказывают антипротеинурическое действие. Выявленные эффекты нейрогипофизарных гормонов на экскрецию альбумина открывают новые перспективные терапевтические мишени для коррекции гломерулярных дисфункций.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Все процедуры, выполненные в исследованиях с участием животных, соответствовали этическим стандартам, утвержденным правовыми актами РФ, принципам Базельской декларации и требованиям Регламента использования лабораторных животных в Институте эволюционной физиологии и биохимии им. И.М. Сеченова РАН. План исследований одобрен комиссией по биоэтике, утвержденной Приказом Директора Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН № 6 от 20.01.2022 г. (протокол № 1-15/2022 от 27.01.2022).
Список литературы
Ballermann BJ, Nystrom J, Haraldsson B (2021) The glomerular endothelium restricts albumin filtration. Front Med (Lausanne) 8: 766689. https://doi.org/10.3389/fmed.2021.766689
Daehn IS, Duffield JS (2021) The glomerular filtration barrier: a structural target for novel kidney therapies. Nat Rev Drug Discov 20(10): 770–788. https://doi.org/10.1038/s41573-021-00242-0
Добронравов ВА, Смирнов АВ, Каюков ИГ (2009) Многогранная альбуминурия: аспекты клинического значения. Нефрология 13(3): 33–39. [Dobronravov VA, Smirnov AV, Kayukov IG (2009) Manysided albuminuria: aspects of clinical value. Nefrologiya 13(3): 33–39. (In Russ)].
Шишкин АН, Лындина МЛ (2009) Эндотелиальная дисфункция, метаболический синдром и микроальбуминурия. Нефрология 13(3): 24–32. [Shishkin AN, Lyndina ML (2009) Endothelial dysfunction, metabolic syndrome and microalbuminuria. Nefrologiya 13(3): 24–32. (In Russ)].
Velho G, Bouby N, Hadjadj S, Matallah N, Mohammedi K, Fumeron F, Potier L, Bellili-Munoz N, Taveau C, Alhenc-Gelas F, Bankir L, Marre M, Roussel R (2013) Plasma copeptin and renal outcomes in patients with type 2 diabetes and albuminuria. Diabetes Care 36(11): 3639–3645. https://doi.org/10.2337/dc13-0683
Bardoux P, Martin H, Ahloulay M, Schmitt F, Bouby N, Trinh-Trang-Tan MM, Bankir L (1999) Vasopressin contributes to hyperfiltration, albuminuria, and renal hypertrophy in diabetes mellitus: study in vasopressin-deficient Brattleboro rats. Proc Natl Acad Sci U S A 96(18): 10397–10402. https://doi.org/10.1073/pnas.96.18.10397
Bouby N, Hassler C, Bankir L (1999) Contribution of vasopressin to progression of chronic renal failure: study in Brattleboro rats. Life Sci 65(10): 991–1004. https://doi.org/10.1016/s0024-3205(99)00330-6
Bankir L, Bardoux P, Ahloulay M (2001) Vasopressin and diabetes mellitus. Nephron 87(1): 8–18. https://doi.org/10.1159/000045879
Кутина АВ, Наточин ЮВ (2008) Аналоги вазотоцина усиливают экскрецию белков почкой крыс. Рос физиол журн им ИМ Сеченова 94(11): 1325–1334. [Kutina AV, Natochin IuV (2008) Vasotocin analogues increase protein excretion by the rat kidney. Russ J Physiol 94(11): 1325–1334. (In Russ)].
Сивак КВ, Забродская ЯА, Добровольская ОА (2019) Апробация метода электрофоретического разделения и идентификации некоторых белков мочи у крыс при токсической нефропатии. Мед акад журн 19(3): 71–82. [Sivak KV, Zabrodskaya YA, Dobrovolskaya OA (2019) Approval of the method of electrophoretic separation and identification of some urine proteins in rats with toxic nephropathy. Med akad zhurn 19(3): 71–82. (In Russ)]. https://doi.org/10.17816/MAJ19371-82
Kutina AV, Golosova DV, Marina AS, Shakhmatova EI, Natochin YV (2016) Role of vasopressin in the regulation of renal sodium excretion: interaction with glucagon-like peptide-1. J Neuroendocrinol 28(4): 1–8. https://doi.org/10.1111/jne.12367
Kutina AV, Makashov AA, Balbotkina EV, Karavashkina TA, Natochin YV (2020) Subtypes of neurohypophyseal nonapeptide receptors and their functions in rat kidneys. Acta Naturae 12(1): 73–83. https://doi.org/10.32607/actanaturae.10943
Kutina AV, Shakhmatova EI, Natochin YuV (2010) Effect of a blocker of nitric oxide production on albumin excretion by rat kidney. Bull Exp Biol Med 150(6): 693–695. https://doi.org/10.1007/s10517-011-1225-z
Ivanova LN (2012) Vasopressin: molecular mechanisms of its antidiuretic effect. Neurosci Behav Physiol 42(7): 661–677. https://doi.org/10.1007/s11055-012-9618-7
Enhörning S, Bankir L, Bouby N, Struck J, Hedblad B, Persson M, Morgenthaler NG, Nilsson PM, Melander O (2013) Copeptin, a marker of vasopressin, in abdominal obesity, diabetes and microalbuminuria: the prospective Malmö Diet and Cancer Study cardiovascular cohort. Int J Obes (Lond) 37(4): 598–603. https://doi.org/10.1038/ijo.2012.88
Lang F, Guelinckx I, Lemetais G, Melander O (2017) Two liters a day keep the doctor away? Considerations on the pathophysiology of suboptimal fluid intake in the common population. Kidney Blood Press Res 42(3): 483–494. https://doi.org/10.1159/000479640
Meijer E, Bakker SJ, Halbesma N, de Jong PE, Struck J, Gansevoort RT (2010) Copeptin, a surrogate marker of vasopressin, is associated with microalbuminuria in a large population cohort. Kidney Int 77(1): 29–36. https://doi.org/10.1038/ki.2009.397
Student J, Sowers J, Lockette W (2022) Thirsty for fructose: arginine vasopressin, fructose, and the pathogenesis of metabolic and renal disease. Front Cardiovasc Med 9: 883365. https://doi.org/10.3389/fcvm.2022.883365
El Boustany R, Tasevska I, Meijer E, Kieneker LM, Enhörning S, Lefevre G, Mohammedi K, Marre M, Fumeron F, Balkau B, Bouby N, Bankir L, Bakker SJ, Roussel R, Melander O, Gansevoort RT, Velho G (2018) Plasma copeptin and chronic kidney disease risk in 3 European cohorts from the general population. JCI Insight 3(13): e121479. https://doi.org/10.1172/jci.insight.121479
Clark WF, Sontrop JM, Huang SH, Gallo K, Moist L, House AA, Cuerden MS, Weir MA, Bagga A, Brimble S, Burke A, Muirhead N, Pandeya S, Garg AX (2018) Effect of coaching to increase water intake on kidney function decline in adults with chronic kidney disease: The CKD WIT randomized clinical trial. JAMA 319(18): 1870–1879. https://doi.org/10.1001/jama.2018.4930
Natochin YV, Golosova DV, Shakhmatova EI (2018) A new functional role of oxytocin: participation in osmoregulation. Dokl Biol Sci 479(1): 60–63. https://doi.org/10.1134/S0012496618020096
Trinder D, Phillips PA, Stephenson JM, Risvanis J, Aminian A, Adam W, Cooper M, Johnston CI (1994) Vasopressin V1 and V2 receptors in diabetes mellitus. Am J Physiol 266(2 Pt 1): E217–E223. https://doi.org/10.1152/ajpendo.1994.266.2.E217
Edwards RM, Trizna W, Kinter LB (1989) Renal microvascular effects of vasopressin and vasopressin antagonists. Am J Physiol 256(2 Pt 2): F274–F278. https://doi.org/10.1152/ajprenal.1989.256.2.F274
Briner VA, Tsai P, Choong HL, Schrier RW (1992) Comparative effects of arginine vasopressin and oxytocin in cell culture systems. Am J Physiol 263(2 Pt 2): F222–F227. https://doi.org/10.1152/ajprenal.1992.263.2.F222
Nishikawa T, Omura M, Iizuka T, Saito I, Yoshida S (1996) Short-term clinical trial of 1-(1-[4-(3-acetylaminopropoxy)-benzoyl]-4-piperidyl)-3, 4-dihydro-2(1H)-quinolinone in patients with diabetic nephropathy. Possible effectiveness of the specific vasopressin V1 receptor antagonist for reducing albuminuria in patients with non-insulin dependent diabetes mellitus. Arzneimittelforschung 46(9): 875–878.
Okada H, Suzuki H, Kanno Y, Saruta T (1995) Effects of novel, nonpeptide vasopressin antagonists on progressive nephrosclerosis in rats. J Cardiovasc Pharmacol 25(5): 847–852. https://doi.org/10.1097/00005344-199505000-00023
Okada H, Suzuki H, Kanno Y, Saruta T (1996) Evidence for the involvement of vasopressin in the pathophysiology of adriamycin-induced nephropathy in rats. Nephron 72(4): 667–672. https://doi.org/10.1159/000188957
Perico N, Zoja C, Corna D, Rottoli D, Gaspari F, Haskell L, Remuzzi G (2009) V1/V2 Vasopressin receptor antagonism potentiates the renoprotection of renin-angiotensin system inhibition in rats with renal mass reduction. Kidney Int 76(9): 960–967. https://doi.org/10.1038/ki.2009.267
Bardoux P, Bichet DG, Martin H, Gallois Y, Marre M, Arthus MF, Lonergan M, Ruel N, Bouby N, Bankir L (2003) Vasopressin increases urinary albumin excretion in rats and humans: involvement of V2 receptors and the renin-angiotensin system. Nephrol Dial Transplant 18(3): 497–506. https://doi.org/10.1093/ndt/18.3.497
Bardoux P, Bruneval P, Heudes D, Bouby N, Bankir L (2003) Diabetes-induced albuminuria: role of antidiuretic hormone as revealed by chronic V2 receptor antagonism in rats. Nephrol Dial Transplant 18(9): 1755–1763. https://doi.org/10.1093/ndt/gfg277
Terada Y, Tomita K, Nonoguchi H, Yang T, Marumo F (1993) Different localization and regulation of two types of vasopressin receptor messenger RNA in microdissected rat nephron segments using reverse transcription polymerase chain reaction. J Clin Invest 92(5): 2339–2345. https://doi.org/10.1172/JCI116838
Tagawa T, Imaizumi T, Shiramoto M, Endo T, Hironaga K, Takeshita A (1995) V2 receptor-mediated vasodilation in healthy humans. J Cardiovasc Pharmacol 25(3): 387–392. https://doi.org/10.1097/00005344-199503000-00006
Loichot C, Krieger JP, De Jong W, Nisato D, Imbs JL, Barthelmebs M (2001) High concentrations of oxytocin cause vasoconstriction by activating vasopressin V1A receptors in the isolated perfused rat kidney. Naunyn Schmiedebergs Arch Pharmacol 363(4): 369–375. https://doi.org/10.1007/s002100000372
Elberry AA, Refaie SM, Kamel M, Ali T, Darwish H, Ashour O (2013) Oxytocin ameliorates cisplatin-induced nephrotoxicity in Wistar rats. Ann Saudi Med 33(1): 57–62. https://doi.org/10.5144/0256-4947.2013.57
Tribollet E, Barberis C, Dreifuss JJ, Jard S (1988) Autoradiographic localization of vasopressin and oxytocin binding sites in rat kidney. Kidney Int 33(5): 959–965. https://doi.org/10.1038/ki.1988.94
Arpin-Bott MP, Waltisperger E, Freund-Mercier MJ, Stoeckel ME (1997) Two oxytocin-binding site subtypes in rat kidney: pharmacological characterization, ontogeny and localization by in vitro and in vivo autoradiography. J Endocrinol 153(1): 49–59. https://doi.org/10.1677/joe.0.1530049
Soares TJ, Coimbra TM, Martins AR, Pereira AG, Carnio EC, Branco LG, Albuquerque-Araujo WI, de Nucci G, Favaretto AL, Gutkowska J, McCann SM, Antunes-Rodrigues J (1999) Atrial natriuretic peptide and oxytocin induce natriuresis by release of cGMP. Proc Natl Acad Sci U S A 96(1): 278–283. https://doi.org/10.1073/pnas.96.1.278
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


