Сенсорные системы, 2019, T. 33, № 4, стр. 269-286
Структура сетчатки глаза человека: классические и современные данные
С. В. Алексеенко *
Институт физиологии им. И.П. Павлова Российской академии наук
199034 Санкт-Петербург, наб. Макарова, д. 6, Россия
* E-mail: binocularity@yandex.ru
Поступила в редакцию 25.02.2019
После доработки 26.05.2019
Принята к публикации 05.07.2019
Аннотация
Представлен краткий обзор имеющихся к настоящему времени данных о сетчатке глаза человека. Приведены классические сведения об общей структуре и клеточном составе этого первого нейронного отдела зрительной системы, а также данные, полученные при использовании новых усовершенствованных методик исследований, которые существенно обогатили и детализировали имевшиеся ранее представления о сетчатке.
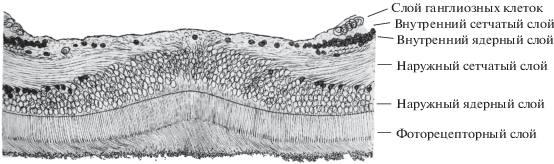
Зрительные способности человека во многом определяются структурной и функциональной организацией сетчатки глаза. К настоящему времени накоплен большой объем материала по морфологии сетчаток человека и обезьян Старого Света, которые во многом сходны (Curcio et al., 1990). Это обстоятельство позволяет интегрировать получаемые в разных исследованиях данные, способствуя формированию более полного представления о структуре. У человека и обезьян сетчатка расположена на внутренней стенке глазного яблока (имеющего диаметр около 24 мм) за стекловидным телом, в ней выделяют десять слоев, которые различаются клеточным составом и cинаптическими связями. Примечательно, что сетчатка инвертирована по отношению к ходу световых лучей: слой светочувствительных рецепторов (входных элементов сетчатки) наиболее удален от оптического аппарата глаза, так что световые лучи проходят к рецепторам через всю толщину сетчатки. При этом возникающие в рецепторах сигналы далее распространяются по сетчатке в обратном направлении, претерпевая сложную обработку, и преобразуются в сигналы ганглиозных клеток (выходных элементов сетчатки), аксоны которых объединяются в зрительный нерв и направляются в мозг.
СВЕДЕНИЯ ОБ ОСНОВНЫХ ЧАСТЯХ СЕТЧАТКИ
В сетчатке выделяют несколько зон, характеризующихся специфическими структурными и морфологическими особенностями, которые подробно описаны Поляком (Polyak, 1941).
Макула (macula lutea) – центральная зона сетчатки диаметром ~5.5 мм, имеющая желтоватую пигментацию – желтое пятно. В состав макулы входят: фовеа с фовеолой, парафовеа и перифовеа.
Фовеола – центральная часть макулы диаметром ~ 350 мкм (~1.25 угл. град.), в которой толщина сетчатки минимальна – 230 ± 21 мкм (Tick et al., 2011). В фовеоле световые лучи могут беспрепятственно проходить к слою фоторецепторов инвертированной сетчатки. Центр фовеолы расположен на ~3.5 мм темпоральнее головки оптического нерва (optic papilla) с небольшими вариациями положения относительно оптической оси глаза. В фовеоле расположены только колбочки, плотность которых, по данным работы (Curcio et al., 1990), составляет в среднем 199 000/мм2, варьируя от 100 000 до 324 000/мм2. Фоторецепторы фовеолы окружены отростками клеток мюллеровской глии, но их ядра лежат в следующем, наружном ядерном слое.
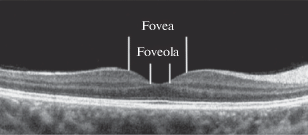
Фовеа (fovea centralis) – область диаметром ~1.5 мм (~5 угл. град). В состав фовеа входит фовеола и окружающая ее наклонная зона (clivus) шириной 70–100 мкм, где толщина сетчатки увеличивается до уровня парафовеа (рис. 1). Фовеа формируется в результате противоположно направленных процессов: центробежного смещения клеток внутренних слоев сетчатки и миграции колбочек в сторону центра сетчатки. Вследствие этого в фовеа частично или полностью отсутствуют внутренние слои сетчатки (рис. 2), они как бы отодвинуты в сторону, и при этом увеличена толщина слоя фоторецепторов. Кровеносные сосуды огибают фовеа, образуя аваскулярную зону диаметром 250–600 мкм (Provis et al., 2005).
Рис. 1.
Срез сетчатки человека в области фовеа, полученный методом оптической когерентной томографии (Вахрамеева и др., 2013).
Парафовеа – зона шириной 0.5 мм, окружающая фовеа, в которой толщина сетчатки максимальна (349 ± 17 мкм) (Tick et al., 2011). В парафовеа расположено 7–11 рядов биполярных клеток и 4–8 рядов ганглиозных клеток (ГК), в ней низкая плотность кровеносных сосудов (Provis et al., 2005).
Перифовеа – зона шириной 1.5 мм, которая окружает парафовеа. Это переходная зона между высокоспециализированной центральной зоной и периферией. Зона обильно снабжена кровеносными сосудами. В ней значительно увеличено количество палочек (Provis et al., 2005). В перифовеа расположено шесть рядов биполярных клеток и несколько (1–4) рядов ГК.
Периферия– зона, простирающаяся от перифовеа до зазубренного края сетчатки (ora serrata). В ней выделяют три подзоны: ближняя периферия шириной 1.5 мм, средняя периферия (экватор) шириной 3 мм; дальняя периферия, размер которой варьирует в зависимости от размера глаза. В ближней периферии расположен один, изредка два, ряда ГК. В средней периферии слой ГК разделяется на сегменты или группы клеток. В дальней периферии большинство ГК расположено на значительных расстояниях друг от друга.
СВЕДЕНИЯ ОБ ОСНОВНЫХ СЛОЯХ СЕТЧАТКИ
Фоторецепторный слой. По данным работы Поляка (Polyak, 1941) толщина фоторецепторного слоя постепенно увеличивается при переходе от периферии к центру, однако резкое увеличение наблюдается только в центре сетчатки, где длина фовеолярных колбочек (до 70 мкм у человека) почти в 2 раза превышает длину периферических фоторецепторов. В этой части сетчатки колбочки образуют частокол плотно упакованных клеток, названный Поляком “букетом колбочек”.
Данные о количестве и плотности фоторецепторов у человека получены при анализе срезов сетчатки на уровне внутренних сегментов рецепторов (Curcio et al., 1990). В разных сетчатках в данных срезах было насчитано от 4.08 до 5.29 млн колбочек и от 78 до 107 млн палочек, которые обеспечивают кодирование зрительного изображения в разных диапазонах интенсивности света (фотопическое и скотопическое зрение). Однако отношение между количеством палочек и колбочек меняется по мере удаления от центра сетчатки. В фовеоле отсутствуют палочки, в парафовеа отношение палочки/колбочки составляет уже 4/1, а в разных участках перифовеа – (33–130)/1 (Provis et al., 2005).
Пиковая плотность колбочек обнаружена в центральном участке фовеа размером 0.032 угл. град2, где она варьирует в среднем от 100 000 до 324 000/мм2. Затем плотность колбочек резко уменьшается к парафовеа до 20 000/мм2, при этом вблизи горизонтального меридиана сетчатки наблюдается некоторое увеличение их плотности. В перифовеа плотность постепенно снижается до уровня 1000/мм2 и к дальней периферии снижается еще на 20%. Однако в дальней периферии отмечено увеличение плотности колбочек (Williams, 1991). Кроме того, снижение плотности колбочек в зависимости от эксцентриситета происходит быстрее вдоль вертикали, чем горизонтали (колбочковая полоска). Также обнаружено увеличение на 45% плотности колбочек в назальной части сетчатки по сравнению с темпоральной (Curcio et al., 1990).
В центре фовеа плотно расположены L- и M-колбочки, чувствительные к длинноволновому и средневолновому диапазонам спектра соответственно. По морфологическим признакам эти типы колбочек не различаются. Молекулярно-генетический анализ показал, что локусы генов их фотопигментов расположены в тандемном массиве на Х-хромосоме с почти идентичными последовательностями аминокислот (Dacey, 2000). Однако имеются данные, указывающие на возможность различий между L- и M-колбочками по количеству синаптических контактов с фовеальными биполярными клетками оff-типа (Schein et al., 2011). Мозаики распределения L- и M-колбочек не зависят друг от друга, но в периферии сетчатки наблюдается тенденция к группированию однотипных колбочек (Hsu et al., 2000). У людей, не имеющих нарушений цветового зрения, выявлены значительные индивидуальные различия количества L- и M-колбочек, что отражается на значениях отношения L/M: от 1/3 до 16/1 (Dacey, Packer, 2003).
S-колбочки, обладающие чувствительностью к излучениям коротковолнового диапазона спектра, морфологически отличаются от L- и M-колбочек и составляют только 5–10% от общего количества колбочек у человека. Максимальная плотность (более 2000/мм2) наблюдается в кольце с эксцентриситетом 0.1–0.5 мм, где они составляют до 5–8% от локальной популяции колбочек по данным работы (Curcio et al., 1991). Следует заметить, что эти авторы не обнаружили S-колбочек в центре фовеальной зоны диаметром ~100 мкм (0.35 угл.град). Однако по данным работы Ахнелт и соавт. (Ahnelt et al., 1990) доля S-колбочек в центре фовеолы составляет 3–5%, на фовеальном склоне она увеличивается до 15%, а на периферии сетчатки снижается до 7–10%.
Наружный ядерный слой (outer nuclear layer) – слой, в котором расположены ядра фоторецепторов. В фовеальной наиболее широкой части этого слоя расположено до десяти рядов ядер колбочек. На склоне фовеа в мозаике этих рядов просматриваются наклонные колонки из ядер, радиально расходящиеся из центра фовеа (рис. 2). В парафовеа толщина слоя уменьшена, но в ней постепенно увеличивается количество ядер палочек, которые в периферической части парафовеа образуют четыре слоя, а количество ядер колбочек уменьшается до одного слоя, локализованного непосредственно под внешним пограничным слоем сетчатки. В перифовеа слой состоит из пяти-шести рядов ядер, причем самый верхний ряд образован ядрами колбочек. В периферических частях сетчатки человека насчитывается до четырех рядов ядер, у макаки количество рядов снижено до двух-трех (Polyak, 1941).
Наружный сетчатый слой (outer plexiform layer) – слой первых синаптических контактов в сетчатке. В нем окончания фоторецепторов из наружного ядерного слоя образуют связи с дендритами биполярных и горизонтальных клеток (Polyak, 1941; Mariani, 1984). Толщина наружного сетчатого слоя увеличена в области фовеального склона, где расположены протяженные наклонные волокна Хенле, исходящие от ножек колбочек и сферул палочек центральной сетчатки к смещенным в сторону периферии сетчатки клеткам последующих слоев.
В этом слое формируется и передается на следующий нейронный уровень концентрическая структура рецептивных полей (РП) с антагонистической организацией центр-периферия. Кроме того, связь фоторецепторов с биполярными клетками разного типа обеспечивает разделение ретинальных сигналов на параллельные пути (Dacey, 2000; Masland, 2012). Кроме химических синапсов, в этом слое образуются электрические контакты (gap junctions) между колбочками, а также между палочками и колбочками; электрические контакты между палочками встречаются относительно редко (Hsu et al., 2000; Bloomfield, Dacheux, 2001). Также отмечено, что S-колбочки не имеют электрических синапсов, а вероятность образования таких контактов между однотипными колбочками (L с L, M c M) больше, чем между разнотипными (L c M) (Hsu et al., 2000).
Внутренний ядерный слой (inner nuclear layer) состоит из тел (perikaryon) горизонтальных, биполярных и амакриновых клеток (АК), а также клеток Мюллера и интерплексиформных клеток. Вследствие центрифугального смещения клеток в пренатальный период развития толщина внутреннего ядерного слоя (ВЯС) различается в разных частях сетчатки. Из области фовеа наименее смещены тела клеток, которые локализуются вблизи слоя фоторецепторов, т.е. горизонтальных клеток. Эти клетки обнаруживаются, начиная с краев фовеолы. Тела биполярных и интерплексиформных клеток, а также клеток Мюллера располагаются в середине слоя, их количество резко уменьшается на фовеальном склоне. На этом склоне направление дендритов и аксонов биполярных клеток отклонено от вертикального (относительно слоев). Подобное отклонение наблюдается также у биполярных клеток дальней периферии сетчатки, где снижено количество клеток, с которыми аксоны биполяров имеют синаптические контакты. АК, которые располагаются в нижнем подслое ВЯС, в области фовеа отсутствуют. В парафовеа толщина слоя максимальна, в ней клетки образуют 12 рядов. В перифовеа слой редуцирован до шести – семи рядов клеток, в периферии – до двух-трех рядов (Polyak, 1941).
ТИПЫ КЛЕТОК ВНУТРЕННЕГО ЯДЕРНОГО СЛОЯ
Горизонтальные клетки сетчатки модулируют выходные сигналы фоторецепторов и участвуют в формировании тормозной периферии РП биполярных клеток (Boycott, Wassle, 1999; Verweij et al., 1999). Кроме того, за счет усреднения сигналов фоторецепторов они могут усиливать контраст при сохранении пространственной информации (Chapot et al., 2017). Эти клетки получают входы от фоторецепторов посредством химических синапсов, а также имеют электрические контакты с другими горизонтальными клетками, образуя синцитий, что приводит к увеличению их РП за пределы области связей с фоторецепторами. Аксоны горизонтальных клеток обеспечивают отрицательную обратную связь на фоторецепторы (Dacey, Packer, 2003; Dacey et al., 2014).
По морфологическим критериям и структуре синаптических контактов во всех участках ВЯС выделено три типа горизонтальных клеток. Клетки HI контактируют со всеми типами колбочек, предпочтительно (85%) с L и M, а их протяженные аксоны оканчиваются на сферулах палочек (Kolb, 1970; Mariani, 1984; Dacey, 2000). Клетки НII также контактируют со всеми типами колбочек, а аксоны только с S-колбочками (Mariani, 1984; Goodchild et al., 1996). Предполагается, что HII cуммируют входы из L- и M-колбочек и обеспечивают латеральное торможение в сети S-колбочек, формируя у них цветооппонентность РП (Dacey, Packer, 2003). Большие асимметричные дендритные поля клеток HIII связаны с L- и M-колбочками и не имеют контактов с S-колбочками, при этом HIII имеют на 30% больше контактов с колбочками, чем клетки HI при тех же эксцентриситетах (Kolb et al., 1992). Плотность расположения и размеры дендритных полей наиболее изучены у клеток типа НI и НII в сетчатке макаки. Показано превышение количества клеток НI по сравнению с НII при всех эксцентриситетах. При этом вблизи фовеа отношение количества клеток НI/HII составляет 4/1, в средней периферии – 3/1, при большем эксцентриситете – 2/1 (Wassle, 2004).
Биполярные клетки (биполяры) передают зрительную информацию от фоторецепторов к ГК и АК. Рамон-и-Кахал (Ramon y Cajal, 1893) при окрашивании срезов сетчатки по методу Гольджи впервые выявил биполяры, контактирующие с палочками или с колбочками. Затем Поляк (Polyak, 1941) по протяженности дендритных полей разделил биполяры на карликовые (midget), которые в основном располагаются в центре сетчатки, и на диффузные, расположенные по всей сетчатке и контактирующие с несколькими колбочками. В дальнейшем было показано, что биполяры разделяются также на два типа в зависимости от структуры их синаптических контактов с фоторецепторами. У одних биполяров дендритные отростки распределяются по поверхности фоторецептора, образуя плоские (базальные) синаптические контакты, у других биполяров отростки дендритов входят в глубь фоторецептора до пресинаптических лентообразных структур, образуя инвагинирующие контакты. Эти типы биполяров различаются также глубиной стратификации аксонов во внутреннем сетчатом слое (ВСС) сетчатки и характером реакций на световую стимуляцию. У биполяров с инвагинирующими контактами и ветвлениями аксонов в нижней половине ВСС при освещении наблюдается деполяризация, при затемнении – гиперполяризация (биполяры оn-типа). У биполяров с базальными синапсами и локализацией аксонов в верхней половине ВСС наблюдается обратное – гиперполяризация при освещении и деполяризация при затемнении (биполяры оff-типа) (Kolb, 1970; Boycott, Wassle, 1999). Дихотомия биполяров на оn- и оff -типы была подтверждена при исследовании ультраструктуры их синаптических контактов на ножках колбочек, состава имеющихся у них на поверхности рецепторов глютамата, чувствительности к разным иммуногистохимическим маркерам. На основании совокупности этих признаков в сетчатке приматов и человека было выделено десять типов колбочковых и один тип палочковых биполяров (Boycott, Wassle, 1999). Впоследствии в результате использования комплекса методов (Гольджи, электронная микроскопия (ЭМ), иммунохимия и электрофизиология) был выделен еще один тип колбочковых биполяров (ДБ-3б), для которых характерны контакты и с палочками. К настоящему времени в сетчатке приматов выделено шесть типов колбочковых оn-биполяров (ИКБ, ДБ-4, ДБ-5, ДБ-6, СБ, ГБ) и пять типов оff-биполяров (ПКБ, ДБ-1, ДБ-2, ДБ-3a, ДБ-3б) (рис. 3). Отмечается, что из 12 типов биполяров (включая палочковые), выделенных по морфологическим признакам, десять были подтверждены данными исследований иммуногистохимическими методами (Tsukamoto, Omi, 2016).
Рис. 3.
Типы биполярных клеток сетчатки приматов, расположенные по уровню стратификации их аксонов (адаптировано из рисунков статей (Boycott, Wassle, 1999; Tsukamoto, Omi, 2016).
а – внутренний ядерный слой; б – внутренний сетчатый слой; ДБ-1 – ДБ-6 –диффузные биполяры, ИКБ-инвагинирующий карликовый биполяр, ПКБ – плоский карликовый биполяр, СБ – “синий” биполяр, ПБ – палочковый биполяр, ГБ – гигантский биполяр.
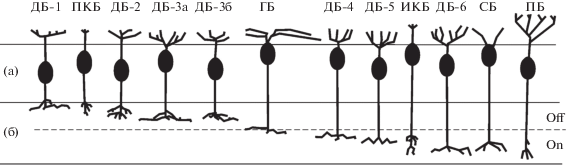
Палочковые биполяры (ПБ на рис. 3) образуют контакты только с палочками, они обнаруживаются в сетчатке человека, начиная с расстояния ~1 мм от центра фовеа (Kolb, 1970). Размер их дендритных полей увеличивается с эксцентриситетом. В центральной сетчатке один палочковый биполяр контактирует примерно с 30-35 палочками, на периферии – с 40–45 палочками (Kolb et al., 1992). Эти биполяры образуют инвагинирующие контакты со сферулами палочек, терминали их аксонов расположены в нижней половине ВСС (Polyak, 1941; Kolb et al., 1992), т.е. в оn-половине. В отличие от колбочковых биполяров, палочковые биполяры не имеют прямых связей с ГК, подключаясь к промежуточному слою АК.
Колбочковые биполяры обнаруживаются в сетчатке, начиная с расстояни 100 мкм от центра фовеа. Их плотность у макаки в 2.4–4 раза превышает плотность колбочек при всех эксцентриситетах. У карликовых биполяров, расположенных в центральной части сетчатки, размер дендритного ветвления сопоставим с размером ножки одной колбочки, у периферических карликовых биполяров наблюдается несколько (2–3) кластеров дендритных терминалей, что указывает на контакты с несколькими колбочками. Pазмер аксонных ветвлений у центральных биполяров составляет 4–10 мкм и увеличивается в периферических областях до 20 мкм (Polyak, 1941; Kolb et al., 1992). В ЭМ исследованиях показано, что в фовеа каждая из L- и M-колбочек связана (являясь пресинаптической) с двумя карликовыми биполярами, один из которых оn-типа (ИКБ на рис. 3), другой – оff-типа (ПКБ на рис. 3) (Kolb, 1970; Ahmad et al., 2003). На основании данных электрофизиологических исследований, предполагается, что синаптические контакты карликовых биполяров с L- и М-колбочками обеспечивают формирование центральной зоны их РП, а тормозная периферическая зона РП образуется при участии горизонтальных клеток типа НI (Dacey, 2000).
Диффузные биполяры, которые разделены на шесть типов (ДБ-1–ДБ-6), различаются морфологией дендритов и типом их синаптических контактов (инвагинирующие и плоские) с L-, M-колбочками, а также стратификацией аксонов во ВСС. Отмечено также небольшое количество их контактов с S-колбочками. Диффузные биполяры ДБ-4–ДБ-6 относятся к оn-типу, биполяры ДБ-1–ДБ-3 – к оff-типу (Tsukamoto, Omi, 2016). В центральной части сетчатки человека один диффузный биполяр образует контакты как минимум с пятью колбочками, на периферии – с 10–15 колбочками (Kolb et al., 1992; Tsukamoto, Omi, 2016). В фовеальном участке сетчатки макаки, в котором плотность колбочек составляет 26 500/мм2, на каждую ножку колбочки, в среднем, приходится 0.88 оff-диффузных биполяра и только 0.4 оn-диффузных биполяра. Предполагается, что эта асимметрия может иметь связь с различиями в разрешающей способности и чувствительности к инкрементам и декрементам освещенности (Ahmad et al., 2003).
В отдельный тип выделены биполяры, контактирующие только с S-колбочками (СБ на рис. 3), которые по морфологическим признакам отличаются от L- и M-колбочек. Эти биполяры, названные “синими” (Mariani, 1984), относятся к оn-типу, их дендриты образуют инвагинирующие контакты с ножками S-колбочек, а терминали аксонов локализуются в нижней половине ВСС. Размеры сомы и дендритных полей этих биполяров увеличиваются с эксцентриситетом. Установлено, что их количество в 2 раза превышает количество S-колбочек; кроме того, каждая S-колбочка связана с одним–пятью СБ-биполярами, а каждый СБ-биполяр имеет контакты с одной– тремя S-колбочками (Wässle, 2004).
По морфологическим характеристикам в сетчатке приматов и человека выделен тип “гигантских” биполяров (ГБ на рис. 3) (Polyak, 1941; Mariani, 1984; Kolb et al., 1992). Эти биполяры имеют большие дендритные поля с редкими ветвями и аксонные поля в 2 раза меньшего размера. В отличие от других крупных клеток с обширными дендритными полями (ДБ-6, СБ), аксоны которых локализуются в нижней половине ВСС, у “гигантских” биполяров аксоны расположены в середине этого слоя. “Гигантские” биполярные клетки образуют контакты менее, чем с 50% колбочек (L- и M-), расположенных в области их дендритных полей (Jоо et al., 2010). Также обнаружены контакты “гигантских” биполяров с палочками (Tsukamoto, Omi, 2016).
Амакриновые клетки (АК) расположены в нижней части ядерного слоя или немного смещены во ВСС. Исходя из названия, которое было дано Рамоном-Кахалем (Ramon y Cajal, 1893), это клетки без аксона, однако Колб (Kolb, 1997) отмечает, что некоторые АК с широкими дендритными полями имеют протяженные аксоноподобные отростки, не покидающие сетчатку в составе зрительного нерва.
Амакриновые клетки – гетерогенная группа интернейронов сетчатки, которые интегрируют и модифицируют сигналы, поступающие в слой ГК. Почти все АК содержат тормозный медиатор – ГАМК (55%) или глицин (40%) в сочетании с другими нейромодуляторами и нейропередатчиками, такими как глутамат, ацетилхолин, допамин, субстанция Р (Kolb, 1997; Masland, 2012).
Амакриновые клетки получают входы (являясь постсинаптическими) от биполяров, других АК, а их выходы контактируют с биполярами АК и ГК. При этом входные и выходные синапсы на отростках АК достаточно часто расположены недалеко друг от друга. АК подразделяют на клетки с узкими (narrow-field) дендритными полями диаметром 30–150 мкм, мелкими (small-field) диаметром 150–300 мкм, средними (medium-field) диаметром 300–500 мкм и широкими полями (wide-field) диаметром >500 мкм (Kolb et al., 1992). Кроме того, АК различаются локализацией дендритов или аксонов во ВСC, поэтому их классифицируют на моно-, би-, мультистратифицированные, а также диффузные, у которых отростки распространяются на всю толщину ВСС. В разных подслоях этого слоя АК образуют контакты (химические и электрические) с определенными типами клеток, формируя сети, предназначенные для выполнения разных зрительных функций. Специфическая роль АК многих типов еще неясна.
В сетчатке человека и приматов различают более 30 морфологически идентифицируемых типов АК. Наиболее исследованы АК двух типов – AII и A17, которые участвуют в нейронных сетях передачи информации из фоторецепторов-палочек. АК типа АII называют “палочковыми амакриновыми клетками”, так как характеристики их ответов (порог чувствительности, уровень насыщения, спектральная чуствительность) сходны с палочками. При темновой адаптации у этих клеток выявляется антагонистическая структура РП с оn-центральной зоной, однако при световой адаптации периферическая зона не обнаруживается (Bloomfield, Dacheux, 2001). Пиковая плотность клеток АII в сетчатке обезьян наблюдается на расстоянии 1.5 мм от центра фовеа. Отростки бистратифицированных клеток AII ветвятся в обоих оff- и оn-половинах ВСС. AII получают входы из терминалей аксонов палочковых биполяров, и в этой же оn-половине ВСС они образуют электрические синапсы с колбочковыми биполярами оn-типа. При этом отростки AII в оff-половине ВСС образуют химические синапсы с колбочковыми биполярами оff-типа. Таким образом, клетки АII объединяют параллельно идущие колбочковые и палочковые пути и обеспечивают разную степень тормозных влияний в зависимости от интенсивности света. Обнаружено, что клетки AII у приматов и человека имеют контакты с колбочковыми оn-биполярами во всех частях сетчатки, включая фовеальную область, в которой палочки и палочковые биполяры встречаются редко или отсутствуют. На основании этих данных предполагается, что AII первоначально развивались для обслуживания колбочковых путей, а впоследствии были вовлечены в обработку скотопических сигналов через палочковые биполяры (Strettoi et al., 2018). A17 – наиболее исследованные ГАМК-ергические АК, РП которых не имеют тормозной периферии. Эти клетки контактируют с АК в оff-половине ВСС и с биполярами оn-половины слоя, образуя реципрокные связи с аксонами палочковых биполяров. Также известно, что они чувствительны в диапазоне низкой освещенности (Kolb, 1997).
Внутренний сетчатый слой (inner plexiform layer), в котором образованы контакты между биполярными, АК и ГК. Это второй уровень обработки ретинальных сигналов. В разных подслоях этого слоя формируются специфические контакты между клетками разных функциональных типов.
Слой ганглиозных клеток (stratum ganglionare) – это выходной слой сетчатки человека и приматов, в котором кроме ГК расположены также “смещенные” АК, перициты, астроциты, эндотелиальные клетки. ГК получают входы от биполярных и АК, локализованных во ВЯС, и направляют аксоны в составе зрительного нерва в другие структуры мозга. Причем информация от ГК в отличие от фоторецепторов, горизонтальных, биполярных и АК передается в виде импульсной активности.
В этом слое сетчатки человека расположено в среднем до двух миллионов ГК. При этом отмечается большая индивидуальная вариабельность этих значений. У взрослого человека около 50% ГК находится в пределах проекции до 13–16 угл. град. поля зрения (Curcio, Allen, 1990). У обезьян общее количество ГК варьирует от 1.4 до 1.8 млн и совпадает с количеством их аксонов в зрительном нерве (Perry, Cowey, 1985). Распределение ГК в слое неоднородно. В области наибольшей толщины слоя (60–70 мкм), которая расположена на краю фовеа и прилегающей к ней части парафовеа, ГК упорядочены в шесть–семь рядов. На фовеальном склоне при переходе от парафовеа к фовеола количество рядов резко снижается до одного слоя, причем у человека в фовеола изредка встречаются только отдельные ГК на расстоянии более 150–200 мкм от ее центра (Curcio, Allen, 1990). Количество ГК постепенно снижается также и к периферии сетчатки, в дальней периферии клетки расположены в один ряд на разных расстояниях друг от друга (Polyak, 1941).
Снижение количества ГК в центре сетчатки обусловлено их смещением в область парафовеа в пренатальном периоде развития. В результате этого возникает несоответствие между положением тел ГК и положением их входов в фоторецепторном слое. Величина смещений РП определяется длиной аксонов фовеальных фоторецепторов, образующих лучеобразно расходящиеся волокна Хенле и контактирующих с биполярными клетками, а также протяженностью наклонного хода аксонов биполярных клеток, которые образуют контакты с ГК. Отмечено, что и дендритные поля фовеолярных ГК у приматов смещены в сторону фовеа относительно их тел (Curcio, Allen, 1990). По данным Драсдо и соавт. (Drasdo et al., 2007) у человека максимальное смещение составляет 626 мкм, из которого 558 мкм – это длина волокон Хенле. Подобная максимальная протяженность фовеолярных волокон Хенле (~600 мкм) была показана и другими авторами. Отметим, что увеличенное количество рядов ГК в парафовеа сетчатки указывает на то, что там расположены как ГК, мигрировавшие из фовеальной части сетчатки, так и несмещенные, однако детальный порядок расположения ГК в этой области, учитывающий локализацию связанных с ними фоторецепторов, к настоящему времени не выяснен.
Область сетчатки с наибольшей плотностью ГК (32 000–38 000/мм2) имеет форму горизонтально ориентированного, овального кольца, удаленного от центра фовеа на расстояние 0.4–2.0 мм. Причем профили линий одинаковой плотности (isodensity contours) ГК смещены в сторону назальной сетчатки, где их дендритные поля имеют меньший размер. Пиковая плотность ГК (в среднем 35100/мм2) обнаружена на эксцентриситете 0.65–1 мм. При этом пик плотности может быть расположен в назальной сетчатке в разных ее участках. Плотность ГК фовеальной области – менее 2500/мм2. В периферической области сетчатки, за пределами кольца, плотность ГК постепенно снижается до 170–350/мм2 вблизи ora serrata (Curcio, Allen, 1990).
Показаны также различия в плотности ГК разных квадрантов сетчатки. В верхней области сетчатки плотность клеток на 60% больше, чем в нижней (Curcio, Allen, 1990). Кроме того, в назальной половине сетчатки плотность клеток на 300% превышает плотность в темпоральной половине при тех же значениях эксцентриситета. При этом в назальной половине сетчатки при переходе от центра к периферии плотность менее значительно снижается, чем в темпоральной. В темпоральной половине градиент плотности центр/периферия составляет 7/1, в назальной половине сетчатки 2.6/1 (Provis et al., 2005). Относительно менее значительное снижение плотности клеток в назальной половине сетчатки указывает на важность детальной оценки положения объектов и параметров их движения в темпоральном полуполе зрения по сравнению с назальным для ориентировки в пространстве. У макаки профили линий одинаковой плотности ГК, как и колбочек, располагаются не радиально вокруг фовеа, а смещены в сторону назальной сетчатки, где их дендритные поля имеют меньший размер. Пиковая плотность ГК выявлена на расстоянии от 0.6 до 1 мм от фовеа.
Известно, что ГК сетчатки развиваются раньше клеток других типов и их распределение меняется в пренатальном периоде. Наибольшая плотность ГК у человека наблюдается на 17-й пренатальной неделе (в среднем 20986–23474/мм2). Во второй половине пренатального периода плотность клеток снижается и к концу этого периода составляет в среднем 2750/мм2. При этом в перифовеальной области сетчатки плотность остается высокой (18 000–21 000/мм2), а в фовеальной области уменьшается до 2132/мм2 (Provis et al., 2005).
ТИПЫ ГАНГЛИОЗНЫХ КЛЕТОК
По морфологическим признакам в сетчатке приматов выделено более 15–20 типов ГК (Kolb et al., 1992; Yamada et al., 2005; Thoreson, Dacey, 2019). На тотальных плоских препаратах сетчатки in vitro у менее половины этих типов клеток исследованы также функциональные характеристики при одновременном использовании комплекса методов (введение ретроградно транспортируемых маркеров в подкорковые центры проекций этих клеток, внутриклеточное окрашивание клеток и регистрация их активности на хроматические и ахроматические стимулы) (Dacey, 2000). Относительно недавно разработанный метод фотодинамического окрашивания клеток ретроградно транспортируемым конъюгатом родамина позволил более детально оценить морфологические характеристики клеток, мозаику их распределения, а также выявить новые типы ГК (Dacey et al., 2003).
Карликовые (midget) ганглиозные клетки
Наиболее многочисленный тип ГК составляют клетки, названные карликовыми (рис. 4, а), поскольку в центре сетчатки размер их дендритных полей составляет только 5–10 мкм (Polyak, 1941). С эксцентриситетом размер их полей увеличивается, при этом уменьшается плотность клеток. Карликовые ГК составляют ~95% в фовеальной области сетчатки и ~45% в периферии. Отмечено, что размеры дендритных полей карликовых ГК у человека и макаки не отличаются. В центральной части сетчатки человека (0–6 угл. град.) размер дендритных полей значительно не меняется. При эксцентриситете от 2 до 7 мм (6–25 угл. град.) он резко увеличивается в 10 раз, затем в диапазоне эксцентриситета от 7 до 20 мм (25–75 угл. град.) увеличивается в 2–3 раза при значительной вариабельности. В назальном квадранте сетчатки дендритные поля и тела карликовых ГК меньше, чем в темпоральном (Dacey, 1994).
Рис. 4.
Локализация дендритов некоторых типов ганглиозных клеток (ГК) во внутреннем сетчатом слое сетчатки (адаптировано из статьи (Dacey, Packer, 2003).
а – карликовые ГК; б – парасольные ГК; в – гигантские ГК; г – колючая широкая ГК; д – колючие узкие ГК; е – мелкая бистратифицированная ГК; ж – крупная бистратифицированная ГК.
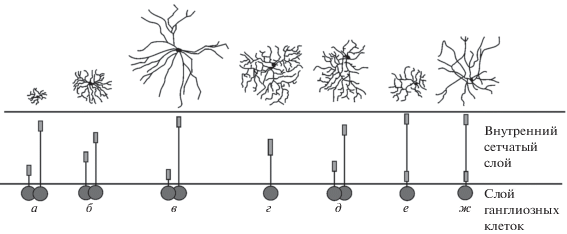
Особенностью организации вертикальных нейронных связей в фовеальной части сетчатки является прямой путь из отдельной колбочки через карликовую биполярную клетку к карликовой ГК. Такие связи были прослежены при анализе Гольджи препаратов сетчатки человека и приматов (Polyak, 1941; Kolb, 1970). По мнению Провис и соавт. (Provis et al., 2005) параллельные и раздельные пути из отдельных колбочек, кроме возможности увеличения плотности мелких клеток, обеспечивают также сохранность нервных волокон и синаптических контактов при смещении положения клеток в процессе образования фовеальной ямки.
Сведения о том, что в фовеа каждый карликовый биполяр имеет выход на одну карликовую ГК, были подтверждены в электронно-микроскопических (ЭМ) исследованиях (Boycott, Wassle, 1999), однако при этом было также показано, что каждая колбочка имеет контакты, в основном с двумя биполярами (Wässle, 2004; Tsukamoto, Omi, 2016). В центральной части сетчатки на одну колбочку приходится две-три ГК (Curcio, Allen, 1990), в среднем 2.4 ГК (Drasdo et al., 2007), 2.6 ГК (Ahmad et al., 2003). Также определено количество колбочек, приходящихся на одну карликовую ГК в периферии сетчатки: десять колбочек при эксцентриситете ~3 мм (Tsukamoto, Omi, 2016), 12–19 колбочек при эксцентриситете 6.8 мм (Field et al., 2010). Увеличение этих значений может быть обусловлено конвергенцией большего количества биполяров на ГК или конвергенцией большего количества колбочек на биполярной клетке. При идентификации клеток сетчатки макаки при помощи иммуноцитохимических маркеров было выявлено, что отношение количества биполяров к количеству колбочек не меняется по всей сетчатке, вариации от 2.5 до 4 (Wässle, 2004). При этом в ЭМ исследованиях показано, что каждая карликовая ГК, расположенная на расстоянии ~3 мм (15 угл. град.) от центра фовеа, получает входы не от одного, как в фовеа, а от четырех карликовых биполяров (Tsukamoto, Omi, 2016). Выявленные мелкие кластеры ветвлений в дендритных полях карликовых ГК, количество которых (2–8) зависит от размеров дендритного поля, также указывают на конвергенцию биполярных клеток (Dacey, 1994).
Функциональные свойства ГК в значительной мере зависят от входных биполярных клеток, которые разделяются на оn- и оff-типы, различающиеся составом глютамат-рецепторов на их поверхности, структурой синапсов с колбочками (плоские и инвагинирующие), глубиной расположения тел клеток в слое, чувствительностью к разным иммуноцитохимическим маркерам, стратификацией аксонов во ВСС, а также типом реакций на освещение и затемнение фоторецепторов-колбочек. Биполяры оff-типа, как и фоторецепторы, гиперполяризуются при освещении и деполяризуются при затемнении, у биполяров оn-типа вызываются противоположные реакции. Проведение сигналов от колбочек к биполярам модулируется горизонтальными клетками (тормозные интернейроны), которые обеспечивают латеральные связи между фоторецепторами. Вследствие этого биполяры приобретают антагонистическую структуру РП центр/периферия (Dacey et al., 2014; Wool et al., 2018). Аксоны биполяров оff- и оn-типов расположены в разных половинах ВСС. У карликовых ГК дендритные ветвления также локализованы в верхней или в нижней половинах этого слоя, это моностратифицированные клетки (рис. 4, а). В зависимости от того, в какой половине ВСС дендриты карликовых ГК образуют контакты с аксонами биполяров, происходит формирование двух типов карликовых ГК: клетки с оn-центром РП и оff- периферией и клетки с оff-центром и оn-периферией. Известна локальность контактов биполяров и карликовых ГК: ~70% аксонного поля биполяра перекрывается с дендритным полем карликовой ГК (Jusuf et al., 2006). Таким образом, разделение зрительных путей на параллельные оn- и оff- каналы и антагонистические отношения между ними, сформированные на уровне первых синаптических контактов клеток наружного сетчатого слоя, сохраняются в слое ГК.
Мозаики дендритных полей карликовых ГК оff- и оn-типов расположены во ВСС друг под другом. При этом дендритные поля соседних клеток в этих мозаиках не перекрываются. Фактор покрытия сетчатки (плотность клеток, умноженная на размер дендритного поля) у обоих этих типов клеток ≤1. Значение фактора, равное единице, означает наилучшее покрытие без перекрывания и незаполненных (пустых) участков между ними. Пространственное распределение оff- и оn-карликовых ГК отличается. В фовеа и парафовеа сетчатки человека и макаки не было выявлено различий в плотности этих типов ГК (Ahmad et al., 2003). Однако в области эксцентриситета от 2 до 15 мм (т.е. при удаленности от центра фовеа на более 5 угл. град.) размер дендритных полей у оff-ГК на 30–50% меньше, чем у оn-ГК, поэтому плотность оff-ГК больше; отношение плотности клеток оff/оn в периферии составляет 1.7/1 (Dacey, 2000).
В центральной и периферической зонах РП карликовые ГК реагируют на стимулы разных диапазонов спектра – длинноволнового (L) и средневолнового (M). С учетом этих свойств в сетчатке представлено четыре типа карликовых ГК: L(оn)/M(оff), L(оff)/M(оn), M(оn)/L(оff), M(оff)/L(оn). Экспериментально доказано, что цветооппонентность у карликовых ГК обеспечивают антагонистические отношения между зонами РП, формируемые при участии горизонтальных клеток (Dacey et al., 2014; Wool et al., 2018). Однако у карликовых ГК периферии сетчатки цветооппонентные ответы обнаружены только у части клеток. Предполагается, что это обусловлено суммированием сигналов от обоих типов колбочек в увеличенного размера зонах РП (Dacey, Packer, 2003). Кроме того, в дальней периферии сетчатки ~10% оn-карликовых ГК получают также входы от коротковолновых (S) колбочек (Field et al., 2010).
Карликовым ГК характерны тонические реакции на включение и выключение стимулов, они слабо реагируют на низкоконтрастные (<5%) стимулы, а при больших контрастах в их импульсных реакциях насыщение не наблюдается. При введении ретроградно транспортируемых маркеров в наружное коленчатое тело (НКТ) было показано, что карликовые ГК проецируются в мелкоклеточные (парво) слои, в которых идентифицированы цветооппонентные клетки c мелкими РП. В эти слои проецируется 80% ГК сетчатки (Perry et al., 1984). Повреждение мелкоклеточных слоев НКТ приводит к снижению остроты зрения, нарушениям цветового зрения, а также восприятию временных низкочастотных и пространственных высокочастотных сигналов.
Парасольные (parasol) ганглиозные клетки
Эти клетки названы парасольными (ПГК), так как на гистологических препаратах они похожи на раскрытый зонтик (парасоль) (Polyak, 1941). Во всех участках сетчатки размеры дендритных полей ПГК превышают размеры карликовых ГК, что дало основание для выделения их в отдельный тип. Эти клетки в сетчатке человека и приматов составляют ~10% ГК. ПГК – моностратифицированные клетки, их дендриты ветвятся в верхней или нижней половинах ВСC (рис. 4, б). Дендритные поля ПГК увеличиваются с эксцентриситетом, но в назальной части сетчатки поля имеют меньший размер. По сравнению с карликовыми ГК размер дендритных полей ПГК менее значительно увеличивается с эксцентриситетом (Dacey, 2000). В сетчатке человека при эксцентриситете 3 угл. град. (1.4 мм) дендритные поля ПГК превышают размеры полей карликовых ГК в 10 раз и только в 3 раза при эксцентриситете 50 угл. град., поэтому предполагается, что в центральной части сетчатки количество ПГК в 30 раз меньше, чем карликовых. У макаки дендритные поля ПГК меньше, чем у человека, при этом в центре сетчатки при эксцентриситете 5 угл. град. они меньше на 90%, в периферии – на 20%. Предполагается, что у макаки, по сравнению с человеком, ПГК обусловливают относительно большую пространственную разрешающую способность и меньшую контрастную чувствительность (Dacey, 2000).
В центральной сетчатке ПГК составляют 5–8% ГК, в периферии – ~20% (Dacey, 2000). В отличие от карликовых ГК, получающих входы от карликовых биполярных клеток, ПГК получают входы от диффузных биполярных клеток, каждая из которых контактирует в наружном сетчатом слое с 5–10 колбочками (Jacoby et al., 1996; Tsukamoto, Omi, 2016). С учетом конвергенции диффузных биполяров отдельная фовеальная ПГК получает сигналы от 30–50 колбочек. Кроме того, ПГК получает в 10–15 раз больше входов от палочек, чем карликовая ГК (Goodchild et al., 1996). Большинство ПГК имеет концентрическую структуру РП с оn- и оff-антагонистическими зонами центр/периферия. При исследовании свойств ПГК методом пэтч-клампа показано, что структура их РП сформирована пресинаптически и передается путем модуляции возбуждающего входа от биполярных клеток (Dacey et al., 2014).
Спектральная чувствительность центральной и периферической зон РП ПГК, которые получают сигналы от L- и M-колбочек, не различается, поэтому эти клетки ахроматичны (Dacey, 2000). Несмотря на то что у некоторых типов биполяров, контактирующих с ПГК, обнаружены синапсы с S-колбочками (Tsukamoto, Omi, 2016), в физиологических опытах показано, что вклад S-колбочек в ответы ПГК незначителен (Sun et al., 2006). ПГК могут передавать информацию о локальных различиях в освещенности, сравнивая ее между зонами РП, т.е. являются физиологической основой канала освещенности. Отмечено, что в НКТ ахроматичные ПГК получают 10% входов из S-колбочек (Chatterjee, Callaway, 2002).
ПГК характерен фазический тип ответов на предъявление стимулов. По сравнению с карликовыми ГК они реагируют и на небольшие изменения контраста стимулов, т.е. у них более высокая контрастная чувствительность, что объясняется относительно большим размером центральной зоны их РП (Chichilnisky, Kalmar, 2002). Вследствие большей толщины аксона, скорость проведения сигналов у этих клеток также больше. ПГК чувствительны к временной частоте стимуляции до 35–40 Гц, при этом максимальные ответы наблюдаются в диапазоне от 10 до 40 Гц (Dacey et al., 2014).
В морфологических исследованиях выявлены различия между оn- и оff-типами ПГК. У оn-ПГК фовеальной и периферической частей сетчатки по сравнению с оff-ПГК размер дендритных полей на 30–50% больше (Dacey, 2000). В физиологических экспериментах показано, что и размер РП у оn-ПГК на 20% больше, а также быстрее динамика ответов и меньше на 10–20% латентный период реакций, чем у оff-ПГК (Chichilnisky, Kalmar, 2002). Различия между оn- и оff-ГК могут иметь связь с разной разрешающей способностью и чувствительностью к инкрементам и декрементам освещенности. Тем более известно, что в натуральной среде содержится больше негативных, чем позитивных перепадов контраста (Balasubramanian, Sterling, 2009).
Парасольные ГК проецируются в крупноклеточные (магно) слои НКТ и составляют 5–10% ГК, аксоны которых направлены на эту структуру. При этом в фовеальной части сетчатки такие ретроградно окрашенные из НКТ клетки не были обнаружены или выявлено незначительное их количество (Perry et al., 1984). В парафовеа у макаки такие ГК составляют 26%, что было показано в ранних исследованиях проекций. Повреждение магно-слоев НКТ вызывает снижение чувствительности к высоким временным и низким пространственным частотам.
Как и у карликовых ГК, контакты ПГК оn- и оff-типов с входными биполярными клетками локализуются в разных половинах ВCС (рис. 4, б). Однако у ПГК эти контакты расположены ближе к середине слоя (Jacoby et al., 1996; Perry et al., 1984; Tsukamoto, Omi, 2016). Это указывает, что в пределах каждой половины ВCС пространственно разделены контакты с биполярами у ГК, выходы которых направлены в магно- или в парво- слои НКТ. Имеются сведения о том, что и тела ГК, относящихся к парво-системе, по сравнению с клетками магно-системы, расположены в слое ГК глубже, т.е. относительно дальше от фоторецепторов.
МАЛОЧИСЛЕННЫЕ ТИПЫ ГАНГЛИОЗНЫХ КЛЕТОК СЕТЧАТКИ
Примерно 10% ГК сетчатки представлены разнообразными типами клеток по морфологическим признакам (Polyak, 1941, Dacey, 1999; Yamada et al., 2005). Значительная часть клеток этих типов имеет большой размер дендритных полей (wide field). В зависимости от характера ветвления дендритов во ВСС эти клетки разделены на три типа: моностратифицированные, бистратифицированные и диффузные, дендриты которых ветвятся по всей ширине этого слоя.
Моностратифицированные ганглиозные клетки, экспрессирующие меланопсин
В ганглиозном и во ВCС сетчатки обнаружены внутренне фоточувствительные ГК, которые сигнализируют об изменениях освещенности среды и синхронизируют циркадные ритмы с циклом день-ночь. Эти клетки (МГК) содержат фотопигмент меланопсин и генерируют ответы вне зависимости от входов от нейронов сетчатки других типов. МГК составляют 0.2–1.5% от общего количества ГК и проецируются в НКТ, претектум, супрахиазматическое ядро, верхнее двухолмие (ВД). В сетчатке человека обнаружено 7283 ± 237 МГК (Hannibal et al., 2017), их плотность в центре сетчатки составляет 30–35/мм2 и 7–10/мм2 в периферии (Curcio, Allen, 1990). У макаки их плотность в парафовеа составляет 20–25/мм2 и снижается к периферии до 5/мм2 (Liao et al., 2016). Плотность МГК больше в назальной части сетчатки.
По морфологической классификации к МГК относится тип гигантских клеток (giant very sparse) сетчатки человека (рис. 4, в), а также большие и мелкие очень редко ветвящиеся клетки (large and fine very sparse) сетчатки макаки. Дендритные поля МГК значительно превышают размер полей ПГК и бистратифицированных ГК, вблизи фовеа они больше в 7–8 раз, в периферии в 4–5 раз (Liao et al., 2016).
Выявлено два типа МГК, дендриты которых ветвятся в верхней (оff) или в нижней (оn) половинах ВCС (Hannibal et al., 2017; Dacey et al., 2005). В ЭМ исследованиях с использованием иммуноцитохимии у обоих типов МГК выявлены входы от диффузных оn-биполяров типа DB6, которые имеют контакты с коротковолновыми S-колбочками. У МГК с верхними дендритными ветвлениями обнаружены входы от допаминергических АК. У МГК с нижними дендритными ветвлениями выявлены входы от АК типа АII и палочковых биполяров, а также электрические синапсы с другими МГК и АК (Liao et al., 2016; Hannibal et al., 2017). При этом у 11% МГК, имеющих дендриты в оn-половине ВCС, обнаружены коллатерали аксонов, направленные в оff-половину этого слоя. Предполагается, что они обеспечивают положительную обратную связь передачи сигналов об освещенности от МГК к нейронам сетчатки через допаминергические АК (Dacey, 1994). У МГК также выявлены тормозные входы из мультистратифицированных АК, экспрессирующих нейропептид секретонейрин. Поскольку эти АК получают возбуждающие входы от S-оn биполяров, предполагается, что они могут опосредовать S-off ответы у МГК (Bordt et al., 2017).
Функциональные свойства МГК были изучены в морфофизиологических исследованиях гигантских клеток сетчатки человека. Обнаружено, что кроме внутренней фоточувствительности, эти клетки активируются при стимуляции палочек и колбочек, имеют цветооппонентные РП типа S-оff/(L + M)-оn. В совокупности у этих МГК комбинирование ответов, обусловленных меланопсин-активностью, с ответами (L+M) колбочек и палочек обеспечивает сигналы об освещенности во всем динамическом диапазоне зрения человека (Dacey et al., 2005).
Колючие (thorny) моностратифицированные ганглиозные клетки
Эти клетки были обнаружены в сетчатке человека, макаки, мармозеток и выделены в отдельный тип по морфологическим признакам. Для них характерны дендритные поля среднего размера (в среднем 517 мкм) с множеством тонких шипикоподобных веточек. Колючие клетки различаются характером ветвления дендритов во ВCС.
У клеток одного типа – широкие колючие (broad thorny) (рис. 4, г) – дендриты относительно широко ветвятся в середине ВCС (Yamada et al., 2005; Chandra et al., 2017). Эти клетки составляют только ~1% ГК и проецируются предпочтительно в кониоклеточный слой К3 НКТ и ВД (Percival et al., 2014). В электрофизиологических исследованиях сетчатки макаки было показано, что они имеют РП с оn-оff центральной зоной и сильной тормозной периферией, реагируют на движущиеся стимулы, но не избирательно к ориентации и направлению движения. Предполагается, что эти клетки участвуют в зрительно опосредованных моторных реакциях слежения за целью (Puller et al., 2015).
У клеток другого типа – узкие колючие (narrow thorny) (рис. 4, д) – дендриты более локально ветвятся в верхней или нижней половинах ВCС (Yamada et al., 2005). У мармозеток эти клетки получают основной доминирующий вход от диффузных биполяров типа ДБ6 и проецируются предпочтительно в конио-слой К1 НКТ. Известно, что в слое К1 расположены клетки, чувствительные к быстрым дижениям стимула, они посылают проекции в первичную зрительную кору, а также прямо в ассоциативные зрительные поля. Предполагается, что зрительный путь из биполяров ДБ6 через узкие колючие ГК в конио-слои НКТ участвует в обеспечении остаточного зрения (“blindsight”) (Percival et al., 2014).
Гладкие (smooth) моностратифицированные ганглиозные клетки
Это новый тип ГК, который был обнаружен в сетчатке макаки при использовании более чувствительного метода ретроградного окрашивания клеток родамин декстраном (Dacey et al., 2003; Crook et al., 2008). Они составляют ~3% ГК и проецируются в НКТ и ВД. По сравнению с ПГК эти ГК имеют меньший размер тел, более гладкие дендритные ветви, более тонкий аксон и в 1.5–3 раза больший размер дендритного дерева. Как и у ПГК, дендриты гладких ГК локализованы вблизи середины ВСС в верхней (оff) или в нижней (оn) половинах. По функциональным свойствам гладкие клетки сходны с ПГK, они имеют РП с центральной и периферической зонами, суммируют ответы М- и L-колбочек, у них высокий уровень спонтанной и вызванной активности, высокая контрастная и временно-частотная чувствительность, нелинейность пространственной суммации Y-типа. Предполагается, что такие ГК представляют другой параллельный путь в НКТ и ВД, отличающийся от уже известного пути из ПГК.
Гирляндовые (garland) моностратифицированные ганглиозные клетки
Такие клетки идентифицированы в фовеа сетчатки на Гольджи препаратах (Polyak, 1941; Kolb et al., 1992) и за пределами фовеа при внутриклеточных инъекциях маркеров (Dacey, Packer, 2003; Yamada et al., 2005). Размер их дендритных полей занимает промежуточное положение между карликовыми ГК и ПГК. В ЭМ исследованиях выявлено, что эти клетки, как и ПГК оff-типа, получают возбуждающие входы от диффузных оff-биполяров ДБ2 и ДБ3, которые имеют контакты с 5–7 колбочками, включая S-колбочки. Однако в отличие от ПГК у них в 2 раза больше контактов с биполярами типа ДБ2 (67%), чем с ДБ3 и больше контактов (70%) с АК. Предполагается, что эти ахроматические оff-ГК являются детекторами локального края (Calkins, Sterling, 2007). Центральные проекции и функциональные характеристики этих клеток пока неизвестны.
Бистратифицированные (bistratified) ганглиозные клетки
Бистратифицированные клетки (БГК) имеют две дендритные ветви вблизи верхней и нижней границ ВСС, причем диаметр дендритных ветвлений в оn-половине этого слоя относительно больше. Выделено два типа БГК – мелкие и крупные (рис. 4, е, ж), которые отличаются размером дендритных и РП, однако их функциональные свойства не различаются. Наиболее исследованы мелкие БГК. В центральной части сетчатки эти клетки составляют 1–3%, в периферии до 6–10% (Calkins et al., 1998). Мозаика распределения БГК в сетчатке совпадает с распределением S-колбочек, у которых максимальная плотность наблюдается при эксцентриситете в области 1 угл. град. (Curcio et al., 1991). Размер дендритного поля клеток увеличивается от 50 мкм в центре сетчатки до 400 мкм в дальней периферии, фактор покрытия сетчатки ~1.8. У макаки диаметр дендритных полей этих клеток на ~20% меньше, чем у человека (Dacey, 2000).
При внутриклеточной регистрации активности у обоих типов БГК наблюдаются возбудительные ответы на оn-стимуляцию в коротковолновом диапазоне спектра, к которому чувствительны S-колбочки, а также оff-ответы на комбинированную стимуляцию в среднем (M) и длинноволновом (L) диапазонах (Dacey, Packer, 2003). Причем (L + M)-оff ответы развиваются медленнее, чем S-оn ответы, и у них менее выражен фазический компонент, чем у одновременно регистрируемых оff-ПГК (Field et al., 2007). Рецептивные поля БГК центральной сетчатки не имеют классических пространственно антагонистических зон центр/периферия; у этих клеток пространственно совпадают антагонистические зоны РП, различающиеся спектральной чувствительностью: S-оn/(M+L)-оff. Такого типа РП были ранее обнаружены в НКТ в сетчатке. Однако при исследовании БГК периферии сетчатки (эксцентриситет 25–70 угл. град.) выявлено превышение на ~50% размера (M + L)-оff компонента РП по сравнению с размером S-оn компонента (Field et al., 2007).
При прослеживании синаптических связей БГК по серии ЭМ фотографий было выявлено, что нижние ветви их дендритного дерева образуют контакты с аксонами “синих” биполярных клеток (Mariani, 1984), получающих входы от S-колбочек, а верхние ветви имеют контакты с диффузными биполярными клетками оff-типа – ДБ2 и ДБ3, которые получают входы от M- и L-колбочек (Calkins et al., 1998). В дальней периферии сетчатки синаптические контакты в верхней половине ВCС встречаются редко.Таким образом, была выявлена организация нейронных связей, обеспечивающая антагонистическое сравнение сигналов из S-оn и (M+L)-оff колбочек, т.е. цвето-оппонентность синее/желтое. ГК с подобными морфологическими характеристиками и функциональными свойствами были также выявлены у обезьян Нового Света дихроматов и трихроматов.
Местоположение контактов БГК с биполярными клетками во ВCС отличается от карликовых ГК и ПГК. Синапсы с аксонами биполярных клеток у них локализуются относительно ближе к краям этого слоя: синапсы с биполярными клетками оn-типа расположены вблизи границы со слоем ГК, а синапсы с клетками оff-типа – вблизи границы с ВЯC (Dacey, 1994). Это указывает на раздельность нейронных путей передачи “сине-желтых” сигналов относительно “красно-зеленых”, опосредуемых карликовыми ГК, и ахроматических, опосредуемых ПГК. У S-оn БГК также другая направленность проекций в НКТ – они проецируются в кониоклеточные слои этой структуры (Hendry, Reid, 2000).
Ганглиозные клетки S-off типа
Это редко регистрируемый в электрофизиологических исследованиях тип ГК, которые получают тормозный вход из коротковолновых S-колбочек, т.е. ГК типа S-оff. Клетки с такими свойствами обнаружены также в НКТ у макак, у обезьян Нового Света – мармозеток. У таких S-оff клеток, регистрируемых в НКТ, по сравнению с S-оn клетками ниже контрастная чувствительность, больше размер РП, выше ахроматическая пространственная разрешающая способность, наблюдается адаптация к контрасту стимула (Tailby et al., 2008).
Выявление структуры входов таких ГК, обладающих спектральной оппонентностью S-оff/(M + L)-оn, стало возможным после того, как были обнаружены контакты S-колбочек с карликовыми биполярами оff-типа (Dacey et al., 2014). Ранее были известны только “синие” биполяры, специализированные для передачи S-оn сигналов (Mariani, 1984). Обнаруженные Клугом и соавт. (Klug et al., 2003) карликовые биполяры образуют плоские синапсы с S-колбочкой, а их аксоны ветвятся в верхней (оff) части ВCС. Предложена схема организации нейронных связей S-оff карликовой ГК, согласно которой центр ее РП формируется входом от карликового оff-биполяра (ПКБ на рис. 3), контактирующего с S-колбочкой, а оn-периферия РП – входами от M- и L-колбочек через горизонтальную клетку НII, которая обеспечивает отрицательную обратную связь (Packer et al., 2010). За пределами парафовеа такая карликовая ГК становится неоппонентной вследствие увеличения количества входов из S-, L- и M-колбочек. В связи с этим отмечается, что из двух нейронных путей, исходящих из S-колбочек, в периферии сетчатки представлены только S-оn пути (Dacey, 2000). S-оff ГК составляют только 2–3% из популяции карликовых ГК.
Однако имеются экспериментальные данные, которые требуют уточнения предложенной структуры формирования S-оff ответов у ГК. Показано, что у этих клеток реакции на стимуляцию L-колбочек могут быть противоположны по знаку ответам на стимуляцию S- и M-колбочек или только M-колбочек (Tailby et al., 2008). Кроме того, выявлено, что в сетчатке мармозеток S-оff сигнал не передается через клетки карликовой (парво) системы (Lee et al., 2005). Надо полагать, что дальнейшие исследования позволят выяснить причины наблюдаемой неоднородности по хроматическим свойствам у популяции ГК S-оff типа и детализировать структуру их связей.
Пути проведения сигналов из фоторецепторов-палочек в ганглиозные клетки
Фоторецепторов-палочек в 20 раз больше, чем колбочек, кроме того, в сетчатке имеются палочковые биполярные клетки, специализированные для передачи сигналов из палочек (Kolb, 1970). Однако ГК, принимающие только палочковые сигналы, не обнаружены в сетчатке. Тем не менее в психофизических исследованиях показано, что у человека сигналы из палочек передаются двумя механизмами, различающимися светочувствительностью и временной разрешающей способностью. Один механизм обеспечивает скотопическое зрение и характеризуется временной разрешающей способностью до 15 Гц, а пороги чувствительности второго механизма на 3 лог. ед. выше (мезопический диапазон) и его временная разрешающая способность достигает 28 Гц (Sharpe et al., 1989).
Имеющиеся к настоящему времени данные об архитектуре нейронных связей в сетчатке свидетельствуют о возможности передачи информации из палочек в ганглиозные клетки по трем параллельным путям.
Первый путь. Сигнал из палочек передается посредством химических синапсов в палочковые биполяры, которые контактируют с АК определенного типа – АII. Эти АК имеют электрические контакты (gap-junctions) с колбочковыми биполярами оn-типа, а также тормозные синапсы с колбочковыми биполярами оff-типа. Таким образом, AII обеспечивают путь, по которому сигналы палочек могут передаваться через колбочковые биполяры к оn- и оff-типам ГК. АК этого типа реагируют в скотопическом диапазоне освещенности, поэтому данный путь лежит в основе наиболее светочувствительного палочкового механизма у человека (Kolb, 1997; Wässle, 2004).
Второй путь. Сигнал из палочек через электрические синапсы передается колбочкам (Bloomfield, Dacheux, 2001) и далее по колбочковым путям к ГК. При исследовании у макаки активности палочек, которую регистрировали в колбочках, было обнаружено, что ответы развиваются раньше и в них появляется фазический компонент при более высоких уровнях освещенности. Это показывает, что данный палочковый путь является более быстро проводящим и менее светочувствительным, чем путь из палочек через палочковые биполяры (Verweij et al., 1999).
Третий путь. Сигнал из палочек передается путем прямых синаптических контактов непосредственно на некоторые типы колбочковых биполярных клеток оff-типа (Tsukamoto, Omi, 2016). Несмотря на то что только ~7% палочек имеют такие контакты у макаки, палочковый сигнал в мезопических условиях увеличивается за счет объединения сигналов из соседних палочек, что происходит еще до поступления сигнала в колбочковые пути. Предполагается, что чувствительность этого палочкового пути занимает промежуточное положение между первым и вторым путями, и при изменении условий освещения между скотопическим и мезопическим диапазонами эти пути функционируют одновременно, но с разной динамикой (Ke et al., 2014).
ЗАКЛЮЧЕНИЕ
Из приведенного обзора очевиден значительный вклад результатов исследований механизмов спектрального кодирования в сетчатке, которые проводились в последние 30 лет под руководством Дениса Дейси (D. Dacey). Также необходимо отметить цикл недавних (2012–2017) работ японских исследователей Иошихито Тсукамото и Наоко Оми (Y. Tsukamoto, N. Omi), которые идентифицировали входные и выходные связи 12 типов биполярных клеток в сетчатке макаки и показали различия в количестве синапсов, образуемых между разными типами биполярных клеток и ганглиозными клетками разных типов. Надо полагать, что дальнейший прогресс в развитии морфофизиологических методик позволит оценить свойства и определить функциональное назначение малочисленных типов ганглиозных клеток сетчатки.
При подготовке обзора были использованы сотни источников, но список литературы пришлось ограничить, отобрав наиболее важные первоисточники и новые работы, по которым при необходимости можно найти публикации других авторов.
Список литературы
Вахрамеева О.А., Сухинин М.В., Моисеенко Г.А., Муравьева С.В., Пронин С.В., Волков В.В., Шелепин Ю.Е. Изучение порогов восприятия в зависимости от геометрии фовеа. Сенсорные системы. 2013. Т. 27. № 2. С. 122–129.
Ahmad K.M., Klug K., Herr S., Sterling P., Schein S. Cell density ratios in a foveal patch in macaque retina. Visual Neurosci. 2003. V. 20. P. 189–209.
Ahnelt P., Keri C., Kolb H. Identification of pedicles of putative blue-sensitive cones in the human retina. J. Comp. Neurol. 1990. V. 293. P. 39–53. https://doi.org/10.1002/cne.902930104
Balasubramanian V., Sterling P. Receptive fields and functional architecture in the retina. J. Physiol. 2009. 587. 12. P. 2753–2767. https://doi.org/10.1113/jphysiol.2009.170704
Bloomfield S.A., Dacheux R.F. Rod vision: pathways and processing in the mammalian retina. Prog. Retin. Eye Res. 2001. V. 20. P. 351–384.
Bordt A.S., Long Y., Kouyama N., Yamada E.S., Hannibal J., Marshak D.W. Wavy Multistratified Amacrine Cells in the Monkey Retina Contain Immunoreactive Secretoneurin. Peptides. 2017. V. 94. P. 33–42.
Boycott B.B., Wassle H. Parallel processing in the mammalian retina: the Proctor Lecture. Invest. Ophthalm. Visual Sci. (JOVS). 1999. V. 40 (7). P. 1313–1327.
Calkins D.J., Sterling P. Microcircuitry for two types of achromatic ganglion cell in primate fovea. J. Neurosci. 2007. V. 27 (10). P. 2646–2653.
Calkins D.J., Tsukamoto Y., Sterling P. Microcircuitry and mosaic of a blue-yellow ganglion cell in the primate retina. J. Neurosci. 1998. V. 18. P. 3373–3385.
Chandra A.J., Lee S.C.S., Grünert U. Thorny ganglion cells in marmoset retina: Morphological and neurochemical characterization with antibodies against calretinin. J. Comp. Neurol. 2017. V. 525 (18). P. 3962–3974. https://doi.org/10.1002/cne.24319
Chapot C.A., Euler T., Schubert T. How do horizontal cells 'talk' to cone photoreceptors? Different levels of complexity at the cone-horizontal cell synapse. J. Physiol. 2017. V. 595 (16). P. 5495–5506. https://doi.org/10.1113/JP274177
Chatterjee S., Callaway E. S cone contributions to the magnocellular visual pathway in macaque monkey. Neuron. 2002. V. 35 (6). P. 1135–1146.
Chichilnisky E.J., Kalmar R.S. Functional asymmetries in ON and OFF ganglion cells of primate retina. J. Neurosci. 2002. V. 22. P. 2737–2747. DOI: 20026215
Crook J.D., Peterson B.B., Packer O.S., Robinson F.R., Gamlin P.D., Troy J.B., Dacey D.M. The smooth monostratified ganglion cell: evidence for spatial diversity in the Y-cell pathway to the LGN and superior colliculus in the macaque monkey. J. Neurosci. 2008. V. 28 (48). P. 12654–12671. https://doi.org/10.1523/JNEUROSCI.2986-08.2008
Curcio C.A., Allen K. Topography of ganglion cells in human retina. J. Comp. Neurol. 1990. V. 300. P. 5–25. https://doi.org/10.1002/cne.903000103
Curcio C.A., Sloan K.R., Kalina R.E., Hendrickson A.E. Human photoreceptor topography. J. Comp. Neurol. 1990. V. 292. P. 497–523. https://doi.org/10.1002/cne.902920402
Curcio C.A., Allen K.A., Sloan K.R., Lerea C.L., Hurley J.B., Klock I.B., Milam A.H. Distribution and morphology of human cone photoreceptors stained with antiblue opsin. J. Comp. Neurol. 1991. V. 312. P. 610–624. https://doi.org/10.1002/cne.903120411
Dacey D.M. Physiology, morphology and spatial densities of identified ganglion cell types in primate retina. Ciba Found Symp. 1994. V. 184. P. 12–28.
Dacey D.M. Parallel pathways for spectral coding in primate retina. Annu Rev. Neurosci. 2000. V. 23. P. 743–775. https://doi.org/10.1146/annurev.neuro.23.1.743
Dacey D.M., Packer O.S. Colour coding in the primate retina. diverse cell types and cone-specific circuitry. Curr. Opin. Neurobiol. 2003. V. 13. P. 421–427.
Dacey D.M., Peterson B.B., Robinson F.R., Gamlin P.D. Fireworks in the primate retina: in vitro photodynamics reveals diverse LGN-projecting ganglion cell types. Neuron. 2003. V. 37. P. 15–27.
Dacey D.M., Liao H.W., Peterson B.B., Robinson F.R., Smith V.C., Pokorny J., Yau K.W., Gamlin P.D. Melanopsin-expressing ganglion cells in primate retina signal colour and irradiance and project to the LGN. Nature. 2005. V. 433. P. 749–754. https://doi.org/10.1038/nature03387
Dacey D.M., Crook J.D., Packer O.S. Distinct synaptic mechanisms create parallel S-ON and S-OFF color opponent pathways in the primate retina. Vis. Neurosci. 2014. V. 31 (2). P. 139–151. https://doi.org/10.1017/S0952523813000230
Drasdo N., Millican C.L., Katholi C.R., Curcio C.A. The length of Henle fibers in the human retina and a model of ganglion receptive field density in the visual field. Vision Res. 2007. V. 47 (22). P. 2901–2911. https://doi.org/10.1016/j.visres.2007.01.007
Field G.D., Sher A., Gauthier J.L., Greschner M., Shlens J., Litke A.M., Chichilnisky E.J. Spatial properties and functional organization of small bistratified ganglion cells in primate retina. J. Neurosci. 2007. V. 27 (48). P. 13261–1372. https://doi.org/10.1523/JNEUROSCI.3437-07.2007
Field G.D., Gauthier J.L., Sher A., Greschner M., Machado T.A., Jepson L.H., Shlens J., Gunning D.E., Mathieson K., Dabrowski W., Paninski L., Litke A.M., Chichilnisky E.J. Functional connectivity in the retina at the resolution of photo-receptors. Nature. 2010. V. 467. P. 673–677.
Goodchild A.K., Ghosh K.K., Martin P.R. Comparison of photoreceptor spatial density and ganglion cell morphology in the retina of human, macaque monkey, cat, and the marmoset Callithrix jacchus. J. Comp. Neurol. 1996. V. 366 (1). P. 55–75. https://doi.org/10.1002/(SICI)1096-9861
Hannibal J., Christiansen A.T., Heegaard S., Fahrenkrug J., Kiilgaard J.F. Melanopsin expressing human retinal ganglion cells: Subtypes, distribution, and intraretinal connectivity. J. Comp. Neurol. 2017. V. 525 (8). P. 1934–1961. https://doi.org/10.1002/cne.24181
Hendry S.H.C., Reid R.C. The koniocellular pathway in primate vision. Annu. Rev. Neurosci. 2000. V. 23. P. 127–153.
Hsu A., Smith R.G., Buchsbaum G., Sterling P. Cost of cone coupling to trichomacy in primate fovea. J. Opt. Soc. Am. A. Opt. Image Sci. 2000. V. 17. P. 635–640.
Jacoby R., Stafford D., Kouyama N., Marshak D. Synaptic inputs to ON parasol ganglion cells in the primate retina. J. Neurosci. 1996. V. 16 (24). P. 8041–8056.
Joo H.R., Peterson B.B., Haun T.J., Dacey D.M. Characterization of a novel large-field cone bipolar cell type in the primate retina: Evidence for selective cone connections. Visual Neurosci. 2010. P. 1–9. https://doi.org/10.1017/S0952523810000374
Jusuf P.R., Martin P.R., Grünert U. Random wiring in the midget pathway of primate retina. Neurosci. 2006. V. 26 (15). P. 3908–3917. https://doi.org/10.1523/JNEUROSCI.4891-05.2006
Ke J.B., Wang Y.V., Borghuis B.G., Cembrowski M.S., Riecke H., Kath W.L, Demb J.B., Singer J.H. Adaptation to background light enables contrast coding at rod bipolar cell synapses. Neuron. 2014. V. 81 (2). P. 388–401. https://doi.org/10.1016/j.neuron.2013.10.054
Klug K., Herr S., Ngo I.T., Sterling P., Schein S. Macaque retina contains an S-cone OFF midget pathway. J. Neurosci. 2003. V. 23. P. 9881–9887.
Kolb H. Organization of the outer plexiform layer of the primate retina: electron microscopy of Golgi-impregnated cells. Philos Trans R Soc Lond B Biol Sci. 1970. V. 258 (823). P. 261–283. https://doi.org/10.1098/rstb.1970.0036
Kolb H. Amacrine cells of the mammalian retina: neurocircuitry and functional roles. Eye (Lond). 1997. V. 11. P. 904–923. https://doi.org/10.1038/eye.1997.230
Kolb H., Linberg K.A., Fisher S.K. Neurons of the human retina: a Golgi study. J. Comp. Neurol. 1992. V. 318 (2). P. 47–87. https://doi.org/10.1002/cne.903180204
Lee S.C., Telkes I., Grünert U. S-cones do not contribute to the OFF-midget pathway in the retina of the marmoset, Callithrix jacchus. Eur. J. Neurosci. 2005. V. 22 (2). P. 437–447. https://doi.org/10.1111/j.1460-9568.2005.04231.x
Liao H.W., Ren X., Peterson B.B., Marshak D.W., Yau K.W., Gamlin P.D., Dacey D.M. Melanopsin-expressing ganglion cells on macaque and human retinas form two morphologically distinct populations. J. Comp.Neurol. 2016. V. 524 (14). P. 2845–2872.
Mariani A.P. The neuronal organization of the outer plexiform layer of the primate retina. Int Rev Cytol. 1984. V. 86. P. 285–320.
Masland R.H. The neuronal organization of the retina. Neuron. 2012. V. 76 (2). P. 266–280. https://doi.org/10.1016/j.neuron.2012.10.002
Packer O.S., Verweij J., Li P.H., Schnapf J.L., Dacey D.M. Blue-yellow opponency in primate S cone photoreceptors. J. Neurosci. 2010. V. 30 (2). P. 568–572. https://doi.org/10.1523/JNEUROSCI.4738-09.2010
Percival K.A., Koizumi A., Masri R.A., Buzás P., Martin P.R., Grünert U. Identification of a pathway from the retina to koniocellular layer K1 in the lateral geniculate nucleus of marmoset. J. Neurosci. 2014. V. 34 (11). P. 3821–3825. https://doi.org/10.1523/JNEUROSCI.4491-13.2014
Perry V.H., Cowey A. The ganglion cell and cone distributions in the monkey’s retina: implications for central magnification factors.Vision Res. 1985. V. 25. P. 1795–1810.
Perry V.H., Oehler R., Cowey A. Retinal ganglion cells that project to the dorsal lateral geniculate nucleus in the macaque monkey. Neuroscience. 1984. V. 12 (4). P. 1101–1123.
Polyak S.L. The retina. Chicago: Univ. Chicago Press. 1941. 607 p.
Provis J.M., Penfold P.L., Cornish E.E., Sandercoe T.M., Madigan M.C. Anatomy and development of the macula: specialisation and the vulnerability to macular degeneration. Clin Exp Optom. 2005. V. 88 (5). P. 269–281.
Puller C., Manookin M.B., Neitz J., Rieke F., Neitz M. Broad thorny ganglion cells: a candidate for visual pursuit error signaling in the primate retina. J. Neurosci. 2015. V. 35 (13). P. 5397–5408. https://doi.org/10.1523/JNEUROSCI.4369-14.2015
Ramon y Cajal S. La retine des vertebres. La Cellule. 1893. V. 9. P. 119–257.
Schein S., Ngo I.T., Huang T.M., Klug K., Sterling P., Herr S. Cone synapses in macaque fovea: I. Two types of non-S cones are distinguished by numbers of contacts with OFF midget bipolar cells. Vis Neurosci. 2011. V. 28 (1). P. 3–16. https://doi.org/10.1017/S0952523810000477
Sharpe L.T., Stockman A., MacLeod D.I. Rod flicker perception: scotopic duality, phase lags and destructive interference. Vision Res. 1989. V. 29. P. 1539–1559.
Strettoi E., Masri R.A., Grünert U. AII amacrine cells in the primate fovea contribute to photopic vision. Sci Rep. 2018. V. 8 (1). P. 16429. https://doi.org/10.1038/s41598-018-34621-2
Sun H., Smithson H.E., Zaidi Q., Lee B.B. Do magnocellular and parvocellular ganglion cells avoid short-wavelength cone input? Vis Neurosci. 2006. V. 3–4. P. 441–446. https://doi.org/10.1017/S0952523806233042
Tailby C., Solomon S.G., Lennie P. Functional asymmetries in visual pathways carrying S-cone signals in macaque. J. Neurosci. 2008. V. 28 (15). P. 4078–4087. https://doi.org/10.1523/JNEUROSCI.5338-07.2008
Thoreson W., Dacey D.M. Diverse Cell Types, Circuits, and Mechanisms for Color Vision in the Vertebrate Retina. Physiol. Rev. 2019. V. 99 (3). P. 1527–1573. https://doi.org/10.1152/physrev.00027.2018
Tick S., Rossant F., Ghorbel I., Gaudric A., Sahel J-A., Chaumet-Riffaud P., Paques M. Foveal shape and structure in a normal population. Invest. Ophthalmol. Vis. Sci. 2011. V. 52 (8). P. 5105–5110. https://doi.org/10.1167/iovs.10-7005
Tsukamoto Y., Omi N. ON Bipolar Cells in Macaque Retina: Type-Specific Synaptic Connectivity with Special Reference to OFF Counterparts. Front. Neuroanat. 2016. V. 10. P. 104 https://doi.org/10.3389/fnana.2016.00104
Verweij J., Dacey D.M., Peterson B.B., Buck S.L. Sensitivity and dynamics of rod signals in H1 horizontal cells of the macaque monkey retina. Vision Res. 1999. V. 39 (22). P. 3662–3672.
Wässle H. Parallel processing in the mammalian retina. Nat. Rev. Neurosci. 2004. V. 5. P. 747–757.
Williams R.W. The human retina has a cone-enriched rim. Vis. Neurosci. 1991. V. 6 (4). P. 403–406.
Wool L.E., Crook J.D., Troy J.B., Packer O.S., Zaidi Q., Dacey D.M. Nonselective Wiring Accounts for Red-Green Opponency in Midget Ganglion Cells of the Primate Retina. Neurosci. 2018. V. 38 (6). P. 1520–1540. https://doi.org/10.1523/JNEUROSCI.1688-17.2017
Yamada E.S., Bordt A.S., Marshak D.W. Wide-field ganglion cells in macaque retinas. Vis. Neurosci. 2005. V. 22. P. 383–393. https://doi.org/10.1017/S095252380522401X
Дополнительные материалы отсутствуют.
Инструменты
Сенсорные системы