Сенсорные системы, 2020, T. 34, № 3, стр. 179-187
Вариативность параметров зрительных вызванных потенциалов на паттерн у детей без нарушения зрения и вопросы доклинической диагностики
Д. И. Кошелев 1, *, Е. М. Гареев 1, А. А. Ивлева 1, Р. Г. Юсупов 1
1 ФГБУ “Всероссийский центр глазной и пластической хирургии”
Министерства здравоохранения Российской Федерации
450076 Республика Башкортостан, г. Уфа, ул. Р.Зорге, 67/1, Россия
* E-mail: koshelev_d@mail.ru
Поступила в редакцию 05.02.2020
После доработки 25.03.2020
Принята к публикации 18.04.2020
Аннотация
У 35 детей (7–14 лет) с эмметропией и остротой зрения (ОЗ) не менее единицы исследовались амплитудно-временные параметры бинокулярного зрительно вызванного потенциала (ЗВП) на реверсивный шахматный паттерн с размерами ячеек 240, 96, 48, 24 и 12 угл. мин. Кластерным анализом выявлено наличие двух разных вариантов зависимости компонент ЗВП от угловых размеров стимула. В обеих группах с уменьшением размеров стимула латентный период (ЛП) N75 и P100 и амплитуда ЗВП “от пика до пика” N75-P100 значимо возрастает, но для ЛП N75 и P100 это происходит на значимо разном уровне, причем эти группы не различаются ни полом, ни возрастом. В группе с большей латентностью ЛП N75 и P100 при всех размерах стимула ОЗ оказалась значимо выше. Факторный анализ ЛП N75 и P100 показал, что на низких, средних и высоких пространственных частотах эти компоненты имеют разное происхождение. Рассматривается возможность использования различных компонент ЗВП и их динамики при изменении пространственной частоты стимула в качестве доклинических маркеров при оценке эффективности работы зрительной системы.
ВВЕДЕНИЕ
Для адекватной оценки патологических изменений в любой системе организма требуется сопоставление ее характеристик с аналогичными параметрами, полученными в группе без соответствующей патологии (“нормативами”). Это позволяет оценить степень патологических изменений, разработать стратегию лечебных мероприятий и проводить эффективный мониторинг состояния нарушенной функции.
При исследовании зрительных функций человека, наряду с общепринятыми психофизиологическими параметрами, зачастую возникает необходимость оценки процесса передачи зрительной информации и активности центральных отделов зрительной системы (ЗС). Особенно актуальна такая оценка при исследовании зрительных функций детей с целью получения комплексной и более объективной информации о состоянии и активности различных уровней зрительного анализатора. Для этого в клинической и научной практике широко используется метод регистрации зрительных вызванных потенциалов (ЗВП) (Гнездицкий, 2003; Odom et al., 2010; Robson et al., 2018). При оценке функций центрального зрения обычно используется регистрация ЗВП на реверсивный шахматный паттерн (Odom et al., 2010; Robson et al., 2018). На паттерн ЗВП имеет достаточно устойчивую структуру с четкими амплитудно-временными параметрами отдельных компонентов (Гнездицкий, 2003; Odom et al., 2010). Несмотря на хорошую индивидуальную воспроизводимость параметров ЗВП, в нормативной выборке они имеют широкий диапазон варьирования (Sharma et al., 2015; Ивлева, Кошелев, 2019; Mahjoob et al., 2019). В связи с этим актуален поиск факторов, лежащих в основе межиндивидуальной вариации и условий ее минимизации. Так, предприняты попытки расширения диапазона пространственных частот, используемых в ходе регистрации ЗВП, с целью оценки влияния размера стимула на параметры ЗВП и определения диапазона наиболее устойчивых ответов (Nakamura et al., 2000; Kothari et al., 2014). В ряде исследований либо признается, либо подвергается сомнению роль половых различий и размера головы испытуемых (Gregori et al., 2006; Chen et al., 2012; Sharma et al., 2015; Dotto et al., 2017). Кроме того, на параметры ЗВП большое влияние оказывают возраст испытуемого и степень развития зрительной системы. В связи с многочисленностью факторов, определяющих вариабельность параметров ЗВП, каждой из лабораторий рекомендуется выработать и использовать свои собственные нормативные базы для повышения эффективности диагностических процедур (Odom et al., 2010). Одной из причин, затрудняющих выработку единой “нормы”, на наш взгляд, является то, что высокое зрение, судя по всему, обеспечивается широким динамическим диапазоном состояний отдельных подсистем зрительного анализатора (Гареев и др., 2001а, 2001б). Поиск опорных метрик для описания внутренней структуры “пространства нормы” особенно актуален в настоящее время с целью обнаружения маркеров качества функционирования зрительной системы и доклинической диагностики пограничных состояний.
Цель нашего исследования – оценка внутренней структуры параметров ЗВП и степень их межиндивидуальной вариабельности у детей без нарушения зрительных функций.
ОПИСАНИЕ МЕТОДИКИ
В исследовании принимали участие 35 здоровых в офтальмологическом плане детей (17 мальчиков и 18 девочек) в возрасте 7–14 лет с остротой зрения не ниже 1.0 с пяти метров по стандартной таблице Сивцева-Головина, с эмметропией и нормальным состоянием глазного дна. После предварительного тестирования ОЗ для более детального выявления возможных индивидуальных различий мы использовали модифицированные таблицы с кольцами Ландольта, позволяющие измерять ОЗ с большей точностью в интервале от 0.7 до 2.0 с оценкой ОЗ по известной формуле Снеллена-Дондерса (Волков и др., 1976) и округлении результатов “до сотых”. Оценку ОЗ осуществляли в условиях монокулярного и бинокулярного тестирования.
Клиническую рефракцию определяли в покое аккомодации на автоматическом рефрактометре HRK-8000A производства “Huvitz Co., Ltd” (Южная Корея) с точностью 0.25 дптр. Регистрацию ЗВП осуществляли в стандартных световых условиях, расстояние до монитора составляло 1 м. Для регистрации использовали 4-х канальный электронейромиограф “Нейро-МВП-4” производства компании “Нейрософт” (Россия) с соответствующим программным обеспечением. Электроды для регистрации устанавливали, согласно международной системе “10-20”: Oz (активный электрод), Cz (референтный электрод), Fpz (заземляющий электрод). Электрическое сопротивление под электродами не превышало 5 кОм. В качестве стимула использовали реверсивный шахматный паттерн с угловым размером ячеек: 240, 96, 48, 24, 12 угл. мин. Регистрацию ЗВП на всех исследуемых пространственных частотах осуществляли в условиях бинокулярного и монокулярного тестирования. При анализе полученных записей осуществляли измерение латентного периода компонент ЗВП N75, P100 и амплитуду от пика до пика на участке от N75 до P100 (А1). В данной работе будут рассмотрены только данные бинокулярных исследований.
Полученные данные подвергали математико-статистической обработке с использованием дисперсионного (ДА, ANOVA, MANOVA), кластерного и факторного анализа (Реброва, 2002; Халфин, 2008). При ДА для оценки зависимости параметров ЗВП от угловых размеров стимула использовали “корреляционное отношение” (η) – коэффициент корреляции, отражающий одностороннюю зависимость некого признака от “контролируемого фактора” (Плохинский, 1970).
Исследование было проведено в соответствии с требованиями Хельсинкской декларации всемирной медицинской ассоциации по этическим принципам проведения научных медицинских исследований с участием человека (2000 г.).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первом этапе исследования мы решили проверить вариабельность анализируемых компонент ЗВП. С этой целью для каждой из пяти пространственных частот был рассчитан коэффициент вариации (Cv), отражающий относительную вариативность временных и амплитудных характеристик ЗВП.
Как видно из табл. 1, наименьшей межиндивидуальной вариативностью и соответственно наибольшей устойчивостью на всех пространственных частотах обладает ЛП N75. ЛП Р100 имеет сопоставимую среднюю вариативность, но более широкие ее границы на разных частотах. У остальных компонент вариативность индивидуальных значений многократно выше. Особенно это относится к амплитудным характеристикам ЗВП.
Таблица 1.
Коэффициенты вариации (Cv) анализируемых параметров ЗВП по пяти пространственным частотам реверсивного шахматного паттерна
| Компонента ЗВП | Границы значений Сv, % | Средний Cv, % |
|---|---|---|
| ЛП N75 | 3.1–3.7 | 3.4 ± 0.2 |
| ЛП P100 | 3.2–5.1 | 4.0 ± 0.8 |
| ЛП N145 | 6.2–13.5 | 10.2 ± 2.7 |
| Амплитуда A1 | 30.8–34.8 | 34.6 ± 3.3 |
| Амплитуда A2 | 34.1–44.8 | 40.6 ± 4.0 |
Вариативность амплитудно-временных параметров ЗВП, наблюдаемая в нашей выборке, сопоставима с данными аналогичных исследований (Chen et al., 2012; Sharma et al., 2015; Mahjoob et al., 2019), хотя и проведенных на взрослых людях. При этом в нашей выборке вариативность ЛП N75 и P100 несколько ниже, что может быть следствием более однородной по возрасту выборки. Однако, как будет показано далее, даже в такой “плотной” выборке обнаруживаются “варианты нормы”.
В соответствии с главной целью исследования еще до оценки характера и степени зависимости компонент ЗВП от размеров шахматного паттерна мы проверили, существуют ли в исследуемой группе подгруппы испытуемых, у которых такая зависимость отличается неким своеобразием – ее “типологическим вариантом”. С этой целью массив данных о последовательных значениях ЛП N75, как наиболее устойчивого к межиндивидуальным различиям испытуемых при всех пяти размерах стимула, был подвергнут кластерному анализу по методу Уорда (Олдендерфер, Блашфилд, 1989), позволяющему получать наиболее компактные группировки.
При анализе однородности последовательных изменений ЛП N75 были выделены два кластера – подгруппы испытуемых 18 и 17 человек, имеющих варианты последовательных изменений ЛП и различающихся, как оказалось, только средними уровнями ЛП N75 при всех размерах стимула (рис. 1).
Рис. 1.
Типологические варианты зависимости среднего уровня латентного периода компоненты N75 ЗВП от угловых размеров реверсивного шахматного паттерна.
По оси абсцисс – размеры шахматного паттерна, в угл. мин. По оси ординат – длительность ЛП компоненты N75 ЗВП, в мс. ГДИ и СО – границы доверительного интервала и стандартная ошибка среднего уровня ЛП.
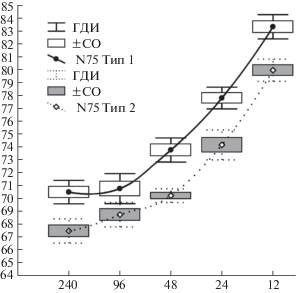
Как видно на рис. 1, в обеих подгруппах по мере уменьшения размеров стимула имеет место увеличение среднего уровня ЛП компоненты N75. По данным ДА зависимость ЛП от размеров стимула (“фактор угловых размеров”) в обеих группах почти функциональная – корреляционное отношение (η) составляло 0.92 (p ≪ 0.0001). При этом средние уровни ЛП при величине стимула 240 и 96 угл. мин. в обеих группах почти совпадают или достаточно близки (70.5 ± 2.0 и 70.7 ± ± 25 мс в первой группе, 67.4 ± 2.0 и 68.7 ± 2.0 мс во второй) и значимо не различаются (р > 0.05). Первый значимый прирост ЛП на 2.3–3 мс в обеих группах происходит при величине стимула 48 угл. мин. При стимулах менее 48 угл. мин. при каждом последующем снижении размеров стимула вдвое имеет место последовательный и статистически значимый прирост среднего уровня ЛП, составляющий от порядка 3–4 до 5–6 мс. В целом между средним уровнем ЛП от максимального размера стимула 240 угл. мин. до минимального стимула 12 угл. мин. (в 20 раз меньшего) накапливается различие в 12.7 мс (c 70.5 до 83.2 мс) и 12.5 мс (с 67.4 до 79.9 мс) для первой и второй групп соответственно. В обоих случаях этот прирост составляет порядка 18% от среднего уровня ЛП при размерах стимула 240 угл. мин. При этом для любого размера стимула в первой группе средний уровень ЛП статистически значимо выше на 2.5–4 мс. Следовательно, при уменьшении угловых размеров стимула средний ЛП компоненты N75 ЗВП существенно возрастает, а в рассматриваемой популяции офтальмологически здоровых детей имеются, как минимум, две подгруппы со значимо более высоким и более низким уровнем ЛП при всех размерах стимула.
Проверка возможных различий между испытуемыми, относящимися к первой или второй группе по полу, возрасту, состоянию оптики глаза и ОЗ показала следующее. Корреляция (коэффициент Фишера для номинальных признаков) c полом оказалась ничтожной и незначимой (φ = = 0.02, p > 0.86), поскольку мальчики и девочки попадали в каждую группу практически поровну.
Различия этих групп по возрасту оказались статистически незначимыми: 10.7 ± 2.5 года против 9.7 ± 1.6 года (p > 0.19). Тем не менее необходимо отметить, что в первой группе дети 10–14 лет составляли основную массу (78%) против примерно половины (47%) во второй. Однако сравнение по критерию процентных долей (φ) показало, что это различие статистически незначимо (p > > 0.06). Непараметрический критерий Манна–Уитни также показал, что различия распределения детей по возрасту в обеих группах незначимы (Z = 1.37, p > 0.17). Следовательно, применительно к выделенным группам говорить о наличии существенных возрастных различий не приходится. Тем не менее, учитывая широкий возрастной диапазон испытуемых в нашем исследовании, следует проверить полученные результаты на более однородных по возрасту выборках.
Незначимыми были и различия в сферической (0.18 ± 0.32 и 0.02 ± 0.45 дптр, p > 0.21) и цилиндрической (0.10 ± 0.3 7 и 0.04 ± 0.55 дптр, p > 0.38) компонентах рефракций.
Различия в бинокулярной ОЗ оказались значимыми. В первой группе средняя ОЗ составила 1.71 ± 0.20 против 1.45 ± 0.26 во второй (p < 0.006), т.е. выше примерно на 18%. Понятно, что в реальных жизненных условиях такая разница будет практически неощутима, но факт того, что в данной группе детей значимо более позднему возникновению N75 соответствует и более высокая ОЗ остается фактом.
Представлялось логичным проверить, каким образом в этих группах с однотипным, но разноуровневым характером изменений ЛП N75 изменяется ЛП Р100 – следующий надежно выделяемый компонент ЗВП, а также пусть и крайне вариативный, но физически связывающий эти первые два пика параметр – амплитуда ЗВП от N75 до Р100 (А1). При этом анализ изменений ЛП Р100 осуществлялся при помощи двухфакторного ДА. Оценивалось влияние как “фактора пространственной частоты”, так и фактора “групповой принадлежности”.
Как видно на рис. 2, в обеих группах испытуемых с разным уровнем изменений ЛП N75 последовательные изменения ЛП Р100 также в принципе похожи и демонстрируют повышение ЛП Р100 по мере уменьшения угловых размеров стимула. Зависимость ЛП Р100 от “фактора пространственной частоты” оказалась достаточно тесной (η = 0.50, p ≪ 0.0001), от “фактора групповой принадлежности” более слабой, но значимой (η = = 0.33, p ≪ 0.0001), а их взаимодействие несущественным (F = 0.5, p > 0.76). Это означает, что картина изменений ЛП Р100 при разных размерах стимула в группах с разным уровнем ЛП N75 принципиально не различается (рис. 2), но рассматривать ее как единое целое нельзя. В первой группе зависимость среднего ЛП от угловых размеров паттерна достаточно жесткая (η = 0.62, p ≪ ≪ 0.0001) и, как видно, порождена, прежде всего, разницей ЛП Р100 при размерах паттерна 96 и 12 угл. мин (99.7 ± 2.8 и 108.9 ± 3.5 мс соответственно). При этом следует отметить, что средний ЛП Р100 при размерах стимула 240, 48 и 24 угл. мин в этой группе значимо не различается (p > 0.8), но достоверно отличается от среднего ЛП при 96 и 12 угл. мин. Во второй группе зависимость ЛП от угловых размеров стимула также оказалась тесной (η = 0.63, p ≪ 0.0001). Ее особенностью является то, что при размерах стимула от 240 до 24 угл. мин средние уровни ЛП достаточно близки (от 97.6 ± 3.2 до 100.7 ± 4.1 мс) и статистически значимо не различаются (p > 0.07–0.87). Существенный рост среднего уровня ЛП (до 106.0 ± 4.5 мс) в этой группе имеет место только при угловых размерах 12 угл. мин. При этом для всех угловых размеров средний уровень ЛП в первой группе оказался значимо (p < 0.05–0.003) выше, чем во второй.
Рис. 2.
Варианты зависимости среднего уровня ЛП компоненты Р100 ЗВП от угловых размеров реверсивного шахматного паттерна в группах испытуемых, выделенных по типологическим вариантам зависимости ЛП компоненты N75.
По оси ординат – длительность ЛП компоненты P100 ЗВП, в мс. Обозначения, как на рис. 1.
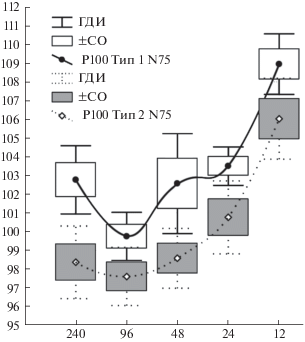
Вероятно, что общее усложнение структуры зависимости ЛП P100 от размера стимула может отражать индивидуальные особенности топографии вовлечения зрительных структур в обработку поступившего зрительного сигнала и увеличение количества факторов, способных оказать влияние на этой фазе обработки.
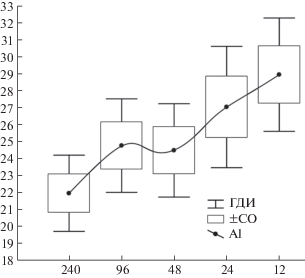
Аналогичный анализ был осуществлен для амплитудных значений А1 (от пика до пика N75 – Р100). Для этого параметра в выделенных группах зависимость от угловых размеров стимула выражена еще менее, чем для ЛП Р100 (η = 0.26, p < < 0.002), а от групповой принадлежности и взаимодействия обоих факторов оказалась незначимой (F = 3.3, p > 0.07 и F = 0.26, p > 0.90 соответственно). Это позволило рассматривать изменения амплитуды А1 без учета групповой принадлежности как одну совокупность (рис. 3). Как видно на рис. 3, рост средней амплитуды А1 по мере уменьшения угловых размеров паттерна имеет вид медленного тренда – статистически значимой является лишь разница между средним уровнем А1 при максимальном (240 угл. мин) и минимальных (24 и 12 угл. мин) размерах стимула – 21.9 ± 6.8 против – 27.0 ± 10.8 и – 28.9 ± 10.0 мкВ соответственно. Наблюдаемое увеличение амплитуды компонента А1 ЗВП, вероятно, отражает постепенную активацию нейронов зрительной коры в ответ на увеличение пространственной частоты стимула.
Рис. 3.
Зависимость среднего уровня амплитуды A1 ЗВП от угловых размеров реверсивного шахматного паттерна.
По оси ординат – амплитуды A1 ЗВП, в мкВ. Обозначения, как на рис. 1.
В завершении исследования мы решили проверить, представляет ли из себя достаточно “гладкая” и, в принципе, однотипная в обеих выделенных группах испытуемых зависимость ЛП N75 и Р100 от размеров стимула нечто однородное или в ней существует некая скрытая структура. С этой целью данные о последовательных изменениях ЛП N75, Р100 и А1 в каждой группе были подвергнуты факторному анализу, позволяющему объяснить наблюдаемые взаимосвязи некоторой совокупности переменных наличием существенно меньшего числа независимых и, как правило, ненаблюдаемых источников их варьирования – “факторов” (Ким, Мьюллер, 1989). При этом структура ЛП N75 и Р100 анализировалась совместно, но в каждой из выделенных по уровню N75 групп раздельно. Соотношение числа “объектов” (испытуемых) и “признаков” (последовательных значений переменных) позволяло провести такой анализ достаточно корректно.
В первой группе было выделено три фактора, удовлетворяющих “критерию Кайзера” (Ким, Мьюллер, 1989) и совместно объясняющих 74% вариации данных. Как видно на рис. 4, все три фактора являются “общими”, поскольку отражают наличие достаточно тесной корреляции между двумя и более переменными. Первый фактор отражает наличие сложной системы существенных (от r = 0.41 до 0.70) корреляций ЛП N75 и Р100 при угловых размерах стимула 96, 48 и 12 угл. мин.
Рис. 4.
Факторная структура последовательных изменений ЛП N75 и Р100 ЗВП в ответ на изменения угловых размеров реверсивного шахматного паттерна в первой группе испытуемых.
По оси абсцисс – ЛП N75 и Р100 с указанием угловых размеров стимула, в угл. мин., при которой регистрировался ЗВП. По оси ординат – факторные нагрузки (корреляции переменной с осью гипотетического скрытого фактора). F1–F3 – выделенные факторы с указанием доли (в %) объясняемой ими вариации данных. S.L. – уровень значимых факторных нагрузок.
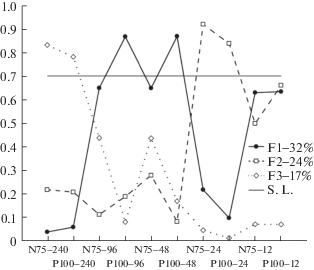
Второй фактор отражает наличие такой же системы корреляций (от r = 0.26 до 0.75) между ЛП N75 и Р100 при угловых размерах стимула 24 и 12 угл. мин. При этом, как видно на рис. 4, ЛП N75 и Р100 при угловых размерах стимула 12 угл. мин обладает так называемой “факторной сложностью”, имея нагрузки, близкие к значимым, сразу по первому и второму фактору. За этим стоит тот факт, что обе эти переменные имеют достаточно тесные связи как с ЛП P100 при размерах стимула 96 и 48 угл. мин (r = 0.44 и 0.70), так и с ЛП N75 при стимуле размером 24 угл. мин (r = = 0.57 и 0.75). Кроме того, ЛП N75 и Р100 при стимуле 12 угл. мин также связаны достаточно жестко (r = 0.64).
Третий фактор отражает наличие относительно слабой (r = 0.41) корреляции ЛП N75 и Р100 при угловых размерах стимула 240 угл. мин, которая существенно сильнее их связи с прочими переменными.
Структурная неоднородность имела место и во второй группе испытуемых. Здесь также было выделено два “общих” и один “характерный” фактор, совокупно детерминирующих 69% вариации данных (рис. 5).
Рис. 5.
Факторная структура последовательных изменений ЛП N75 и Р100 ЗВП в ответ на изменения угловых размеров реверсивного шахматного паттерна во второй группе испытуемых.
Обозначения, как на рис. 4.
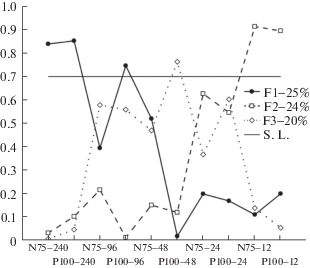
Первый “общий” фактор отражает наличие системы достаточно тесных (от r = 0.49 до 0.68) корреляций между ЛП N75 и Р100 при угловых размерах стимула 240, 96 и 48 угл. мин. Второй “общий” фактор порожден наличием еще одной системы корреляций (от r = 0.42 до 0.76) между ЛП N75 и Р100 при угловых размерах стимула 24 и 12 угл. мин. Третий – “характерный” фактор, на который значимую нагрузку имеет лишь ЛП Р100 при угловых размерах стимула 48 угл. мин. Следует отметить, что, как видно на рис. 5, ЛП Р100 при угловых размерах стимула 24 угл. мин. также обладает факторной сложностью, имея близкие к значимым нагрузки на второй и третий факторы. Эта переменная имеет сопоставимые по величине корреляции как с ЛП Р100 при угловых размерах стимула 48 угл. мин. (r = 0.46), так и с ЛП N75 и Р100 при угловых размерах стимула 12 угл. мин. (r = 0.50 и 0.42).
Аналогичный анализ для параметра А1 осуществлялся без разбиения на группы с разным уровнем ЛП N75, поскольку, как было показано выше, в отличие от ЛП Р100, амплитуда ЗВП от пика N75 до пика Р100 значимо не зависела от фактора “групповой принадлежности” испытуемых, и массив этих данных мог рассматриваться как одна совокупность. Факторный анализ показал, что в последовательных изменениях А1 отсутствуют какая-либо скрытая структура, гетерогенность, поскольку все переменные оказались связаны системой тесных и очень тесных корреляций (от r = 0.61 до r = 0.91) и соответственно был выделен лишь один фактор, детерминирующий 81% вариации данных. Следовательно, в отличие от ЛП N75 и Р100 изменения А1 ЗВП во всем диапазоне использованных пространственных частот стимула носили унитарный характер.
Подытоживая полученные результаты, возможно предположить следующее. Индивидуальные вариации ЛП N75 и Р100 в достаточно существенной степени согласованы. Однако эта согласованность проявляется фрагментарно: как было показано выше, при изменении угловых размеров стимула ЛП N75 и Р100 ЗВП в обеих группах испытуемых проецируются на независимые факторные оси, т.е. имеют различные источники варьирования. Одна из возможных причин этого может заключаться в увеличении количества источников электрической активности и усложнения ее суммации в области активного электрода. Считается, что источники ранних компонентов ЗВП (N75) расположены в области первичной зрительной коры (V1), но ко времени последующего позитивного отклонения количество активированных областей постепенно увеличивается (DiRusso et al., 2005). При этом хорошо заметно, что здесь имеет место и явная упорядоченность – ЛП N75 и Р100 имеют независимые источники варьирования на наиболее низкие (стимул размером 240 угл. мин.), средние (стимулы размером 96 и 48 угл. мин.) и наиболее высокие (стимулы размером 24 и 12 угл. мин.) пространственные частоты. Можно предположить, что в ответы на наиболее низкую пространственную частоту вовлекаются нейрональные сети магноцеллюлярной системы сетчатки и ЛКТ, обладающие наибольшей скоростью проведения сигнала в зрительную кору. По мере увеличения пространственной частоты стимула включаются структуры парвоцеллюлярной системы, обеспечивающие более детальную обработку картины распределения освещенности на сетчатке, но, соответственно, с меньшей скоростью проведения сигнала. В первой группе испытуемых с более высоким средним уровнем ЛП N75 и Р100 такое переключение, судя по всему, происходит наиболее упорядоченно и рельефно, причем при наиболее малых угловых размерах стимула в обработку сигнала, надо полагать, в достаточной степени вовлечены нейрональные сети, работающие как при средних, так и высоких пространственных частотах. Следует особо отметить, что испытуемые этой группы, как было показано, имеют и наиболее высокую остроту зрения. Во второй группе с более низкой ОЗ и в целом более короткими ЛП на средних пространственных частотах такое переключение, по-видимому, происходит с запозданием и как бы в форме своеобразной конкуренции между тремя механизмами, работающими в разных частотных диапазонах. Возможно также, что все это является и следствием модификаций в работе одного и того же внекоркового нейронального механизма, последовательно перестраивающегося на обработку все более мелких деталей изображения, пусть и с некоторыми потерями во времени передачи информации в проекционные зоны коры.
Хотя такое объяснение представляется логичным в свете особенностей и различий магно (M)- и парво (Р)-систем передачи сигнала, необходимо отметить следующее. На уровне ЛКТ приматов действительно латентность М-нейронов в среднем на 7–8 мс меньше, чем латентность Р-нейронов, с существенным перекрытием распределений латентностей (Maunsell et al., 1999). По мнению авторов, это различие на уровне нейронов стриарной коры может быть нивелировано за счет примерно десятикратного превышения проекций Р-клеток над проекциями М-клеток. Моделирование процессов суммации входных сигналов М- и Р-клеток ЛКТ в коре с учетом этого соотношения показало, что латентности Р-клеток мало отличаются от латентности М-клеток, а при суммации небольшого числа клеток даже короче, чем у М-нейронов. К этому следует добавить, что в сетчатке молодых макак М и Р ганглиозные клетки в пределах двух градусов центра сетчатки имеют сходный лимит разрешения в опытах со стимулами разной пространственной частоты (Crook et al., 1988). В той же работе показано, что размеры центров рецептивных полей в этой зоне мало отличаются у двух типов клеток. Аналогичные данные по разрешению пространственной частоты для М и Р- клеток были получены и другими авторами на уровне ЛКТ (Kaplan, Shapley, 1982; Hicks et al., 1983). Таким образом, по крайней мере в фовеа, М-нейроны на стимулы высокой пространственной частоты должны активироваться так же эффективно, как и Р-нейроны. Поэтому объяснение роста латентностей ранних компонентов ЗВП с ростом пространственной частоты только за счет перераспределения активности двух систем должно быть очень осторожным. В связи с этим нельзя исключить, что наблюдаемый эффект является результатом удлинения процессов обработки зрительных сигналов в структурах зрительной коры при увеличении пространственной частоты стимулов.
Нельзя также, учитывая возраст испытуемых в нашей выборке, исключать, что наблюдаемые нами варианты зависимости ЛП начальных компонент ЗВП от пространственной частоты стимула связаны с индивидуальными особенностями протекания процесса развития периферических и центральных нейрональных механизмов зрения.
В практическом плане полученные данные заставляют полагать, что создание нормативной базы, позволяющей не только четко дифференцировать патологические состояния зрительной системы, но и выявлять возможность их возникновения, является чрезвычайно сложной задачей. Действительно, как было показано, даже группа офтальмологически здоровых детей и даже по такому достаточно “объективному” и маловариабельному параметру, как ЛП ранних компонент, ЗВП может быть разделена, как минимум, на две подгруппы, не только различающиеся по уровню ЛП на разных пространственных частотах, но и, что наиболее важно и интересно, по уровню остроты зрения. В ряде работ была показана вариабельность значений некорригированной остроты зрения в зависимости от расстояния до тестовых знаков, полученная на выборках детей и взрослых (Рожкова и др., 2004). Не исключено, что выделенные в вышеуказанных работах типы испытуемых с различными вариантами зависимости остроты зрения от расстояния могут обладать также спецификой передачи и обработки зрительного сигнала. Однако такое предположение нуждается в специальной проверке.
Понятно, что при большем объеме выборки и, особенно, использовании иных параметров, разнообразие “вариантов нормы” могло бы быть более обширным и даже причудливым, а границы между “нормой” и “патологией” в некоторых областях пространства состояний ЗС размытыми. Тем не менее сам факт того, что даже в “норме” некоторым особенностям процесса обработки и передачи сигнала соответствует разная острота зрения, свидетельствует о том, что исследование пространства состояний “нормы”, имеющего, надо полагать, сложную метрику и поиск “маркеров” возможного выхода из этого пространства в пространство патологических состояний, может оказаться вполне продуктивным.
ВЫВОДЫ
У офтальмологически здоровых детей в возрасте 7–14 лет с высокой остротой зрения в ЗВП на реверсивный шахматный паттерн с угловыми размерами 240, 96, 48, 24 и 12 угл. мин. наименьшей межиндивидуальной вариабельностью обладают ЛП компонент N75 и P100, а наибольшей –амплитуды от N75 до P100 (А1) и от Р100 до N145 (А2).
Выделены две группы детей, у которых рост среднего ЛП N75 и P100 при повышении пространственной частоты стимула происходит однотипно, но на статистически значимо разном уровне. В группе с более высоким на всех частотах ЛП N75 и P100 острота зрения статистически значимо выше, чем в группе с более низкими значениями ЛП.
Факторный анализ показал, что вариации ЛП N75 и P100 в обеих группах при низких, средних и высоких пространственных частотах стимула относительно независимы, что, надо полагать, отражает последовательное включение нейрональных механизмов, обеспечивающих обработку все более мелких деталей изображения.
Список литературы
Волков В.В., Горбань А.И., Джалиашвили О.А. Клиническая визо- и рефрактометрия. Л.: Медицина, 1976. 216 с.
Гареев Е.М., Артамонова Е.А., Кошелев Д.И. Исследование пространства состояний зрительной системы. I. Чем может обеспечиваться “очень хорошее” зрение? Сенсорные системы. 2001. Т. 15. № 1. С. 11–19.
Гареев Е.М., Артмонова Е.А., Кошелев Д.И. Исследование пространства состояний зрительной системы. II. Что может лежать в основе “плохого зрения”? Сенсорные системы. 2001. Т. 15. № 1. С. 20–28.
Гнездицкий В.В. Вызванные потенциалы мозга в клинической практике. М.: МЕДпресс-информ, 2003. 264 с.
Ивлева А.А., Кошелев Д.И. Нормативные значения амплитудно-временных параметров зрительных вызванных потенциалов (ЗВП) на обращаемый шахматный паттерн у детей 7–14 лет без нарушения зрения. Практическая медицина. 2019. Т. 17. № 1. С. 134–140. https://doi.org/10.32000/2072-1757-2019-1-134-140
Ким Дж.-О., Мьюллер Ч.У. Факторный анализ: статистические методы и практические вопросы. Факторный, дискриминантный и кластерный анализ. Под ред. Енюкова И.С. М.: Финансы и статистика, 1989. С. 5–77.
Олдендерфер М.С., Блэшфилд Р.К. Кластерный анализ. Факторный, дискриминантный и кластерный анализ. Под ред. Енюкова И.С. М.: Финансы и статистика, 1989. С. 139–210.
Плохинский Н.А. Биометрия. М.: МГУ, 1970. 367 с.
Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М.: МедиаСфера, 2002. 312 с.
Рожкова Г.И., Токарева В.С., Николаев Д.П., Огнивов В.В. Основные типы зависимости остроты зрения от расстояния у человека в разном возрасте по результатам дискриминантного анализа. Сенсорные системы. 2004. Т. 18. № 4. С. 330–338.
Халфин А.А. STATISTICA 6. Статистический анализ данных. М.: Бином-Пресс, 2008. 512 с.
Chen X., Li Q., Liu X., Yang L., Xia W., Tao L. Visual acuity evaluated by pattern-reversal visual-evoked potential is affected by check size/visual angle. Neurosci Bull. 2012. V. 28 (6). P. 737–745. https://doi.org/10.1007/s12264-01
Crook J.M., Lange-Malecki B., Lee B.B., Valberg A. Visual resolution of macaque retinal ganglion cells. J. Physiol. 1988. V. 396. P. 205–224. https://doi.org/10.1113/jphysiol.1988.sp016959
Di Russo F., Pitzalis S., Spitoni G., Aprile T., Patria F., Spinelli D., Hillyard S.A. Identification of the neural sources of the pattern-reversal VEP. Neuroimage. 2005. V. 24 (3). P. 874–886. https://doi.org/10.1016/j.neuroimage.2004.09.029
Dotto P.F., Berezovsky A., Sacai P.Y., Rocha D.M., Salomão S.R. Gender-based normative values for pattern-reversal and flash visually evoked potentials under binocular and monocular stimulation in healthy adults. Doc. Ophthalmol. 2017. V. 135 (1). P. 53–67. https://doi.org/10.1007/s10633-017-9594-x
Gregori B., Pro S., Bombelli F., La Riccia M., Accornero N. Vep latency: sex and head size. Clin. Neurophysiol. 2006. V. 117 (5). P. 1154–1157. https://doi.org/10.1016/j.clinph.2006.01.014
Hicks T.P., Lee B.B., Vidyasagar T.R. The responses of cells in macaque lateral geniculate nucleus to sinusoidal gratings. J Physiol. 1983. V. 337. P. 183–200. https://doi.org/10.1113/jphysiol.1983.sp014619
Kaplan E., Shapley R.M. X and Y cells in the lateral geniculate nucleus of the macaque monkey. J. Physiol. 1982. V. 330. P. 125–143. https://doi.org/10.1113/jphysiol.1982.sp014333
Kothari R., Singh S., Singh R., Shukla A.K., Bokariya P. Influence of visual angle on pattern reversal visual evoked potentials. Oman. J. Ophthalmol. 2014. V. 7 (3). P. 120–125. https://doi.org/10.4103/0974-620X.142593
Mahjoob M., Heravian Shandiz J., Mirzajani A., Ehsaei A., Jafarzadehpur E. Normative values of visual evoked potentials in Northeastern of Iran. J. Optom. 2019. V. 12 (3). P. 192–197. https://doi.org/10.1016/j.optom.2018.12.001
Maunsell J.H.R., Ghose G.M., Assad J.A., Mcadams C.J., Boudreau C.E., Brett D., Noerager B.D. Visual response latencies of magnocellular and parvocellular LGN neurons in macaque monkeys. Visual Neuroscience. 1999. V. 16 (1). P. 1–14. https://doi.org/10.1017/s0952523899156177
Nakamura M., Kakigi R., Okusa T., Hoshiyama M., Watanabe K. Effects of check size on pattern reversal visual evoked magnetic field and potential. Brain Res. 2000. V. 872 (1–2). P. 77–86. https://doi.org/10.1016/s0006-8993(00)02455-0
Odom J.V., Bach M., Brigell M., Holder G.E., McCul-loch D.L., Tormene A.P. ISCEV standart for clinical visual evoked potentials (2009 update). Doc. Ophthalmol. 2010. V.120 (1). P. 111–119. https://doi.org/10.1007/s10633-009-9195-4
Robson A.G., Nilsson J., Li S., Jalali S., Fulton A.B., Tormene A.P., Holder G.E., Brodie S.E. ISCEV guide to visual electrodiagnostic procedures. Doc. Ophthalmol. 2018. V. 136 (1). P. 1–26. https://doi.org/10.1007/s10633-017-9621-y
Sharma R., Joshi S., Singh K.D., Kumar A. Visual Evoked Potentials: Normative Values and Gender Differences. J Clin Diagn Res. 2015. V. 9 (7). P. 12–15. https://doi.org/10.7860/JCDR/2015/12764.6181
Дополнительные материалы отсутствуют.
Инструменты
Сенсорные системы


