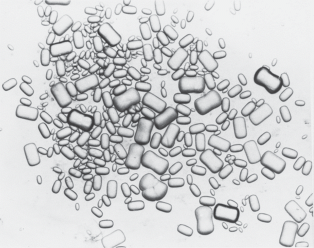Сенсорные системы, 2020, T. 34, № 4, стр. 267-282
Пластичность инерциальной массы в органе равновесия в изменяющемся гравитационном поле
Г. И. Горгиладзе *
Федеральное государственное бюджетное учреждение науки
Государственный научный центр Российской Федерации, Институт медико-биологических проблем РАН
123007 Москва, Хорошевское шоссе, д. 76а, Россия
* E-mail: gio119193@mail.ru
Поступила в редакцию 07.05.2020
После доработки 11.06.2020
Принята к публикации 10.07.2020
Аннотация
В обзоре обобщены экспериментальные исследования инерциальной массы в органе равновесия беспозвоночных и позвоночных животных (кишечнополостные, моллюски, рыбы, амфибии, птицы, крысы), подвергнутых воздействию невесомости на автоматических и пилотируемых космических кораблях и орбитальных станциях, клиностатированию и в среде повышенной весомости на центрифуге. Инерциальная масса, предназначенная для реагирования на земную силу тяжести и линейные ускорения, представлена достаточно крупными единичными статолитами либо многочисленными и небольшого размера статокониями. Эти образования представляют собой биоминералы эндогенного происхождения, растущие слоями-приростами вокруг своих ядер. Инерциальной массе свойственна высокая пластичность. В невесомости и при клиностатировании она увеличивается, а при перегрузках на центрифуге, напротив, уменьшается. Из этих данных следует вывод о том, что гравитация – значимый фактор абиотической среды, ответственный за формирование инерциальной массы в органе равновесия животных организмов.
Первые полеты человека на околоземной орбите выявили явные расстройства различных функций под влиянием необычных условий физической среды. Прежде всего нарушались все те функции, в организации которых исключительную роль играет гравитация: сердечно-сосудистая, опорно-двигательная и вестибулярная. Нарушения вестибулярной функции проявлялись в виде ощущений, приводящих к замешательству, головокружению, дезориентации, а также весьма нежелательных вегетативных реакций – тошноты и рвоты (космическая форма болезни движения, космический адаптационный синдром). Необходимость понять причины вестибулярной дисфункции в невесомости стала стимулом для проведения масштабных исследований. На сегодня многие виды беспозвоночных и позвоночных животных от нескольких суток до нескольких месяцев экспонировались в невесомости на автоматических и пилотируемых космических кораблях и орбитальных станциях (Горгиладзе и др., 2012). Проведенные исследования, все более усложнявшиеся методически, с выбором наиболее адекватных поставленным задачам объектов, позволили собрать достаточно обширный экспериментальный материал, который способствовал нашему представлению о состоянии инерциальной массы в органе равновесия (у беспозвоночных статоцист, у позвоночных лабиринт) в изменяющемся гравитационном поле, и которая является первостепенным, определяющим элементом гравирецепции (табл. 1), (фото и схематическое изображение животных). У подавляющего большинства животных организмов инерциальная масса состоит из биоминералов эндогенного происхождения и представлена в виде единичных, достаточно крупных статолитов либо многочисленных и значительно меньших по размерам статоконий, которые растут слоями-приростами минерально-органического происхождения (Винников и др. 1971). По этой причине они, как и зубы, когти, кости, чешуя и раковина, причисляются к так называемым регистрирующим структурам (Мина, Клевезаль, 1970).
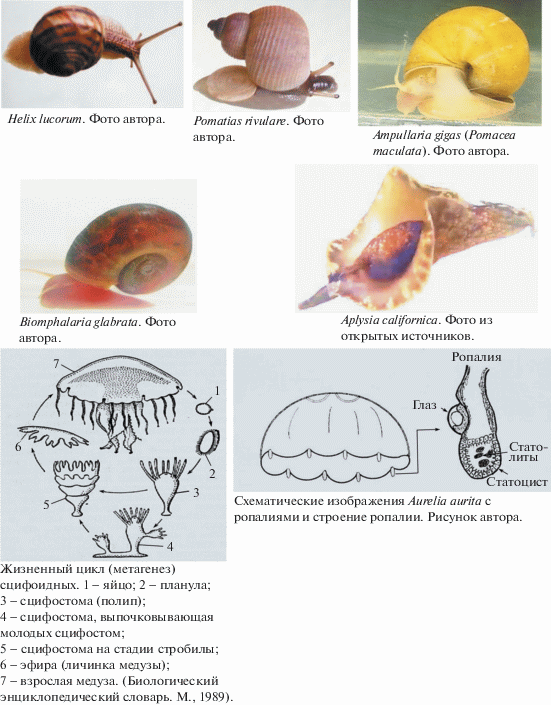
Таблица 1.
Инерциальная масса в органе равновесия беспозвоночных и позвоночных животных, экспонированных в невесомости на космических летательных аппаратах
| Летательный аппарат | Год полета | Длительность эксперимента, сут | Объект исследования | Источник |
|---|---|---|---|---|
| ОС “Салют-6” | 1982 | 9 | Личинки Xenopus laevis | Лычаков, Лавров, 1985 |
| LM-1 Spacelab-3 Challenger (STS-51B) | 1985 | 7 | Крыса | Ross , 1987 |
| Discovery (STS-29) | 1989 | 5 | Эмбрионы Gallus domesticus | Fermin et al., 1996 |
| АКА “Фотон-Ф” | 1990 | 14 | Helix lucorum Ampullaria gigas (Pomacea maculata) | Горгиладзе, 2001 |
| SLS-1 Columbia (STS-40) | 1991 | 9 | Полипы и эфиры Aurelia aurita | Spangenberg et al., 1994a, b; 1996; 2004 |
| IML-2 Columbia (STS-65) | 1994 | 14 | Оплодотворенная икра Cynops pyrrhogaster Полипы и эфиры Aurelia aurita | Wiederhold, 1997 Spangenberg et al., 1994a, b; 1996; 2004 |
| “Прогресс М-28/Мир” | 1995 | 53 | Helix lucorum | Горгиладзе, 2002 |
| “Прогресс М-30/Мир” | 1995–1996 | 73 | Helix lucorum | Горгиладзе, 2002 |
| “Прогресс М-32/Мир” | 1996 | 31 | Helix lucorum | Горгиладзе, 2002 |
| “Прогресс М-35/Мир” | 1997 | 40 | Helix lucorum | Горгиладзе, 2002 |
| “Прогресс М-36/Мир” | 1997–1998 | 135 | Helix lucorum | Горгиладзе, 2002 |
| Endeavour (STS-89) Neurolab, Columbia (STS-90) | 1998 1998 | 9 16 | Эмбрионы Biomphalaria glabrata Беременные Xiphophorus helleri | Wiederhold et al., 1997; 1999; 2000 |
| “Прогресс М-41/Мир” | 1999 | 148 | Helix lucorum | Горгиладзе, 2002 |
| “Прогресс М-42/Мир” | 1999 | 43 | Helix lucorum | Горгиладзе, 2002 |
| “Прогресс М-52/МКС” | 2005 | 56 | Pomatias rivulare | Горгиладзе и др., 2011 |
Примечание. АКА – автоматический космический аппарат; ОС – орбитальная станция; IML-2 – International Microgravity Laboratory-2; LM-1 – Laboratory Module-1; SLS-1 – Spacelab Life Sciences-1; STS – Space Transportation System (космические челноки). Уровень гравитации на АКА, ОС “Мир” и МКС – 10–4–10–5 g. Параметры орбиты (апогей/перигей, км): STS – 185/643; “Фотон” – 393/226; ОС “Салют-6” – 275/219; ОС “Мир” – 408/380; МКС – 390/375.
НЕВЕСОМОСТЬ
Кишечнополостные, медузы
Aurelia aurita. Разнополая дискомедуза из рода Aurelia. Сперматозоиды из воды проникают в материнский организм, где происходит оплодотворение яиц и их развитие до личинки – планулы. Планула покидает материнский организм и плавает в толще воды при помощи ресничек. Она питается, растет, вытягивается в длину, прикрепляется к субстрату и превращается в сцифостому (полип). Полипы размножаются почкованием или поперечным делением. В последнем случае появляются пелагические личинки медузы – эфиры, со временем вырастающие в половозрелые особи. У эфир в отличие от полипа есть статоцисты, позволяющие им поддерживать положение тела ротовым отверстием вниз и перемещаться в воде ритмическими сокращениями зонтика. По краю зонтика на равном расстоянии друг от друга имеются небольшие вырезы с восемью пальцевидными утолщениями, так называемыми краевыми тельцами или ропалиями. В ропалиях расположены нервные ганглии, глаза и статоцисты. Изнутри статоцисты выстланы волосковыми чувствительными клетками-гравирецепторами и содержат один или несколько статолитов, образованных из сульфата кальция. Aurelia aurita ведет пелагический образ жизни в теплых прибрежных водах умеренного и тропического поясов, в том числе Азовского, Черного и Средиземного морей (Наумов, 1961; Банников и др., 1968). В двух экспериментах полипы Aurelia aurita в специальных кассетах с морской водой экспонировались в орбитальном полете (ОП) продолжительностью 9 сут (Columbia, SLS-1 STS-40) и 14 сут (“Columbia”, IML-2 STS-65). Спустя 8 ч после старта для индуцирования стробиляции полипов и появления эфир в кассеты добавляли тироксин (гормон тироксин стимулирует рост, дифференцировку и регенерацию тканей) или йод (медузы используют йод для синтеза тироксина). Сегментация полипов и образование эфир происходили в течение трех суток ОП. Часть эфир была подвергнута соответствующей фиксации в полете для проведения морфологических исследований после завершения эксперимента. У появившихся в невесомости эфир все восемь ропалий со статоцистами и статолитами оказались в наличии, волосковые чувствительные клетки и элементный состав статолитов не отличались сколько-нибудь заметно от таковых наземного контроля. Отличие проявилось в поведении эфир и заметном увеличении числа статолитов в ропалиях. Они плавали петлеобразно, кругами или находились в неподвижном состоянии. У многих развившихся в невесомости эфир отмечались нарушения в строении тела. У 40% особей имелись более восьми щупалец. После завершения полета в 18.3% случаев наблюдались спазмы, судороги, нарушения пульсации тела и синхронизации движений щупалец. Перечисленные изменения отсутствовали у эфир, появившихся в ОП и вращающихся на центрифуге с ускорениями 1g, и у эфир, отправленных в полет спустя 24 и 48 ч после стробиляции со сформировавшимися ропалиями. Число статолитов в ропалиях у этих эфир оказалось таким же, как у эфир, индуцированных в лабораторных условиях (Helm, 1994; Spangenberg, 1971; 1991; 2004; Spangenberg et al., 1994a, b; 1996).
Моллюски, брюхоногие
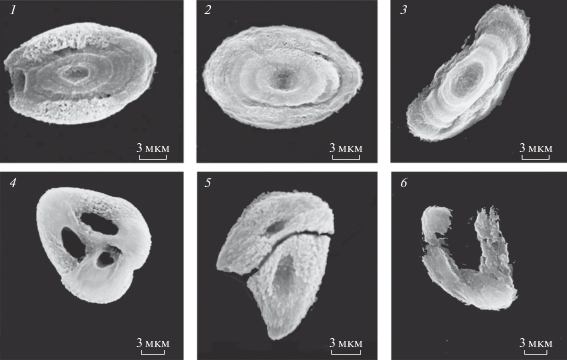
Helix lucorum var. taurica. Двуполая наземная легочная улитка, подвид из рода Helix. Тело улитки заключено в твердую, закрученную в виде спирали из 4.5–5 оборотов раковину. На голове имеются четыре щупальца: пара передних и пара задних. Передние служат для механорецепции, значительно более длинные задние щупальца являются глазными. По способу передвижения относится к ползающим улиткам. Половозрелость наступает в возрасте 6 мес. Примерно через месяц после оплодотворения при помощи ноги выкапывает ямку в земле и откладывает яйца на глубине до 5 см. В кладке от 105 до 120 яиц. Спустя 30–40 сут из яиц вылупляются улитки. Helix lucorum питается зелеными побегами растений. Масса взрослой улитки может достигать 25 г. В зимнее время года при понижении температуры ниже +8°С впадает в спячку, закопавшись в землю, либо укрывшись под опавшими листьями. Продолжительность жизни cоставляет 5–6 лет. Ареал распространения: Закавказье, Черноморское побережье Кавказа, горный Крым, Пиринейский и Балканский полуострова, Малая Азия, Сирия, Иран. Обитает в лесу, в зарослях кустарников (Джавелидзе, 1972; Лихарев, Раммельмейер, 1952). Статоцисты Helix lucorum – парные образования сферической формы, расположенные на дорсолатеральной поверхности педальных ганглиев подглоточного ганглионарного комплекса. Полость статоциста заполнена статолимфой и статокониями (рис. 1). Морфологические параметры статоконий варьируют в пределах: толщины 2–5 мкм, ширины и длины 2.2–4.0 мкм и 20–30 мкм, площадей 50–500 мкм2. С ростом улиток увеличиваются размеры статоцистов и число статоконий. Большая часть статоконий имеют овальные формы с уплощенными поверхностями и сглаженными краями. В центральной части такие статоконии содержат ядро округлой формы диаметром 1.5–2 мкм. Ядро окружено чередующимися друг за другом слоями-приростами (рис. 2). Около 15% статоконий содержат не одно, а два и более (до 12) ядер. В одних случаях ядра таких статоконий лишены собственной слоистости и все они окружены общими слоями-приростами. В других, статоконии срастаются между собой своими поверхностями. В-третьих, сросшиеся между собой статоконии обрастают общими для них слоями-приростами (рис. 3). В статоцистах как ювенальных, так и половозрелых улиток наряду с крупными статокониями всегда присутствует значительное число мелких и очень мелких статоконий и отдельные ядра. Статоконии состоят из карбоната кальция в виде кристаллов арагонита, заполняющие остов органического происхождения (Горгиладзе, 2002; Горгиладзе и др., 2010). В статоцистах улиток, экспонированных в невесомости различной продолжительности, имело место увеличение объема инерциальной массы. На многих статокониях выявлялись наросты, которые покрывали их поверхность сплошным, переменной толщины слоем. В ряде случаев наросты имели вид хлопьев, либо “сидящих” на поверхности статоконий своеобразных пучков, достигающих значительных размеров (рис. 4). Хлопьевидные, нитевидные и игольчатые включения встречались в большом числе в свободном состоянии в самой полости статоциста, в непосредственной близости от поверхности статоконий и в цитоплазматических пальцевидных выпячиваниях опорных клеток. У полетных улиток основные параметры статоконий: длина, ширина, периметр и площадь – превышали контрольные значения с тенденцией их возрастания и с увеличением продолжительности экспозиции в невесомости, за исключением 31-суточного ОП. Кроме того, у ювенальных улиток этот процесс был более заметным по сравнению со взрослыми улитками (табл. 2) (Горгиладзе, 2002).
Рис. 1.
Вскрытые статоцисты Helix lucorum. Справа: три статоконии и многочисленные волоски рецепторных клеток. Скан. эл. микроскоп. Масштаб: 5 мкм.

Рис. 2.
Слоистая структура статоконии с ядром в центре (отмечено стрелкой). Трансмисс. эл. микроскоп. Масштаб: 5 мкм.
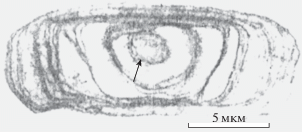
Рис. 3.
Простые (1–2) и сложные (4–6) формы статоконий и их ядра (3), извлеченные из статоцистов Helix lucorum. Скан. эл. микроскоп. Масштаб: 1 – 10 мкм, 2–6 – 3 мкм.
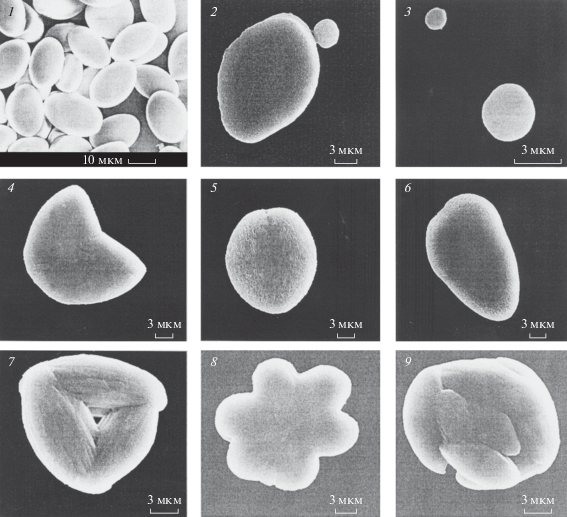
Рис. 4.
Наросты на поверхности статоконий в виде хлопьев (1), сплошного слоя (2) и пучка (3). 1, 2 –трансмиссионный эл. микроскоп; 3 – свет. микроскоп. Фиксация статоциста спустя 4–4.5 ч после завершения 40 сут (1, 2) и 43 сут (3) ОП на ОС “Мир”.

Таблица 2.
Морфологические параметры статоконий полетных и контрольных Helix lucorum (М ± м)
| Параметры статоконий | Продолжительность экспозиции на ОС “Мир”, сут | |||||
|---|---|---|---|---|---|---|
| 14 | 31 | 40 ☼ | 40 | 135 | 148 | |
| Длина, мкм | 18.9 ± 0.1 20.4 ± 0.1** | 18.4 ± 0.4 19.6 ± 0.2* | 18.2 ± 0.2 21.7 ± 0.2** | 18.5 ± 0.2 20.5 ± 0.2** | 18.1 ± 0.3 19.8 ± 0.1** | 18.4 ± 0.3 21.2 ± 2.7** |
| Ширина, мкм | 12.4 ± 0.1 13.6 ± 0.1** | 12.3 ± 0.2 13.1 ± 0.1** | 12.5 ± 0.1 14.9 ± 0.1** | 12.9 ± 0.2 13.6 ± 0.1** | 12.4 ± 0.3 15.0 ± 0.1** | 12.5 ± 0.2 16.2 ± 2.4** |
| Периметр, мкм | 51.2 ± 0.3 55.2 ± 0.4** | 51.6 ± 1.0 54.6 ± 0.6** | 48.4 ± 0.7 58.2 ± 0.5** | 51.9 ± 0.7 57.5 ± 0.6** | 51.0 ± 0.6 60.9 ± 0.6** | 50.9 ± 0.46 67.9 ± 1.2** |
| Площадь, мкм2 | 176 ± 2.0 209 ± 2.6** | 170 ± 6.0 193 ± 3.4** | 175 ± 4.1 245 ± 3.3** | 187 ± 4.2 208 ± 3.5** | 168 ± 6.8 212 ± 2.8** | 175 ± 5.1 240 ± 4.6** |
Pomatias rivulare. Разнополая переднежаберная наземная улитка из рода Pomatias. По способу локомоции относится к “шагающим” улиткам. Устье раковины закрывается роговой пластинкой, расположенной на задней части ноги. На голове расположена одна пара щупалец, глаза на небольших отростках у основания щупалец. Обитает во влажных местах, покрытых мхом, под листовым опадом, под камнями, между гниющими корнями. Питается детритом. Максимальная масса не более 0.8 г. Ареал распространения: Северный Кавказ и Закавказье, горный Крым, Румыния, Балканский полуостров, Малая Азия (Джавелидзе, 1972; Лихарев, Раммельмейер, 1952). Статоцисты Pomatias rivulare расположены в небольших углублениях в мускулатуре ноги поблизости от нервных ганглиев. В каждом статоцисте имеется один ближе к шарообразной форме статолит, который растет по мере роста улитки. У взрослой особи диаметр статолита может достигать 200 мкм, у улитки массой 16 мг не превышает 50 мкм. Как правило, парные статолиты одной и той же улитки асимметричны и отличаются друг от друга своими морфометрическими показателями (рис. 5). Структурообразующим минералом, придающим статолиту тяжесть, является карбонат кальция в виде кристаллов арагонита, заполняющих остов из органической природы (Горгиладзе и др., 2013). Экспонирование в невесомости (56-суточный ОП на орбитальной станции “Мир”) привело к заметным изменениям морфометрических показателей статолитов Pomatias rivulare. На 31% увеличилось число статолитов диаметрами 145–165 мкм, и на 24.5% уменьшилось число статолитов с большими диаметрами по сравнению с контрольными показателями. На 65% возросло число правосторонних статолитов объемом 1.8–2.6 × 103 мкм, и на 11% уменьшилось число статолитов объемом 1.0–1.8 × 103 мкм. В то же время структура распределения частот по объему для левосторонних статолитов не изменилась. На многих статолитах были обнаружены многочисленные наросты. В ряде случаев они имели вид хорошо структурированных образований с заметным сходством с самими статолитами. Поверхность некоторых из них почти полностью была покрыта наростами (рис. 6) (Горгиладзе и др., 2011).
Рис. 5.
Асимметрия статолитов Pomatias rivulare. а – левосторонние; б – правосторонние. Улитка диаметром раковины 5.7 мм (1) и 6.3 мм (2). Скан. эл. микроскоп. Масштаб: 50 мкм.

Рис. 6.
Статолиты Pomatias rivulare. Норма (1); наросты на поверхности статолитов у полетных улиток (2–4), 56-суточный ОП на ОС “Мир”. Скан. эл. микроскоп.
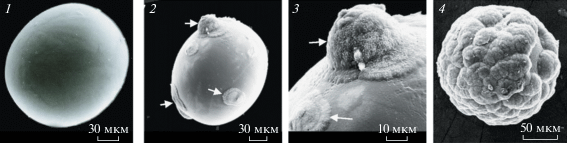
Ampullaria gigas (Pomacea maculata). Разнополая переднежаберная пресноводная улитка из рода Pomacea. Устье раковины закрывается роговой пластинкой, расположенной на задней части ноги. На голове расположены передняя и задняя пары осязательных и хемочувствительных щупалец, глаза – на небольших отростках у основания задней пары щупалец. Амфибионтная улитка может выходить за переделы воды. Ее мантийная полость разделена перегородкой: с правой стороны тела находится жабра для водного дыхания, с левой стороны – легкое. Для дыхания атмосферным воздухом выставляет сифон длиной до 10 см и закачивает в легкое воздух ритмичными движениями всего тела. Размножается круглый год, половозрелость наступает в возрасте 4–5 мес. Самка откладывает одну или две имеющие форму гроздьев кладки вне воды на листьях растений со стороны, обращенной к воде. В кладке 150–200 яиц. Спустя 19–21 сут из яиц вылупляются улитки диаметром 1.5–2 мм, которые сразу падают в воду. Продолжительность жизни от 1 до 4 лет (зависит от температуры воды). Диаметр раковины взрослой улитки достигает 10 см. Питается водорослями, листьями растений. Ареал распространения: Южная Америка, обитает в стоячих или медленнотекущих водоемах Амазонии (Ghesquiere, 2007; Мертенс, 2011). Парные статоцисты сферической формы расположены симметрично в небольших углублениях в мускулатуре ноги, рядом с педальными ганглиями. Каждый из них на 3/4 заполнен статокониями. В день вылупления в статоцисте можно насчитать 11–13 статоконий. В годичном возрасте их количество составляет чуть более 700 (рис. 7). Морфологические параметры статоконий колеблются по толщине в пределах 2–10 мкм, по ширине 3–70 мкм и по длине 5–100 мкм. Совсем небольшие статоконии большей частью веретенообразной формы, статоконии среднего размера и особенно крупные по своему внешнему виду напоминают “кирпичиков”, некоторые имеют цилиндрическую форму. Предварительные наблюдения показали, что эта улитка в состоянии в течение довольно длительного времени обходиться без воды. В эксперименте были использованы ювенальные улитки массой 0.3–2 г. Продолжительность экспозиции в невесомости на автоматическом космическом аппарате (АКА) “Ресурс-Ф” составила 14 сут. Спустя 4–4.5 ч после завершения орбитального полета из статоцистов извлекали статоконии для последующего рассмотрения в сканирующем электронном микроскопе и проведения морфометрических измерений. При этом было выявлено увеличение объема инерциальной массы: длина и ширина статоконий мелких и средних фракций уменьшились, тогда как для крупных фракций эти параметры возросли в 6 и 4 раза соответственно (рис. 8) (Горгиладзе, 2001).
Рис. 8.
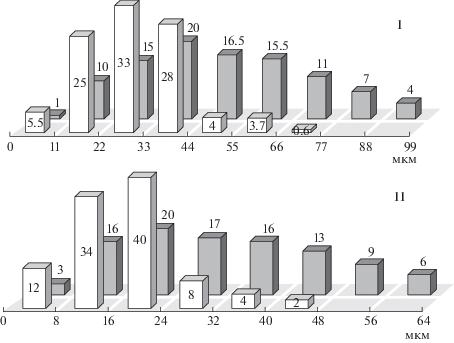
Распределение статоконий (в %): I – по длине и II – по ширине в статоцистах Ampullaria gigas контрольной группы (светлые столбики, n = 1735) и полетной группы (темные столбики, n = 1957). Масса улиток 2.1–2.6 г. Приготовление препарата спустя 4–4.5 ч после завершения 14-суточного ОП на АКА “Ресурс-Ф”.
Biomphalaria glabrata. Двуполая пресноводная улитка-катушка из рода Biomphalaria. Раковина коричневого или розовато-красного цвета диаметром до 10 мм. Витки раковины плотно закручены в виде спирали. На голове имеется одна пара длинных осязательных щупалец, в основании которых расположены глаза. Двоякодышащая, вбирает атмосферный воздух в легочную полость мантии, из воды кислород добывает при помощи тонкого выступа мантии, который выполняет функцию жабры. Улитка способна к самооплодотворению. Откладывает в воду почти каждый день по кладке из 20–30 икринок. Улитки выводятся в течение одной недели. Продолжительность жизни составляет 15–18 мес. Ареал распространения: Южная Америка, Африка, Юго-Западная Азия, обитает в медленно текущих или стоячих мелководных водоемах с обилием гниющей растительности, которая служит пищей (Банников и др., 1968; Jarne, 2005). Статоцисты Biomphalaria glabrata расположены на дорсолатеральной поверхности педальных ганглиев. Они сферической формы диаметром около 60 мкм у ювенальных улиток и 110 мкм у дефинитивных улиток. В статоцистах эмбриональных улиток на 4–5-е сутки после кладки содержатся 40–50 статоконий круглой или эллиптической формы. У улиток диаметром раковины 4 мм их число возрастает до 400 (Gao, Wiederhold, 1997; Gao et al., 1997). Оплодотворенные взрослые особи Biomphalaria glabrata экспонировались в невесомости продолжительностью 9 сут (Endeavour, STS-89) и 16 сут (Columbia, Neurolab STS-90). У развивающихся и вылупившихся в ОП улиток спустя 4 ч и на пятые сутки после возвращения на Землю статоцисты подвергались фиксации и на серийных срезах определялся объем статоконий. В обоих случаях отмечалось достоверное увеличение общего числа статоконий: на 37% спустя 4 ч и на 60% на пятые сутки по сравнению с наземным контролем (Wiederhold et al., 1999).
Рыбы
Взрослые самки пресноводных живородящих рыбок меченосцев Xiphophorus helleri экспонировались на STS-89 (9-суточный ОП) и STS-90 (16-суточный ОП). У этих рыб внутреннее оплодотворение, и у зародышей отолиты в лабиринте формируются до их вылупления. В части экспериментов появление личинок по времени было приурочено к завершению полета. У полетных эмбрионов были обнаружены достоверно более крупные отолиты в утрикулюсе, саккулюсе и лагене по сравнению с наземным контролем (Wiederhold et al.,2000). Семисуточная имитация пониженной весомости клиностатированием величиной 0.007 g привела к значительному увеличению размеров статолитов утрикулюса у личинок цихлид Oreochromis mossambicus при отсутствии изменений в статолитах саккулюса (Anken et al., 2010).
Тритоны
Помещенная в IML-2 на Columbia (STS-65) оплодотворенная икра японского краснобрюхого тритона Cynops pyrrhogaster была индуцирована человеческим хориогонадотропином. Спустя 6 ч после полета личинки тритонов подвергались соответствующей фиксации. У полетных личинок отмечалось более раннее появление статоконий в лабиринте по сравнению с наземным контролем. В течение первой недели после полета отолитовые мембраны утрикулюса и саккулюса полетных и контрольных личинок не отличались заметно друг от друга. Однако в более поздние сроки были выявлены увеличение объема статоконий в эндолимфатической системе и увеличение отолитовых мембран саккулюса и утрикулюса по сравнению с наземным контролем (Wiederhold et al., 1997).
Лягушки
Личинки шпорцевой лягушки Xenopus leavis в течение 8–9 сут развивались со стадии бластулы и хвостовой почки на борту ОС “Салют-6”. На вторые сутки после завершения полета личинки находились на 45–46-й стадии развития. Они подвергались фиксации либо заморозке. Объем отолитовой мембраны был достоверно больше в утрикулюсе и недостоверно в саккулюсе и лагене по сравнению с наземным контролем (Лычаков, Лаврова, 1985).
Птицы
В пятисуточном ОП на Discovery (STS-29) был размещен инкубатор с 16 двухдневными (1-я группа) и 16 девятидневными (2-я группа) эмбрионами кур Gallus domesticus. При возвращении на Землю все 16 эмбрионов первой группы были мертвы. Восемь из второй группы вылупились без анатомических аномалий развития. Оставшиеся восемь эмбрионов были подвергнуты фиксации. Статоконии в лабиринте полетных объектов по форм-фактору оказались такими же, как у объектов синхронной контрольной группы. Отмечалось лишь небольшое увеличение площади статоконий по сравнению с наземным контролем (Fermin et al., 1996).
Крысы
Крысы в течение 7 сут экспонировались в лабораторном модуле LM-1 Spacelab-3 Challenger (STS-51B). Спустя 12 ч после посадки корабля они были подвергнуты декапитации и фиксации материала. По латеральному краю отолитовой мембраны утрикулюса было обнаружено увеличение числа мелких статоконий, а в отолитовой мембране саккулюса – увеличение размеров статоконий и уменьшение шероховатости их поверхности по сравнению с наземным контролем (Ross, 1987).
ПОВЫШЕННАЯ ВЕСОМОСТЬ
Моллюски, брюхоногие
Helix lucorum var. taurica. Статоконии в статоцистах улиток, в течение 30 сут подвергнутых центрифугированию 6 g, претерпели драматические изменения. Поверхность статоконий изобиловала трещинами, локальными изменениями в виде разрыхления и образования углублений. Большое число статоконий были разрушены. Процесс разрушения, как правило, начинался с центральной части статоконии. Сначала выпадала ее сердцевина, затем истончались окружающие ее слои и отчетливо проступала слоистая структура статоконий. Сложные статоконии распадались на составные части (рис. 9) (Горгиладзе и др., 2011).
Рис. 9.
Деструктивные последствия 30-суточной повышенной весомости 6 g на статоконий Helix lucorum. 1, 2, 3 – простые статоконии, 4, 5 – сложные статоконии, 6 – фрагмент разрушенной статоконии. Скан. эл. микроскоп. Масштаб: 3 мкм.
Aplysia californica. Заднежаберный двуполый морской моллюск, слизень из рода Aplysia. Имеет двусторонние жабры, передвигается при помощи ноги. Нога имеет два боковых массивных придатка параподии, которые расправляются и, волнообразно сокращаясь, позволяют плыть. Растительноядный моллюск с массой до 7 кг при длине тела до 70 см. Обитает в тихоокеанском прибрежье северной Америки (в Калифорнии) и северной Мексики на глубине до 20 м. Жизненный цикл состоит из нескольких стадий. Эмбриогенез занимает 10–12 дней. Вылупляются снабженные ресничками свободноплавающие планктонные личинки велигер. Спустя чуть больше месяца они подвергаются метаморфозу: теряют реснички, опускаются на дно и превращаются в ползучую донную ювенальную форму моллюска. При дальнейшем развитии, занимающем 80–90 дней, становится половозрелой особью, готовой к размножению. Продолжительность жизни около года. Парные сферической формы статоцисты у личинок содержат по одному статолиту аморфной структуры. У прошедших метаморфоз особей статоцисты заполнены многочисленными статокониями (Kriegstein et al., 1974; Wiederhold et al., 1990; Мертенс, 2011). В течение всего времени, предшествующего вылуплению, эмбрионы Aplysia californica подвергались перегрузкам 2, 3 и 5.7 g. Прошедшие метаморфоз аплизии в течение трех недель подвергались перегрузкам 2 g. У личинок с увеличением перегрузки уменьшались размеры статолитов. Перегрузки после метаморфоза сопровождались уменьшением общего числа статоконий и их объема. Такая же картина наблюдалась в культуре изолированных статоцистов. Уменьшение новообразования статоконий коррелировало со снижением активности уреазы в статоцистах (этот фермент принимает участие в регуляции pH) (Wiederhold et al., 1986, 1990; Pedrozo, Wiederhold, 1994; Pedrozo et al., 1996).
Рыбы
Личинки цихлид Oreochromis mossambicus на центрифуге подверглись перегрузкам 3 g. После прекращения центрифугирования было обнаружено уменьшение размеров статолитов утрикулюса и саккулюса. Существующая в норме асимметрия между парными статолитами утрикулюса и саккулюса в результате повышенной весомости претерпела определенные изменения: она заметно возросла для статолитов саккулюса и снизилась для статолитов утрикулюса (Anken et al., 1998; 1999; 2002; Rahmann, Anken, 1998; 2002).
Из всех абиотических факторов, пожалуй, только гравитация, численно равная ускорению свободного падения величиной 9.8 м/с2, оставалась неизменным фоном развития жизни на Земле. Противодействие этой силе в процессе эволюции привело к формированию антигравитационных систем у большинства земных существ, в том числе специализированного сенсорного органа – органа равновесия, при помощи которого осуществляются установка тела, активная ориентация в пространстве и управление движениями глаз. Начиная с 80-х годов прошлого столетия различные виды беспозвоночных и позвоночных животных с целью оценки гравирецепции в органе равновесия при потере веса экспонировались на автоматических и пилотируемых космических кораблях и орбитальных станциях. Значительная часть исследований была проведена на брюхоногих моллюсках. Наиболее длительный эксперимент продолжался в течение 163 сут на ОС “Мир” на улитках Helix lucorum, что составило около 9% от средней продолжительности жизни этого моллюска (Горгиладзе, 2002). У гастропод статоцист представляет собой аналог вестибулярного аппарата позвоночных животных в той его части, которая является измерителем гравитационных сил и прямолинейных ускорений – отолитового аппарата. (Измерители угловых ускорений – кристы среди моллюсков есть только у цефалопод). Относительно простая структурная организация статоциста гастропод, легкость доступа и осуществления соответствующих манипуляций, возможность проведения точной морфометрии инерциальной массы, установления ее структуры и элементного состава на большом числе животных, неприхотливость и выносливость к условиях содержания и, что немаловажно, дешевизна таких экспериментов – все вышеперечисленное предопределило их выбор в качестве тестовых, модельных объектов для изучения гравирецептивной функции в изменяющемся гравитационном поле: невесомости и повышенной весомости.
Представленные в обзоре беспозвоночные животные занимают различные экологические ниши с присущими каждому из них собственными поведенческими паттернами и морфофункциональными особенностями органа равновесия. У морской дискомедузы Aurelia aurita восемь статоцистов, у гастропод – по одной паре. Инерциальная масса свободно располагается в статолимфе в виде отдельных достаточно крупных статолитов в статоцистах Aurelia aurita, наземной переднежаберной шагающей улитки Pomatias rivulare, пелагической морской личинки Aplysia californica, и в виде многочисленных мелких статоконий в статоцистах наземной легочной улитки Helix lucorum, пресноводных переднежаберных улиток Ampullaria gigas (Pomacea maculata) и Biamphalaria glabrata, и морского заднежаберного слизняка Aplysia californica после метаморфоза). Кроме того, каждому виду этих гастропод присуща собственная “картина” инерциальной массы. У позвоночных животных инерциальная масса представлена в трех структурах лабиринта: утрикулюсе, саккулюсе и лагене. У рыб в каждой из них содержится по одному статолиту. У остальных позвоночных в этих структурах апикальная поверхность волосковых чувствительных клеток покрыта желеобразным веществом из мукополисахаридов, куда вкраплены многочисленные мелкие статоконии, образуя так называемую отолитовую мембрану. Волосковые чувствительные клетки вместе с отолитовой мембраной, называемые макулами, предназначены для гравирецепции и являются детекторами (датчиками) линейных ускорений, как и статоцисты беспозвоночных животных. Макулы в лабиринте пространственно расположены во взаимно перпендикулярных плоскостях, что позволяет отслеживать линейные движения в любом направлении, кодируя и направляя электрические сигналы в соответствующие мозговые центры. Совершенным отолитовым аппаратом обладают летающие птицы, которые по сравнению с остальными обитателями Земли наиболее преуспели в преодолении гравитации. Птицы с удаленными лабиринтами навсегда утрачивают способность к полету. У медузы после удаления ропалий ритмическая пульсация купола, благодаря которой она перемещается в толще воды, практически сходит на нет.
Инерциальной массе свойственна высокая пластичность. Наличие в одном и том же статоцисте у половозрелых и завершивших свой рост улиток наряду с крупными статокониями мелких и очень мелких статоконий и их ядер свидетельствует о том, что статоконии находятся в состоянии постоянного обновления, генерации и роста в течение всей жизни животного. “Ростовая потенция” инерциальной массы показана на пресноводной улитке Lymnaea stagnalis: после оперативного опустошения статоцистов они довольно быстро заполнялись новыми статокониями, заметно быстрее у ювенальных улиток по сравнению со взрослыми особями (Geuze, 1968). Инерциальная масса на снижение или потерю веса (клиностат, невесомость) реагирует увеличением, на повышение веса (перегрузки на центрифуге) – уменьшением ее объема. Каков физиологический механизм этого феномена? В первом случае в статоцистах беспозвоночных животных, в частности гастропод, инерциальная масса, будучи в свободном состоянии в статолимфе, “всплывает” и теряет контакт с волосками чувствительных клеток, тогда как в отолитовых образованиях лабиринта позвоночных животных происходит некоторый подъем отолитовой мембраны под действием упругих сил волосков чувствительных клеток. Вышеуказанные изменения, очевидно, служат сигналом для активации выработки и выделения клетками нейроэпителия “строительного материала” и тем самым увеличения объема инерциальной массы. При повышенной весомости причиной уменьшения объема инерциальной массы могло быть ее частичное растворение в результате сдвига pH эндолимфы в кислую сторону. Увеличение инерциальной массы в невесомости и ее уменьшение при повышенной весомости указывают на адаптивную природу этого явления.
Инерциальной массе присуща в разной степени выраженная билатеральная асимметрия. В наших исследованиях ни в одном случае в парных статоцистах нескольких сотен улиток Pomatias rivulare статолиты не были полностью идентичными друг другу по своим морфометрическим показателям. Всегда наблюдалась большая либо меньшая асимметрия между ними. Еще ранее асимметрия была обнаружена между право- и левосторонними статолитами утрикулюса, саккулюса и лагены у щуки обыкновенной Esox lucius (Егоров, Самарин, 1970; Самарин, Егоров, 1973). 10% мальков меченосцев Xiphophorus helleri и 12% мальков цихлид Oreochromis mossambicus в невесомости, создаваемой в параболических полетах на самолетах-лабораториях, совершали петлеобразные плавательные движения или движения в виде верчения, принимали положение вниз головой. У этих мальков с необычным плавательным поведением была установлена достоверная отолитовая асимметрия (различие в размерах между правым и левым отолитами утрикулюса). Наряду с этим клеточные элементы в чувствительном эпителии макул утрикулюса имели неправильную форму и их плотность была заметно меньше по сравнению с нормально плавающими мальками (Hilbig et al., 2002). У космонавтов была выявлена высокая корреляция между частотой возникновения болезни движения и отолитовой асимметрией (Брянов и др., 1986). Перечисленные выше данные подвигли исследователей видеть первопричину этого болезненного состояния во врожденных анатомических особенностях лабиринта, а именно межлабиринтной асимметрии (Егоров, Самарин, 1970; Самарин, Егоров, 1973; Горгиладзе и др., 1986; Hilbig et al., 2002).
На первом этапе космоплавания животных использовали для получения опережающей информации для оценки безопасности человека в невесомости. В настоящее время космическая биология приобрела собственное “лицо” со своей методологией и стратегиями исследования. Биолог-исследователь получил доступ к уникальной экспериментальной среде, в которой отсутствует гравитационная составляющая. Очевидно, в такой среде максимально в обнаженном виде должны проявиться все адаптационные потенции, заложенные природой в земных организмах. Для такой задачи человек в качестве объекта исследования оказался непригоден не только из-за этических причин. Всего нескольких суток жизни в безопорной среде (18-суточный орбитальный полет на корабле “Союз-9” Виталия Севастьянова и Андрияна Николаева) оказалось достаточно, чтобы потеря веса превратилась в реальную угрозу для нормального функционирования человеческого организма – конструкции, выстроенной природой на Земле, где сила тяжести выступала в роли ее ваятеля. “…Они казались раздавленными земной тяжестью. Даже при небольших движениях пульс подскакивал до 120 ударов. Голова кружилась, дышать было тяжело. Даже сидеть было трудно. Была потеряна значительная часть мышечной массы. Периметр бедра сократился на 7.5 см, голени – на 3.5 см. У Виталия Севастьянова сердце потеряло 20% в объеме. Андриян Николаев, отличавшийся до полета отменным здоровьем, мастер спорта, перенес несколько инфарктов. Виталий Севастьянов долго и тяжело болел. С того полета физические нагрузки (беговая дорожка, велоэргометр, силовой тренажер, нагрузочный костюм “Пингвин” и другое) стали обязательной частью жизненного уклада на орбите. Все профилактические и терапевтические процедуры, предписанные экипажу в орбитальном полете, имеют одну цель: воспрепятствовать адаптации к невесомости и тем самым добиться относительно безболезненного возвращения на Землю. Это есть парадигма для врачей, ответственных за здоровье космонавтов. Между тем для исследователя, занимающегося проблемой “Невесомость – земной организм”, животные в качестве экспериментальных объектов дали возможность изучить в “чистом” виде состояние и последствия воздействия невесомости.
Эксперимент на Aurelia aurita продемонстрировал сохранность и реализацию наследственной программы чередования раздельнополого и бесполого поколений в жизненном цикле медуз и, что особенно следует подчеркнуть, закладку и развитие специализированного органа гравитации – ропалий в крайне необычной для земного организма среде, каковой является невесомость. Другими словами, генетическая программа развития органа равновесия реализуется вне зависимости от гравитационного фактора среды. Вместе с тем увеличение инерциальной массы в ропалиях и появление аномалий у значительной части развившихся в невесомости эфир в виде “лишних” щупалец, отразившиеся в нарушениях на поведенческом уровне, могли быть следствием эпигенетических изменений в формообразовательных процессах развития медузы в ответ на невесомость. Такое предположение подтверждается тем фактом, что эфиры, появившиеся в орбитальном полете и помещенные в центрифугу для имитации земной гравитации в 1g, не отличались от эфир, появившихся в лабораторных условиях на Земле. Сравнительно недавно было установлено, что эпигенетические изменения, не затрагивающие последовательность молекул ДНК у свободноживущих нематод Caenorhabditis elegans, выращенных при 10-кратном уменьшении веса в клиностате, передаются следующим поколениям. Можно ожидать, что родившиеся и ставшие взрослыми в сенсорном поле, в котором отсутствует либо существенно снижена гравитационная составляющая, будут все больше отдаляться от своих земных собратьев.
В работе использованы собственные материалы автора по космическим экспериментам “Гравирецепция” и “Статокония”, проводимые в ИМБП по долгосрочной программе научно-прикладных исследований и экспериментов РКА и Роскосмоса.
Список литературы
Банников А.Г., Гиляров М.С., Гладков Н.А. и др. Жизнь животных. Беспозвоночные. Под ред. Зенкевича Л.А. М.: Изд-во “Просвещение”, 1968. 576 с.
Брянов И.И., Горгиладзе Г.И., Корнилова Л.Н. Вестибулярная функция. Результаты медицинских исследований, выполненных на орбитальном научно-исследовательском комплексе “Салют-6” – “Союз”. Гл. 10. Сенсорные системы. Под ред. Гуровского Н.Н. М.: Изд-во Акад. наук СССР. 1986. С. 169–185.
Винников Я.А., Газенко О.Г., Титова Л.К. Рецептор гравитации. Серия “Проблемы космической биологии”. Т. XII. Л.: “Наука”, 1971. 523 с.
Горгиладзе Г.И. Стимулирующее влияние невесомости на рост статоконий (эксперименты на автоматических космических аппаратах “Фотон” и “Ресурс-Ф” и пилотируемом орбитальном комплексе “Мир”). Georgian Engineering News. 2001. № 4. С. 113–119.
Горгиладзе Г.И. Структурно-функциональные особенности статоциста улиток Helix lucorum. Орбитальная станция “Мир”. Медико-биологические эксперименты. 2002. Т. 2. С. 366–383.
Горгиладзе Г.И., Букия Р.Д., Давиташвили М.Т. Морфологические особенности статоконий в статоцистах наземной легочной улитки Helix lucorum. Бюл. экспер. биол. 2010. Т. 149. № 2. С. 236–240.
Горгиладзе Г.И., Букия Р.Д., Каландаришвили Э.Л. Пластичность инерциальной массы в статоцистах наземных гастропод в условиях изменяющегося гравитационного поля (невесомость, гипервесомость). Авиакосм. и экол. мед. 2011. Т. 45. № 5. С. 28–32.
Горгиладзе Г.И., Носовский А.М., Букия Р.Д. Статолит Pomatias rivulare. Сенсорные системы. 2013. Т. 27. № 3. С. 216–223.
Горгиладзе Г.И., Самарин Г.И., Брянов И.И. Межлабиринтная асимметрия, вестибулярная дисфункция и космическая болезнь движения. Косм. биол. и авиакосм. мед. 1986. Т. 20. № 3. С. 19–31.
Горгиладзе Г.И., Шипов А.А., Хорн Э. Биологические эксперименты в невесомости: функция равновесия. Авиакосм. и экол. мед. 2012. Т. 46. № 5. С. 3–18.
Джавелидзе Г. Определитель наземных моллюсков Грузии. Тбилиси, 1972. (На груз. яз.).
Егоров Б.Б., Самарин Г.И. Возможное изменение парной работы вестибулярного аппарата в условиях невесомости. Космическая биол. 1970. № 2. С. 85–86.
Лихарев И.М., Раммельмейер Е.С. Наземные моллюски фауны СССР. М.–Л.: Изд-во Академии наук СССР, 1952.
Лычаков Д.В., Лаврова Е.А. Исследование структуры вестибулярного аппарата и ионного состава тела личинок шпорцевой лягушки после пребывания в условиях невесомости. Космическая биол. 1985. Т. 19. № 3. С. 48–52.
Мертенс Д. Мир моллюсков. Изд-во “Мир книги”, 2011. 428 с.
Мина М.В., Клевезаль Г.А. Принципы исследования регистрирующих структур. Усп. совр. биологии. 1970. Т. 70. Вып. 3(6). С. 341–352.
Наумов Д.В. Сцифоидные медузы морей СССР. М.–Л.: Изд-во Академии наук СССР, 1961. 106 с.
Самарин Г.И., Егоров Б.Б. Об асимметрии отолитовых реакций у рыб. Космическая биол. 1973. № 2. С. 37–40.
Anken R.H., Baur U., Hilbig R. Clinorotation increases the growth of utricular otoliths of developing cichlid fish. Microgravity Sci. and Technol. 2010. V. 22. Is. 2. P. 151–154.
Anken R.H., Beier M., Rahmann H. Influence of hypergravity on fish inner ear otoliths: I. Developmental growth profile. Adv. Space Res. 2002. V. 30. № 4. P. 721–725.
Anken R.H., Kappel Th., Rahmann H. Morphometry of fish inner ear otoliths after development at 3g hyper-gravity. Acta Otolaryngol. 1998. V. 118. P. 534–539.
Anken R.H., Kappel T., Rahmann H. On the influence of altered gravity on the growth of fish inner ear otoliths. Acta Astronaut. 1999. V. 44 (7–12). P. 585–591.
Fermin C.D., Martin D., Jones T. Microgravity in the STS-29 space shuttle Discovery affected the vestibular system of chick embryos. Histol. and Histopathol. 1996. V. 11. № 2. P. 407–426.
Gao W., Wiederhold M.L. The structure of the statocyst of the freshwater snail Biomphalaria glabrata (Pulmonata, Basommatophora). Hear. Res. 1997. V. 109. № 1–2. P. 109–124.
Gao W., Wiederhold M., Hejl R. Development of the statocyst in the freshwater snail Biomphalaria glabrata (Pulmonata, Basommatophora). Hear Res. 1997. V. 109 № 1–2. P. 125–134.
Geuze J.J. Observations on the function and the structure of the statocysts of Lymnae stagnalis. Netherl. J. Zool. 1968. V. 18. № 2. P. 155–204.
Ghesquiere S. Apple snail (Ampullariidae). 2007.
http://www.applesnail.net (accessed 28 April 2007).
Helm R.R. Evolution and development of scyphozoan jellyfish. Adv. Space Res. 1994. V. 14. Is. 8. P. 317–325.
Hilbig R., Anken R.H., Bauerle A. Susceptibility to motion sickness in fish: a parabolic aircraft flight study. J. Grav. Physiol. 2002. V. 9. № 1. P. 29–30.
Jarne P. Biological invasions: The case of planorbid snails. J. of Helminthol. 2005. V. 79. № 3. P. 249–256.
Kriegstein A.R., Castellucci V.F., Kandel E.R. Metamorphosis of Aplysia californica in laboratory culture. Proceedings of the National Academy of Sciences. 1974. V. 71. № 9. P. 3654–3658.
Pedrozo H.A., Schwartz Z., Luther M. A mechanism of adaptation to hypergravity in the statocyst of Aplysia californica. Hear. Res. 1996. V. 102. № 1–2. P. 51–62.
Pedrozo H.A., Wiederhold M.L. Effects of hypergravity on statocyst development in embryonic Aplysia californica. Hear. Res. 1994. V. 79. P. 137–146.
Rahmann H., Anken R.H. Neuroplastic reactivity of fish induced by altered gravity conditions: a review of recent results. Adv. Space Res. 1998. V. 22. P. 255–264.
Rahmann H., Anken R.H. Gravity related research with fishes – perspectives in regard to the upcoming International space station, ISS. Adv. Space Res. 2002. V. 30. № 4. P. 697–710.
Ross M.D. Implications of otoconial changes in microgravity. Physiologist. 1987. V. 30. (Suppl.). P. 90–93.
Spangenberg D.B. Thyroxine induced metamorphosis in Aurelia. The J. of Experimental Zoology. 1971. V. 178. P. 183–194.
Spangenberg D.B. Rhopalium development in Aurelia aurita ephyrae. Hydrobiol. 1991. V. 216/217. P. 45–49.
Spangenberg D.B. Effects of microgravity-induced weightlessness on Aurelia ephyrae differentiation and statolith synthesis (DC85). Reproduced under NASA’s terms for educational use. March 2004.
Spangenberg D.B., Coccaro E., Schwarte R. Touch-plate and statolith formation in gravireceptors of ephyrae which developed while weightless in space. Scanning Microscopy. 1996. V. 10. № 3. P. 875–888.
Spangenberg D.B., Jernigan T., McCombs R. et al. Development studies of Aurelia (jellyfish) ephyrae, which developed during the SLS-1 mission. Adv. Space Res. 1994a. V. 14. № 8. P. 239–247.
Spangenberg D.B., Jernigan T., Philput C., Lowe B. Gravireceptor development in jellyfish ephyrae in space and on earth. Adv. Space Res. 1994b. V. 14. № 8. P. 317–325.
Wiederhold M.L., Harrison J.L., Ortiz C.A. Enhanced production of the “test mass” in the statocyst of pond snails reared in microgravity. Proc. Fifteenth Space Utilization Res. Sympos. Tokyo. 1999. V. 15. P. 89– 92.
Wiederhold M.L., Harrison J.L., Parker K.A., Nomura H. Otoliths developed in microgravity. J. Grav. Physiol. 2000. V. 7. № 2. P. 39–42.
Wiederhold M.L., Pedrozo H.A., Harrison J.L. et al. Development of gravity-sensing organs in altered gravity conditions: opposite conclusions from an amphibian and a molluscan preparation. J. Grav. Physiol. 1997. V. 4. № 2. P. 51–54.
Wiederhold M.L., Sharma J.S., Driscoll B.P., Harrison J.L. Development of the statocyst in Aplysia californica. 1. Observations on statoconial development. Hear. Res. 1990. V. 49. P. 63–78.
Wiederhold M.L., Sheridan C.E., Smith N.K. Statoconia formation in molluscan statocysts. Scanning Microsc. 1986. V. 2. P. 781–792.
Дополнительные материалы отсутствуют.
Инструменты
Сенсорные системы