Сенсорные системы, 2020, T. 34, № 4, стр. 299-306
Роль медленных натриевых каналов в ГАМК- и NO-ергической модуляции возбудимости ноцицептивного нейрона
В. Б. Плахова 1, *, В. А. Пеннияйнен 1, С. Г. Терехин 1, С. А. Подзорова 1, А. Д. Калинина 1, Б. В. Крылов 1
1 Федеральное государственное бюджетное учреждение науки Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, наб. Макарова, д. 6, Россия
* E-mail: verapl@mail.ru
Поступила в редакцию 23.06.2020
После доработки 10.07.2020
Принята к публикации 22.07.2020
Аннотация
Методами локальной фиксации потенциала и органотипической культуры нервной ткани исследовано действие на медленные натриевые каналы ряда агентов, активность которых связана с функционированием ГАМК- и NO-ергических систем. Установлено, что ГАМК не влияет на активность каналов NaV1.8 в отличие от лекарственного препарата РГПУ-260, являющегося композицией L-аргинина и мефебута (метиловый эфир бета-фенил-гамма-аминомасляной кислоты). Синтетический препарат РГПУ-260, как и его компонент мефебут, согласно нашим данным, способны снижать функциональную активность каналов NaV1.8, что делает перспективным их применение в качестве анальгетических лекарственных субстанций периферического механизма действия. Обнаружено, что нитропруссид натрия также снижает функциональную активность исследуемых каналов, но этот эффект наблюдается при относительно высоких концентрациях, а его совместное применение с РГПУ-260 не приводит к усилению действия на медленные натриевые каналы. Анализ полученных данных позволяет предположить, что каналы NaV1.8, находящиеся в асинаптической мембране первичного сенсорного нейрона, не контролируются ГАМК- и NO-ергическими системами мозга.
ВВЕДЕНИЕ
Возбудимость нервной ткани на уровне периферической нервной системы обеспечивается молекулярными структурами, важнейшими из которых являются потенциалозависимые натриевые каналы (NaV1.1–NaV1.9), кодирующие ноцицептивную информацию. В ноцицептивных нейронах главную роль в этом явлении играют медленные тетродотоксиннечувствительные натриевые каналы NaV1.8 (Kostyuk et al., 1981; Gold et al., 1996). Увеличение функциональной активности каналов NaV1.8 происходит при воспалительных процессах, механических повреждениях, а также при действии агентов, вызывающих гипералгезию (Akopian et al., 1996; Gold et al., 1996, Lai et al., 2004). Это ведет к повышению частоты импульсной активности афферентных нервных волокон и к возникновению ощущения боли. Напротив, снижение частоты повторных ответов вызывает анальгетический эффект. Поэтому агенты, которые способны снижать возбудимость ноцицепторов благодаря уменьшению функциональной активности медленных натриевых каналов, могут претендовать на роль анальгетиков (Krylov et al., 2017). Такая специфическая модуляция каналов NaV1.8 позволяет полимодальным ноцицепторам сохранить способность передачи сигналов других модальностей (например, тактильных и температурных), избирательно выключив относительно более высокочастотную компоненту их импульсной активности, кодирующую болевой сигнал.
Большой интерес представляет исследование механизмов ГАМК-ергической и NO-ергической модуляции каналов NaV1.8, ответственных, как было отмечено выше, за кодирование ноцицептивных сигналов. Проноцицептивный эффект оксида азота хорошо известен. Влияние эндогенного оксида азота на болевую чувствительность подтверждается тем, что ингибиторы NO-синтазы снижают болевые реакции и связанные с ними метаболические и вегетативные расстройства (Desvignes et al., 1998; Millan, 2002). При этом в литературе отсутствуют данные об участии медленных натриевых каналов в процессах, запускаемых оксидом азота. Отметим, что в литературе также отсутствуют данные о влиянии ГАМК-ергической системы на воротное устройство медленных натриевых каналов. Эта система относится к основным стресс-лимитирующим системам, поскольку, продуцируя гамма-аминомасляную кислоту (ГАМК), она оказывает сильнейшее тормозное действие на нейроны головного и спинного мозга (Vaiva et al., 2004).
Известно, что лекарственный препарат РГПУ-260 обладает не только позитивной нейротропной и психотропной активностью, но и положительно влияет на сердечно-сосудистую систему. Структурно этот препарат состоит из двух компонентов, один из которых является модулятором NO-ергической системы, а другой – ГАМК-ергической. При этом РГПУ-260 является модификацией того ряда лекарственных веществ, которые уже нашли свое широкое применение в клинической практике (фенибут, фенотропил) (Lapin, 2001; Тюренков и др., 2012). Однако их влияние на ноцицептивную систему, в особенности на ее периферическую часть, оставалось малоизученным. РГПУ-260 является композицией L-аргинина и мефебута (метиловый эфир бета-фенил-гамма-аминомасляной кислоты) (Tyurenkov et al., 2018). В настоящей работе исследовано действие на каналы NaV1.8 мефебута и ГАМК. Возможное влияние NO-ергической системы на каналы NaV1.8 исследовано нами с использованием ее специфического активатора нитропруссида натрия.
МЕТОДИКИ ИССЛЕДОВАНИЯ
Метод локальной фиксации потенциала. В наших электрофизиологических экспериментах был использован метод локальной фиксации потенциала (patch-clamp method) в конфигурации “регистрация активности целой клетки” (“whole-cell”) (Hamill et al., 1981). Объектом исследования являлись полученные методом краткосрочного культивирования изолированные сенсорные нейроны, выделенные из областей L5–S1 ганглиев спинного мозга новорожденных крысят линии Wistar. Интактные нервные клетки были получены путем культивирования изолированных нейронов в течение двух часов в стандартных питательных средах с использованием СО2-инкубатора. Более подробно модифицированный метод краткосрочного культивирования диссоциированных сенсорных нейронов описан ранее (Plakhova et al., 2019).
Работа была проведена на животных из ЦКП Биоколлекция ИФ РАН, поддержанной Программой ФАНО России по сохранению и развитию биоресурсных коллекций.
Для регистрации характеристик каналов NaV1.8. применялись стандартные растворы (концентрации представлены в ммоль/л). Внеклеточный: NaCl – 65, CaCl2 – 2, MgCl2 – 2, Choline Cl – 70, HEPES Na – 10, TTX – 0.0003, pH 7.4. Внутриклеточный: CsF – 100, NaCl – 10, CsCl – 40, MgCl2 – 2, HEPES Na – 10, pH 7.2. Наличие ионов фтора во внутриклеточном растворе и полное отсутствие ионов калия позволили избавиться от всех компонентов калиевых и кальциевых токов (Kostyuk et al., 1975; Elliott, Elliott, 1993). Благодаря присутствию во внеклеточном растворе тетродотоксина блокировалось функционирование быстрых тетродотоксинчувствительных каналов, что делало возможным регистрировать ответы только одной популяции натриевых каналов, NaV1.8. В работе использовали реактивы фирмы “Sigma Chemical Co.” (США).
Метод органотипической культуры эмбриональной нервной ткани. Применяемая нами методика подробно описана ранее (Lopatina et al., 2012; Penniyaynen et al., 2019; Plakhova et al., 2019). Объектами исследования являлись эксплантаты спинальных ганглиев Е10-Е12 куриных эмбрионов. Было исследовано более двухсот эксплантатов, культивируемых в СО2-инкубаторе (Sanyo) в течение трех суток на подложках из коллагена в чашках Петри при 36.5°С и 5%-го СО2. Контрольными служили эксплантаты, культивируемые только в условиях питательной среды. В питательную среду добавляли исследуемое вещество в широком диапазоне концентраций. Для количественной оценки роста эксплантатов применяли морфометрический метод. Индекс площади (ИП) рассчитывали как отношение площади зоны роста эксплантата к исходной центральной площади, где находятся немигрирующие клетки. Контрольное значение ИП принимали за 100%. Для визуализации объектов использовали микроскоп Axio Observer Z1 (Carl Zeiss, Германия). Полученные изображения анализировали с использованием программ ImageJ и ZEN_2012. Работу выполняли на оборудовании ЦКП “Конфокальная микроскопия” Института физиологии им. И.П. Павлова РАН.
Статистическую обработку полученных данных выполняли в программе STATISTICA 10.0 (StatSoft, США) с использованием t-критерия Стьюдента. Результаты представлены в виде среднего значения ± стандартная ошибка среднего. Различия принимались статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ
Лекарственный препарат РГПУ-260, как было отмечено выше, структурно состоит из двух компонентов, один из которых является модулятором NO-ергической системы (L-аргинин), а другой – ГАМК-ергической (мефебут). Результаты наших экспериментов свидетельствуют о том, что РГПУ-260 оказывает влияние на активационную воротную систему каналов NaV1.8, снижая эффективный заряд их активационного воротного устройства. При этом также наблюдается снижение амплитуд токов (рис. 1, а, б). В отличие от этого воздействие ГАМК не снижает эффективный заряд воротного устройства и также почти не влияет на амплитудные значения токов (рис. 1, в, г). Эти данные указывают на то, что каналы NaV1.8 первичного сенсорного нейрона не связаны с рецепторами ГАМК. Также они не являются молекулярной мишенью гамма-аминомасляной кислоты.
Рис. 1.
Исследование влияния РГПУ-260 и ГАМК на функциональную активность каналов NaV1.8.
а – семейства медленных натриевых токов в контрольных экспериментах (сверху) и после приложения РГПУ-260 в концентрации 10 мкмоль/л (снизу). Диапазон тестирующего потенциала от –45 до 35 мВ, шаг – 10 мВ. Во всех записях поддерживаемый потенциал, длительность которого составляла 500 мс, был равен 110 мВ. Вычитание токов утечки и емкостных токов осуществлялось программным способом. б – экспоненциальная функция, представленная в логарифмическом масштабе (ось ординат), позволяет определить величину Zeff по тангенсу угла наклона асимптот, проведенных к начальным участкам этих функций в контрольном опыте (1) и после приложения РГПУ-260 в концентрации 10 мкмоль/л (2). в – семейства медленных натриевых токов в контрольных экспериментах (сверху) и после приложения ГАМК в концентрации 10 мкмоль/л (снизу). Диапазон тестирующего потенциала от –35 до 35 мВ, шаг – 10 мВ. Во всех записях поддерживаемый потенциал, длительность которого составляла 500 мс, был равен 110 мВ. Вычитание токов утечки и емкостных токов осуществлялось программным способом. г – экспоненциальная функция, представленная в логарифмическом масштабе (ось ординат), позволяет определить величину Zeff по тангенсу угла наклона асимптот, проведенных к начальным участкам этих функций в контрольном опыте (1) и после приложения ГАМК в концентрации 10 мкмоль/л (2). д – семейства медленных натриевых токов в контрольных экспериментах (сверху) и после приложения РГПУ-260 в концентрации 10 мкмоль/л (снизу) в экспериментах с использованием внутриклеточного раствора, содержащего блокатор Src-киназы РР2. Диапазон тестирующего потенциала от –40 до 40 мВ, шаг – 10 мВ. Во всех записях поддерживаемый потенциал, длительность которого составляла 500 мс, был равен 110 мВ. Вычитание токов утечки и емкостных токов осуществлялось программным способом. е – присутствие во внутриклеточном растворе ингибитора Src-киназы не блокирует эффект снижения потенциалочувствительности активационной воротной системы медленных натриевых каналов. Экспоненциальные функции, представленные в логарифмическом масштабе (ось ординат), позволяют определить величины Zeff по тангенсам углов наклона асимптот, проведенных к начальным участкам этих функций в контрольном опыте (1) и после приложения РГПУ-260 с внешней стороны мембраны клетки (2).
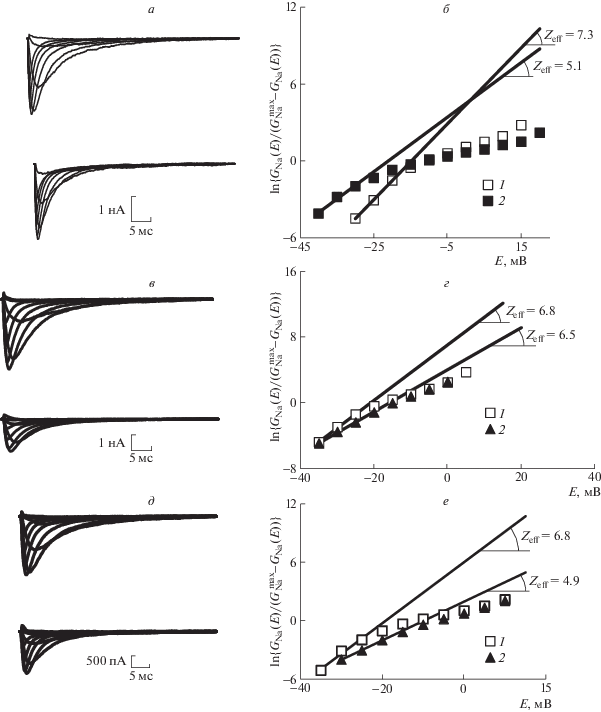
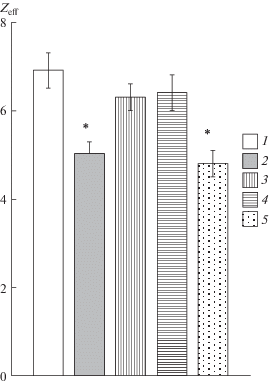
Следующая серия экспериментов показала, что эффект РГПУ-260 не устраняется РР2, специфическим блокатором Src-киназы (рис. 1, д, е). Этот факт свидетельствует о непосредственном связывании РГПУ-260 с каналом NaV1.8, а не с мембранным опиоидоподобным (или другим) рецептором и/или комплексом Na, K-АТФаза/ Src, играющими важнейшую роль в механизмах модуляции возбудимости каналов NaV1.8 первичного сенсорного нейрона (Penniyaynen et al., 2019; Plakhova et al., 2019). Статистически обобщенные данные, представленные на рис. 2, указывают на то, что препарат РГПУ-260, в отличие от ГАМК, способен модулировать функциональную активность каналов NaV1.8, что может указывать на его возможное применение еще и в качестве анальгетика, действующего на уровне периферической нервной системы.
Рис. 2.
Влияние исследуемых веществ на величину эффективного заряда активационной воротной системы медленных натриевых каналов NaV1.8.
1 – контрольные значения; 2 – после приложения РГПУ-260 (10 мкмоль/л); 3 – после приложения ГАМК (100 нмоль/л); 4 – после приложения ГАМК (1 мкмоль/л); 5 – после приложения РГПУ-260 (10 мкмоль/л) в экспериментах с использованием внутриклеточного раствора, содержащего блокатор Src-киназы РР2. * – различия достоверны относительно контрольных значений, p < 0.05.
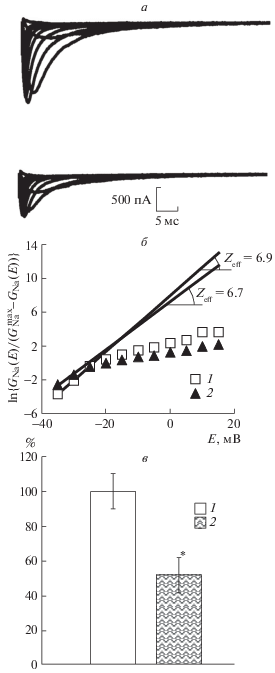
На рис. 3 представлены результаты изучения действия мефебута, одного из компонентов РГПУ-260, на каналы NaV1.8 мембраны ноцицептивного нейрона. Установлено, что этот агент снижает функциональную активность исследуемых каналов благодаря снижению амплитуд токов (рис 3). Применение мефебута (10 мкмоль/л) позволило выявить его сильное ингибирующее действие на исследуемые каналы NaV1.8: установлено, что максимальная амплитуда токов снижалась в 2 раза (рис. 3, в). Это свидетельствует о том, что указанное двухкратное уменьшение функциональной активности исследуемых каналов, вызванное мефебутом, может приводить к антиноцицептивному эффекту на системном уровне.
Рис. 3.
Исследование влияния мефебута на функциональную активность каналов NaV1.8.
а – семейства медленных натриевых токов в контрольных экспериментах (сверху) и после приложения мефебута в концентрации 10 мкмоль/л (снизу). Диапазон тестирующего потенциала от –40 до 40 мВ, шаг – 10 мВ. Во всех записях поддерживаемый потенциал, длительность которого составляла 500 мс, был равен 110 мВ. Вычитание токов утечки и емкостных токов осуществлялось программным способом. б – экспоненциальная функция, представленная в логарифмическом масштабе (ось ординат), позволяет определить величину Zeff по тангенсу угла наклона асимптот, проведенных к начальным участкам этих функций в контрольном опыте (1) и после приложения мефебута в концентрации 10 мкмоль/л (2). в – величины амплитуды максимальных значений тока, выраженных в процентах, в контрольном эксперименте (1) и через 6 мин после приложения мефебута в концентрации 10 мкмоль/л (2). * – различия достоверны относительно контрольных значений, p < 0.05.
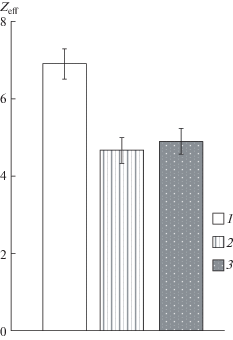
Ранее, исследуя влияние NO-ергической системы на каналы NaV1.8, нами был обнаружен эффект нитропруссида натрия (SNP, донора NO), который заключался в том, что после приложения SNP (10 ммоль/л) происходило снижение потенциалочувствительности исследуемых каналов (Плахова и др., 2019). Однако осталась неисследованной эффективность совместного действия РГПУ-260 и SNP, поэтому нами была проведена следующая серия экспериментов. Первоначально регистрировались семейства натриевых токов каналов NaV1.8 в контрольных опытах и после приложения SNP (10 ммоль/л). Затем еще через 6 мин после приложения SNP в наружный раствор добавляли РГПУ-260 (10 мкмоль/л) и после этого повторно проводили регистрацию медленных натриевых токов. Полученные результаты суммированы на рис. 4, где представлено изменение Zeff при воздействии SNP (Zeff = 4.7 ± 0.3; n = 30), а также после последующего добавления РГПУ-260 во внеклеточный раствор (Zeff = 4.9 ± 0.3; n = 28). Эти данные указывают на то, что совместное действие исследуемых агентов не приводит к усилению эффектов каждого из них по сравнению с их индивидуальным воздействием на потенциалочувствительность активационного воротного устройства каналов NaV1.8.
Рис. 4.
Снижение Zeff активационной воротной системы каналов NaV1.8 после приложения SNP и при сочетанном действии SNP и РГПУ-260.
1 – контрольные эксперименты; 2 – после приложения SNP в концентрации 10 ммоль/л; 3 – при сочетанном действии SNP (10 ммоль/л) и РГПУ-260 (10 мкмоль/л). * – различия достоверны относительно контрольных значений, p < 0.05.
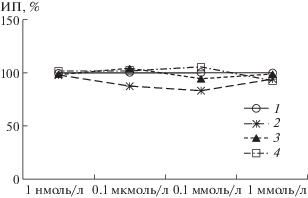
Методом органотипической культуры ткани было исследовано влияние ГАМК, мефебута и РГПУ-260 на рост нейритов спинальных ганглиев 10–12-дневных куриных эмбрионов в широком диапазоне концентраций: 1 нмоль/л, 0.1 мкмоль/л, 0.1 ммоль/л и 1 ммоль/л. В изучаемых концентрациях данные агенты не влияли на рост исследуемой ткани. ИП эксплантатов спинальных ганглиев не отличался от своего контрольного значения (рис. 5). Полученные данные свидетельствуют о том, что ГАМК, РГПУ-260 и мефебут не влияют на чрезвычайно чувствительную нервную ткань, находящуюся на эмбриональном этапе своего развития.
Рис. 5.
Изменение индекса площади эксплантатов спинальных ганглиев Е10–Е12 куриных эмбрионов при воздействии ГАМК, РГПУ-260 и мефебута.
1 – контроль; 2 – ГАМК; 3 – мефебут; 4 – РГПУ-260. По оси ординат – индекс площади эксплантатов (ИП, %). * – различия достоверны относительно контрольных эксплантатов, p < 0.05.
ОБСУЖДЕНИЕ
Важнейшим результатом, полученным в нашей работе методами локальной фиксации потенциала и органотипической культуры ткани, может считаться тот факт, что ГАМК не влияет на функциональную активность каналов NaV1.8 ноцицептивного нейрона. Это свидетельствует о том, что на уровне первичного сенсорного нейрона взаимодействие ГАМК-ергической и ноцицептивной систем представляется маловероятным. Полученный результат может быть объяснен отсутствием на этом уровне синаптических контактов. Действительно, первичный сенсорный нейрон, являясь псевдоуниполярной клеткой, не имеет синаптических связей на своей мембране. Этим может объясняться полное отсутствие здесь эффектов ГАМК, которая также ни в одной из широкого спектра исследованных нами концентраций, не влияет на рост нейритов эмбриональной нервной ткани.
Мефебут, являясь производным ГАМК, оказывает сильное действие на функциональную активность каналов NaV1.8, ингибируя их токи. Этот обнаруженный нами эффект может быть объяснен прямым взаимодействием исследуемого агента со структурой канала. Полученный результат позволяет предсказать антиноцицептивное действие мефебута на системном уровне. Эти данные объясняют анальгетическое действие лекарственного препарата РГПУ-260, включающего в свой состав мефебут. Антиноцицептивный эффект РГПУ-260, проявляющийся на спинальном уровне, связан со снижением функциональной активности каналов NaV1.8 (Tyurenkov et al., 2018). Действие РГПУ-260 на активационное воротное устройство может быть связано с тем, что РГПУ-260 состоит из двух компонентов, где помимо мефебута (который не влияет на активационное воротное устройство) вторым составляющим элементом служит L-аргинин. Возможно, что только их совместное действие в качестве атакующих молекул приводит к уменьшению потенциалочувствительности активационного воротного устройства каналов NaV1.8.
Поскольку гамма-аминомасляная кислота не оказывает прямого влияния на каналы NaV1.8, то можно заключить, что на уровне первичного сенсорного нейрона их функциональная активность не находится под прямым контролем ГАМК-ергической системы мозга. Обнаруженное нами ингибирующее влияние мефебута на эти каналы может быть обусловлено прямым лиганд-рецепторным взаимодействием мефебута и канала.
Мы предполагаем, что именно этот механизм прямого лиганд-рецепторного взаимодействия объясняет обнаруженный нами ранее эффект нитропруссида натрия (Плахова и др., 2019). Донор молекул NO действует на мембрану ноцицептивного нейрона, снижая его возбудимость в относительно высокой концентрации. Совместное действие SNP и РГПУ-260 не приводило к дополнительному снижению функциональной активности каналов NaV1.8, что должно было бы происходить, если бы SNP запускал модулирующее действие NO-ергической системы на уровне первичного сенсорного нейрона. По-видимому, SNP (10 ммоль/л) связывается непосредственно с каналом NaV1.8, снижая его функциональную активность.
Можно заключить, что влияние ГАМК-ергической и NO-ергической систем на исследуемый нами периферический отдел ноцицептивной системы может осуществляться не на уровне каналов NaV1.8 первичного сенсорного нейрона, а выше. ГАМК- и NO-ергическая модуляция ноцицептивной системы происходит, видимо, на уровне вторичного сенсорного нейрона, где существует синаптическая передача. Наши данные подтверждают гипотезу о том, что асинаптическая мембрана первичных ноцицептивных нейронов не контролируется ни ГАМК-ергической, ни NO-ергической системами. Обнаруженные нами антиноцицептивные эффекты препарата РГПУ-260, мефебута и нитропруссида натрия обусловлены, вероятно, их прямым лиганд-рецепторным связыванием с каналами NaV1.8.
Авторы выражают искреннюю благодарность И.Н. Тюренкову, И.В. Рогачевскому и О. С. Васильевой за ценное обсуждение результатов исследования и за синтезированные препараты РГПУ-260 и мефебут. Авторы также признательны Г.П. Никитиной за техническую помощь.
Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий на 2013–2020 гг. (ГП-14, раздел 64) и РФФИ (грант № 18-015-00071).
Список литературы
Плахова В.Б., Пеннияйнен В.А., Рогачевский И.В., Калинина А.Д., Подзорова С.А., Крылов Б.В. Роль донора молекул NO в регуляции ответов первичного сенсорного нейрона. Сенсорные системы. 2019. Т. 33. № 2. С. 135–141. https://doi.org/10.1134/S0235009219020069
Тюренков И.Н., Багметова В.В., Бородкина Л.Е., Берестовицкая В.М., Васильева О.С. Фенибут и его цитрат в предупреждении психоневрологических нарушений, вызванных хроническим стрессом – лишением парадоксальной фазы сна. Экспериментальная и клиническая фармакология. 2012. Т. 7. № 6. С. 8–13.
Akopian A.N., Sivilotti L., Wood J.N. A tetrodotoxin-resistant voltage-gated sodium channel expressed by sensory neurons. Nature. 1996. V. 379. № 6562. P. 257–262.
Desvignes C., Robert F., Vachette C., Chouvet G., Cespuglio R., Renaud B., Lambas-Senas L. Monitoring nitric oxide (NO) in rat locus coeruleus: differential effects of NO synthase inhibitors. Neuroreport. 1998. V. 8. № 6. P. 1321–1325. https://doi.org/10.1097/00001756-199704140-00001
Elliott A.A., Elliott J.R. Characterization of TTX-sensitive and TTX-resistant sodium currents in small cells from adult rat dorsal root ganglia. J. Physiol. (Lond). 1993. V. 463. № 4. P. 39–56.
Gold M.S., Reichling D.B., Shuster M.J., Levine J.D. Hyperalgesic agents increase a tetrodotoxin-resistant Na+ current in nociceptors. Proc. Natl. Acad. Sci. USA. 1996. V. 93. № 3. P. 1108–1112.
Hamill O.P., Marty A., Neher E., Sakmann B., Sigworth F. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Arch. 1981. V. 391. № 1. P. 85–100.
Kostyuk P. G., Krishtal O. A., Pidoplichko V. I. Effect of internal fluoride and phosphate on membrane currents during intracellular dialysis of nerve cells. Nature. 1975. V. 257. № 5528. P. 691–693.
Kostyuk P.G., Veselovsky N.S., Tsyndrenko A.Y. Ionic currents in the somatic membrane of rat dorsal root ganglion neurons – I. Sodium currents. Neuroscience. 1981. V. 6. № 12. P. 2423–2430.
Krylov B.V., Rogachevskii I.V., Shelykh T.N., Plakhova V.B. Frontiers in pain science. Volume 1. New nonopioid analgesics: understanding molecular mechanisms on the basis of patch-clamp and quantumchemical studies. Sharjah, U.A.E., Bentham Science Publishers Ltd., 2017. 203 p.
Lai J., Porreca F., Hunter J.C., Gold M.S. Voltage-gated sodium channels and hyperalgesia. Ann. Rev. Pharmacol. Toxicol. 2004. V. 44. P. 371–397. https://doi.org/10.1146/annurev.pharmtox.44.101802.121627
Lapin I. History of drug development. Phenibut (β-Phenyl-GABA): a tranquilizer and nootropic drug. CNS Drug Reviews. 2001. V. 7. № 4. P. 471–481. https://doi.org/10.1111/j.1527-3458.2001.tb00211.x
Lopatina E.V., Yachnev I.L., Penniyaynen V.A., Plakhova V.B., Podzorova S.A., Shelykh T.N, Rogachev-sky I.V., Butkevich I.P., Mikhailenko V.A., Kipenko A.V., Krylov B.V. Modulation of signal-transducing function of neuronal membrane Na+,K+-ATPase by endogenous ouabain and low-power infrared radiation leads to pain relief. Med. Chem. 2012. V. 8. № 1. P. 33–39. https://doi.org/10.2174/157340612799278531
Millan M.J. Descending control of pain. Prog. Neurobiol. 2002. V. 66. № 6. P. 355–474. https://doi.org/10.1016/s0301-0082(02)00009-6
Penniyaynen V.A., Plakhova V.B., Rogachevsky I.V., Terekhin S.G., Podzorova S.A., Krylov B.V. Molecular mechanisms and signaling by comenic acid in nociceptive neurons influence the pathophysiology of neuropathic pain. Pathophysiology. 2019. V. 26. № 3–4. P. 245–252. https://doi.org/10.1016/j.pathophys.2019.06.003
Plakhova V., Penniyaynen V., Yachnev I., Rogachevskii I., Podzorova S., Krylov B. Src kinase controls signaling pathways in sensory neuron triggered by low-power infrared radiation. Can. J. Physiol. Pharmacol. 2019. V. 97. № 5. P. 400–406. https://doi.org/10.1139/cjpp-2018-0602
Tyurenkov I., Perfilova V., Vasil’eva O., Rogachevskii I., Penniyaynen V., Shelykh T., Podzorova S., Krylov B., Plakhova V. GABA- and NO-ergic modulators control antinociceptive responses. Act. Nerv. Super. Rediviva. 2018. V. 60. № 1. P. 1–8.
Vaiva G., Thomas P., Ducrocq F. Low posttrauma GABA plasma levels as a predictive factor in the development of acute posttraumatic stress disorder. Biol. Psychiatry. 2004. V. 55. № 3. P. 250–254. https://doi.org/10.1016/j.biopsych.2003.08.009
Дополнительные материалы отсутствуют.
Инструменты
Сенсорные системы


